pH
PH-ul este o cantitate fizică care indică aciditatea (și, prin urmare, basicitatea ) pentru gaze și lichide.
Simbolul „pH” a fost creat în 1909 de chimistul danez Søren Sørensen . [1]
Termenul p (operator) simbolizează două operații matematice pornind de la activitatea cationului oxoniu ( hidroxoniu ) în soluție apoasă : facem logaritmul la baza 10 a activității și punem semnul minus în fața sa. Pentru proprietățile logaritmilor, același rezultat se obține și prin calcularea logaritmului reciproc al activității ionilor de oxoniu .
Prin urmare, este definit după cum urmează: [2]
unde un H + reprezintă activitatea cationilor oxoniu . Activitatea ionilor de oxoniu este o cantitate adimensională, de fapt poate fi definită în termeni de concentrație molară de ioni de oxoniu ca:
unde este este concentrația molară a cationilor de oxoniu, este concentrația molară unitară respectivă (introdusă numai în scopul de a face argumentul logaritmului adimensional) și este coeficientul de activitate molară, un parametru adimensional care măsoară abaterile de la idealitate datorate în principal interacțiunilor electrostatice dintre ionii în soluție.
Coeficientul de activitate tinde spre unitate (și, prin urmare, activitatea tinde spre concentrația molară a cationilor de oxoniu) în soluții apoase suficient de diluate (≤ 0,1 mol / dm³ ). În aceste condiții, ecuația anterioară se simplifică pentru:
Deși matematic incorect, este o practică obișnuită, din motive de scurtă durată, să omiți indicația concentrației unitare în argumentul logaritmului (implicând prezența sa) și să scrii pH-ul pur și simplu ca:
În mod convențional, pH-ul soluțiilor apoase presupune valori cuprinse între minim 0 (aciditate maximă) și maxim 14 (basicitate maximă). Condiția de neutralitate, tipică apei pure la 25 ° C, corespunde valorii intermediare de 7.
PH-ul poate fi măsurat electric, exploatând potențialul creat de diferența de concentrație a ionilor de hidrogen pe cele două fețe ale unei membrane de sticlă (vezi piaccameter ), sau chimic, exploatând capacitatea unor substanțe (numite indicatori ) de a-și schimba culoarea în funcție de la pH-ul mediului în care se găsesc. În mod normal, acestea sunt substanțe utilizate în soluție, cum ar fi fenolftaleina și albastrul de bromotimol .
Foarte des, indicatorii sunt folosiți și pe suporturi de hârtie (așa-numitele „ hârtii indicatoare universale ”), care își schimbă culoarea atunci când sunt scufundați în substanțe acide sau bazice. Cel mai frecvent exemplu este cel al „ hârtiilor de turnesol ”, care sunt roz într-un mediu acid și albastru într-un mediu alcalin.
Aciditatea și bazicitatea soluțiilor apoase
| Substanţă | pH |
|---|---|
| 1 M acid clorhidric | 0 |
| Suc gastric | 1.0 - 2.0 |
| Coca Cola și suc de lămâie | 2.5 |
| Oţet | 2.9 |
| Suc de portocale | 3.7 |
| Bere | 4.5 |
| Ploaie acidă | 4,5 - 4,8 |
| Cafea | 5.0 |
| Ceai și piele sănătoasă | 5.5 |
| Apă deionizată a 25 ° C | 5,5 - 6,0 |
| Apă oxigenată | 6.2 |
| Lapte bine conservat | 6.5 - 6.7 |
| Apă distilată a 25 ° C | 7.0 |
| Saliva umană normală | 6.5 - 7.5 |
| Sânge | 7.35 - 7.45 |
| Apă regulată din piscină | 7.2 - 7.8 |
| Apa de mare | 7.7 - 8.3 |
| Bicarbonat de sodiu | 8.31 |
| Săpunuri alcaline | 9.0 - 10.0 |
| Amoniac | 11.5 |
| Varechina | 12.5 |
| Leşie | 13.5 |
| 1 M hidroxid de sodiu | 14 |
Apa distilată (fără săruri și diverse substanțe, spre deosebire de cea a robinetului sau a sticlelor) nu este un electrolit bun, adică nu conduce curent electric, deoarece o cantitate foarte mică de ioni oxoniu este dizolvată în el [H 3 O + ] (încărcat pozitiv) și hidroxili [OH - ] (încărcat negativ), datorită reacției de auto - protoliză a apei în funcție de echilibru:
Pentru soluțiile diluate, unde este permisă aproximarea activităților cu concentrațiile, constanta de auto-protoliză este egală cu produsul concentrațiilor ionilor de hidroxil și oxoniu:
Valoarea a în apă distilată la 25 ° C și 100 kPa (condiții STP) este egal cu 1,0 x 10 −14 M 2 .
În apa pură la 25 ° C, starea electroneutralității combinată cu echilibrul autoprotolizei impune ca concentrația ionilor H 3 O + și OH - provenită din disocierea naturală a apei să fie
- [H 3 O + ] = [OH - ] = 1 × 10 −7 M
corespunzător pH = 7, indicativ de neutralitate.
Deoarece constanta autoprotolizei se modifica cu temperatura, această concentrație variază pe măsură ce temperatura se schimbă și, prin urmare, calculele ar trebui trimise la temperatura standard de 25 ° C.
Deoarece adăugarea unui acid sau a unei baze la apă crește sau scade, respectiv, concentrația ionilor [H 3 O + ] în raport cu valoarea neutralității, o soluție (la 25 ° C) va spune:
- Acid când [H 3 O + ]> 10 −7 M
- Neutru când [H 3 O + ] = 10 −7 M
- Alcalin când [H 3 O + ] <10 −7 M
O modalitate mai ușoară de a exprima aciditatea sau alcalinitatea unei soluții este funcția pH , dată în introducere. Utilizarea funcției pH este foarte utilă, deoarece vă permite să restrângeți gama unei scale de valori numerice. Prin urmare, utilizarea funcției pH ne permite să afirmăm că (la 25 ° C) soluția este: [3]
- Acid dacă pH-ul este <7
- Neutru dacă pH-ul este = 7
- Bazic dacă pH-ul este> 7.
O măsurare rapidă a pH-ului este posibilă cu așa-numitele hârtii indicatoare universale , benzi subțiri sau benzi de hârtie impregnate cu un amestec de indicatori diferiți. De culoare galbenă, când sunt uscate, expuse la o soluție apoasă acidă sau bazică, acestea își schimbă culoarea în funcție de pH-ul soluției:
- Bordeaux / roșu închis = aciditate extremă (pH 0)
- Roșu = aciditate ridicată
- Portocaliu = aciditate medie
- Galben = aciditate slabă
- Galben în tendințe de verde = aciditate minimă
- Verde = neutralitate perfectă (pH 7)
- Verde care tinde spre albastru = alcalinitate minimă
- Albastru deschis = alcalinitate slabă
- Albastru = alcalinitate medie
- Albastru închis = alcalinitate ridicată
- Indigo = alcalinitate extremă (pH 14)
pOH

În mod similar, pOH poate fi introdus:
- pOH = -log 10 [OH - ]
Utilizarea pH-ului și a pOH permite exprimarea produsului ionic al apei în felul următor:
- pH + pOH = 14
Relația indică faptul că într-o soluție apoasă la 25,00 ° C suma pH-ului și a pOH trebuie să fie întotdeauna egală cu 14. Cunoscând pH-ul sau pOH este posibil să se urmărească [H 3 O + ] și [OH - ], prin următoarele expresii:
- [H 3 O +] = 10 -Ph; [OH - ] = 10 -pOH
Simetric față de pOH, pH-ul este definit și ca logaritm zecimal negativ al concentrației ionice în soluție și este indicat ca:
- .
Concentrația este măsurată în moli / litru de soluție și se numește concentrația molară .
De exemplu, dacă o soluție apoasă are un pH de 3,5, definiția arată că concentrația ionilor Și:
- mol / L.
Standard pentru măsurarea pH-ului
Standardul internațional acceptat este o soluție apoasă 0,05 M de hidrogen ftalat de potasiu , a cărei valoare a pH-ului la 25,00 ° C a fost atribuită valoarea pH = 4,005.
Cu toate acestea, au fost definite o serie de alte standarde secundare, al căror pH a fost măsurat cu cea mai mare precizie posibilă față de pH-ul standardului principal.
PH-ul în calibrarea electrodului de sticlă
Deoarece sunt disponibile un număr mare de standarde secundare, este posibil să se utilizeze în calibrarea electrodului de sticlă un standard având un pH apropiat de cel al soluției necunoscute sau mai bine două standarde având un pH ușor mai mare și mai mic decât necunoscutul una, pentru a minimiza posibilul comportament „non-ideal” al electrodului în sine. De fapt, se poate întâmpla ca panta liniei drepte care leagă forța electromotivă a celulei create pentru măsurare de pH să fie ușor diferită de valoarea „ Nernstiană ” ( ), egal cu 59,16 mV la 25,00 ° C.
pH-ul tonifierii
Valoarea pH-ului corespunzătoare schimbării culorii unui indicator se numește pH tonifiant : această valoare este, prin urmare, utilă pentru a determina care indicator este cel mai potrivit pentru a fi utilizat la o titrare între un acid și o bază. De fapt, pH-ul schimbării culorii ar trebui să corespundă punctului de echivalență, atunci când echivalenții celor două componente sunt egale ca număr.
Protoni acizi din compușii organici

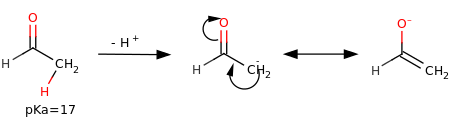
În compușii organici, de obicei, protonii legați de carboni au o aciditate scăzută, totuși unii dintre ei sunt capabili să se poată desprinde de moleculă (de unde și aciditatea lor) cu o anumită ușurință. Chiar dacă aciditatea nu este comparabilă cu un acid puternic (pKa <1), fenomenul devine important atunci când acestea intră în contact cu o bază de rezistență moderată, capabilă să detașeze protonul. Acest aspect este de interes, deoarece reacțiile acido-bazice sunt importante în chimia organică .
Mai sus este prezentată detașarea unui proton în alfa de un carbonil , cu pKa = 17, care în comparație cu aciditatea protonilor unui alcan (pKa≈50) este mult mai mică. Desprinderea în acest caz poate fi explicată prin observarea faptului că carbanionul este stabilizat printr-o rezonanță , în special printr - un tautomerism ceto-enol . [4]
Notă pentru completitudine
Scara pH-ului internațional se bazează pe concentrații exprimate în mol / kg în loc de mol / L. Acest lucru se datorează faptului că concentrațiile pot fi măsurate în termeni de masă mult mai precis decât în termeni de volum. Deși, în cele mai multe scopuri practice, această diferență este irelevantă.
Note istorice și etimologice
A apărut o întrebare cu privire la etimologia termenului pH. Potrivit unora, „p” ar indica pur și simplu operatorul matematic descris mai sus, în timp ce alții consideră că înseamnă „pondus” („greutate” în latină) sau „putere” (putere în engleză). Aceste ultime două interpretări sunt oarecum ilogice, deoarece Sørensen a publicat doar în trei limbi: germană, franceză și daneză. Interesant este că Sørensen a folosit adesea „q” în loc de „p” pentru a desemna electrodul de referință (hidrogen).
Inițial Sørensen a folosit ca simbol „ Ph ”, care apoi a schimbat „ PH ” și abia în anii douăzeci a devenit „ pH-ul ” definitiv, unde „ p ” are binecunoscuta funcție de operator matematic.
Notă
- ^ Silvestroni , p. 424 .
- ^(RO) IUPAC Gold Book, "pH"
- ^ Silvestroni , p. 425 .
- ^ Ch21: Aciditatea hidrogenilor alfa
Bibliografie
- Paolo Silvestroni, Fundamentals of chemistry , ed. A X-a, CEA, 1996, ISBN 88-408-0998-8 , ..
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « pH »
Wikționarul conține dicționarul lema « pH » -
 Wikimedia Commons conține imagini sau alte fișiere cu pH
Wikimedia Commons conține imagini sau alte fișiere cu pH
linkuri externe
- Determinarea acidității sucului de lămâie , pe itchiavari.org .
- Fun Science Gallery - Experimente cu acizi și baze , pe funsci.com . Adus la 19 octombrie 2010 (arhivat din original la 20 octombrie 2010) .
| Controlul autorității | Tezaur BNCF 32910 · LCCN (EN) sh85063427 · BNF (FR) cb11944522b (data) |
|---|

![{\ displaystyle a_ {H ^ {+}} = \ gamma {\ frac {[H_ {3} O ^ {+}]} {C_ {H ^ {+}} ^ {0}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f3d4cad14b6bd0dab156faf9219cf12c0c451b29)
![[H_ {3} O ^ {+}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/16f048721398f4ee57fcd410f0ec4f4a1e3846d5)


![pH = - \ log _ {{10}} {\ frac {\ left [H_ {3} O ^ {+} \ right]} {C _ {{H ^ {+}}} ^ {0}}} = \ log _ {{10}} {{\ frac {C _ {{H ^ {+}}} ^ {0}} {\ left [H_ {3} O ^ {+} \ right]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5c5d44580fe44c0bddfeebcb356e2e807393a2d3)
![pH = - \ log _ {{10}} [H_ {3} O ^ {+}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/f8c0d937fa8a6fdad879aa15a464fd2c9ef9b1f6)

![K_ {w} = [H_ {3} O ^ {+}] [OH ^ {-}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/304d912d3773d702f8d6c37ea78a6321c6396065)


![{\ displaystyle pH = - \ log _ {10} [H ^ {+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/645372dffba272d2e09a6da6aff7063616b46270)
![{\ displaystyle [H ^ {+}] = 10 ^ {- 3.5} = 3.16 \ cdot 10 ^ {- 4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5892005732171b76ab090037544785ae84ffa530)