Acid cromic
| Acid cromic | |
|---|---|
| Caracteristici generale | |
| Formula moleculară sau brută | H 2 CrO 4 |
| Masa moleculară ( u ) | 118.01 |
| numar CAS | |
| Numărul EINECS | 231-801-5 |
| PubChem | 24425 |
| ZÂMBETE | O[Cr](=O)(=O)O |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
     | |
| Pericol | |
| Fraze H | 271 - 350 - 340 - 361f - 330 - 301 - 311 - 372 - 314 - 317 - 334 - 335 - 410 |
| Sfaturi P | 201 - 273 - 280 - 301 + 330 + 331 - 304 + 340 - 305 + 351 + 338 - 309 + 310 [1] |
Acidul crom este specia cu formula H 2 CrO 4 , unde cromul are un număr de oxidare +6; este o specie foarte oxidantă și corozivă . Este un acid format prin protonarea ionului cromat , [CrO 4 ] 2− , care nu poate fi izolat în formă pură. Acid cromic este de asemenea comună , dar nepotrivit numele folosit pentru trioxidul de crom , CrO 3. [2]
Structura
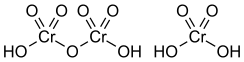
Structura moleculei H 2 CrO 4 se bazează pe coordonarea tetraedrică a atomului de crom și este reprezentată în cutie alături. În dimerul H 2 Cr 2 O 7 (acid dicromic) doi tetraedri sunt uniți prin împărțirea unui atom de oxigen.
Sinteză
Spre deosebire de CrO 3 oxidul de la care provine în mod formal, acid cromic nu poate fi izolat. Se prepară de obicei in situ prin adăugarea de acid sulfuric concentrat la o soluție de dicromat , o procedură utilizată în mod normal pentru prepararea amestecului cromic . Inițial culoarea se schimbă de la portocaliu (ion dicromat) la roșu, semnalând formarea acidului crom și a acidului dicromic. Ulterior, roșu închis cristalele de trioxid de crom (CrO 3) precipitat. Culoarea acestor specii se datorează benzilor de absorbție a tranziției sarcinii de tip LMCT.
Reactivitate
În H 2 CrO 4 cromul se află în starea sa maximă de oxidare , +6, iar acest lucru conferă soluții puternice proprietăți oxidante. Chimia acidului crom este destul de complexă. H 2 CrO 4 este forma total protonată a ionului cromat, [CrO 4 ] 2− și există doar în soluție puternic acidă. Nu poate fi izolat din cauza numeroaselor echilibre acido-bazice sau de condensare. În ceea ce privește echilibrele acido-bazice, H 2 CrO 4 este, în diferite privințe, similar cu acidul sulfuric, H 2 SO 4 . Ambii sunt considerați acizi puternici , deși numai primul proton este foarte acid:
PKa a acestui echilibru nu este bine cunoscut, și valori între -0.8 și 1.6 sunt raportate. [3] Determinarea constantei de forță ionică zero este complicată de faptul că jumătate din disociere are loc la pH aproape de zero, când concentrația protonului este apropiată de 1 mol / L. Al doilea proton se pierde la valori de pH cuprinse între 4 și 8 și, prin urmare, ionul [HCrO 4 ] - este un acid slab :
Chimia acestor specii este complicată de prezența echilibrelor care duc la formarea speciilor condensate, care la rândul lor sunt implicate în echilibrele acido-bazice. Cea mai simplă specie condensată este ionul dicromat care se formează odată cu eliberarea unei molecule de apă:
- 2 [HCrO 4 ] - ⇄ [Cr 2 O 7 ] 2− + H 2 O, log K D = 2,05.
Într-o soluție acidă, de asemenea, ionul dicromat se poate protona până la acid dicromic, H 2 Cr 2 O 7 ; ambele procese pot fi ignorate la pH> 4: [4]
Structura acidului dicromic H 2 Cr 2 O 7 este prezentată în cutie împreună cu H 2 CrO 4 .
În funcție de pH, se formează și speciile mai condensate [Cr 3 O 10 ] 2− și [Cr 4 O 13 ] 2− . Pe de altă parte, nu se formează specii cu conținut ridicat de nucleare, asemănătoare cu polioxometalații, observate în chimia vanadiului , molibdenului și tungstenului . [5]
Utilizări
Acidul cromic este o specie găsită în soluțiile utilizate pentru placarea cromată . Se găsește și în amestecul cromic , o soluție puternic oxidantă folosită pentru curățarea sticlăriei în laboratorul chimic . Cu toate acestea, amestecul cromic este din ce în ce mai puțin utilizat din motive de mediu. [6] Mai mult, amestecul poate lăsa urme de ioni paramagnetici Cr (III) care interferează în anumite tipuri de aplicații, cum ar fi spectroscopia RMN . În special, suporturile de probă RMN nu trebuie spălate cu un amestec cromic. [7]
Notă
- ^ Foaie compusă despre IFA-GESTIS Arhivat 16 octombrie 2019 la Arhiva Internet . accesat la 10.12.2014
- ^ (EN) Trioxid de crom , pe chemicalland21.com, Chemical Land21. Adus la 23 septembrie 2013 .
- ^ Baza de date a constantelor de stabilitate IUPAC , la acadsoft.co.uk . Adus la 16 decembrie 2010 .
- ^ F. Brito, J. Ascanio, S. Mateo, C. Hernández, L. Araujo, P. Gili, P. Martín-Zarza, S. Domínguez și A. Mederos, Echilibrul speciilor de cromat (VI) în mediu acid și Studii ab initio ale acestor specii , în Poliedru , vol. 16, n. 21, pp. 3835–3846, DOI : 10.1016 / S0277-5387 (97) 00128-9 . Adus la 16 decembrie 2010 .
- ^ CE Housecroft, AG Sharpe, Chimie anorganică , ediția a II-a, Harlow (Anglia), Pearson Education Limited, 2005, ISBN 0-13-039913-2 .
- ^ JM McCormick, Cleaning Glassware , pe chemlab.truman.edu . Adus la 18 decembrie 2010 (arhivat din original la 7 decembrie 2008) .
- ^ NMR-010: Proceduri de curățare adecvate pentru tuburile de probă RMN , pe wilmad-labglass.com . Adus la 18 decembrie 2010 (arhivat din original la 13 mai 2008) .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre acidul crom
Wikimedia Commons conține imagini sau alte fișiere despre acidul crom
linkuri externe
- ( EN ) Acid cromic , pe Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | Thesaurus BNCF 32179 · LCCN (EN) sh2013000232 |
|---|
![{\ displaystyle {\ ce {[Cr2O7] ^ 2- + 2H + <=> H2Cr2O7 <=> H2CrO4 + CrO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8e32b388975be1ef5636f90b3ad14b46fbd023fb)
![{\ displaystyle {\ ce {H2CrO4 <=> [HCrO4] - + H +}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a2d77838bc8fc1e7cf53ddc5e16b50c69eea1340)
![{\ displaystyle {\ ce {[HCrO4] - <=> [CrO4] ^ 2- + H +}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f66c99245753c659a6fa3be5ce95db3bccc0a603)
![{\ displaystyle {\ ce {[Cr2O7] ^ 2- + H + <=> [HCr2O7] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a26f2e11894f4277c987217888ebe67fcdac413)
![{\ displaystyle {\ ce {[HCr2O7] - + H + <=> H2Cr2O7}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8fdfa92f7888f14535b633951c4ed26114efcaae)
