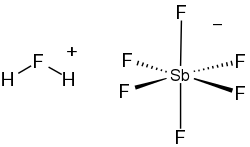
Acid fluoroantimonic
| Acid fluoroantimonic | |
|---|---|
| Numele IUPAC | |
| acid fluoroantimonic | |
| Caracteristici generale | |
| Formula moleculară sau brută | HSbF 6 |
| Masa moleculară ( u ) | 236.808 |
| Aspect | gaz incolor |
| numar CAS | |
| Numărul EINECS | 241-023-8 |
| PubChem | 6337100 |
| ZÂMBETE | F[Sb-](F)(F)(F)(F)[FH+] |
| Proprietăți fizico-chimice | |
| Constanta de disociere a acidului (pKa) la 298 ° K | > −25 |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
   | |
| Pericol | |
| Fraze H | 300 + 310 + 330 - 314 - 410 |
| Sfaturi P | 260 - 264 - 273 - 280 - 284 - 301 + 310 [1] |
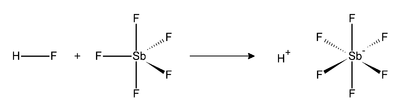
Acidul fluoroantimonic HSbF 6 este un amestec de acid fluorhidric și pentafluorură de antimoniu în proporții diferite. [2] Amestecul 1: 1 este cel mai puternic superacid . Reacția dintre HF și SbF 5 este exotermă. HF își eliberează protonul ( H + ) în timp ce baza sa conjugată (F - ) este sechestrată de una sau mai multe molecule de SbF 5 pentru a da octaedrul SbF 6 - . Acest anion este clasificat ca necoordonator, deoarece este atât un nucleofil foarte slab, cât și o bază foarte slabă. În practică, protonul rămâne „gol”, iar acest lucru determină aciditatea extremă a compusului. Acidul fluorantimonic este de 20 miliarde miliarde de ori mai puternic decât acidul sulfuric 100%.
Reacția dintre acidul fluorhidric și pentafluorură de antimoniu are loc după cum urmează:
Structura
Două produse înrudite au fost cristalizate din soluții de HF-SbF 5 și ambele au fost analizate printr-o cristalografie la raze X cu un singur cristal. Aceste săruri au formulele [H 2 F + ] [Sb 2 F 11 - ] și [H 3 F 2 + ] [Sb 2 F 11 - ]. La ambele săruri anionul este Sb 2 F 11 - . [3] După cum sa menționat mai sus, SbF 6 - este clasificat ca o bază slabă; monoanionul mai mare Sb 2 F 11 - de așteptat să fie și mai slab.
Comparație cu alți acizi
Următoarele valori [ citate ] se bazează pe funcția de aciditate a lui Hammett . Aciditatea este indicată de valorile negative ridicate H 0 .
Pentru comparație, acidul sulfuric (utilizat ca referință pentru definiția superacidului) are o valoare de -12.
- Acid fluoroantimonic (1990) (H 0 = -31,3)
- Acid magic (1974) (H 0 = -19,2)
- Carborane superacide (1969) (H 0 = -18,0)
- Acid fluorosulfonic (1944) (H 0 = -15,1)
- Acid triflic (1940) (H 0 = -14,9)
Aplicații
Acest superacid extraordinar este capabil să protoneze aproape toți compușii organici . În 1967, Bickel și Hogeveen au arătat cum HF-SbF 5 elimină H 2 din izobutan și metan din neopentan : [4] [5]
Siguranță
HF-SbF 5 este descompus rapid de apă cu o reacție explozivă violentă. Teoretic reacționează cu toți solvenții cunoscuți. [2] Solvenții care s-au dovedit a fi compatibili cu HF-SbF 5 sunt clorofluorosulfura și dioxidul de sulf lichefiat. Fluorocarburile au fost, de asemenea, utilizate ca solvenți. Containerele pentru HF-SbF 5 sunt fabricate din PTFE .
Notă
- ^ Sigma Aldrich; rev. din 28.11.2012
- ^ a b Olah , GA; Prakash, GKS; Wang, Q.; Li, X. „Fluorură de hidrogen - fluorură de antimoniu (V)” în Enciclopedia reactivilor pentru sinteza organică (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002 / 047084289.
- ^ Mootz, D.; Bartmann, K., The Fluoronium Ions H 2 F + and H 3 F 2 + : Characterization by Crystal Structure Analysis , în Angewandte Chemie, ediția internațională în limba engleză , vol. 27, 1988, pp. 391–392, DOI : 10.1002 / anie . 198803911 .
- ^ Bickel, AF; Gaasbeek, CJ; Hogeveen, H.; Oelderik, JM; Platteeuw, JC, Chimie și spectroscopie în soluții puternic acide: reacție reversibilă între ioni carboniu alifatic și hidrogen , în Chemical Communications , vol. 1967, 1967, pp. 634-5, DOI : 10.1039 / C19670000634 .
- ^ Hogeveen, H.; Bickel, AF, Chimie și spectroscopie în soluții puternic acide: substituție electrofilă la alcan-carbon cu protoni , în Chemical Communications , vol. 1967, 1967, pp. 635-6, DOI : 10.1039 / C19670000635 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre acid fluoroantimonic
Wikimedia Commons conține imagini sau alte fișiere despre acid fluoroantimonic