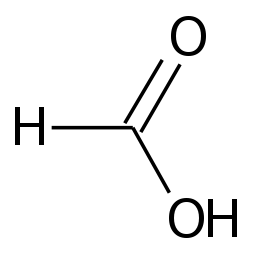
Acid formic
| Acid formic | |
|---|---|
| Numele IUPAC | |
| acid metanoic | |
| Caracteristici generale | |
| Formula moleculară sau brută | CH 2 O 2 |
| Masa moleculară ( u ) | 46.03 |
| Aspect | lichid incolor |
| numar CAS | |
| Numărul EINECS | 200-579-1 |
| PubChem | 284 |
| DrugBank | DB01942 |
| ZÂMBETE | C(=O)O |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.22 |
| Constanta de disociere a acidului la 298 K. | 1,77 × 10 −4 |
| Solubilitate în apă | complet solubil |
| Temperatură de topire | 8,4 ° C (281,5 K) |
| Δ fus H 0 (kJ mol −1 ) | 12.7 |
| Δ fus S 0 (J K −1 mol −1 ) | 45.1 |
| Temperatura de fierbere | 100,8 ° C (373,9 K) |
| Δ eb H 0 (kJ mol −1 ) | 22.7 |
| Δ eb S 0 (J K −1 mol −1 ) | 119,8 |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −425,0 |
| Δ f G 0 (kJ mol −1 ) | −361,4 |
| S 0 m (J K −1 mol −1 ) | 129,0 |
| C 0 p, m (J K −1 mol −1 ) | 99,0 |
| Informații de siguranță | |
| Punct de flacără | 48 ° C (321 K) |
| Limite de explozie | 12 - 38% vol. |
| Temperatură de autoaprindere | 480 ° C (753 K) |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 226 - 302 - 314 - 331 |
| Sfaturi P | 210 - 280 - 303 + 361 + 353 -304 + 340 + 310 - 305 + 351 + 338 -403 + 223 [1] |
Acidul formic (sau acidul metanoic , conform nomenclaturii IUPAC ) este cel mai simplu dintre acizii carboxilici cu formula chimică HCOOH. Sărurile sale se numesc „formate”.
Este un lichid incolor cu miros înțepător, este coroziv și, dacă este ținut în contact cu pielea, provoacă arsuri, distrugând întreaga grosime a țesutului pielii. Este un agent de reducere puternic.
Își datorează numele furnicilor , în al căror organism este sintetizat și folosit ca otravă înțepătoare.
Proprietate
Acidul formic este un lichid incolor cu miros pătrunzător și penetrant [2] la temperatura camerei. Este miscibil în glicerol , acetat de etil , metanol și apă ; este foarte solubil în acetonă . În hidrocarburi și în faza de vapori este format din dimeri legați între ei prin legături de hidrogen, mai degrabă decât molecule unice. [3] [4] Din acest motiv, acidul formic gazos nu respectă legea ideală a gazelor . [4] Acidul formic solid, care poate exista în ambele polimorfe , este alcătuit dintr-o rețea practic infinită de molecule de acid formic. Acidul formic lichid tinde să copleșească .
Producție
A fost obținut pentru prima dată în 1670 din distilarea distructivă a furnicilor.
Acidul formic este produs prin reacția mai întâi a metanolului cu monoxid de carbon la 80 ° C și la o presiune de 40 atm în faza lichidă:
Se formează formiat de metil , un derivat, care ulterior este hidrolizat :
Deoarece este necesară o cantitate mare de apă pentru hidroliză, este de preferat să se reacționeze mai întâi formatul cu amoniac pentru a forma formamida :
Apoi, formamida este hidrolizată cu apă și acid sulfuric :
O altă metodă este de a reacționa monoxidul de carbon cu hidroxidul de sodiu pentru a forma formiat de sodiu
Acesta din urmă este apoi reacționat cu acid sulfuric pentru a produce acid formic:
În biochimie, formatul este produs din oxalat într-un mediu acid datorită acțiunii enzimei oxalat decarboxilază . Din reacție se produce și dioxid de carbon .
Utilizări
Principala utilizare a acidului formic este ca agent conservant și antibacterian în hrana animalelor de crescătorie. Vaporizat pe fân sau alte furaje, oprește unele procese de fermentare. În industria păsărilor de curte, uneori se adaugă hrană pentru a ucide bacteriile salmonella .
Printre aditivii alimentari este identificat prin inițialele E 236 .
În apicultură este folosit în lupta împotriva Varroa destructor . Dificultatea și pericolul administrării limitează utilizarea acestuia.
Unele păsări, inclusiv corbul și jayul , provoacă puternic furnicile, care, în încercarea de a respinge hărțuitorul, pulverizează acid formic împotriva acestuia. Această practică este cunoscută sub numele de Anting sau baie ant . Pasărea folosește acidul pentru a scăpa de paraziți. [5] [6]
Formatele, sărurile derivate din acidul formic, sunt utilizate în industria de bronzare a textilelor, hârtiei, cauciucului, plasticului și pielii. Unii dintre esterii săi se folosesc ca arome artificiale și ca parfumuri.
Notă
- ^ foaie informativă cu acid formic pe IFA-GESTIS Arhivat 16 octombrie 2019 la Internet Archive .
- ^ OSHA Ocupational Chemical Database - Administrarea securității și sănătății ocupaționale , la www.osha.gov .
- ^ Werner Reutemann și Heinz Kieczka, Formic Acid , în Ullmann's Encyclopedia of Industrial Chemistry , 2000, DOI : 10.1002 / 14356007.a12_013 , ISBN 978-3-527-30673-2 .
- ^ a b Roman M. Balabin, izomer polar (aciclic) al dimerului acidului formal: studiu de spectroscopie Raman în fază gazoasă și parametri termodinamici , în Jurnalul de chimie fizică A , vol. 113, nr. 17, 2009, pp. 4910–8, Bibcode : 2009JPCA..113.4910B , DOI : 10.1021 / jp9002643 , PMID 19344174 .
- ^ Fundația Ecospirituality , pe eco-spirituality.org . Adus la 26 septembrie 2007 (arhivat din original la 21 iunie 2007) .
- ^ Pădurile Buccheri , pe isaporidisicilia.com . Adus pe 29 martie 2012 .
Bibliografie
- ( EN ) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chimie , ediția a IV-a, Wiley-VCH, 2003, pp. 42-46, ISBN 3-527-30578-5 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre acidul formic
Wikimedia Commons conține imagini sau alte fișiere despre acidul formic
linkuri externe
- ( EN ) Acid formic , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | Tezaur BNCF 32773 · LCCN (EN) sh85050819 · GND (DE) 4261520-3 · BNF (FR) cb122285920 (data) |
|---|