Dioxid de carbon
| Dioxid de carbon | |
|---|---|
| Numele IUPAC | |
| dioxid de carbon | |
| Denumiri alternative | |
| dioxid de carbon dioxid de carbon gaze sălbatice | |
| Caracteristici generale | |
| Formula moleculară sau brută | CO 2 |
| Masa moleculară ( u ) | 44.010 [1] |
| Aspect | gaz incolor |
| numar CAS | |
| Numărul EINECS | 204-696-9 |
| PubChem | 280 |
| DrugBank | DB09157 |
| ZÂMBETE | C(=O)=O |
| Proprietăți fizico-chimice | |
| Densitate (kg m −3 , în cs ) | 1,9763 (0 ° C), 1,8714 (15 ° C), 1,8075 (25 ° C) [2] |
| Solubilitate în apă | 1,688 g / L la 20 ° C (293,15 K), 1,48 g / L la 25 ° C (298,15 K) [3] |
| Temperatură de topire | 216,59 K (−56,56 ° C) în punctul triplu [4] |
| Temperatura de fierbere | 194,7 K (−78,5 ° C) sublimează [4] |
| Punct triplu | 216,5 K (−56,6 ° C) 5,18 × 10 5 Pa |
| Punct critic | 304,13 K (30,98 ° C) 7.375 × 10 6 Pa [4] |
| Presiunea de vapori ( Pa ) la 293 K. | 5,73 × 10 6 |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | −393,51 [1] |
| Δ f G 0 (kJ mol −1 ) | −394,36 [1] |
| S 0 m (J K −1 mol −1 ) | 213,74 [1] |
| C 0 p, m (J K −1 mol −1 ) | 37.11 [1] |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 280 |
| Sfaturi P | 410 + 403 [5] |
Dioxidul de carbon (cunoscut și ca dioxid de carbon sau, mai corect, dioxid de carbon ; formula chimică CO₂ ) este un oxid acid [6] a cărui moleculă este formată dintr-un atom de carbon ( simbol : C) legat de doi atomi de oxigen (O). În special, de o importanță fundamentală în procesele vitale ale plantelor și animalelor , această substanță este implicată în fotosinteză (din care oxigen și vapori de apă [7] ) și este produsă în timpul respirației , precum și este produsă în majoritatea arderilor .
Produs de activitățile umane, este considerat principalul gaz cu efect de seră din atmosfera terestră [8] (producția sa necontrolată ar duce la o creștere a efectului de seră , care contribuie cu 70% la încălzirea globală [9] ); deși există gaze cu efect de seră potențial mai periculoase (cum ar fi metanul [9] , trifluorura de azot [10] și perfluorotributilamina [11] ), acestea sunt prezente în atmosferă în concentrații mult mai mici decât dioxidul de carbon. În cele din urmă, trebuie remarcat faptul că, în nomenclatura IUPAC de astăzi, termenul de dioxid de carbon este acum învechit; termenul anhidridă , pe de altă parte, desemnează o clasă specifică de compuși organici (de care dioxidul de carbon nu aparține, fiind un compus anorganic ). În general, cantitatea de dioxid de carbon din atmosfera Pământului trebuie să fie la un nivel echilibrat: dacă ar fi prea mult, Pământul s-ar supraîncălzi și ar putea suferi un efect de seră extrem și incontrolabil ca cel al lui Venus , în timp ce dacă ar fi prea puțin. , plantele nu mai puteau folosi fotosinteza pentru a produce oxigen, făcând planeta nelocuibilă.
fundal
Comportamentul dioxidului de carbon a fost descris pentru prima dată de chimistul belgian Jean Baptiste van Helmont în 1638 , [12] care l-a identificat ca un gaz diferit de celelalte gaze cunoscute și produs în timpul proceselor de ardere și fermentare. [13]
În 1750 chimistul britanic Joseph Black a determinat căldura latentă și valoarea specifică a căldurii dioxidului de carbon, numindu-l aer fix [12] [14] (datorită faptului că dioxidul de carbon la temperaturi scăzute poate deveni „fix”, adică se solidifică ). În 1772 Joseph Priestley a jucat „ absorbția dioxidului de carbon în apă , obținând pentru prima dată” apă carbogazoasă . [12] În 1781 Antoine-Laurent de Lavoisier a descoperit reacția de formare a dioxidului de carbon pornind de la componentele sale elementare carbon și oxigen . [12] În 1866 Thaddeus Lowe a dezvoltat un ciclu de refrigerare cu dioxid de carbon, utilizat pentru producerea de gheață . [15]
Creșterea efectului de seră atribuită producției de dioxid de carbon a fost subliniată în 1896 de Svante Arrhenius , care a raportat concentrația de dioxid de carbon din atmosferă cu temperatura atmosferei. [16] Această relație a fost clarificată în continuare de multe studii ulterioare; în special,Organizația Meteorologică Mondială (OMM) a arătat o creștere constantă a concentrației de dioxid de carbon în atmosferă, de la valoarea de 280 ppm înainte de a doua revoluție industrială până la valoarea record de 407,8 ppm în 2018, niciodată atinsă până acum în ultimii 800.000 de ani. [17] [18]
Caracteristici fizico-chimice

La temperatura ambiantă și presiune , dioxidul de carbon este un incolor și inodor gaz . [5] La concentrații mari, reacționând parțial cu apa mucoaselor gurii , produce acid carbonic , astfel respirația într-o atmosferă deosebit de bogată în CO₂ produce un gust acru în gură și un sentiment de iritație în nas. , faringelui și laringelui .
Formula sa chimică este C O ₂. Molecula de dioxid de carbon este liniară; fiecare dintre cei doi atomi de oxigen este legat printr-o legătură dublă covalentă la atomul de carbon. Unghiul de legătură neutralizează cele două momente dipolare opuse ale fiecărei legături duble C = O, deci molecula este global apolară . Atomul de carbon din molecula de dioxid de carbon are numărul de oxidare +4, deci se află la cea mai înaltă stare de oxidare posibilă. În consecință, dioxidul de carbon este neinflamabil și chimic relativ inert la temperaturi obișnuite. [13]
Densitatea dioxidului de carbon la temperatura și presiunea ambiantă este de aproximativ o dată și jumătate decât cea a aerului; [14], prin urmare, tinde să se stratifice pe fundul mediilor închise și neventilate. În faza solidă, la temperaturi peste -78 ° C și la presiunea ambiantă, nu se topește, ci se sublimează . Dioxidul de carbon solid este denumit în mod obișnuit „ gheață uscată ” și sub această formă are o densitate de 1562 kg / m³. Cu toate acestea, dioxidul de carbon poate fi lichefiat prin supunerea acestuia la presiuni ridicate la temperaturi sub 31 ° C și în această formă are o densitate de 1022 kg / m³. [19]
Prezență în natură
Atmosfera

În ciuda concentrației sale mici, CO₂ este o componentă fundamentală a atmosferei terestre, deoarece - împreună cu vapori de apă , metan și alte gaze cu efect de seră - captează radiațiile infraroșii din lumina soarelui și o reflectă înapoi la suprafața pământului (așa-numitul „ efect de seră ” ), împiedicând suprafața Pământului să sufere marile variații termice ale ritmului zi-noapte. Mai mult, dioxidul de carbon participă la ciclul carbonului , care permite schimbul de carbon între ființele vii și mediul înconjurător. [8] Creșterea concentrației sale în atmosferă cauzată de activitățile umane, care a fost observată de la revoluția industrială [8], a provocat în schimb dezechilibre grave în ciclul natural, în special prin favorizarea încălzirii globale și a fenomenelor sale legate de ca schimbări climatice catastrofale, topirea ghețarilor, creșterea nivelului mării, modificarea habitatelor naturale și, prin urmare, dispariția multor specii vii).
Eliberarea de dioxid de carbon în atmosferă se datorează atât cauzelor naturale (inclusiv: vulcani , gheizere , fumarole și dizolvarea rocilor carbonatice ), cât și antropice (inclusiv centrale electrice pe cărbune și poluarea vehiculelor). Vulcanii au fost primele surse de dioxid de carbon atmosferic ale Pământului nou-născut, datorită acestuia a fost posibil să se stabilească un climat favorabil dezvoltării vieții . Astăzi, vulcanii eliberează în atmosferă aproximativ 130 - 230 de milioane de tone de dioxid de carbon în fiecare an, dar această cantitate reprezintă mai puțin de 1% din cantitatea totală de dioxid de carbon eliberată în atmosferă de activitățile umane, care este egală cu 27 miliarde de tone. an: 50.000 tone pe minut. [ fără sursă ]
În martie 2013, concentrația măsurată de dioxid de carbon în atmosfera terestră a fost de aproximativ 399 ppm . [20] Datorită extinderii mai mari a terenului și, prin urmare, a suprafeței mai mari ocupate de vegetație, în emisfera nordică a Pământului există o fluctuație a concentrației de dioxid de carbon de aproximativ 5 ppm pe parcursul anului, care atinge minimul său în luna mai, grație activității fotosintetice intense a plantelor, iar maximul său în octombrie, la sfârșitul sezonului vegetativ al emisferei nordice, când biomasa vegetală a planetei este la valoarea sa maximă. Se presupune că concentrația atmosferică de dioxid de carbon înainte de revoluția industrială a fost de 280 ppm și, prin urmare, a crescut cu 35% de la revoluția industrială și cu 20% din 1958 . Arderea combustibililor fosili ( cărbune , petrol ) ar fi prima cauză a acestei creșteri cu 64%, în timp ce defrișările ar fi a doua cu 34% [21] .
Teoria încălzirii globale apare în literatura științifică pentru prima dată la sfârșitul secolului al XIX-lea . Creșterea cantității de dioxid de carbon din atmosferă crește efectul de seră și, prin urmare, contribuie la creșterea temperaturii medii a planetei, la care ecosistemele nu au timp să se adapteze. Amploarea acestui efect este încă în discuție, dar credința pe scară largă că trecem de fapt printr-o fază de încălzire generalizată a climatului Pământului a determinat multe țări din întreaga lume să semneze Protocolul de la Kyoto , un acord în care națiunile se angajează să limitează și reduce emisiile de dioxid de carbon, astfel încât concentrația acestuia să rămână sub 450 ppm: în ultimul deceniu (1999-2009) nivelul de dioxid de carbon din aer a crescut cu 2 ppm pe an și este în continuă accelerare. Dacă emisiile nu sunt reduse în conformitate cu acordurile, nivelul pragului stabilit în Kyōto va fi, prin urmare, depășit în jurul anului 2030. Conform celor mai populare modele climatologice, depășirea acestui prag ar duce la creșterea temperaturii medii a pământului cu două grade, iar nivelul mării să crească cu cel puțin un metru până în 2040. Alte studii, acum considerate mai puțin probabile, prezic până la 6 grade de creștere a temperaturii și până la 3 metri de creștere a mării. [ fără sursă ]
Oceanele
Oceanele terestre conțin cantități enorme de dioxid de carbon sub formă de ioni bicarbonat și carbonat, mai mult decât există în atmosferă. Ionul hidrogen carbonat este produs de acțiunea dioxidului de carbon liber asupra rocilor de calcar - un exemplu este reacția de dizolvare a carbonatului de calciu:
Prin reacții de acest gen, oceanele tamponează modificările concentrației de dioxid de carbon din atmosferă; reacția este de fapt reversibilă. De sute de milioane de ani acest proces a produs cantități enorme de roci formate din carbonați care au ajuns să se așeze pe fundul mării. Pe măsură ce concentrația de dioxid de carbon din atmosferă crește, cantitatea de ioni de hidrogen carbonat prezenți în apele marine crește odată cu scăderea consecventă a pH - ului , fenomen cunoscut sub numele de acidifiere oceanică . Se crede că creșterile temperaturii și acidității sunt la originea morții recifelor de corali observate în ultimii ani în multe zone tropicale ale planetei.

Distribuția în sistemul solar

Dioxidul de carbon este prezent în concentrații mari pe planeta Venus , unde constituie 96,4% din atmosferă . [22] Datorită dioxidului de carbon, efectul de seră asupra lui Venus este deosebit de intens și acest lucru înseamnă că planeta este cea mai fierbinte din sistemul solar , cu 750 K (corespunzând la 475 ° C ). [23]
Atmosfera de pe Marte, pe de altă parte, conține o cantitate mai mică de dioxid de carbon decât Venus, dar totuși considerabilă, egală cu 85,32%. Cu toate acestea, având în vedere masa redusă a acestei planete, este incapabilă să o rețină în atmosfera sa rarefiată: de fapt, acest procent derivă parțial din concentrația acestui gaz în capacele polare, formate în întregime din gheață uscată . Dioxidul de carbon este prezent și pe unii sateliți ai planetelor majore, de exemplu atmosfera din Callisto (satelitul lui Jupiter ) este compusă în esență din dioxid de carbon. [24]
Producție
Dioxidul de carbon este rezultatul arderii unui compus organic în prezența unei cantități de oxigen suficiente pentru a completa oxidarea . Poate fi produs și prin reacția unui carbonat sau bicarbonat cu un acid. [14] În natură, este produsă și de bacterii aerobe în timpul procesului de fermentație alcoolică și este produsul secundar al respirației . Plantele îl folosesc pentru fotosinteza care, combinând-o cu apa și prin acțiunea energiei solare ușoare și a clorofilei , o transformă în glucoză prin eliberarea oxigenului ca produs secundar.
Dioxidul de carbon este produs în principal din următoarele procese: [25]
- din arderea petrolului și cărbunelui; și mai ales de la centrale termoelectrice și autovehicule;
- ca produs secundar din instalațiile de producere a amoniacului și hidrogenului , în care metanul este transformat în dioxid de carbon;
- ca produs secundar al fermentației;
- prin descompunerea termică a CaCO3;
- ca produs secundar al producției de fosfat de sodiu ;
- ca produs secundar al proceselor de oxidare [26] [27] [28]
- direct din chiuvete naturale de dioxid de carbon.
Reactivitate
La presiunea ambiantă, apa este capabilă să absoarbă un volum aproximativ egal de dioxid de carbon și chiar mai mult sub presiune. Aproximativ 1% din dioxidul de carbon absorbit se transformă în acid carbonic , un acid slab , care la rândul său se disociază în ioni hidroxoniu , ioni hidrogen carbonat și ioni carbonat.
Din punct de vedere chimic, dioxidul de carbon este un reactiv electrofil . Reacționează cu reactivii Grignard și alți compuși organometalici pentru a da acizii carboxilici corespunzători
De asemenea, reacționează cu fenolul în reacția Kolbe pentru a da acid 2-hidroxibenzoic, adică acid salicilic , precursorul aspirinei .
La temperaturi peste 1700 ° C, dioxidul de carbon se transformă parțial în monoxid de carbon (CO) și oxigen (O). [13]
Aspect biologic

Dioxidul de carbon este un produs rezidual al organismelor care obțin energie din oxidarea zaharurilor sau a grăsimilor , un sistem de reacții care face parte din metabolismul lor, într-un proces numit respirație celulară . Acesta din urmă aparține plantelor , animalelor , multor ciuperci și unor bacterii . La animalele superioare, dioxidul de carbon se deplasează în sânge (în soluție ) din țesuturile corpului în plămâni , unde este expirat.
Dioxidul de carbon din aer este prezent într-o cantitate de aproximativ 0,04%, în timp ce în aerul expirat după o respirație este de aproximativ 4,5%. O atmosferă care conține mai mult de 5% dioxid de carbon este toxică pentru oameni și animale, deoarece saturează hemoglobina din sânge împiedicându-l să se lege de oxigen și blocând astfel oxigenarea țesuturilor. Din acest motiv, atât atunci când este utilizat sub formă gazoasă, cât și când este utilizat ca gheață uscată, dioxidul de carbon trebuie manipulat în spații bine ventilate. Limitele stabilite de OSHA (agenția SUA pentru siguranța la locul de muncă) pentru concentrația de dioxid de carbon la locul de muncă sunt de 0,5% (5000 ppm, 9000 mg / mc TLV- TWA [4] ) pentru expunerea continuă. Limita STEL este de 3% (30000 ppm [4] ). Cu toate acestea, dioxidul de carbon este mult mai puțin toxic decât monoxidul de carbon (formula chimică: CO), care produce inconștiență în câteva minute și posibilitatea producerii de daune ireversibile și deces într-un timp scurt.
Cea mai mare parte a dioxidului de carbon prezent în sânge (72%) este prezentă sub formă de ion hidrogen carbonat , HCO 3 - , unde acționează ca un tampon pentru reglarea pH-ului din sânge, chiar dacă secundar puterii de tamponare a proteinelor care acoperiți 3/4 din total. Nivelul optim al ionului hidrogen carbonat este menținut prin viteza respirației și contracția sau dilatarea vaselor de sânge și a căilor pulmonare. Aproximativ 22% din CO₂ din organism se găsește sub formă de carbaminohemoglobină și 6% sub formă de CO free liber. În fiecare zi, corpul uman produce 12-15 mol de CO₂ (288-360 litri) în repaus și până la 50 mol în activitate fizică intensă. [ Fără sursă ] Când sunt expuse la lumină, plantele absorb dioxidul de carbon din atmosferă prin fotosinteză, prin care dioxidul de carbon și apa sunt transformate în glucoză și oxigen. Atât în prezență, cât și în absența luminii, plantele emit și dioxid de carbon ca urmare a respirației celulare.
Utilizări
Se folosește în formă solidă
Dioxidul de carbon solid (numit și gheață uscată sau zăpadă carbonică [14] ) este utilizat ca mediu de răcire, de exemplu pentru conservarea alimentelor, având avantajul că sublimul trece direct de la starea solidă la starea gazoasă și permite menținerea temperaturii la valori mai mici decât gheața . În special, poate atinge temperaturi cuprinse între -70 ° C și -80 ° C dacă este amestecat cu alcool etilic , acetonă sau alte lichide organice. [14] Dioxidul de carbon este, de asemenea, utilizat în efecte speciale pentru a crea efectul de ceață.
Dioxidul de carbon în stare solidă este, de asemenea, utilizat în curățarea suprafețelor prin metoda de sablare criogenică , în timpul căreia cristalele de dioxid de carbon sunt aruncate pe suprafață pentru a fi curățate de incrustări biologice, patine minerale sau alte depozite, eliminându-le datorită efectului dublu de abraziune și răcire puternică localizată care duce la contracția și rigidizarea părților afectate. Un avantaj al acestei metode în comparație cu sablarea tradițională este legat de faptul că gheața uscată utilizată ca nisip se sublimează imediat, reducând considerabil cantitatea de reziduuri de eliminat după intervenție.
Se utilizează sub formă lichidă
Într-o atmosferă bogată în dioxid de carbon, focul se stinge: din acest motiv, unele tipuri de stingătoare conțin dioxid de carbon lichid sub presiune la 73 atm . Vestele de salvare conțin adesea capsule de dioxid de carbon lichid, care sunt folosite pentru a se umfla rapid în caz de urgență.
Se utilizează sub formă gazoasă

Apele minerale spumante și băuturile răcoritoare carbogazoase își datorează efervescența adăugării de dioxid de carbon. Unele băuturi răcoritoare, inclusiv berea și vinurile spumante , conțin dioxid de carbon ca urmare a fermentației pe care au suferit-o.
Din nou, dioxidul de carbon este cel care face ca aluatul să crească; multe drojdii , naturale sau chimice, dezvoltă dioxid de carbon prin fermentare sau prin reacție chimică. Dioxidul de carbon și apa sunt materiile prime ale fotosintezei ; adesea aerul din sere este îmbogățit cu dioxid de carbon pentru a stimula creșterea plantelor; în plus, o atmosferă care conține aproximativ 1% dioxid de carbon este letală pentru mulți paraziți. Fertilizarea cu carbon este utilizată și în acvarii pentru a promova creșterea plantelor acvatice scufundate.
Dioxidul de carbon este utilizat ca fluid frigorific în sistemele de refrigerare și climatizare cu impact redus asupra mediului și este identificat prin abrevierea R-744. Utilizarea CO₂ ca fluid frigorific este supusă unor condiții speciale, deoarece are loc un ciclu transcritic . În plus, dioxidul de carbon este utilizat în unele tipuri de lasere industriale. În industrie, este utilizat ca reactiv împreună cu amoniac pentru producerea de carbamat de amoniu , [13] folosit la rândul său pentru a produce uree , [13] care găsește aplicații în producția de îngrășăminte și materiale plastice . [13] În cele din urmă, în industrie, amestecat cu argon sau pur, este folosit ca gaz inert pentru protecția / pătrunderea băii în timpul sudării ( arc deschis ). Printre aditivii alimentari este identificat prin inițialele E 290 .
Captură și confiscare
Principala metodă de eliminare a unor cantități uriașe de dioxid de carbon este fotosinteza clorofilei efectuată de plante: acest proces implică lumină, dioxid de carbon și apă, transformându-le în oxigen și glucoză ; prin urmare, constă în plantarea și / sau conservarea pădurilor de defrișări și incendii . Acesta este cel mai simplu, mai ieftin și mai spontan mod care sa întâmplat practic în mod natural pe planeta noastră de când există plante. De asemenea, face parte din măsurile care pot fi adoptate în temeiul Protocolului de la Kyoto pentru a respecta restricțiile privind emisiile de CO₂ de către fiecare țară.
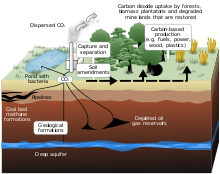
Sunt studiate metode artificiale, aparținând așa-numitei „ geoinginerii ”, pentru captarea și sechestrarea carbonului (în engleză Carbon Capture and Sequestration , prescurtat în CCS) cu scopul de a captura, transporta și stoca CO₂ pentru a contracara creșterea concentrația acestui gaz cu efect de seră în atmosferă. În acest caz, captarea dioxidului de carbon are loc în locurile în care este produsă în cantități mari: vapori de ardere (de exemplu centrale termoelectrice pe cărbune sau gaz) sau din reziduuri de rafinare; „sechestrarea” constă în injecția în subsol, unde dioxidul de carbon poate rămâne segregat datorită diferitelor mecanisme chimico-fizice.
Astăzi există trei situri principale de experimentare a sechestrării geologice , toate legate de industria petrolieră: Weyburn în Canada , In Salah în Algeria și Sleipner în offshore-ul norvegian . Cantitatea de dioxid de carbon sechestrată de aceste proiecte este de ordinul unui milion de tone pe an, în realitate o cantitate foarte modestă. Sleipner funcționează din 1995. Aceste metode nu elimină în mod formal dioxidul de carbon, ci necesită depozitarea acestuia în buzunare subterane care ar trebui să rețină molecula timp de mii de ani. [29]
Au fost făcute unele propuneri de inginerie pentru captarea dioxidului de carbon direct din atmosferă, dar evoluțiile, deși promițătoare, sunt abia la început. În prezent se desfășoară experimente pe prototipuri, [30] [31] [32] [33], dar nu este încă posibil să se prevadă dacă va fi posibil să le aplicăm pe scară largă.
Notă
- ^ a b c d e Atkins SH - Ediția 8
- ^ [1]
- ^ hmdb.ca , http://www.hmdb.ca/metabolites/HMDB0001967 .
- ^ a b c d și HSDB: dioxid de carbon , la toxnet.nlm.nih.gov .
- ^ a b Foaie compusă pe IFA-GESTIS [ link rupt ] accesat la 27.04.2017
- ^ sau anhidridă , conform nomenclaturii clasice (acum în uz)
- ^ [2]
- ^ a b c ( EN ) Agenția Statelor Unite pentru Protecția Mediului - Prezentare generală a gazelor cu efect de seră, a emisiilor de dioxid de carbon
- ^ a b La Repubblica.it Alarmă cu metan, „mai periculoasă decât dioxidul de carbon”
- ^ GreenStyle - NF3: un gaz cu efect de seră mai nociv decât CO2
- ^ Focus - PFTBA: cel mai periculos gaz cu efect de seră decât CO2
- ^ a b c d Istoria și proprietatea CO₂ Arhivat 19 noiembrie 2011 la Internet Archive .
- ^ a b c d e f Dioxid de carbon , pe britannica.com .
- ^ a b c d și dioxid de carbon , pe treccani.it .
- ^ Istoricul agentului frigorific CO2 , pe interfred.it . URL consultato il 31 agosto 2011 (archiviato dall' url originale il 24 dicembre 2011) .
- ^ Storia dell'effetto serra e del riscaldamento globale
- ^ Nuovo record delle emissioni dei gas serra , su public.wmo.int , 30 ottobre 2017.
- ^ ( EN ) Greenhouse gas concentrations in atmosphere reach yet another high , su World Meteorological Organization , 25 novembre 2019. URL consultato il 27 novembre 2019 .
- ^ Il ghiaccio secco Archiviato l'11 febbraio 2015 in Internet Archive .
- ^ CO2 Now
- ^ CDIAC - Frequently Asked Global Change Questions , su cdiac.ornl.gov . URL consultato il 2 maggio 2009 (archiviato dall' url originale il 20 gennaio 2013) .
- ^ Copia archiviata , su physics.infis.univ.trieste.it . URL consultato il 27 novembre 2010 (archiviato dall' url originale il 7 maggio 2009) .
- ^ Venere Archiviato il 27 ottobre 2011 in Internet Archive .
- ^ RW Carlson et al. , A Tenuous Carbon Dioxide Atmosphere on Jupiter's Moon Callisto ( PDF ), in Science , vol. 283, 1999, pp. 820–821, DOI : 10.1126/science.283.5403.820 , PMID 9933159 . URL consultato il 27 novembre 2010 (archiviato dall' url originale il 3 ottobre 2008) .
- ^ Pierantozzi .
- ^ The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts http://pubman.mpdl.mpg.de/pubman/item/escidoc:1896844:6/component/escidoc:1896843/JCAT-13-716_revised_06Dec2013.pdf ( PDF ), in Journal of Catalysis , vol. 311, 2014, pp. 369-385. URL consultato il 22 marzo 2018 (archiviato dall' url originale il 15 febbraio 2016) .
- ^ Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid ( PDF ), in Journal of Catalysis , vol. 285, 2012, pp. 48-60. URL consultato il 22 marzo 2018 (archiviato dall' url originale il 30 ottobre 2016) .
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts ( PDF ).
- ^ Un serbatoio contro l'effetto serra
- ^ First Successful Demonstration of Carbon Dioxide Air Capture Technology Achieved by Columbia University Scientist and Private Company Archiviato il 22 giugno 2010 in Internet Archive .
- ^ Machine to clean up greenhouse gas is breakthrough in war on global warming, say scientists
- ^ 1000 tonne/day - Machine Air Fuel Synthesis , su airfuelsynthesis.com . URL consultato il 7 agosto 2013 (archiviato dall' url originale il 20 agosto 2013) .
- ^ 30'000 tonnes/year Carbon Recycling International (CRI)
Bibliografia
- ( EN ) Ronald Pierantozzi, Kirk-Othmer Encyclopedia of Chemical Technology - Carbon Dioxide , Wiley, 2001.
- ( EN ) Michele Aresta, Carbon Dioxide as Chemical Feedstock , John Wiley & Sons, 2010, ISBN 3-527-62992-0 .
- ( EN ) Bhalchandra M. Bhanage, Masahiko Arai, Transformation and Utilization of Carbon Dioxide , Springer Science & Business Media, 2014, ISBN 3-642-44988-3 .
- ( EN ) Kyung Cho, Irvin F. Hawkins, Carbon Dioxide Angiography: Principles, Techniques, and Practices , CRC Press, 2007, ISBN 1-4200-1626-1 .
Voci correlate
- Quoziente respiratorio
- Effetto serra
- Gas serra
- Ghiaccio secco
- Laser ad anidride carbonica
- Stati per emissioni di CO2
- Monossido di carbonio
- Carbaminoemoglobina
Altri progetti
-
 Wikiquote contiene citazioni di o su anidride carbonica
Wikiquote contiene citazioni di o su anidride carbonica -
 Wikimedia Commons contiene immagini o altri file su anidride carbonica
Wikimedia Commons contiene immagini o altri file su anidride carbonica
Collegamenti esterni
- ( EN ) Anidride carbonica , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Centro Studi Galileo - CO2 come gas refrigerante
- ( EN ) Informazioni sul ghiaccio secco , su dryiceinfo.com .
- ( EN ) Scheda informativa OSHA , su osha.gov .
- ( EN ) Bassam Z. Shakhashiri: Il composto della settimana: l'anidride carbonica
- ( EN ) Keeling, CD and TP Whorf: Controllo sull'anidride carbonica atmosferica dall'osservatorio di Manua Loa, 2002
- ( EN ) Aggiornamenti da Mauna Loa 2004 , su usatoday.com .
- ( EN ) Catalogo delle Emissioni Naturali di CO2 in Italia - [3] Archiviato il 13 febbraio 2021 in Internet Archive .
- ( EN ) Emissioni di CO2 negli ultimi 40 anni per nazione e attività , su enviroware.com .
- Video sulla cattura e il sequestro della CO2 [4]
| Controllo di autorità | Thesaurus BNCF 31199 · LCCN ( EN ) sh85020108 · GND ( DE ) 4031648-8 · NDL ( EN , JA ) 00568539 |
|---|