Azeotrop

Un azeotrop [1] (din greacă: α- : non, ζέειν : fierbe și τρόπος : schimbare, deci „fierbe neschimbat” sau „fără schimbare în timpul fierberii”), sau amestecul azeotrop este un amestec de două sau mai multe lichide pe care le nu modificați compoziția lor prin simpla distilare [2] . Termenul a fost inventat în 1911 de chimiștii britanici John Wade și Richard William Merriman. [3]
Azeotrop de minim și maxim
Un azeotrop se formează atunci când apar fenomene de atracție sau repulsie între moleculele celor două sau mai multe substanțe care îl compun, datorită formării de legături intermoleculare ; datorită acestor legături, comportamentul amestecului se abate de la condițiile ideale definite de legea lui Raoult .
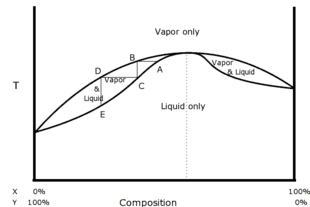
Azeotropul poate avea un punct de fierbere mai mic sau mai mare decât oricare dintre componentele amestecului. În primul caz se numește azeotrop cu fierbere scăzută sau azeotrop minim sau azeotrop pozitiv , în al doilea azeotrop cu fierbere ridicată sau azeotrop maxim sau azeotrop negativ . Expresiile minime sau maxime se referă la faptul că într-o diagramă Tx un amestec azeotrop are un punct minim sau maxim (extremele excluse). Rețineți că, într-o diagramă Px, pe de altă parte, concavitatea este inversată. Termenii azeotrop pozitiv și azeotrop negativ se referă în schimb la faptul că în cele două cazuri avem abateri pozitive și negative de la legea lui Raoult .
Omogenitatea azeotropului
Datorită acestei particularități, un azeotrop se comportă ca o substanță în sine. În special, abaterea de la idealitatea exprimată de legea lui Raoult pentru sistemele azeotropice devine extremă, precum și abaterea coeficienților de activitate γi de la valoarea unitară (idealitatea amestecului lichid): în sisteme suficient de ne-ideale, diagramele Tx prezintă maxime sau minime (azeotrope cu fierbere ridicată și fierbere scăzută). În aceste puncte extreme, compozițiile fazei lichide și a vaporilor în echilibru între ele sunt identice și apar condițiile azeotrope. Pentru astfel de sisteme se știe de fapt că
- Y i = X i pentru i = 1 ... n
Spre deosebire de un amestec generic de două lichide diferite, un azeotrop nu poate fi separat în componentele sale prin distilare simplă. Temperatura de fierbere și concentrația azeotropică depind de presiunea externă.
Exemple de amestecuri azeotrope
Un exemplu obișnuit de azeotrop cu fierbere scăzută este cel format dintr-un amestec format din 95,6% din masă de etanol și 4,4% din apă . Punctele de fierbere ale etanolului și apei sunt de 78,4 ° C și respectiv 100 ° C, în timp ce punctul de fierbere al azeotropului lor este de 78,1 ° C (deci avem un azeotrop minim ).
Un exemplu de azeotrop dur este dat de amestecul de acid clorhidric la 20,2% din masă și apă la 79,8%. Punctele de fierbere ale acidului clorhidric și ale apei sunt respectiv -84 ° C și 100 ° C, în timp ce azeotropul lor fierbe la 110 ° C.
În unele cazuri, se poate observa și un "azeotrop dublu". Acesta este cazul amestecului benzen - hexafluorobenzen .

Separarea amestecurilor azeotrope
Prin distilarea unui amestec care poate forma azeotrop, compoziția distilatului este mai aproape de compoziția azeotropă decât compoziția furajului. De exemplu, dacă distilăm un amestec 80:20 de etanol-apă, vom obține un distilat îmbogățit cu etanol. Dar dacă distilăm un amestec 97: 3 de etanol-apă, vom obține un distilat epuizat de etanol sau, în ambele cazuri, ne apropiem de compoziția azeotropă. Aceasta înseamnă că putem separa amestecurile de etanol și apă prin distilare numai dacă dorim să obținem o puritate în etanol mai mică de 95,6%.
Prin urmare, distilarea nu este o metodă eficientă în separarea amestecurilor azeotrope. Metodele utilizate în mod obișnuit pentru separarea amestecurilor azeotrope (sau ruperea azeotropică ) sunt:
- distilare azeotropă
- distilare prin presiune
- separarea prin acțiune chimică
- distilarea cu sare dizolvată
- distilare extractivă
- pervaporare și alte separări de membrană
Distilarea azeotropă
În distilarea azeotropă se introduce un agent care influențează volatilitatea unuia dintre constituenții amestecului. Prin urmare, se formează un azeotrop ternar pornind de la un azeotrop binar. Un exemplu de distilare azeotropică are loc prin adăugarea de benzen sau ciclohexan la un amestec de etanol-apă. Azeotropul ternar rezultat este compus din 7% apă, 17% etanol și 76% ciclohexan și fierbe la 62,1 ° C. În practică, ciclohexanul este adăugat într-o cantitate astfel încât să închidă toată apa din azeotropul ternar. Îndepărtarea azeotropului ternar prin evaporare produce un reziduu de etanol aproape pur.
Distilare sub presiune variabilă
O altă metodă de realizare a distilării unui amestec azeotrop este utilizarea unei a doua coloane de distilare cu o presiune diferită. De fapt, condițiile de existență ale azeotropului variază pe măsură ce presiunea variază, astfel încât alegând presiunea în mod adecvat este posibil să se îndepărteze azeotropul de condițiile de funcționare.
Prin urmare, pentru a separa un amestec care formează azeotrop, pot fi utilizate două coloane: în prima coloană separarea se realizează până când sunt atinse condiții apropiate de azeotrop, în timp ce în a doua coloană, care funcționează la o presiune diferită de prima, separarea se continuă până se ajunge la concentrația dorită.
Distilarea cu adsorbție
În cazul unui amestec format dintr-un azeotrop și un al treilea component, odată ce azeotropul a fost atins, este posibil să se procedeze la adsorbția unui component al amestecului azeotrop și apoi să se continue separarea pentru a elimina al treilea component (care nu formează azeotrop cu celelalte două componente).
Notă
- ^ Azeotropul mai este numit azeotrop omogen , pentru a-l distinge de azeotropul eterogen , o expresie care indică un punct eutectic .
- ^ sau distilează la o temperatură constantă
- ^ Jurnal , pe archive.org . Adus pe 29 mai 2017 .
Bibliografie
- (EN) Robert H. Perry , Don W. Green, James O. Maloney, 13 ani , în Perry's Chemical Engineers 'Handbook, ediția a VII-a, McGraw-Hill, 1997, ISBN 0-07-049841-5 .
- Dr. GA Busato; Profesorul G. Bashein, Update in Anesthesia: The halotan / eter azeotrope - O reconsiderare , în Farmacologie , n. 18, Seattle, Universitatea din Washington, 2004. Accesat la 9 aprilie 2007 (arhivat din original la 17 februarie 2007) .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe azeotrop
Wikimedia Commons conține imagini sau alte fișiere pe azeotrop
linkuri externe
- Ce este un Azeotrop? , pe solvent--recycling.com .
- Azeotrope Databank , la eweb.chemeng.ed.ac.uk . Adus la 24 aprilie 2007 (arhivat din original la 24 aprilie 2007) .
- Azeotrope , pe oedilf.com .
- Publicații despre separarea azeotropelor , pe vegyelgep.bme.hu .
| Controlul autorității | NDL ( EN , JA ) 00560423 |
|---|