Cancer de prostată
| Cancer de prostată | |
|---|---|
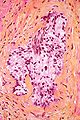
 Micrografia unui adenocarcinom în celulele prostatei acinarie. | |
| Tip | Malign |
| Celula de origine | În primul rând celulele bazale |
| Factori de risc | · Vârsta · Dieta · Familiarizare |
| Vârsta medie la diagnostic | 70 de ani |
| Clasificare și resurse externe | |
| ICD - 9 -CM | ( RO ) 185 |
| ICD - 10 | ( EN ) C61 |
Cancerul de prostată este o categorie de diagnostic care include neoplasmele maligne care provin din celulele epiteliale ale prostatei , o glandă a sistemului genital masculin . Această neoplasmă poate da naștere la metastaze , cu o preferință pentru oasele loco-regionale și ganglionii limfatici . Cancerul de prostată poate provoca durere, dificultăți la urinare , disfuncție erectilă și alte simptome.
Cancerul de prostată se dezvoltă mai frecvent la peste 50 de ani; este al doilea tip de cancer cel mai frecvent din Statele Unite , unde este responsabil pentru cel mai mare număr de decese cauzate de cancer după cancerul pulmonar . [1] Mulți factori, inclusiv genetică și dietă , au fost implicați în dezvoltarea cancerului de prostată.
Cancerul de prostată este cel mai adesea descoperit la examinarea fizică sau prin teste de sânge , cum ar fi măsurarea PSA ( antigen specific prostatei). Suspiciunea de cancer de prostată este de obicei confirmată prin excizia ( biopsia ) unui fragment de țesut și examinarea histologică ulterioară. Testele suplimentare, cum ar fi ultrasunetele , radiografia și scintigrafia, pot fi utilizate pentru a determina răspândirea acesteia și dacă tumora s-a metastazat sau nu.
Cancerul de prostată poate fi tratat cu intervenții chirurgicale , radioterapie , terapie hormonală , ocazional chimioterapie sau combinații ale acestora. Vârsta și starea de sănătate a pacientului, precum și răspândirea tumorii, aspectul microscopic și răspunsul la tratamentul inițial, sunt importante în determinarea prognosticului . Deoarece cancerul de prostată este o boală tipică bărbaților în vârstă, mulți dintre ei vor putea muri înainte ca cancerul să se răspândească sau să provoace simptome; acest lucru face dificilă selectarea tratamentului. [2] Decizia de a trata sau nu o tumoare localizată (adică complet limitată în prostată) implică un echilibru între beneficiile așteptate și efectele negative în ceea ce privește supraviețuirea pacientului și calitatea vieții.
Istorie
Deși prostata a fost descrisa pentru prima data de venețiană anatomistul Niccolò Massa în 1536 , și ilustrat de flamand Andrea Vesalio in 1538 , cancerul de prostata nu a fost identificat inainte de 1853 . [3]

A fost inițial clasificată ca boală rară, datorită metodelor slabe de investigație și a speranței de viață reduse medii a timpului. Primele tratamente puse în aplicare au fost intervenții chirurgicale pentru rezolvarea obstrucției urinare. [4] Prostatectomia perineală radicală a fost efectuată pentru prima dată în 1904 de Hugh Young la Spitalul Johns Hopkins [5] . Îndepărtarea chirurgicală a testiculelor, orchiectomia , ca tratament a fost efectuată în 1890 ( terapia cu hormoni infra ), dar cu succes limitat. Rezecția transuretrală a prostatei a înlocuit prostatectomia radicală pentru deblocarea uretrei la mijlocul secolului al XX-lea . Prostatectomia retropubiană radicală a fost dezvoltată în 1983 de Patrick Walsh. [6] Această abordare chirurgicală a permis îndepărtarea prostatei și a ganglionilor limfatici, menținând în același timp funcția erectilă a penisului.
În 1941 Charles B. Huggins a publicat un studiu privind utilizarea estrogenului pentru a contracara producția de testosteron la pacienții cu cancer de prostată metastatic . Descoperirea acestei terapii i-a adus lui Huggins Premiul Nobel pentru medicină în 1966 . [7] Rolul GnRH în câmpul reproductiv a fost stabilit de Andrzej W. Schally și Roger Guillemin , care pentru aceasta a câștigat Premiul Nobel pentru medicină în 1977 ; prin urmare, agoniștii pentru receptorii GnRH au fost dezvoltați și utilizați în terapie. [8] [9]
Radioterapia pentru cancerul de prostată a fost dezvoltată la începutul secolului al XX-lea și a constat inițial din implantarea razei intraprostatice. Radioterapia cu fascicul extern a fost folosită pe scară mai largă atunci când surse mai puternice de radiații au devenit disponibile la mijlocul secolului al XX-lea. Brahiterapia cu implant de semințe a fost descrisă pentru prima dată în 1983 . [10] Chimioterapia sistemică pentru cancerul de prostată a fost studiată pentru prima dată în anii 1970 . Protocolul inițial cu ciclofosfamidă 5-fluorouracil a fost în scurt timp alăturat de alții multipli cu o gamă largă de medicamente sistemice. [11]
Epidemiologie

Nu există date
mai puțin de 4
4-8
8-12
12-16
16-20
20-24
24-28
28-32
32-36
36-40
40-44
mai mult de 44
Frecvența cancerului de prostată în întreaga lume variază foarte mult. [13] Este mai puțin frecventă în Asia de Sud și de Est, mai frecventă în Europa , cu mari diferențe între țări și cu atât mai mult în Statele Unite . [14] Conform Societății Americane a Cancerului , există diferențe geografice și etnice puternice în ceea ce privește frecvența; de fapt, cancerul de prostată este mai puțin frecvent în rândul bărbaților asiatici, mai frecvent în rândul bărbaților negri, incidența în rândul bărbaților europeni este intermediară în comparație cu cele două populații anterioare. [15] [16] [17] Conform datelor din 2002, rata anuală a incidenței în Asia Centrală este mai mică de 3/100 000 de locuitori, în timp ce pe continentul nord-american există peste 160/100 000 de locuitori înregistrați. [18] [19] Cu toate acestea, detectarea acestor frecvențe mai mari ar fi putut fi influențată de rate mai mari de diagnostic datorită progresului diagnosticului și a politicilor de prevenire [20] .
Cauzele specifice ale malignității sunt necunoscute. [21] Riscul de a dezvolta cancer este legat de vârstă [22] , genetică , [23] rasă , [24] dietă , [25] stil de viață, consumul de medicamente și alți factori. Factorul principal este vârsta. Cancerul de prostată este rar la bărbații cu vârsta sub 45 de ani, dar devine mai frecvent odată cu îmbătrânirea. Vârsta medie la momentul diagnosticului este de 70 de ani [26] . Mulți subiecți afectați, totuși, nu prezintă semne de boală în viață: studii de autopsie pe bărbați chinezi , germani , israelieni , jamaicani , suedezi și ugandani , care au murit din alte cauze, au identificat cancer de prostată la treizeci la sută din copiii de cincizeci de ani , și în optzeci la sută dintre cei de șaptezeci de ani. [27] În 2005, aproximativ 230.000 de cazuri noi și 30.000 de decese s-au produs în Statele Unite [28] . Fiind o neoplasmă tipică de vârstă avansată, se poate întâmpla de fapt ca moartea persoanei afectate, din cauza bătrâneții sau a altor cauze, să apară înainte ca tumora să prezinte simptome sau semne care dezvăluie prezența acesteia.
Istoricul familial al bărbatului și machiajul genetic contribuie la riscul de a dezvolta cancer. Acest lucru este sugerat de o incidență crescută găsită la anumite grupuri rasiale, la gemenii identici și la bărbații care poartă anumite gene . În Statele Unite, cancerul de prostată afectează bărbații negri mai frecvent decât albii sau hispanicii și, de asemenea, provoacă mai multe decese la primii [16] . Bărbații cu un frate sau un tată afectat de cancer prezintă, de asemenea, un risc dublu de a dezvolta cancer [29] . Studiile gemene efectuate în Scandinavia sugerează că patruzeci la sută din risc poate fi atribuit factorilor ereditari [30] . Cu toate acestea, nicio genă nu este responsabilă de tumoră, într-adevăr sunt suspectate multe gene diferite. Două gene ( BRCA1 și BRCA2 ), care sunt, de asemenea, factori de risc importanți pentru cancerul ovarian și mamar , sunt, de asemenea, implicați în cancerul de prostată [31] .
Aportul alimentar al anumitor alimente, vitamine și minerale poate contribui la risc. Bărbații cu niveluri serice mai ridicate de acid α-linolenic , un acid gras polinesaturat cu lanț scurt, prezintă un risc crescut de cancer de prostată. Cu toate acestea, aceleași studii au arătat că bărbații cu niveluri ridicate de acizi grași cu lanț lung ( EPA și DHA ) scad incidența. [32] Alți factori dietetici care pot crește riscul includ un aport scăzut de vitamina E (găsită în legumele cu frunze verzi), licopen (găsit în roșii ), acizi grași omega-3 [33] (găsit în carnea grasă de pește [33] [ 34] cum ar fi somonul sau peștele gras ) și seleniu . [35] Nivelurile scăzute de vitamina D din sânge pot crește, de asemenea, riscul de a dezvolta cancer; acest lucru poate fi legat de o expunere mai mică la razele ultraviolete [36] [37] .
Există, de asemenea, legături între cancerul de prostată și administrarea de medicamente, proceduri și afecțiuni medicale. Utilizarea zilnică a antiinflamatoarelor nesteroidiene ( AINS ), cum ar fi aspirina, poate reduce riscul [38] . Medicamentele hipolipemiante, cum ar fi statinele, pot reduce, de asemenea, acest lucru [39] . Sterilizarea cu vasectomie poate crește riscul de cancer de prostată, dar datele sunt contradictorii[40] . Ejaculările mai frecvente pot reduce riscul; un studiu a arătat că bărbații care ejaculează de cinci ori pe săptămână între vârsta de douăzeci și treizeci de ani au un risc redus de cancer [41] . O infecție sau inflamație a prostatei ( prostatită ) poate crește șansele de cancer. În special, infecțiile cu transmitere sexuală precum chlamydia , gonoreea și sifilisul par să crească riscul [42] , la fel ca și obezitatea [43] .
În trecut, se credea că nivelurile ridicate de testosteron cauzează sau facilitează cancerul de prostată, în realitate nivelurile scăzute ale acestui hormon sunt legate de această tumoare, în plus chiar și utilizarea testosteronului la subiecții hipogonadali nu crește acest risc [44] .
Mai mult, este stabilit că bărbații cu sindrom Klinefelter au o incidență semnificativ mai mică a cancerului de prostată decât bărbații sănătoși [45]
Anatomie
Prostata este o parte a organului sistemului genital masculin care intervine în producția de lichid spermatic . La un bărbat adult, prostata măsoară aproximativ trei centimetri și cântărește aproximativ douăzeci de grame. [46] Se află în pelvis , sub vezică și anterior rectului ; înconjoară parțial uretra . [47] Datorită localizării sale, bolile de prostată interferează adesea cu urinarea , ejacularea sau defecația . Prostata conține multe glande mici care produc aproximativ douăzeci la sută din partea lichidă a spermei. [48] În cancerul de prostată, celulele acestor glande mută în celule canceroase. Pentru a funcționa, prostata are nevoie de hormoni masculini, cunoscuți ca androgeni ; androgenii includ testosteronul , produs în testicule , dehidroepiandrosteronul , produs de glandele suprarenale și dihidrotestosteronul , produs chiar de prostată.
Etiologie
Cauzele specifice ale cancerului de prostată rămân încă necunoscute. [49] Cu toate acestea, primii factori de risc sunt vârsta și istoricul familial. Cancerul de prostată este foarte rar la bărbații sub 45 de ani, dar devine mai frecvent odată cu creșterea vârstei. Vârsta medie a pacienților la momentul diagnosticului este de 70 de ani. [50] Cu toate acestea, mulți bărbați nu știu niciodată că au acest tip de cancer. Testele de autopsie efectuate pe bărbați chinezi, germani, israelieni, jamaicani, suedezi și ugandezi, care au murit din diferite cauze, au arătat prezența cancerului de prostată în 30% din cazurile cu vârsta sub 50 de ani și în 80% peste 70 de ani. [51 ] Bărbații care au un membru al familiei de gradul I care a avut acest tip de cancer au riscul de a-l dezvolta de două ori decât bărbații care nu au avut o boală în familie. [52] Riscul pare mai mare pentru bărbații care au un frate cu acest cancer decât pentru cei care au doar un tată.
În Statele Unite , în 2005, au existat aproximativ 230.000 de cazuri noi de cancer de prostată și 30.000 de decese cauzate de acesta. [53] Bărbații cu hipertensiune arterială sunt, de asemenea, mai predispuși să dezvolte cancer de prostată. [54] Un studiu din 2010 a arătat că celulele bazale de prostată sunt cel mai frecvent loc al cancerului. [55]
Anatomie patologică
Adenocarcinomul acinar (tumora care se dezvoltă din structurile acinare, în formă de struguri ale prostatei) este cel mai frecvent histotip al neoplasmelor de prostată. Cu toate acestea, există și alte histotipuri care trebuie recunoscute și raportate, datorită prezentării clinice diferite și a evoluției prognostice .
- Adenocarcinomul ductal, provine din celulele canalelor prostatice. Dacă provin din conductele periuretrale, acestea dau simptome similare carcinoamelor de origine urotelială . Este bine să recunoaștem acest tip de carcinom pentru prognosticul mai prost decât adenocarcinomul clasic.
- Carcinom adenocvamos sau scuamos, pentru metaplazia epitelioidă spontană a unui neoplasm cu diferențiere glandulară sau după tratament hormonal.
- Carcinoamele mucinoase ale prostatei, neoplasme care se caracterizează prin producerea de mucus , uneori în cantități mari.
- Carcinomul cu celule mici, cel mai agresiv histotip, provine din celulele neuroendocrine intercalate în contextul parenchimului prostatic.
- Neoplasmele mezenchimale, cum ar fi sarcoamele sau liposarcoamele , foarte rare.
- Limfoame .
În 70% din cazuri, adenocarcinomul acinar provine din porțiunea periferică, cu localizare tipică posterioară. [56] Rațiunea explorării rectale se bazează pe această caracteristică ca abordare și examinare de diagnostic complet în examinarea unui pacient cu echipament clinic atribuit patologiei prostatice. În ultimul deceniu, îmbunătățirea metodelor de diagnostic a permis o identificare din ce în ce mai precoce a maselor limitate la parenchim, făcând dificil pentru patolog recunoașterea macroscopică a neoplasmului în piesa chirurgicală doar prin inspecție vizuală; foarte des, de fapt, neoplasmele mici sunt palpativ recunoscute ca mase de lemn dure în interiorul glandei. La suprafața tăiată, neoplasmul este alb sau galben-portocaliu, compact, cu margini spiculate sau policiclice și pătrunde în parenchimul din jur. Evoluția naturală a neoplasmului prevede expansiunea locală în contextul glandei și infiltrarea ulterioară a veziculelor seminale , gâtului vezicii urinare și uretrei prostatice , eveniment care implică manifestări obstructive cu disurie , polakiurie și strangurie , uneori hemospermie [57]. ] . În stadiile avansate există, de asemenea, infiltrarea podelei pelvine și a rectului cu tenesmul consecvent. Căile limfatice implicate cel mai frecvent sunt în ordinea frecvenței: [58]
- Ganglionii limfatici obturatori
- Ganglionii limfatici perversici
- Ganglionii limfatici hipogastrici
- Ganglionii limfatici iliaci
- Ganglionii limfatici presacri
- Ganglionii limfatici paraortici
Sângele de metastază implică în mod obișnuit oasele , în special coloana lombară (mai rar toracică , femurul , pelvisul și coastele ). [58]
Aspect microscopic
Glandele neoplazice sunt de obicei mai mici, aglomerate și mai rigide decât în mod normal; au hiperplazie masivă, cu pierderea papilelor și a stratului bazal extern. Culorile normale prezintă un nucleu mare, prevăzut cu un nucleol , înconjurat de citoplasmă clară sau uneori intens eozinofilă (cu o culoare omogenă violet-roz caracteristică). [56] Deși aceste insule neoplazice sunt ușor de identificat, diagnosticul histologic ar putea fi dificil din cauza lipsei pleomorfismului și a cifrelor mitotice atipice, cu toate acestea monomorfismul ridicat și rigiditatea apariției fructelor de pădure aglomerate, cu celule și nuclei așezați în poziții monotone. în cadrul focalizării adenocarcinomului, permite o distincție ușoară de glandele normale, de obicei mai pestrițe ca aspect, cu profiluri tortuoase și celule dispuse într-un mod fiziologic dezordonat, cu citoplasmă secretorie clară și nuclei mici și alungiți, conici, albastru - purpurii întunecați, diferiți de cele rigid rotunde și nucleolate ale carcinomului. Cu toate acestea, uneori focarele neoplazice detectate în frustulele de biopsie obținute cu un ac de tăiere sunt foarte mici și cu caracteristici care pot fi evaluate pe un număr mic de fructe de padure suspecte. Colorarea normală a hematoxilinei-eozinei care prezintă glande mici aglomerate cu celule cu pierderi de papile poate fi în aceste cazuri numai sugestivă a cancerului de prostată; diagnosticul este confirmat dacă apar una sau mai multe dintre aceste caracteristici: [56]
- Nucleii mari și amorfi, citoplasma întunecată, nucleoli proeminenți.
- Absența celulelor bazale în contextul glandelor bazale (căutată cu markeri imunologici)
- Invazie perineurală (vezi imaginea)
O entitate histologică de o importanță considerabilă este neoplazia intraepitelială prostatică sau PIN de înaltă calitate, caracterizată prin formațiuni glandulare mari cu proeminențe papilare (primul element de distincție cu neoplasme maligne), proliferare intra-acinară neinvazivă, anaplasie nucleară și nucleoli proeminenți (în mai mult de 10% din celule). O altă caracteristică importantă de căutat în PIN este prezența celulelor bazale, absente în carcinom, aici doar atenuate. PIN-ul este o leziune importantă care trebuie urmată în timp pentru o posibilă transformare malignă. [59] [60] [61] [62] [63]
Frustulă de biopsie, colorare crom-hematoxilin-floxină. În porțiunea centrală, frustula este traversată perpendicular de un nerv , infiltrat de un mic grup glandular neoplazic în partea de jos. Acesta este un exemplu tipic de invazie perineurală.
Profil clinic
Cancerul de prostată în stadiu incipient, de obicei, nu provoacă simptome. Este adesea diagnosticat după ce se constată un nivel ridicat de PSA în timpul unui control de rutină. Uneori, totuși, carcinomul provoacă probleme, adesea similare cu cele care apar în hiperplazia benignă de prostată ; acestea includ polakiurie , nocturie , dificultate la inițierea urinării și menținerea unui flux constant, hematurie , strangurie . De asemenea, poate provoca probleme cu funcția sexuală, cum ar fi dificultăți în obținerea unei erecții și ejaculare dureroasă. [64]
În stadii avansate poate provoca simptome suplimentare atunci când se răspândește în alte părți ale corpului. Cel mai frecvent simptom este durerea osoasă, adesea localizată la vertebre , pelvis sau coaste și cauzată de metastaze în aceste locuri. Localizarea vertebrală poate induce compresia măduvei spinării , provocând slăbiciune la nivelul picioarelor și incontinență urinară și fecală . [65]
Profil de diagnosticare
Screeningul cancerului este o metodă de detectare a cancerelor nediagnosticate. Testele de screening pot duce la teste mai specifice, cum ar fi biopsia . Opțiunile de screening pentru cancerul de prostată includ examinarea rectală și testarea PSA .
Valabilitatea testelor de screening este controversată, deoarece nu este clar dacă beneficiile rezultate depășesc riscurile testelor de diagnostic ulterioare și ale terapiei anticancerigene. Cancerul de prostată este un cancer cu creștere lentă, care este foarte frecvent în rândul bărbaților în vârstă. De fapt, majoritatea cancerelor de prostată nu cresc suficient pentru a provoca simptome, iar pacienții mor din diverse cauze. Dozajul de PSA poate dezvălui aceste mici tumori care altfel nu ar fi avut ocazia să se manifeste; un astfel de screening poate duce, prin urmare, la un număr excesiv de diagnostice, cu secvența aferentă de teste și terapii suplimentare. Biopsia poate provoca dureri, sângerări și infecții; terapiile pot provoca incontinență urinară și disfuncție erectilă . Prin urmare, este esențial ca riscurile și beneficiile să fie luate în considerare înainte de a efectua screening-ul folosind testul PSA [66] .
Testele încep de obicei după vârsta de 50 de ani, dar pot fi propuse mai devreme la bărbații negri și la cei cu antecedente familiale puternice de cancer de prostată. [67] [68]
Examen rectal
Examinarea rectală digitală este o procedură în care examinatorul introduce un deget înmănușat și lubrifiat în rectul pacientului pentru a evalua dimensiunea, forma și consistența prostatei: zonele neregulate, dure sau noduloase trebuie să fie supuse unor evaluări suplimentare, deoarece acestea ar putea fi indicativ al cancerului. Examenul rectal este capabil să evalueze doar partea din spate a prostatei, dar din fericire 85% din cazurile de cancer provin din această parte. În general, oferă posibilitatea de a aprecia tumorile care sunt deja într-un stadiu avansat. [69]
Nu s-a demonstrat niciodată că, ca singur test de screening, examenul rectal poate reduce rata mortalității. [70]
Dozajul PSA
Testul PSA măsoară nivelul sanguin al unei enzime produse de prostată. Nivelurile de PSA sub 4 ng / ml ( nanograme pe mililitru ) sunt în general considerate normale, în timp ce nivelurile peste 4 ng / ml sunt considerate anormale (deși la bărbații cu vârsta peste 65 de ani pot fi acceptate până la 6,5 ng / ml, în funcție de referință parametrii fiecărui laborator). Nivelurile de PSA între 4 și 10 ng / ml indică un risc mai mare decât cel normal de cancer, dar riscul în sine nu pare direct proporțional cu nivelul. Când PSA este peste 10 ng / ml, asocierea cu tumora devine mai puternică, totuși PSA nu este un test perfect. Unii bărbați cu cancer activ de prostată nu au un nivel ridicat de PSA, iar majoritatea bărbaților cu PSA ridicat nu au cancer. Astăzi este posibil să se măsoare un marker suplimentar pentru cancerul de prostată, PCA3 (gena cancerului de prostată 3); supraexprimarea acestei gene (evaluabilă prin măsurarea ARNm în urină) este strâns asociată cu transformarea malignă a celulelor prostatei. Dozajul este, prin urmare, deosebit de util la pacienții care au suferit deja biopsie, pentru a prezice evoluția tumorii. [71] [72] [73] [74] [75] [76] [77]
Confirmați diagnosticul
Când se suspectează cancerul de prostată sau un test de screening indică un risc crescut, se are în vedere o evaluare mai invazivă. Singurul test care poate confirma pe deplin diagnosticul este o biopsie , care este îndepărtarea unor bucăți mici de țesut pentru examinare la microscop. Cu toate acestea, înainte de biopsie, pot fi utilizate metode mai puțin invazive pentru a colecta informații despre prostată și căile urinare: cistoscopia arată căile urinare începând din interiorul vezicii urinare folosind un mic endoscop introdus în uretra ; Ecografia transrectală desenează o imagine a prostatei prin ultrasunete emise de o sondă introdusă în rect.
Dacă se suspectează o tumoare, se folosește o biopsie. Cu el, se obțin probe de țesut de la prostată prin rect: un pistol de biopsie introduce și apoi îndepărtează ace speciale cu vârfuri goale (de obicei trei până la șase pe fiecare parte a prostatei) în mai puțin de o secundă. Probele de țesut sunt apoi examinate la microscop pentru a determina prezența tumorii, pentru a evalua aspectele sale histomorfologice (clasificarea în funcție de sistemul de scor Gleason). Biopsiile de prostată se fac de obicei în ambulatoriu și rareori necesită spitalizare . 55% dintre bărbați raportează disconfort în timpul procedurii. [78]

Un studiu finalizat în 2003 de Institutul Științific al Universității San Raffaele . [79] [80] a demonstrat eficacitatea utilizării tomografiei cu emisie de pozitroni (PET) cu ajutorul trasorului C-colină ca test pentru a detecta recurența cancerului de prostată. Acest test este recomandat pacienților care au suferit deja un tratament radical al tumorii și care au detectat o valoare a markerului PSA care sugerează o recuperare a bolii.
Grazie alla PET è possibile, inoltre, differenziare una diagnosi di cancro alla prostata da una iperplasia benigna, da una prostatite cronica e da un tessuto prostatico sano. [81]
Stadiazione
Una parte importante della valutazione diagnostica è la stadiazione , ossia il determinare le strutture e gli organi interessati dal tumore. Determinare lo stadio aiuta a definire la prognosi ea selezionare le terapie . Il sistema più comune è il sistema a quattro stadi TNM (abbreviazione da Tumore/LinfoNodi/Metastasi), che prevede di considerare le dimensioni del tumore, il numero di linfonodi coinvolti e la presenza di metastasi .
La distinzione più importante operata da qualsiasi sistema di stadiazione è se il tumore è o meno confinato alla prostata. Diversi esami sono disponibili per evidenziare una valutazione in questo senso, e includono la TAC per valutare la diffusione nella pelvi, la scintigrafia per le ossa, e la risonanza magnetica per valutare la capsula prostatica e le vescicole seminali .
I risultati possono poi essere classificati grazie alla stadiazione TNM o di Whitmore-Jewett:
| Stadio | Descrizione |
|---|---|
| T1a | tumore in meno del 5% del parenchima (corrisponde allo stadio A1 di WJ). |
| T1b | tumore in più del 5% del parenchima. |
| T1c | come 1b + PSA elevato (questi 2 stadi corrispondono allo stadio A2 di WJ) |
| T2a | coinvolge 1 lobo (comprende gli stadi B1 e B2 di WJ) |
| T2b | coinvolge entrambi i lobi (stadio B3 di WJ) |
| T3a | oltrepassa la capsula prostatica da un solo lobo (stadio C1 di WJ) |
| T3b | oltrepassa la capsula da entrambi i lobi |
| T3c | invade le vescichette seminali (stadio C2 di WJ) |
| T4 | invade organi adiacenti (stadio D di WJ, diviso in ormono-sensibile e insensibile) |
| N1a | metastasi linfonodali non rilevabili |
| N1b | una sola minore o uguale a 2 cm |
| N1c | una sola fra 2 e 5 cm |
| N2a | oltre 5 cm o multiple |
| MX | metastasi a distanza non rilevabili |
| M0 | assenza di metastasi a distanza |
| M1a | linfonodi extraregionali |
| M1b | scheletro |
| M1c | altri siti |
Dopo una biopsia prostatica, un patologo esamina il campione al microscopio. Se è presente un tumore il patologo ne indica il grado; questo indica quanto il tessuto tumorale differisce dal normale tessuto prostatico, e suggerisce quanto velocemente il tumore stia crescendo. Il grado di Gleason assegna un punteggio da 2 a 10, dove 10 indica le anormalità più marcate; il patologo assegna un numero da 1 a 5 alle formazioni maggiormente rappresentate, poi fa lo stesso con le formazioni immediatamente meno comuni; la somma dei due numeri costituisce il punteggio finale. Il tumore è definito ben differenziato se il punteggio è fino 4, mediamente differenziato se 5 o 6, scarsamente differenziato se maggiore di 6. È da notare che non solo è importante la somma algebrica ma anche come è stata ottenuta, ovvero un 4+2 è sicuramente più grave di un 2+4, perché questo indica che nel primo caso ci siano soprattutto formazioni scarsamente differenziate, mentre nel secondo caso soprattutto ben differenziate.
| Grado | Descrizione |
|---|---|
| Grado 1: | altamente differenziato |
| Grado 2: | ben differenziato: |
| Grado 3: | moderatamente differenziato |
| Grado 4: | scarsamente differenziato |
| Grado 5: | altamente indifferenziato (cellule infiltranti) |
Un'appropriata definizione del grado di malignità del tumore è di importanza fondamentale, in quanto è uno dei fattori utilizzati per guidare le scelte terapeutiche.
Terapia
La terapia del carcinoma prostatico può comprendere: l'osservazione in assenza di trattamento, la chirurgia , la radioterapia , gli ultrasuoni focalizzati ad alta intensità HIFU , la chemioterapia , la criochirurgia , la terapia ormonale, o una combinazione di queste. La scelta dell'opzione migliore dipende dallo stadio della malattia, dal punteggio secondo la scala Gleason, e dai livelli di PSA . Altri fattori importanti sono l'età del paziente, il suo stato generale, e il suo pensiero riguardo alla terapia proposta e agli eventuali effetti collaterali. Poiché tutte le terapie possono indurre significativi effetti collaterali , come le disfunzione erettile e l'incontinenza urinaria, discutere col paziente circa la possibile terapia spesso aiuta a bilanciare gli obiettivi terapeutici coi rischi di alterazione dello stile di vita. [85] [86] [87]
Se il tumore si è diffuso esternamente alla prostata, le opzioni terapeutiche cambiano. La terapia ormonale e la chemioterapia sono spesso riservate ai casi in cui la malattia si è estesa esternamente alla prostata; tuttavia esistono delle eccezioni: la radioterapia può essere impiegata per alcuni tumori in fase avanzata, e la terapia ormonale per alcuni in fase precoce. La crioterapia , la terapia ormonale e la chemioterapia possono inoltre essere utilizzate se il trattamento iniziale fallisce e il tumore progredisce. [88] [89] [90]
Osservazione
L'osservazione, una "sorveglianza attiva", prevede il regolare monitoraggio della malattia in assenza di un trattamento invasivo. Spesso vi si ricorre quando si riscontra, in pazienti anziani, un tumore in stadio precoce ea crescita lenta. Può essere consigliabile anche quando i rischi connessi alla chirurgia, alla radioterapia, o alla terapia ormonale sopravanzino i possibili benefici. Si possono intraprendere gli altri trattamenti se si manifestano sintomi, o se appaiono indizi di un'accelerazione nella crescita del tumore. La maggioranza degli uomini che optano per l'osservazione di tumori in stadi precoci vanno incontro alla possibilità di manifestare segni di progressione del tumore, ed entro tre anni hanno necessità di intraprendere una terapia. [91] Sebbene tale scelta eviti i rischi connessi alla chirurgia e alle radiazioni, il rischio di metastasi si può innalzare. I problemi di salute connessi all'avanzare dell'età durante il periodo di osservazione possono anch'essi complicare la chirurgia e la radioterapia. [92]
Chirurgia
La rimozione chirurgica della prostata, o prostatectomia , è un trattamento comune sia per i tumori prostatici in stadi precoci, sia per i tumori non rispondenti alla radioterapia. Il tipo più comune è la prostatectomia retropubica radicale , in cui si rimuove la prostata tramite un'incisione addominale. Un altro tipo è la prostatectomia perineale radicale , in cui l'incisione è praticata a livello del perineo , la regione fra lo scroto e l' ano . La prostatectomia può risolvere, a cinque anni, circa il 70% dei casi di tumore della prostata; [93] tassi di sopravvivenza più alti si sono trovati con un Gleason score inferiore a 3. [94]
La prostatectomia radicale è molto efficace per i tumori limitati alla prostata, tuttavia può causare danni ai nervi in grado di alterare significativamente la qualità della vita dei pazienti.
I nervi deputati all'erezione e alla minzione sono immediatamente adiacenti alla prostata, per cui le complicazioni più importanti sono l' incontinenza urinaria e l' impotenza . Circa il 40% degli uomini residuano incontinenza urinaria, di solito sotto forma di perdite quando starnutiscono, tossiscono o ridono. L'impotenza è anch'essa un problema comune: sebbene la sensibilità sul pene e la capacità di raggiungere l' orgasmo rimangano intatte, l'erezione e l'eiaculazione sono spesso compromesse; farmaci come il sildenafil ( Viagra ), il tadalafil (Cialis), o il vardenafil (Levitra) possono ristabilire un certo grado di potenza. In alcuni uomini con tumori più piccoli, una tecnica chirurgica meno invasiva può essere d'aiuto per evitare queste complicazioni. [95]
La prostatectomia radicale è stata tradizionalmente usata come unico trattamento per un tumore di piccole dimensioni. Tuttavia cicli di terapia ormonale prima della chirurgia possono migliorare le percentuali di successo, e sono correntemente oggetto di studio [96] . La chirurgia può essere intrapresa anche quando il tumore non risponde alla radioterapia, tuttavia, poiché le radiazioni causano modifiche dei tessuti, in questa situazione aumentano i rischi di complicazioni.
Da uno studio comparativo condotto nel 2009 su un totale di 8 837 [97] interventi di chirurgia radicale per tumore alla prostata, l'incidenza dell'incontinenza urinaria e impotenza ha evidenziato che:
- Chirurgia con robot/laparoscopia:
- 15,9% di incontinenza urinaria
- 26,8% di impotenza e disfunzioni erettili.
- Chirurgia classica-tradizionale a "cielo aperto":
- 12,2% di incontinenza urinaria
- 19,2% di impotenza e disfunzioni erettili.
La resezione transuretrale della prostata è una procedura chirurgica messa in atto quando l' uretra è ostruita a causa dell'ingrossamento prostatico; generalmente è riservata alle malattie prostatiche benigne e non è intesa come trattamento definitivo del tumore. Consiste nell'inserimento nell'uretra di un piccolo endoscopio , tramite il quale, con apposito strumento, si taglia via la parte di prostata che occlude il lume.
Radioterapia
La radioterapia utilizza i raggi X per uccidere le cellule tumorali; i raggi X sono un genere di radiazione ionizzante in grado di danneggiare o distruggere il DNA delle cellule in crescita. Due differenti tipi di radioterapia sono utilizzati nel trattamento del carcinoma prostatico: la radioterapia a fascio esterno e la brachiterapia .
La radioterapia a fascio esterno utilizza un acceleratore lineare per produrre raggi X ad alta energia che vengono raggruppati in un fascio diretto contro la prostata. Una tecnica chiamata Radioterapia a Intensità Modulata (IMRT) può essere utilizzata per adattare il fascio radiante alla forma del tumore, permettendo di somministrare dosi maggiori con minor danno per la vescica e il retto. La radioterapia a fascio esterno viene in genere somministrata per diverse settimane, con visite giornaliere ai centri di radioterapia. [98]
La brachiterapia prevede il posizionamento di circa 100 piccoli "semi" contenenti materiale radioattivo (come lo iodio 125 o il palladio 103) tramite un ago attraverso la cute del perineo direttamente nel tumore. Questi semi emettono radiazioni ionizzanti a bassa energia, in grado di percorrere solo una breve distanza; sono permanenti ma non comportano rischi di emissioni all'esterno. [99] [100]

La radioterapia è di uso comune nel trattamento del carcinoma prostatico. Può essere utilizzata al posto della chirurgia nei tumori in fase precoce, così come in quelli in fase avanzata per trattare le dolorose metastasi ossee; può essere associata alla terapia ormonale per i casi a rischio intermedio, quando la radioterapia da sola ha meno probabilità di essere risolutiva. Alcuni oncologi associano radioterapia a fascio esterno e la brachiterapia per casi con rischio da intermedio a elevato. Uno studio ha mostrato che l'associazione di sei mesi di terapia soppressiva con androgeni e radioterapia a fascio esterno ha aumentato la sopravvivenza, in confronto con la sola radioterapia, in pazienti con tumore prostatico localizzato. [101] Altri oncologi utilizzano una tripla combinazione di radioterapia a fascio esterno, brachiterapia e terapia ormonale.
Applicazioni meno comuni per la radioterapia si hanno quando il tumore comprime il midollo spinale , o talvolta dopo la chirurgia, quando il tumore per esempio si trova nelle vescicole seminali, nei linfonodi, al di fuori della capsula prostatica, o ai margini della biopsia.
La radioterapia viene spesso utilizzata per quei pazienti in cui lo stato di salute aumenta il rischio chirurgico. Sembra in grado di curare i piccoli tumori confinati alla prostata quasi quanto la chirurgia. Tuttavia, al 2006 , alcune questioni rimangono irrisolte, ossia se le radiazioni debbano essere somministrate al resto della pelvi , quale debba essere la dose assorbita , e la terapia ormonale debba essere effettuata contemporaneamente.
Gli effetti collaterali della radioterapia possono presentarsi dopo poche settimane dall'inizio del trattamento. Entrambi i tipi di radioterapia possono causare diarrea e sanguinamento gastrointestinale dovuti a una proctite da radiazioni, così come incontinenza urinaria e impotenza. I sintomi tendono a migliorare nel corso del tempo. [102] I pazienti sottoposti a radioterapia a fascio esterno vedono aumentato il rischio di sviluppare in seguito tumore del colon e della vescica . [103]
Criochirurgia
La criochirurgia è un altro metodo di trattamento del tumore della prostata. È meno invasivo della prostatectomia radicale, e richiede meno frequentemente l' anestesia generale . Sotto guida ecografica vengono inserite delle barrette metalliche attraverso la cute del perineo sino alla prostata. Le barrette vengono raffreddate con azoto liquido , portando i tessuti circostanti a −196 °C . L'acqua contenuta nelle cellule della prostata congela e le cellule muoiono. L'uretra viene protetta dal freddo con un catetere Foley riempito di acqua calda. La criochirurgia in genere comporta meno problemi sul controllo dell'urinazione rispetto ad altri trattamenti, ma nel 90% dei casi residua impotenza. Quando utilizzata come trattamento iniziale, la criochirurgia non ha l'efficacia della chirurgia tradizionale o della radioterapia, [104] tuttavia è potenzialmente preferibile alla prostatectomia radicale nel caso di recidive tumorali dopo radioterapia.
Terapia ormonale
La terapia ormonale utilizza i farmaci o la chirurgia per impedire alle cellule tumorali della prostata di assumere diidrotestosterone (DHT), un ormone prodotto dai testicoli e dalla prostata stessa, e necessario alla maggioranza dei tumori per accrescersi. Bloccare il DHT spesso fa sì che il tumore smetta di crescere e anche diminuisca di volume. Tuttavia la terapia ormonale di rado è curativa, perché il tumore di solito sviluppa resistenza nell'arco di uno o due anni. La terapia ormonale è dunque di solito impiegata quando il tumore si è espanso oltre la prostata; può impiegarsi anche in alcuni pazienti sottoposti a radioterapia o chirurgia per prevenire recidive. [105]
La terapia ormonale colpisce le vie metaboliche che l'organismo utilizza per produrre DHT, a qualche livello del circuito di feedback endocrino che coinvolge i testicoli, l' ipotalamo , l' ipofisi , i surreni e la prostata. Innanzitutto bassi livelli ematici di DHT stimolano l'ipotalamo a produrre GnRH (ormone rilasciante le gonadotropine). Il GnRH stimola l'ipofisi a produrre ormone luteinizzante (LH), il quale fa produrre ai testicoli testosterone . Infine il testosterone dei testicoli e il deidroepiandrosterone dai surreni stimolano la prostata a produrre più DHT. La terapia ormonale può ridurre i livelli di DHT interrompendo questo percorso in qualche punto.
Esistono varie forme di terapia ormonale:
- L' orchiectomia è la rimozione chirurgica dei testicoli. Poiché i testicoli producono la maggioranza del testosterone, dopo l'orchiectomia i livelli di testosterone cadono.
- Gli antiandrogeni sono farmaci come la flutamide , bicalutamide , nilutamide , e il ciproterone acetato che bloccano direttamente l'azione del testosterone e del DHT all'interno delle cellule tumorali.
- I farmaci bloccanti la produzione di androgeni nei surreni, come il DHEA , comprendono il ketoconazolo e l' amminoglutetimide . Poiché i surreni producono solo il 5% circa degli androgeni circolanti, questi farmaci si usano in genere in combinazione con altri metodi, in grado di bloccare la produzione testicolare di androgeni.
- L'azione del GnRH può essere interrotta in due modi. Gli antagonisti del GnRH sopprimono direttamente la produzione del GnRH, mentre gli agonisti del GnRH agiscono con una downregulation dopo un iniziale effetto stimolante. Degarelix e abarelix sono esempi di GnRH-antagonisti, mentre gli agonisti comprendono la leuprolide , la goserelina , la triptorelina , e la buserelina . Inizialmente questi farmaci aumentano la produzione di LH, tuttavia, poiché la somministrazione del farmaco non segue il ritmo giornaliero di produzione dell'ormone, i livelli di LH e GnRH decrescono dopo poche settimane. [106]
A oggi 2006 la terapia ormonale di maggior efficacia sono l'orchiectomia ei GnRH-agonisti. Nonostante i loro elevati costi, i GnRH-agonisti sono scelti più spesso dell'orchiectomia per ragioni estetiche ed emotive. [107]
Ogni trattamento ha degli svantaggi che ne limitano gli impieghi in certe circostanze. Sebbene l'orchiectomia sia una chirurgia a basso rischio, l'aspetto psicologico della rimozione dei testicoli può essere significativo. Il calo di testosterone può anche causare vampate , aumento di peso, calo della libido , ginecomastia , impotenza e osteoporosi . I GnRH-agonisti possono causare gli stessi effetti dell'orchiectomia ma sintomi peggiori all'inizio del trattamento; quando vi si ricorre in prima istanza l'impennata nei livelli di testosterone causa aumento del dolore dalle metastasi ossee, così spesso vi si accompagnano gli antiandrogeni per mitigarne questi effetti collaterali. Gli estrogeni non si usano comunemente, perché aumentano il rischio di malattie cardiovascolari, e trombosi . Gli antiandrogeni non causano in genere impotenza e danno luogo a minore perdita di massa muscolare e densità ossea. Il chetoconazolo può causare danni epatici con l'uso prolungato, e l'amminoglutetimide rash cutaneo . [107]
Le terapie possono anche essere neoadiuvanti (pre-operatorie per ridurre lo stadio prima della prostatectomia) o adiuvanti (post-operatoria per ridurre il rischio di recidive).
Recidiva biochimica
Per recidiva biochimica si intende un innalzamento dei valori di PSA successivo alla prostatectomia radicale (che, essendo prodotto dalle cellule neoplastiche, indica una ripresa della crescita tumorale). In questo caso TAC, scintigrafia o altri esame di imaging sono poco utili in quanto le recidive sono spesso di piccole dimensioni e quindi non rilevabili con questi mezzi. Il metodo migliore per capire se la recidiva è localizzata nella loggia prostatica o è sistemica consiste nell'analizzare la presenza di alcuni fattori di rischio (sotto elencati quelli per recidiva locale, la recidiva sistemica è presunta dai parametri opposti):
- Grado di Gleason <7
- non invasione delle vescichette seminali
- linfonodi pelvici negativi
- PSA dosabile oltre un anno dall'intervento
- PSA velocity < 0,74 ng/mL/mese
- tempo di raddoppiamento >6 mesi
La terapia è solamente radioterapica ( 66 Gy ) o associata a ormonoterapia.
Carcinoma della prostata resistente alla castrazione
Il carcinoma della prostata può progredire con aumento del PSA, comparsa o progressione delle metastasi durante o dopo la terapia ormonale classica. Si parla in questi casi di carcinoma della prostata resistente alla castrazione. In questa fase di malattia il tumore è in grado di crescere e progredire anche in presenza di basse dosi di testosterone circolante. [108]
Tra i chemioterapici utilizzabili, il docetaxel mostra un aumento della sopravvivenza di circa 2-3 mesi. [109] [110] Un farmaco di seconda linea è rappresentato dal cabazitaxel , [111] mentre una certa efficacia è dimostrata dalla combinazione di bevacizumab , docetaxel , talidomide e prednisone . [112]
L'immunoterapia con sipuleucel-T nei pazienti con carcinoma resistente alla castrazione può aumentare la sopravvivenza di circa 4 mesi, [113] mentre il trattamento di seconda linea può essere effettuato con abiraterone , che mostra un aumento della sopravvivenza di 4 mesi e mezzo, [114] o con enzalutamide , una molecola organica, a struttura non steroidea capace di inibire il recettore per gli ormoni androgeni con potenziale attività antitumorale [115] [116] che mostra un aumento della sopravvivenza di 5 mesi. [117] [118] [119]
La terapia radiometabolica delle metastasi ossee con 223 Ra ha dimostrato in recenti studi un allungamento della sopravvivenza nei pazienti con tumore resistente alla castrazione [120] .
Cure palliative
Una cura palliativa per i tumori prostatici in fase avanzata è rivolta al migliorare la qualità della vita attenuando i sintomi delle metastasi. La chemioterapia può utilizzarsi per ridurre la progressione della malattia e procrastinarne i sintomi. [121]
Il regime terapeutico usato più di frequente combina il chemioterapico docetaxel con un corticosteroide come il prednisone . [122]
I bifosfonati come l' acido zoledronico si sono dimostrati in grado di posticipare le complicazioni a carico dello scheletro come le fratture ; inoltre inibiscono direttamente la crescita delle cellule neoplastiche. L'utilizzo della radioterapia in pazienti con metastasi di carcinoma prostatico refrattarie alla terapia ormonale. [121] [123]
Il dolore osseo dovuto alle metastasi viene trattato in prima istanza con analgesici oppioidi come la morfina e l' ossicodone . La radioterapia a fascio esterno diretta sulle metastasi ossee assicura una diminuzione del dolore ed è indicata in caso di lesioni isolate, mentre la terapia radiometabolica è impiegabile nella palliazione della malattia ossea secondaria più diffusa [124][125]
Prognosi
Nelle società occidentali i tassi di tumori della prostata sono più elevati, e le prognosi più sfavorevoli che nel resto del mondo. Molti dei fattori di rischio sono maggiormente presenti in Occidente, tra cui la maggior durata di vita e il consumo di grassi animali. Inoltre, dove sono più accessibili i programmi di screening, v'è un maggior tasso di diagnosi. Il tumore della prostata è il nono più frequente tumore nel mondo, e il primo, a parte i tumori cutanei, negli Stati Uniti per quanto riguarda gli uomini, dove nel 2005 ha colpito il 18% degli uomini, e causa di morte per il 3%. [28] In Giappone , il tasso di morte per tumore della prostata era da un quinto alla metà rispetto agli Stati Uniti e all' Europa negli anni novanta ; [126] in India nello stesso periodo metà delle persone con tumore della prostata non invasivo morivano entro dieci anni. [127] Gli afroamericani contraggono il tumore e ne muoiono 50-60 volte più frequentemente rispetto agli uomini di Shanghai , Cina . [128] In Nigeria il 2% degli uomini sviluppano tumore prostatico e il 64% di essi muoiono entro due anni. [129]
Nei pazienti sottoposti a trattamento gli indicatori prognostici più importanti sono lo stadio di malattia, i livelli pre-terapia di PSA e l'indice di Gleason. In generale maggiore il grado e lo stadio peggiore è la prognosi. Si può ricorrere ad algoritmi per calcolare il rischio stimato in un determinato paziente. Le predizioni sono basate sull'esperienza su ampi gruppi di pazienti affetti da tumori in vari stadi. [130]
Prevenzione
Il rischio di tumore prostatico può ridursi modificando fattori di rischio conosciuti, come l'assunzione di grassi animali. Diversi farmaci e vitamine possono anch'essi aiutare nella prevenzione: due supplementi dietetici, la vitamina E e il selenio ; così gli estrogeni ricavati dalla soia e altre fonti vegetali ( fitoestrogeni ). Il toremifene , modulatore selettivo dei recettori per gli estrogeni, si è dimostrato promettente in test preliminari, [131] così come due farmaci in grado di bloccare la conversione del testosterone in diidrotestosterone , la finasteride [132] e la dutasteride . [133]
Frequenza di eiaculazioni
Uno studio del 2003 [134] indica che eiaculazioni regolari possono avere un ruolo nella prevenzione del tumore della prostata. Altri studi, tuttavia: [135] non rilevano un'associazione significativa tra i due fattori. [136] [137] Questi risultati hanno comunque contraddetto precedenti studi i quali suggerivano che aver avuto numerosi partner sessuali o comunque un'elevata attività sessuale incrementerebbe il rischio di carcinoma prostatico del 40%. Una differenza chiave può essere che questi precedenti studi definivano l'attività sessuale come il rapporto sessuale, mentre quelli più recenti si sono concentrati più sul numero di eiaculazioni avvenute con o senza rapporti sessuali. [138]
Un ulteriore studio risalente al 2004 riporta che: "La maggior parte delle categorie di persone con una elevata frequenza di eiaculazione si sono dimostrate non correlate al rischio di cancro alla prostata. Tuttavia, la frequenza di eiaculazione alta è correlata a diminuzione del rischio totale di cancro alla prostata". L' abstract della relazione ha concluso che: "I nostri risultati suggeriscono che la frequenza di eiaculazione non è correlata a un aumento del rischio di cancro alla prostata". [139]
Note
- ^ ( EN ) Prostate cancer - UK mortality statistics , su info.cancerresearchuk.org . URL consultato il 7 gennaio 2012 (archiviato dall' url originale il 4 gennaio 2012) .
- ^ American Cancer Society webpage - ( EN ) Detailed Guide: prostate cancer , su cancer.org . URL consultato il 26 dicembre 2010 .
- ^ Adams, J. The case of scirrhous of the prostate gland with corresponding affliction of the lymphatic glands in the lumbar region and in the pelvis. Lancet 1, 393 (1853).
- ^ Lytton, B. Prostate cancer: a brief history and the discovery of hormonal ablation treatment. J. Urol. 165, 1859-1862
- ^ Young, HH Four cases of radical prostatectomy. Johns Hopkins Bull. 16, 315 (1905).
- ^ Walsh, PC, Lepor, H. & Eggleston, JC Radical prostatectomy with preservation of sexual function: anatomical and pathological considerations. Prostate 4, 473-485 (1983). PMID 6889192
- ^ Huggins, CB & Hodges, CV Studies on prostate cancer: 1. The effects of castration, of estrogen and androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Res. 1, 203 (1941).
- ^ AV. Schally, AJ. Kastin; A. Arimura, Hypothalamic follicle-stimulating hormone (FSH) and luteinizing hormone (LH)-regulating hormone: structure, physiology, and clinical studies. , in Fertil Steril , vol. 22, n. 11, novembre 1971, pp. 703-21, PMID 4941683 .
- ^ G. Tolis, D. Ackman; A. Stellos; A. Mehta; F. Labrie; AT. Fazekas; AM. Comaru-Schally; AV. Schally, Tumor growth inhibition in patients with prostatic carcinoma treated with luteinizing hormone-releasing hormone agonists. , in Proc Natl Acad Sci USA , vol. 79, n. 5, marzo 1982, pp. 1658-62, PMID 6461861 .
- ^ SR. Denmeade, JT. Isaacs, A history of prostate cancer treatment. , in Nat Rev Cancer , vol. 2, n. 5, maggio 2002, pp. 389-96, DOI : 10.1038/nrc801 , PMID 12044015 .
- ^ WW. Scott, DE. Johnson; JE. Schmidt; RP. Gibbons; GR. Prout; JR. Joiner; J. Saroff; GP. Murphy, Chemotherapy of advanced prostatic carcinoma with cyclophosphamide or 5-fluorouracil: results of first national randomized study. , in J Urol , vol. 114, n. 6, dicembre 1975, pp. 909-11, PMID 1104900 .
- ^ WHO Disease and injury country estimates , su World Health Organization , 2009. URL consultato l'11 novembre 2009 .
- ^ Matsuda T, Saika K, Comparison of time trends in prostate cancer incidence (1973-2002) in Asia, from cancer incidence in five continents, Vols IV-IX , in Jpn. J. Clin. Oncol. , vol. 39, n. 7, luglio 2009, pp. 468–9, DOI : 10.1093/jjco/hyp077 , PMID 19553401 .
- ^ ( EN ) web.archive.org , su jncicancerspectrum.oxfordjournals.org (archiviato dall' url originale il 5 febbraio 2006) .
- ^ ( EN ) What causes prostate cancer? , su cancer.org . URL consultato il 26 dicembre 2010 .
- ^ a b RM. Hoffman, FD. Gilliland; JW. Eley; LC. Harlan; RA. Stephenson; JL. Stanford; PC. Albertson; AS. Hamilton; WC. Hunt; AL. Potosky, Racial and ethnic differences in advanced-stage prostate cancer: the Prostate Cancer Outcomes Study. , in J Natl Cancer Inst , vol. 93, n. 5, marzo 2001, pp. 388-95, PMID 11238701 .
- ^ ( EN ) What causes prostate cancer? , su cancer.org , American Cancer Society. URL consultato il 27 gennaio 2012 .
- ^ Shin HR, Masuyer E, Ferlay J, Curado MP, Cancer in Asia - Incidence rates based on data in cancer incidence in five continents IX (1998-2002) , in Asian Pac. J. Cancer Prev. , 11 Suppl 2, 2010, pp. 11–6, PMID 20553065 .
- ^International Agency for Research on Cancer
- ^ ( EN ) The Role of Increasing Detection in the Rising Incidence of Prostate Cancer , su jama.ama-assn.org . URL consultato il 26 dicembre 2010 .
- ^ Ann W. Hsing and Anand P. Chokkalingam, Prostate cancer epidemiology , in Frontiers in Bioscience , n. 11, 1º maggio 2006, pp. 1388-1413.
- ^ Djulbegovic M, Beyth RJ, Neuberger MM, et al. ,Screening for prostate cancer: systematic review and meta-analysis of randomised controlled trials , in BMJ , vol. 341, 2010, pp. c4543, PMC 2939952 , PMID 20843937 .
- ^ Liu H, Wang B, Han C, Meta-analysis of genome-wide and replication association studies on prostate cancer , in Prostate , vol. 71, n. 2, febbraio 2011, pp. 209–24, DOI : 10.1002/pros.21235 , PMID 20690139 .
- ^ Albain KS, Unger JM, Crowley JJ, Coltman CA, Hershman DL,Racial disparities in cancer survival among randomized clinical trials patients of the Southwest Oncology Group , in J. Natl. Cancer Inst. , vol. 101, n. 14, luglio 2009, pp. 984–92, DOI : 10.1093/jnci/djp175 , PMC 2724852 , PMID 19584328 .
- ^ Alexander DD, Mink PJ, Cushing CA, Sceurman B,A review and meta-analysis of prospective studies of red and processed meat intake and prostate cancer , in Nutr J , vol. 9, 2010, p. 50, DOI : 10.1186/1475-2891-9-50 , PMC 2987772 , PMID 21044319 .
- ^ BF. Hankey, EJ. Feuer; LX. Clegg; RB. Hayes; JM. Legler; PC. Prorok; LA. Ries; RM. Merrill; RS. Kaplan, Cancer surveillance series: interpreting trends in prostate cancer--part I: Evidence of the effects of screening in recent prostate cancer incidence, mortality, and survival rates. , in J Natl Cancer Inst , vol. 91, n. 12, giugno 1999, pp. 1017-24, PMID 10379964 .
- ^ N. Breslow, CW. Chan; G. Dhom; RA. Drury; LM. Franks; B. Gellei; YS. Lee; S. Lundberg; B. Sparke; NH. Sternby; H. Tulinius, Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France. , in Int J Cancer , vol. 20, n. 5, novembre 1977, pp. 680-8, PMID 924691 .
- ^ a b A. Jemal, T. Murray; E. Ward; A. Samuels; RC. Tiwari; A. Ghafoor; EJ. Feuer; MJ. Thun, Cancer statistics, 2005. , in CA Cancer J Clin , vol. 55, n. 1, pp. 10-30, PMID 15661684 .
- ^ GD. Steinberg, BS. Carter; TH. Beaty; B. Childs; PC. Walsh, Family history and the risk of prostate cancer. , in Prostate , vol. 17, n. 4, 1990, pp. 337-47, PMID 2251225 .
- ^ P. Lichtenstein, NV. Holm; PK. Verkasalo; A. Iliadou; J. Kaprio; M. Koskenvuo; E. Pukkala; A. Skytthe; K. Hemminki, Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland. , in N Engl J Med , vol. 343, n. 2, luglio 2000, pp. 78-85, DOI : 10.1056/NEJM200007133430201 , PMID 10891514 .
- ^ JP. Struewing, P. Hartge; S. Wacholder; SM. Baker; M. Berlin; M. McAdams; MM. Timmerman; LC. Brody; MA. Tucker, The risk of cancer associated with specific mutations of BRCA1 and BRCA2 among Ashkenazi Jews. , in N Engl J Med , vol. 336, n. 20, maggio 1997, pp. 1401-8, DOI : 10.1056/NEJM199705153362001 , PMID 9145676 .
- ^ Chan JM, Gann PH, Giovannucci EL., Role of diet in prostate cancer development and progression , in Journal of Clinical Oncology , 2005, PMID 16278466 .
- ^ a b Szymanski KM, Wheeler DC, Mucci LA, Fish consumption and prostate cancer risk: a review and meta-analysis , in Am. J. Clin. Nutr. , vol. 92, n. 5, novembre 2010, pp. 1223–33, DOI : 10.3945/ajcn.2010.29530 , PMID 20844069 .
- ^ Reese AC, Fradet V, Witte JS,Omega-3 fatty acids, genetic variants in COX-2 and prostate cancer , in J Nutrigenet Nutrigenomics , vol. 2, n. 3, 2009, pp. 149–58, DOI : 10.1159/000235565 , PMC 2820568 , PMID 19776642 .
- ^ Ledesma MC, Jung-Hynes B, Schmit TL, Kumar R, Mukhtar H, Ahmad N,Selenium and vitamin E for prostate cancer: post-SELECT (Selenium and Vitamin E Cancer Prevention Trial) status , in Mol. Med. , vol. 17, n. 1-2, 2011, pp. 134–43, DOI : 10.2119/molmed.2010.00136 , PMC 3022975 , PMID 20882260 .
- ^ CC. Schulman, S. Ekane; AR. Zlotta, Nutrition and prostate cancer: evidence or suspicion? , in Urology , vol. 58, n. 3, settembre 2001, pp. 318-34, PMID 11549473 .
- ^ Choo CS, Mamedov A, Chung M, Choo R, Kiss A, Danjoux C, Vitamin D insufficiency is common in patients with nonmetastatic prostate cancer , in Nutr Res , vol. 31, n. 1, gennaio 2011, pp. 21–6, DOI : 10.1016/j.nutres.2010.12.007 , PMID 21310302 .
- ^ EJ. Jacobs, C. Rodriguez; AM. Mondul; CJ. Connell; SJ. Henley; EE. Calle; MJ. Thun, A large cohort study of aspirin and other nonsteroidal anti-inflammatory drugs and prostate cancer incidence. , in J Natl Cancer Inst , vol. 97, n. 13, luglio 2005, pp. 975-80, DOI : 10.1093/jnci/dji173 , PMID 15998950 .
- ^ J. Shannon, S. Tewoderos; M. Garzotto; TM. Beer; R. Derenick; A. Palma; PE. Farris, Statins and prostate cancer risk: a case-control study. , in Am J Epidemiol , vol. 162, n. 4, agosto 2005, pp. 318-25, DOI : 10.1093/aje/kwi203 , PMID 16014776 .
- ^ E. Giovannucci, TD. Tosteson; FE. Speizer; A. Ascherio; MP. Vessey; GA. Colditz, A retrospective cohort study of vasectomy and prostate cancer in US men. , in JAMA , vol. 269, n. 7, febbraio 1993, pp. 878-82, PMID 8123059 .
- ^ GG. Giles, G. Severi; DR. English; MR. McCredie; R. Borland; P. Boyle; JL. Hopper, Sexual factors and prostate cancer. , in BJU Int , vol. 92, n. 3, agosto 2003, pp. 211-6, PMID 12887469 .
- ^ LK. Dennis, CF. Lynch; JC. Torner, Epidemiologic association between prostatitis and prostate cancer. , in Urology , vol. 60, n. 1, luglio 2002, pp. 78-83, PMID 12100928 .
- ^ EE. Calle, C. Rodriguez; K. Walker-Thurmond; MJ. Thun, Overweight, obesity, and mortality from cancer in a prospectively studied cohort of US adults. , in N Engl J Med , vol. 348, n. 17, aprile 2003, pp. 1625-38, DOI : 10.1056/NEJMoa021423 , PMID 12711737 .
- ^ Raynaud JP., Prostate cancer risk in testosterone-treated men , in The Journal of Steroid Biochemistry and Molecular Biology , vol. 102, dicembre 2006, pp. 261-266, PMID 17113983 .
- ^ ( EN ) Adrian Burton, Klinefelter's syndrome changes cancer risk , in The Lancet Oncology , vol. 6, n. 10, 1º ottobre 2005, pp. 741, DOI : 10.1016/S1470-2045(05)70375-2 . URL consultato il 3 luglio 2021 .
- ^ Aumüller, G. Prostate Gland and Seminal Vesicles. Springer-Verlag Berlin-Heidelberg. 1979.
- ^ Moore, K., Dalley, A. Clinically Oriented Anatomy. Lippincott Williams & Wilkins, Baltimore, Maryland. 1999.
- ^ Steive, H. Männliche Genitalorgane. In: Handbuch der mikroskopischen Anatomie des Menschen. Vol. VII Part 2, pp. 1-399. Berlin: Springer 1930.
- ^ Hsing AW, Chokkalingam AP, Prostate cancer epidemiology , in Frontiers in Bioscience , vol. 11, 2006, pp. 1388–413, DOI : 10.2741/1891 , PMID 16368524 .
- ^ BF Hankey, Feuer EJ, Clegg LX, Hayes RB, Legler JM, Prorok PC, Ries LA, Merrill RM, Kaplan RS, Cancer surveillance series: interpreting trends in prostate cancer—part I: Evidence of the effects of screening in recent prostate cancer incidence, mortality, and survival rates , in J Natl Cancer Inst , vol. 91, n. 12, 16 giugno 1999, pp. 1017–24, DOI : 10.1093/jnci/91.12.1017 , PMID 10379964 .
- ^ N Breslow, Chan CW, Dhom G, Drury RA, Franks LM, Gellei B, Lee YS, Lundberg S, Sparke B, Sternby NH, Tulinius H., Latent carcinoma of prostate at autopsy in seven areas. The International Agency for Research on Cancer, Lyons, France , in Int J Cancer , vol. 20, n. 5, 15 novembre 1977, pp. 680–8, DOI : 10.1002/ijc.2910200506 , PMID 924691 .
- ^ Zeegers MP, A Jellema e H Ostrer, Empiric risk of prostate carcinoma for relatives of patients with prostate carcinoma: a meta-analysis , in Cancer , vol. 97, n. 8, 2003, pp. 1894–903, DOI : 10.1002/cncr.11262 , PMID 12673715 .
- ^ A Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, Feuer EJ, Thun MJ, Cancer statistics, 2005 , in CA Cancer J Clin , vol. 55, n. 1, Jan-February 2005, pp. 10–30, DOI : 10.3322/canjclin.55.1.10 , PMID 15661684 . Erratum in: CA Cancer J Clin. 2005 Jul-Aug;55(4):259
- ^ Martin RM, Vatten L, Gunnell D, Romundstad P, Blood pressure and risk of prostate cancer: cohort Norway (CONOR) , in Cancer Causes Control , vol. 21, n. 3, marzo 2010, pp. 463–72, DOI : 10.1007/s10552-009-9477-x , PMID 19949849 .
- ^ ( EN ) Witte ON, et al. , Growth Regulation of Hematopoietic and Epithelial Cancers and the Immune Response , in Science , vol. 329, n. 5991, luglio 2010, pp. 568–571, DOI : 10.1126/science.1189992 , PMC 2917982 , PMID 20671189 .
- ^ a b c Robbins e Cotran, 2008 , pp. 1050-1056 .
- ^ Albertazzi-Porena, 2003 , pp. 691-704 .
- ^ a b Harrison, 2006 , pp. 623-632 .
- ^ Busch PC, Egevad L, Haggman M., Precancer of the prostate , in Cancer Surv. , vol. 32, 1998, pp. 149-79., PMID 10489627 .
- ^ McNeal JE., Origin and development of carcinoma in the prostate. , in Cancer , vol. 23, n. 1, 1969 Jan, pp. 24-34, PMID 576325 .
- ^ Wang X, Hickey RJ, Malkas LH, Koch MO, Li L, Zhang S, Sandusky GE, Grignon DJ, Eble JN, Cheng L., Elevated expression of cancer-associated proliferating cell nuclear antigen in high-grade prostatic intraepithelial neoplasia and prostate cancer , in Prostate , 28 ottobre 2010., PMID 21031434 .
- ^ Kronz JD, Allan CH, Shaikh AA, Epstein JI., Predicting cancer following a diagnosis of high-grade prostatic intraepithelial neoplasia on needle biopsy: data on men with more than one follow-up biopsy. , in Am J Surg Pathol , vol. 25, n. 8, 2001 Aug, pp. 107-85., PMID 1147429 .
- ^ Häggman MJ, Macoska JA, Wojno KJ, Oesterling JE., The relationship between prostatic intraepithelial neoplasia and prostate cancer: critical issues. , in J Urol. , vol. 158, n. 1, 1997 Jul, pp. 12-22, PMID 9186314 .
- ^ DC. Miller, KS. Hafez; A. Stewart; JE. Montie; JT. Wei, Prostate carcinoma presentation, diagnosis, and staging: an update form the National Cancer Data Base. , in Cancer , vol. 98, n. 6, settembre 2003, pp. 1169-78, DOI : 10.1002/cncr.11635 , PMID 12973840 .
- ^ IW. van der Cruijsen-Koeter, AN. Vis; MJ. Roobol; MF. Wildhagen; HJ. de Koning; TH. van der Kwast; FH. Schröder, Comparison of screen detected and clinically diagnosed prostate cancer in the European randomized study of screening for prostate cancer, section rotterdam. , in J Urol , vol. 174, n. 1, luglio 2005, pp. 121-5, DOI : 10.1097/01.ju.0000162061.40533.0f , PMID 15947595 .
- ^ Salute internazionale , su saluteinternazionale.info .
- ^ RL. Grubb, KA. Roehl; JA. Antenor; WJ. Catalona, Results of compliance with prostate cancer screening guidelines. , in J Urol , vol. 174, n. 2, agosto 2005, pp. 668-72; discussion 672, PMID 16006944 .
- ^ S. Giusti, D. Caramella; E. Fruzzetti; M. Lazzereschi; A. Tognetti; C. Bartolozzi, Peripheral zone prostate cancer. Pre-treatment evaluation with MR and 3D ¹H MR spectroscopic imaging: correlation with pathologic findings. , in Abdom Imaging , vol. 35, n. 6, dicembre 2010, pp. 757-63, DOI : 10.1007/s00261-009-9577-9 , PMID 19756851 .
- ^ GW. Chodak, P. Keller; HW. Schoenberg, Assessment of screening for prostate cancer using the digital rectal examination. , in J Urol , vol. 141, n. 5, maggio 1989, pp. 1136-8, PMID 2709500 .
- ^ MD. Krahn, JE. Mahoney; MH. Eckman; J. Trachtenberg; SG. Pauker; AS. Detsky, Screening for prostate cancer. A decision analytic view. , in JAMA , vol. 272, n. 10, settembre 1994, pp. 773-80, PMID 7521400 .
- ^ Hessels D, Schalken JA, The use of PCA3 in the diagnosis of prostate cancer. , in Nat Rev Urol. , vol. 5, n. 6, maggio 2009, pp. 255-61, PMID 19424173 .
- ^ ( EN ) Laxman B, Morris DS, Yu J, et al. , A first-generation multiplex biomarker analysis of urine for the early detection of prostate cancer , in Cancer Res. , vol. 68, n. 3, febbraio 2008, pp. 645–9, DOI : 10.1158/0008-5472.CAN-07-3224 , PMID 18245462 .
- ^ ( EN ) de la Taille A, Progensa PCA3 test for prostate cancer detection , in Expert Rev. Mol. Diagn. , vol. 7, n. 5, settembre 2007, pp. 491–7, DOI : 10.1586/14737159.7.5.491 , PMID 17892357 .
- ^ ( EN ) Bussemakers MJ, van Bokhoven A, Verhaegh GW, et al. , DD3: a new prostate-specific gene, highly overexpressed in prostate cancer , in Cancer Res. , vol. 59, n. 23, dicembre 1999, pp. 5975–9, PMID 10606244 .
- ^ ( EN ) Neves AF, Araújo TG, Biase WK, et al. , Combined analysis of multiple mRNA markers by RT-PCR assay for prostate cancer diagnosis , in Clin. Biochem. , vol. 41, n. 14-15, luglio 2008, p. 1191, DOI : 10.1016/j.clinbiochem.2008.06.013 , PMID 18640109 .
- ^ Haese A, de la Taille A, van Poppel H, et al. , Clinical Utility of the PCA3 Urine Assay in European Men Scheduled for Repeat Biopsy , in Eur. Urol. , vol. 54, n. 5, giugno 2008, p. 1081, DOI : 10.1016/j.eururo.2008.06.071 , PMID 18602209 .
- ^ Marks LS, Fradet Y, Deras IL, et al. , PCA3 molecular urine assay for prostate cancer in men undergoing repeat biopsy , in Urology , vol. 69, n. 3, marzo 2007, pp. 532–5, DOI : 10.1016/j.urology.2006.12.014 , PMID 17382159 .
- ^ ML. Essink-Bot, HJ. de Koning; HG. Nijs; WJ. Kirkels; PJ. van der Maas; FH. Schröder, Short-term effects of population-based screening for prostate cancer on health-related quality of life. , in J Natl Cancer Inst , vol. 90, n. 12, giugno 1998, pp. 925-31, PMID 9637143 .
- ^ Sanraffaele.org - Nuovo esame per tumore alla prostata , su sanraffaele.org . URL consultato il 28 marzo 2021 (archiviato dall' url originale il 10 settembre 2012) .
- ^ M. Picchio, C. Messa; C. Landoni; L. Gianolli; S. Sironi; M. Brioschi; M. Matarrese; DV. Matei; F. De Cobelli; A. Del Maschio; F. Rocco, Value of [11C]choline-positron emission tomography for re-staging prostate cancer: a comparison with [18F]fluorodeoxyglucose-positron emission tomography. , in J Urol , vol. 169, n. 4, aprile 2003, pp. 1337-40, DOI : 10.1097/01.ju.0000056901.95996.43 , PMID 12629355 .
- ^ B. Scher, M. Seitz; W. Albinger; R. Tiling; M. Scherr; HC. Becker; M. Souvatzogluou; FJ. Gildehaus; HJ. Wester; S. Dresel, Value of 11C-choline PET and PET/CT in patients with suspected prostate cancer. , in Eur J Nucl Med Mol Imaging , vol. 34, n. 1, gennaio 2007, pp. 45-53, DOI : 10.1007/s00259-006-0190-7 , PMID 16932935 .
- ^ Prostatakrebs-Kodierhilfe. Tumorzentrum Freiburg 2007 Archiviato il 9 ottobre 2007 in Internet Archive . (PDF)
- ^ Christian Wittekind, Hans-Joachim Meyer (Hrsg.): TNM: Klassifikation maligner Tumoren. Wiley-VCH Verlag, 7. Auflage 2010, ISBN 3-527-32759-2
- ^ Cheng L, Montironi R, Bostwick DG, Lopez-Beltran A, Berney DM, Staging of prostate cancer , in Histopathology , gennaio 2012, PMID 22212080 .
- ^ Wagner W, Bölling T, Hambruegge C, Hartlapp J, Krukemeyer MG, Patients' satisfaction with different modalities of prostate cancer therapy--a retrospective survey among 634 patients , in Anticancer Res , novembre 2011, PMID 22110217 .
- ^ Corcoran NM, Gleave ME, Targeted therapy in prostate cancer , in Histopathology , gennaio 2012, PMID 22212088 .
- ^ Bach P, Döring T, Gesenberg A, Möhring C, Goepel M, Psychological aspects of prostate cancer: a clinical review , gennaio 2012, PMID 22212706 .
- ^ Treatments for Clinically Localized Prostate Cancer , PMID 21938810 .
- ^ S. Gupta, M. Varghese; MM. Shareef; MM. Ahmed, Human Prostate Cancer Cells Secrete Neuro-Protective Factors in Response to Cryotherapy. , in Mol Cell Pharmacol , vol. 1, n. 4, gennaio 2009, pp. 200-206, PMID 20401329 .
- ^ DS. Finley, AS. Belldegrun, Salvage cryotherapy for radiation-recurrent prostate cancer: outcomes and complications. , in Curr Urol Rep , vol. 12, n. 3, giugno 2011, pp. 209-15, DOI : 10.1007/s11934-011-0182-4 , PMID 21394596 .
- ^ H. Wu, L. Sun; JW. Moul; HY. Wu; DG. McLeod; C. Amling; R. Lance; L. Kusuda; T. Donahue; J. Foley; A. Chung, Watchful waiting and factors predictive of secondary treatment of localized prostate cancer. , in J Urol , vol. 171, n. 3, marzo 2004, pp. 1111-6, DOI : 10.1097/01.ju.0000113300.74132.8b , PMID 14767282 .
- ^ Klotz L., Active surveillance for prostate cancer: a review , ottobre 2011, PMID 22052761 .
- ^ Aldo Zangara, Terapia medica ragionata , PICCIN, 2002, pp. 1105–, ISBN 978-88-299-1649-8 .
- ^ H. Zincke, JE. Oesterling; ML. Blute; EJ. Bergstralh; RP. Myers; DM. Barrett, Long-term (15 years) results after radical prostatectomy for clinically localized (stage T2c or lower) prostate cancer. , in J Urol , vol. 152, 5 Pt 2, novembre 1994, pp. 1850-7, PMID 7523733 .
- ^ GS. Gerber, RA. Thisted; PT. Scardino; HG. Frohmuller; FH. Schroeder; DF. Paulson; AW. Middleton; DB. Rukstalis; JA. Smith; PF. Schellhammer; M. Ohori, Results of radical prostatectomy in men with clinically localized prostate cancer. , in JAMA , vol. 276, n. 8, agosto 1996, pp. 615-9, PMID 8773633 .
- ^ Ward JF, Zincke H, Radical prostatectomy for the patient with locally advanced prostate cancer , in Curr Urol Rep , vol. 4, n. 3, 2003, pp. 196-204, PMID 12756082 .
- ^ Dott. JC HU, Urologo all'ospedale di Boston, su JAMA (American Medical Association, Vol.302, n°14, 2009
- ^ Radioterapia a fasci esterni , su aimac.it , AIMaC. URL consultato il 25 gennaio 2012 .
- ^ CA. Perez, GE. Hanks; SA. Leibel; AL. Zietman; Z. Fuks; WR. Lee, Localized carcinoma of the prostate (stages T1B, T1C, T2, and T3). Review of management with external beam radiation therapy. , in Cancer , vol. 72, n. 11, dicembre 1993, pp. 3156-73, PMID 7694785 .
- ^ Bice WS, Prestidge BR, Kurtzman SM, et al. , Recommendations for permanent prostate brachytherapy with (131)Cs: a consensus report from the Cesium Advisory Group , in Brachytherapy , vol. 7, n. 4, 2008, pp. 290–6, DOI : 10.1016/j.brachy.2008.05.004 , PMID 18782682 .
- ^ AV. D'Amico, J. Manola; M. Loffredo; AA. Renshaw; A. DellaCroce; PW. Kantoff, 6-month androgen suppression plus radiation therapy vs radiation therapy alone for patients with clinically localized prostate cancer: a randomized controlled trial. , in JAMA , vol. 292, n. 7, agosto 2004, pp. 821-7, DOI : 10.1001/jama.292.7.821 , PMID 15315996 .
- ^ CA. Lawton, M. Won; MV. Pilepich; SO. Asbell; WU. Shipley; GE. Hanks; JD. Cox; CA. Perez; WT. Sause; SR. Doggett, Long-term treatment sequelae following external beam irradiation for adenocarcinoma of the prostate: analysis of RTOG studies 7506 and 7706. , in Int J Radiat Oncol Biol Phys , vol. 21, n. 4, settembre 1991, pp. 935-9, PMID 1917622 .
- ^ DJ. Brenner, RE. Curtis; EJ. Hall; E. Ron, Second malignancies in prostate carcinoma patients after radiotherapy compared with surgery. , in Cancer , vol. 88, n. 2, gennaio 2000, pp. 398-406, PMID 10640974 .
- ^ DK. Bahn, F. Lee; R. Badalament; A. Kumar; J. Greski; M. Chernick, Targeted cryoablation of the prostate: 7-year outcomes in the primary treatment of prostate cancer. , in Urology , vol. 60, 2 Suppl 1, agosto 2002, pp. 3-11, PMID 12206842 .
- ^ M. Robson, N. Dawson, How is androgen-dependent metastatic prostate cancer best treated? , in Hematol Oncol Clin North Am , vol. 10, n. 3, giugno 1996, pp. 727-47, PMID 8773508 .
- ^ DA. Loblaw, DS. Mendelson; JA. Talcott; KS. Virgo; MR. Somerfield; E. Ben-Josef; R. Middleton; H. Porterfield; SA. Sharp; TJ. Smith; ME. Taplin, American Society of Clinical Oncology recommendations for the initial hormonal management of androgen-sensitive metastatic, recurrent, or progressive prostate cancer. , in J Clin Oncol , vol. 22, n. 14, luglio 2004, pp. 2927-41, DOI : 10.1200/JCO.2004.04.579 , PMID 15184404 .
- ^ a b T. Tammela, Endocrine treatment of prostate cancer. , in J Steroid Biochem Mol Biol , vol. 92, n. 4, novembre 2004, pp. 287-95, DOI : 10.1016/j.jsbmb.2004.10.005 , PMID 15663992 .
- ^ CL. Derleth, EY. Yu, Targeted therapy in the treatment of castration-resistant prostate cancer. , in Oncology (Williston Park) , vol. 27, n. 7, luglio 2013, pp. 620-8, PMID 23977754 .
- ^ Clarke NW, Docetaxel for the Treatment of Hormone Refractory Prostate Cancer ( PDF ), su nice.org.uk , 2005. URL consultato il 6 ottobre 2013 (archiviato dall' url originale il 12 luglio 2012) .
- ^ Prostate cancer (hormone-refractory) - docetaxel , su nice.org.uk , National Institute for Health and Clinical Excellence, 10 dicembre 2010. URL consultato il 6 ottobre 2013 .
- ^ JS. de Bono, S. Oudard; M. Ozguroglu; S. Hansen; JP. Machiels; I. Kocak; G. Gravis; I. Bodrogi; MJ. Mackenzie; L. Shen; M. Roessner, Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomised open-label trial. , in Lancet , vol. 376, n. 9747, ottobre 2010, pp. 1147-54, DOI : 10.1016/S0140-6736(10)61389-X , PMID 20888992 .
- ^ YM. Ning, JL. Gulley; PM. Arlen; S. Woo; SM. Steinberg; JJ. Wright; HL. Parnes; JB. Trepel; MJ. Lee; YS. Kim; H. Sun, Phase II trial of bevacizumab, thalidomide, docetaxel, and prednisone in patients with metastatic castration-resistant prostate cancer. , in J Clin Oncol , vol. 28, n. 12, aprile 2010, pp. 2070-6, DOI : 10.1200/JCO.2009.25.4524 , PMID 20308663 .
- ^ PW. Kantoff, CS. Higano; ND. Shore; ER. Berger; EJ. Small; DF. Penson; CH. Redfern; AC. Ferrari; R. Dreicer; RB. Sims; Y. Xu, Sipuleucel-T immunotherapy for castration-resistant prostate cancer. , in N Engl J Med , vol. 363, n. 5, luglio 2010, pp. 411-22, DOI : 10.1056/NEJMoa1001294 , PMID 20818862 .
- ^ FDA approves Zytiga for late-stage prostate cancer , su fda.gov , US Food and Drug Administration, 28 aprile 2011. URL consultato il 6 ottobre 2013 .
- ^ ( FR ) Noel-Wekstein S, Turpin G, De Gennes JL, [Magnetic resonance imaging in the follow-up of craniopharyngioma surgically treated] , in Presse Med , vol. 19, n. 1, 1990, p. 32, PMID 2137222 .
- ^ Scher HI, Beer TM, Higano CS, et al. ,Antitumour activity of MDV3100 in castration-resistant prostate cancer: a phase 1-2 study , in Lancet , vol. 375, n. 9724, aprile 2010, pp. 1437–46, DOI : 10.1016/S0140-6736(10)60172-9 , PMC 2948179 , PMID 20398925 .
- ^ FDA approves new treatment for a type of late stage prostate cancer , su fda.gov , United States Food and Drug Administration, 31 agosto 2012. URL consultato il 6 ottobre 2013 .
- ^ Anna Azvolinsky, FDA Approves Enzalutamide (Xtandi) for Late-Stage Prostate Cancer , su cancernetwork.com , CancerNetwork, 4 settembre 2012. URL consultato il 6 ottobre 2013 .
- ^ ( EN ) Search of: MDV3100 - List Results - ClinicalTrials.gov , su clinicaltrial.gov (archiviato dall' url originale il 25 febbraio 2014) .
- ^ PR. Sieber, Emerging Therapeutic for the Treatment of Skeletal-related Events Associated With Metastatic Castrate-resistant Prostate Cancer. , in Rev Urol , vol. 16, n. 1, 2014, pp. 10-20, PMID 24791151 .
- ^ a b RK. Portenoy, Treatment of cancer pain. , in Lancet , vol. 377, n. 9784, giugno 2011, pp. 2236-47, DOI : 10.1016/S0140-6736(11)60236-5 , PMID 21704873 .
- ^ J. Yaneva, J. Zlatanova, Histone H1 interacts specifically with certain regions of the mouse alpha-globin gene. , in DNA Cell Biol , vol. 11, n. 2, marzo 1992, pp. 91-9, PMID 1547021 .
- ^ Saad F, Gleason DM, Murray R, Tchekmedyian S, Venner P, Lacombe L, Chin JL, Vinholes JJ, Goas JA, Chen B, A randomized, placebo-controlled trial of zoledronic acid in patients with hormone-refractory metastatic prostate carcinoma , in J Natl Cancer Inst , vol. 94, n. 19, 2002, pp. 1458-68, PMID 12359855 .
- ^ E. Seregni, B. Padovano; A. Coliva; E. Zecca; E. Bombardieri, State of the art of palliative therapy. , in QJ Nucl Med Mol Imaging , vol. 55, n. 4, agosto 2011, pp. 411-9, PMID 21738114 .
- ^ DJ. Hillegonds, S. Franklin; DK. Shelton; S. Vijayakumar; V. Vijayakumar, The management of painful bone metastases with an emphasis on radionuclide therapy. , in J Natl Med Assoc , vol. 99, n. 7, luglio 2007, pp. 785-94, PMID 17668645 .
- ^ K. Wakai, [Descriptive epidemiology of prostate cancer in Japan and Western countries]. , in Nihon Rinsho , vol. 63, n. 2, febbraio 2005, pp. 207-12, PMID 15714967 .
- ^ M. Jaubert de Beaujeu, Y. Chavrier, [Deformations of the anterior thoracic wall (author's transl)]. , in Ann Chir Thorac Cardiovasc , vol. 15, n. 1, gennaio 1976, pp. 1-6, PMID 1259345 .
- ^ AW. Hsing, L. Tsao; SS. Devesa, International trends and patterns of prostate cancer incidence and mortality. , in Int J Cancer , vol. 85, n. 1, gennaio 2000, pp. 60-7, PMID 10585584 .
- ^ DN. Osegbe, Prostate cancer in Nigerians: facts and nonfacts. , in J Urol , vol. 157, n. 4, aprile 1997, pp. 1340-3, PMID 9120935 .
- ^ Di Blasio CJ, Rhee AC, Cho D, Scardino PT, Kattan MW, Predicting clinical end points: treatment nomograms in prostate cancer , in Semin Oncol , vol. 30, n. 5, 2003, pp. 567-86, PMID 14571407 .
- ^ MS. Steiner, CR. Pound, Phase IIA clinical trial to test the efficacy and safety of Toremifene in men with high-grade prostatic intraepithelial neoplasia. , in Clin Prostate Cancer , vol. 2, n. 1, giugno 2003, pp. 24-31, PMID 15046680 .
- ^ IM. Thompson, PJ. Goodman; CM. Tangen; MS. Lucia; GJ. Miller; LG. Ford; MM. Lieber; RD. Cespedes; JN. Atkins; SM. Lippman; SM. Carlin, The influence of finasteride on the development of prostate cancer. , in N Engl J Med , vol. 349, n. 3, luglio 2003, pp. 215-24, DOI : 10.1056/NEJMoa030660 , PMID 12824459 .
- ^ RJ. Hamilton, SJ. Freedland, 5-α reductase inhibitors and prostate cancer prevention: where do we turn now? , in BMC Med , vol. 9, 2011, p. 105, DOI : 10.1186/1741-7015-9-105 , PMID 21920036 .
- ^ Giles GG, Severi G, English DR, et al. , Sexual factors and prostate cancer , in BJU Int. , vol. 92, n. 3, agosto 2003, pp. 211–6, PMID 12887469 .
- ^ Leitzmann MF, Platz EA, Stampfer MJ, Willett WC, Giovannucci E, Ejaculation frequency and subsequent risk of prostate cancer , in JAMA , vol. 291, n. 13, aprile 2004, pp. 1578–86, DOI : 10.1001/jama.291.13.1578 , PMID 15069045 .
- ^ Giles GG, Severi G, English DR, McCredie MR, Borland R, Boyle P, Hopper JL, Sexual factors and prostate cancer , in BJU Int. , vol. 92, n. 3, agosto 2003, pp. 211–6, DOI : 10.1046/j.1464-410X.2003.04319.x , PMID 12887469 .
- ^ Leitzmann MF, Platz EA, Stampfer MJ, Willett WC, Giovannucci E, Ejaculation frequency and subsequent risk of prostate cancer , in JAMA , vol. 291, n. 13, aprile 2004, pp. 1578–86, DOI : 10.1001/jama.291.13.1578 , PMID 15069045 .
- ^ Douglas Fox, Masturbating may protect against prostate cancer , su newscientist.com , New Scientist, 16 luglio 2003.
- ^ Dimitropoulou P, Lophatananon A, Easton D, Pocock R, Dearnaley DP, Guy M, Edwards S, O'Brien L, Hall A, Wilkinson R, Eeles R, Muir KR, Sexual activity and prostate cancer risk in men diagnosed at a younger age , in BJU Int. , vol. 103, n. 2, gennaio 2009, pp. 178–85, DOI : 10.1111/j.1464-410X.2008.08030.x , PMID 19016689 .
Bibliografia
- ( EN ) Position of the American Dietetic Association and Dietitians of Canada: Vegetarian diets , in J Am Diet Assoc , vol. 103, n. 6, 2003, pp. 748-65, PMID 12778049 .
- ( EN ) Strom SS, Yamamura Y, Duphorne CM, Spitz MR, Babaian RJ, Pillow PC, Hursting SD. Phytoestrogen intake and prostate cancer: a case-control study using a new database. Nutr Cancer. 1999;33(1):20-5. Erratum in: Nutr Cancer 2000;36(2):243. PMID 10227039
- ( EN ) Clinically localised prostate cancer , Timothy J Wilt, Ian M Thompson, BMJ 2006;333:1102-1106
- ( EN ) Emil A. Tanagho, Jack W. McAninch: Smith's General Urology. Appleton & Lange, Norwalk 1995. ISBN 0-8385-8612-0 .
- ( DE ) Hans Ulrich Schmelz, Christoph Sparwasser, Wolfgang Weidner: Facharztwissen Urologie. Springer, Heidelberg 2006. ISBN 3-540-20009-6 .
- ( DE ) Herbert Rübben: Uroonkologie. Springer, Berlin 2001. ISBN 3-540-67310-5 .
- ( DE ) Jürgen Sökeland: Urologie. Thieme, Stuttgart 1993. ISBN 3-13-300611-8 .
- ( DE ) M. Kessler: Kleintieronkologie . Parey-Verlag, München 2005. ISBN 3-8304-4103-7 .
Testi di oncologia e patologia generale
- Gianni Bonadonna, Gioacchino Robustelli Della Cuna, Pinuccia Valgussa, Medicina oncologica , 8ª ed., Milano, Elsevier Masson, 2007, ISBN 978-88-214-2814-2 .
- Pontieri, Russo, Frati, Patologia generale , 3ª ed., Padova, Piccin, 2005, ISBN 88-299-1734-6 .
Testi di anatomia patologica
- Robbins e Cotran, Le basi patologiche delle malattie , 7ª ed., Torino-Milano, Elsevier Masson, 2008, ISBN 978-88-85675-53-7 .
- Mariuzzi, Anatomia patologica e correlazioni anatomo-cliniche , Padova, Piccin, 2006, ISBN 978-88-299-1769-3 .
- James O'D. McGee, Peter G. Isaacson, Nicholas A. Wright, Heather M. Dick, Mary PE Slack, Oxford Textbook of Pathology , New York, Oxford University Press, USA, 2007, ISBN 978-0-19-261972-3 .
Testi di medicina interna e urologia
- Harrison, Principi di Medicina Interna - 16ª edizione , New York - Milano, McGraw-Hill, 2006, ISBN 978-88-386-3929-6 .
- Claudio Rugarli, Medicina interna sistematica , 5ª ed., Masson, 2005, ISBN 978-88-214-2792-3 .
- Albertazzi-Porena, Malattie del rene, delle vie urinarie e dell'apparato genitale maschile , Padova, Piccin, 2003, ISBN 88-299-1742-7 .
Testi di diagnostica per immagini e radioterapia
- Giorgio Cittadini, Diagnostica per immagini e radioterapia , ECIG, 2008, ISBN 978-88-7544-138-8 .
- Angelelli, AA.VV., Diagnostica per immagini per studenti e medici di medicina generale , Napoli, Idelson-Gnocchi, 2008, ISBN 978-88-7947-489-4 .
Testi di farmacologia e chemioterapia
- Brunton, Lazo, Parker, Goodman & Gilman - Le basi farmacologiche della terapia , 11ª ed., McGraw Hill, 2006, ISBN 978-88-386-3911-1 .
- Bertram G. Katzung, Farmacologia generale e clinica , Padova, Piccin, 2006, ISBN 88-299-1804-0 .
Pubblicazioni (peer-review)
Linee guida (2005 - 2010)
- Wolf AM, Wender RC, Etzioni RB, et al. , American Cancer Society guideline for the early detection of prostate cancer: update 2010 , in CA Cancer J Clin , vol. 60, n. 2, 2010, pp. 70–98, DOI : 10.3322/caac.20066 , PMID 20200110 .
- Horwich A, Parker C, Bangma C, Kataja V, Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up , in Ann. Oncol. , 21 Suppl 5, maggio 2010, pp. v129–33, DOI : 10.1093/annonc/mdq174 , PMID 20555062 .
- Heidenreich A, Albers P, Classen J, et al. , Imaging studies in metastatic urogenital cancer patients undergoing systemic therapy: recommendations of a multidisciplinary consensus meeting of the Association of Urological Oncology of the German Cancer Society , in Urol. Int. , vol. 85, n. 1, luglio 2010, pp. 1–10, DOI : 10.1159/000318985 , PMID 20693823 .
- Mohler J, Bahnson RR, Boston B, et al. , NCCN clinical practice guidelines in oncology: prostate cancer , in J Natl Compr Canc Netw , vol. 8, n. 2, febbraio 2010, pp. 162–200, PMID 20141676 .
- Kawachi MH, Bahnson RR, Barry M, et al. , NCCN clinical practice guidelines in oncology: prostate cancer early detection , in J Natl Compr Canc Netw , vol. 8, n. 2, febbraio 2010, pp. 240–62, PMID 20141680 .
- ( FR ) Mongiat-Artus P, Peyromaure M, Richaud P, et al. , [Recommendations for the treatment of prostate cancer in the elderly man: A study by the oncology committee of the French association of urology] , in Prog. Urol. , vol. 19, n. 11, dicembre 2009, pp. 810–7, DOI : 10.1016/j.purol.2009.02.008 , PMID 19945664 .
- ( ES ) Heidenreich A, Aus G, Bolla M, et al. , [EAU guidelines on prostate cancer] , in Actas Urol Esp , vol. 33, n. 2, febbraio 2009, pp. 113–26, PMID 19418833 .
- Hamashima C, Nakayama T, Sagawa M, Saito H, Sobue T, The Japanese guideline for prostate cancer screening , in Jpn. J. Clin. Oncol. , vol. 39, n. 6, giugno 2009, pp. 339–51, DOI : 10.1093/jjco/hyp025 , PMID 19346535 .
- Kramer BS, Hagerty KL, Justman S, et al. ,Use of 5-alpha-reductase inhibitors for prostate cancer chemoprevention: American Society of Clinical Oncology/American Urological Association 2008 Clinical Practice Guideline , in J. Clin. Oncol. , vol. 27, n. 9, marzo 2009, pp. 1502–16, DOI : 10.1200/JCO.2008.16.9599 , PMC 2668556 , PMID 19252137 .
- Sturgeon CM, Duffy MJ, Stenman UH, et al. , National Academy of Clinical Biochemistry laboratory medicine practice guidelines for use of tumor markers in testicular, prostate, colorectal, breast, and ovarian cancers , in Clin. Chem. , vol. 54, n. 12, dicembre 2008, pp. e11–79, DOI : 10.1373/clinchem.2008.105601 , PMID 19042984 .
- Lin K, Lipsitz R, Miller T, Janakiraman S, Benefits and harms of prostate-specific antigen screening for prostate cancer: an evidence update for the US Preventive Services Task Force , in Ann. Intern. Med. , vol. 149, n. 3, agosto 2008, pp. 192–9, PMID 18678846 .
- Borneman T, Piper BF, Sun VC, Koczywas M, Uman G, Ferrell B,Implementing the Fatigue Guidelines at one NCCN member institution: process and outcomes , in J Natl Compr Canc Netw , vol. 5, n. 10, novembre 2007, pp. 1092–101, PMC 2515169 , PMID 18053431 .
Linee guida italiane
- Ist. toscano tumori, 5. Carcinoma della Prostata ( PDF ), su ittumori.it , www.ittumori.it.
- Bianchi G, Bracarda S, Bruzi P, et al. , [Guidelines for prostate biopsy] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 63–5, PMID 16402733 .
- De Luca S, Bertaccini A, Galetti TP, [Prostate biopsy: staging values] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 57–62, PMID 16402732 .
- Bertè R, [Prostate biopsy: re-biopsy after prostatectomy] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 53–6, PMID 16402731 .
- Bortolus R, [Prostate biopsy: re-biopsy after radiotherapy] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 50–2, PMID 16402730 .
- Fandella A, Bertaccini A, Consonni P, Introini C, Gunelli R, [Prostate biopsy: re-biopsy after first negative biopsy] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 39–49, PMID 16402729 .
- Galosi AB, Maruzzi D, Milani C, Nava L, Scattoni V, Zambolin T, [Prostate biopsy: number and places of sampling] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 33–8, PMID 16402728 .
- De Matteis A, Bollito E, Galosi AB, Gardiman M, Montironi R, Sentinelli S, [Prostate biopsy: characteristics of the histological sample] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 28–32, PMID 16402727 .
- Bertaccini A, Consonni P, Schiavina R, et al. , [Prostate biopsy: approaches] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 24–7, PMID 16402726 .
- Ferrante GL, Manferrari F, Maruzzi D, [Prostate biopsy: patient preparation and anesthesia] , in Arch Ital Urol Androl , vol. 77, 3 Suppl 1, settembre 2005, pp. 17–23, PMID 16402725 .
Voci correlate
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su carcinoma della prostata
Wikimedia Commons contiene immagini o altri file su carcinoma della prostata
Collegamenti esterni
- AIRC – Associazione Italiana Ricerca sul cancro Scheda Tumori: Tumore alla prostata , su airc.it .
- Cancro della prostata approfondimenti circa l'adenocarcinoma prostatico
- Progetto Oncologia del CNR , che illustra, tra le altre cose, l'epidemiologia, la diagnosi, la sintomatologia, le terapie e opzioni alternative, Follow-up e una lunga bibliografia.
- Sito italiano sulla brachiterapia a cura dell'Ospedale San Raffaele di Milano , su brachiterapia.it .
- ( EN ) urologychannel.com , dai sintomi ai trattamenti.
- ( EN ) Prostate Cancer Foundation , su prostatecancerfoundation.org .
- ( EN ) American Cancer Society , su cancer.org .
- ( EN ) National Kidney and Urologic Diseases Information Clearinghouse , su kidney.niddk.nih.gov . URL consultato il 29 gennaio 2006 (archiviato dall' url originale l'8 febbraio 2006) .
- ( EN ) Studies of capsicina by AACR
- ( EN ) deCODE scopre fattori di rischio genetico considerevoli per il carcinoma prostatico , su prnewswire.com . URL consultato il 26 dicembre 2010 (archiviato dall' url originale il 25 luglio 2014) .
- ( EN ) Stadiazione del carcinoma prostatico , su doctorslounge.com .
Supporto per i pazienti (siti in inglese):
- ( EN ) Newsgroup
- ( EN ) Sito non-profit aggiornato settimanalmente , su malecare.org .
| Classificazione e risorse esterne ( EN ) | ICD-9-CM : 185 ; ICD-10 : C6161. ; ICD-10-CM : C61 ; OMIM : 176807 , 300147 , 300704 , 601518 , 602759 , 608656 , 608658 , 609299 , 609558 , 610321 , 610997 , 611100 , 611868 , 611928 , 611955 , 611958 e 611959 ; DiseasesDB : 10780 ; MedlinePlus : 000380 ; eMedicine : 379996 ; |
| Controllo di autorità | LCCN ( EN ) sh85107606 · GND ( DE ) 4047511-6 · BNF ( FR ) cb12647583w (data) · NDL ( EN , JA ) 00575400 |
|---|