Ciclul Krebs
Ciclul Krebs (numit și ciclul acidului tricarboxilic, ciclul acidului citric și ciclul oxaloacetat ) [1] este un ciclu metabolic de o importanță fundamentală în toate celulele care utilizează oxigen în procesul de respirație celulară .
În aceste organisme aerobe ciclul Krebs este calea metabolică în care converg căile catabolismului glucidelor , grăsimilor și proteinelor , ducând la producerea de energie chimică în principal prin sinteza elementelor fundamentale pentru lanțul respirator . Este o cale amfibolică, deoarece participă și la procesele anabolice [2] , oferind unii precursori ai aminoacizilor (de exemplu α- cetoglutarat și oxaloacetat ) și alte molecule fundamentale pentru celulă.
Multe dintre componentele și reacțiile care alcătuiesc ciclul acidului citric au fost determinate în 1930 grație cercetărilor lui Albert Szent-Györgyi , care în 1937 a primit Premiul Nobel pentru descoperirile sale privind o componentă cheie a ciclului, acidul fumaric . [3] Ciclul în întregime a fost identificat ulterior în 1937 de biochimistul anglo-german Hans Adolf Krebs , care a primit Premiul Nobel pentru medicină în 1953 pentru această descoperire. [4] [5]
Istorie
Note generale
Ciclul Krebs apare în mitocondriile celulelor eucariote și în citoplasma celulelor procariote . [6] [7]
Catabolismele glucidice și lipidice (prin glicoliză și beta oxidare ) produc acetil-CoA , o grupare acetil legată de coenzima A ; acetil-CoA constituie substratul principal al ciclului: aportul său constă dintr-o condensare cu oxaloacetat pentru a genera citrat și la sfârșitul ciclului în sine, cei doi atomi de carbon eliberați de acetil-CoA vor fi oxidați în două molecule de CO 2 , din nou oxaloacetat regenerant capabil să se condenseze cu acetil-CoA. Cu toate acestea, producția relevantă din punct de vedere energetic este cea a unei molecule GTP (utilizată imediat pentru regenerarea unei molecule ATP ), a trei molecule NADH și a unei molecule FADH 2 . [8]
Coenzimele reduse (NADH și FADH 2 ) se comportă ca intermediari redox. Când sunt reduse, ele sunt capabile să transporte electroni la o energie relativ ridicată (îndepărtată de pe substraturile oxidate, de exemplu în glicoliză sau în ciclul Krebs în sine) la lanțul respirator mitocondrial, unde sunt reoxidați (la NAD + și FAD) și eliberează electroni către lanțul în sine, care vor putea astfel să regenereze moleculele de ATP din ADP . [8]
Reacția netă este următoarea: [9]
- acetil-CoA + 3 NAD + + GDP + FAD + ADP + P i + 2 H 2 O → CoA + 3 NADH + 3 H + + FADH 2 + ATP + GTP + 2 CO 2
Energia [10] obținută din demolarea completă a unei molecule de glucoză prin cele patru etape diferite ale respirației celulare (glicoliză, piruvat dehidrogenază, ciclul Krebs și lanțul de transport al electronilor), este de 30-32 molecule de ATP în funcție de mecanismul urmat pentru transfer puterea de reducere a NADH citosolic la matricea celulară: 30 ATP cu naveta glicerol fosfat, 32 ATP cu naveta aspartat malat.
| Substrat | Coenzime | Enzimă | Tipul de reacție | Inhibitori | Activatori | Produs | |
|---|---|---|---|---|---|---|---|
| 1 | Oxaloacetat | Acetil-CoA , apă | Citrat sintază | Condensare | Citrat , NADH , Succinil-CoA | - | Citrat |
| 2a | Citrat | - | Aconitaza | Deshidratare | - | - | cis -Aconitate, apă |
| 2b | cis - Aconitate | Cascadă | Hidratare | Izocitrat | |||
| 3a | Izocitrat | NAD + | Izocitrat dehidrogenază | Oxidare | NADH, ATP | Ca 2+ , ADP | Oxalsuccinat, NADH |
| 3b | Oxalsuccinat | H + | Decarboxilare | α-cetoglutarat, CO 2 | |||
| 4 | α- Ketoglutarat | NAD + , CoA-SH | α-cetoglutarat dehidrogenază | Decarboxilarea oxidativă | NADH, Succinil-CoA | Ca 2+ | Succinil-CoA, NADH, CO 2 |
| 5 | Succinil-CoA | PIB , fosfat | Succinil-CoA sintetaza | Transferul de fosfat | - | - | Succinat, GTP , CoA-SH |
| 6 | Succinează | MOFT | Succinat dehidrogenază | Oxidare | - | - | Fumarat, FADH 2 |
| 7 | Fumarat | Cascadă | Fumarasi | Hidratare | - | - | L-Sick |
| 8 | L-Sick | NAD + | Malat dehidrogenază | Oxidare | - | - | Oxaloacetat, NADH |
Etapele ciclului Krebs
Reacția 1: citrat sintază


Citratul sintază catalizează condensarea oxaloacetatului cu acetil-CoA , pentru a obține citrat . Structura sa cuaternară este formată din două subunități, la care se pot lega cele două substraturi. [12]
Situl activ al enzimei activează acetil-CoA pentru a-l face similar cu un centru carbonos al oxaloacetatului: urmând legătura dintre cele două molecule, gruparea tioester (CoA) este hidrolizată , formând astfel molecula de citrat. [13]
Reacția este extrem de exergonică ( ΔG ° ′ = −31,4 kJ / mol ), motiv pentru care acest pas, în condiții standard, este ireversibil. [13] În plus, citratul produs de enzimă este capabil să inhibe competitiv activitatea enzimei: în ciuda faptului că este reacția foarte favorizată (deoarece este exergonică), citratul sintază poate fi ferm reglat. [13] Acest aspect are o importanță biologică considerabilă, deoarece permite o reglare completă a întregului ciclu Krebs, făcând enzima un fel de „stimulator cardiac” al întregului ciclu. [12] [14]
Reacția 2: aconitază

Aconitaza catalizează izomerizarea citratului în izocitrat (prin formarea cis - aconitatului ). [16] Enzima catalizează și reacția inversă, dar în ciclul Krebs această reacție este unidirecțională datorită legii acțiunii în masă : concentrațiile ( în condiții standard ) de citrat (91%), ale cis- aconitatului intermediar (3 %) și izocitrat (6%) împing reacția decisiv către producerea de izocitrat. Odată ce cis-aconitatul a fost produs, se adaugă o moleculă de apă pentru a oxida legătura dublă la gruparea hidroxil și se adaugă izocitrat de apă. [17] [18]
În situl activ al enzimei există un cluster fier-sulf care, împreună cu unele reziduuri de aminoacizi polari, leagă substratul. [19] [20] [21] Mai detaliat, legarea la substrat este asigurată de prezența unui reziduu de serină , arginină , histidină și aspartat , care permit legarea stereospecifică a citratului 1R, 2S numai , respingând opusul său formă. [20] [21]
Reacția 3: izocitrat dehidrogenază

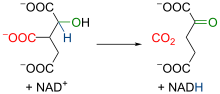
Izocitratul dehidrogenază mitocondrială este o enzimă dependentă de prezența NAD + și Mn 2+ și / sau Mg 2+ : inițial, enzima catalizează oxidarea izocitratului în oxalsuccinat , care generează o moleculă de NADH pornind de la NAD + . [23] [24] ; ulterior, prezența unui ion divalent care complexează oxigenii grupului carboxil în poziția alfa crește electronegativitatea acelei regiuni a moleculei, ceea ce generează o rearanjare a electronilor moleculei cu ruperea consecventă a legăturii dintre carbonul din poziția gamma și gruparea carboxil adiacentă, în acest mod există deci o decarboxilare (adică eliberarea unei molecule de CO 2 ) [25] , ceea ce duce la formarea a- cetoglutaratului , caracterizat prin două carboxili la capete și de o cetonă în poziție alfa față de una dintre cele două grupări carboxil. [26] Această reacție, deoarece este suficient de exergonică (ΔG ° ′ = −8,4 kJ / mol), este capabilă să deplaseze reacția anterioară înainte de aconitază. [19]
Reacția 4: α-cetoglutarat dehidrogenază

Conversia izocitratului în α-cetoglutarat este urmată de o a doua reacție de decarboxilare oxidativă , care duce la formarea succinil CoA : decarboxilarea oxidativă a α-cetoglutaratului este foarte asemănătoare cu cea a piruvatului , un alt α-ceto acid . [28] Ambele reacții includ decarboxilarea unui α-cetoacid și, prin urmare, producerea unei legături tioester de mare energie cu coenzima A : complexele care catalizează aceste reacții sunt similare. [29]
A-cetoglutaratul dehidrogenază (mai corect numită oxoglutarat dehidrogenază ) este de fapt compus din trei enzime diferite. Subunitatea E 1 , numită 2-cetoglutarat dehidrogenază, și E 2 , numită transsuccinilază, au o omologie extremă cu cele ale piruvat dehidrogenazei . E 3 subunitatea, dihydrolipoamide dehidrogenaza, pe de altă parte, este aceeași polipeptidă prezentă în alt complex enzimatic. [29]
Diferențialul de energie liberă al acestei reacții este ΔG ° ′ = -30,1 kJ / mol, prin urmare foarte exergonic. [28]
Reacția 5: succinil-CoA sintetază
Succinil-CoA este un tioester cu energie ridicată (ΔG ° ′ de hidroliză este de aproximativ -33,5 kJ / mol, similar cu cel al ATP, de -30,5 kJ / mol [31] ). Citratul sintază folosește un intermediar care are această legătură cu energie ridicată pentru a produce fuziunea între o moleculă de doi carbon ( acetil-CoA ) și o moleculă de patru carboni ( oxaloacetat ). Enzima succinil-CoA sintetază folosește această energie pentru a fosforila o nucleozidă purină difosfat, cum ar fi PIB . [31] [32]
Energia din tioester este pur și simplu transformată în energie legată de o legătură fosfat : primul pas al reacției generează un nou intermediar cu energie ridicată, cunoscut sub numele de succinil fosfat și, ulterior, o histidină prezentă în situl catalitic elimină fosfatul din carbohidrat moleculă, generând produsul succinat și o moleculă de fosfoistidină , care donează rapid fosfatul unui nucleozid difosfat, „reîncărcându-l” în trifosfat. Acesta este singurul pas din ciclul în care apare fosforilarea la nivel de substrat . [31]
GTP este implicat în principal în calea transducției semnalului : rolul său într-un proces energetic, deoarece ciclul Krebs este în esență cel al utilizării pentru transferul grupărilor fosfat la ATP, într-o reacție catalizată de nucleozid difosfochinasi . [31] [33]
Reacția 6: succinat dehidrogenază

Partea finală a ciclului vede rearanjarea moleculelor cu patru atomi de carbon până la regenerarea oxaloacetatului; pentru ca acest lucru să fie posibil, puntea de metilenă prezentă pe succinat trebuie convertită într-un carbonil , așa cum se întâmplă și în alte căi (de exemplu, oxidarea beta a acizilor grași), această conversie are loc în trei etape: o primă oxidare , o hidratare și a doua oxidare. Aceste trei etape, pe lângă regenerarea oxaloacetatului, permit extragerea de energie suplimentară prin formarea FADH 2 și NADH . [35]
Prima reacție de oxidare este catalizată de complexul succinat dehidrogenazei , singura enzimă din ciclu care are FAD mai degrabă decât NAD + ca acceptor de hidrogen: FAD este legat covalent de enzimă, printr-un reziduu de histidină . Enzima folosește FAD, deoarece energia asociată cu reacția nu este suficientă pentru a reduce NAD + . [36]
Complexul enzimatic este, de asemenea, singurul din ciclu care este cuibărit în membrana mitocondrială . Această poziție se datorează și implicării enzimei în lanțul de transport al electronilor (unde este definită ca „complexul II”): electronii trecuți pe FAD sunt, prin urmare, introduși direct în lanț, datorită legăturii stabile dintre enzimă și cofactorul însuși. [36] [37]
Reacția 7: fumarază

Fumaraza catalizează adăugarea unui proton și a unei grupări OH - de la o moleculă de apă la molecula de poziție trans . Deoarece enzima este capabilă să lege OH - numai pe o parte, fumaratul poate fi transformat numai în L-malat . [39]
Există două clase de fumarază: clasa I și clasa II. [40] Clasificarea depinde de dispunerea subunităților lor relative, de necesitatea metalului și de stabilitatea lor termică. Fumarazele de clasa I sunt capabile să schimbe starea sau să devină inactive atunci când sunt supuse căldurii sau radiațiilor, sunt sensibile la anionul superoxid , sunt dependente de fierul II (Fe 2+ ) și sunt proteine dimerice , inclusiv aproximativ 120 kD. Fumarazele de clasa II se găsesc în procariote și eucariote ; sunt 200.000 D enzime tetramerice care conțin trei segmente distincte de aminoacizi semnificativ omologi și sunt, de asemenea, independente de fier și stabile la căldură. Se știe că procariotele au trei forme diferite de fumarază: fumaraza A, fumaraza B și fumaraza C, aceasta din urmă făcând parte din fumarazele de clasa II, în timp ce fumarazele A și fumarazele B sunt clasificate în clasa I. [41]
Reacția 8: malat dehidrogenază

Ultima reacție a ciclului constă în oxidarea malatului la oxaloacetat . Reacția, catalizată de malat dehidrogenază , folosește o altă moleculă NAD + ca acceptor de hidrogen (producând NADH ). [39]
Energia liberă Gibbs asociată acestei ultime reacții este decisiv pozitivă (spre deosebire de celelalte din ciclu). Activitatea enzimei este condusă de consumul de oxaloacetat de citrat sintază și de NADH de către lanțul de transport al electronilor . [39]
Reglarea ciclului
Viteza ciclului Krebs este modulată continuu pentru a satisface nevoile exacte de energie ale celulei: locurile de control primare sunt enzimele alosterice , izocitrat dehidrogenază și α- cetoglutarat dehidrogenază . [43]
Izocitratul dehidrogenază este stimulat alosteric de prezența ADP , care crește afinitatea enzimei pentru substrat. Legăturile izocitratului , ale NAD + , ale Mg 2+ și ale ADP la enzimă cooperează reciproc în sensul activării. În schimb, NADH inhibă enzima prin deplasarea directă a NAD + . ATP în sine are un efect inhibitor. [44]
Al doilea loc de control al ciclului este situat la a-cetoglutarat dehidrogenază; unele aspecte ale controlului acestei enzime sunt similare cu cele ale complexului piruvat dehidrogenazei , așa cum se poate aștepta din omologia extremă prezentă între cele două enzime. A-cetoglutaratul dehidrogenază este, prin urmare, inhibat de succinil CoA și NADH, produsele reacției care catalizează și pot fi, de asemenea, inhibate generic de un nivel ridicat de energie prezent în celulă, ceea ce înseamnă că, în prezența nivelurilor ridicate de ATP, celula este capabilă să reducă eficiența procesului de producere a energiei, în cadrul căreia ciclul Krebs are o poziție centrală. [44]
La multe bacterii este controlată și intrarea în ciclul moleculelor cu doi atomi de carbon: în ele sinteza citratului din oxaloacetat și acetil CoA este locul unei reglementări importante. De fapt, ATP este un inhibitor alosteric al citratului sintazat : efectul concret al ATP este de a crește KM al enzimei pentru acetil CoA, în acest fel cu cât ATP este mai prezent în celulă, cu atât mai puțin Acetil CoA este introdus în ciclu . [44] [45]
Interacțiunile dintre ciclul Krebs și alte căi metabolice
Ciclul Krebs ocupă o poziție centrală în metabolismul ființelor vii, jucând un rol cheie mai ales în căile catabolice .
În amonte de ciclul Krebs
Ciclul Krebs este a doua etapă a catabolismului carbohidraților : glicoliza degradează glucoza (și alte molecule cu șase carbon) în piruvat (un α-ceto acid care conține trei atomi de carbon). În eucariote , piruvatul este transferat din citoplasmă (locul glicolizei) în mitocondrii unde este decarboxilat prin TPP, Lipo Amidă și transformat în acetil-CoA prin piruvat dehidrogenază ( decarboxilarea oxidativă a piruvatului ): în mitocondrie, acetil-CoA poate intra în ciclul Krebs, așa cum a fost descris anterior. [46] [47]
În ceea ce privește proteinele , acestea sunt degradate cu mecanisme numite proteoliză prin enzime numite proteaze , care le „separă” în constituenții fundamentali: aminoacizii , de fapt unii aminoacizi pot constitui o sursă de energie, deoarece sunt convertibili în niște intermediari ai ciclul în sine (de exemplu aspartat , valină și izoleucină ). Altele, convertibile în molecule de carbohidrați, pot intra în ciclu trecând prin căile catabolice tipice glucidelor (de exemplu, alanina , convertibilă în piruvat ). [48]
În catabolismul lipidic, trigliceridele sunt hidrolizate de enzime numite lipaze pentru a forma acizi grași și glicerol . [49] La organismele superioare, glicerina poate intra în glicoliză în ficat sau poate fi transformată în glucoză prin dihidroxiacetonă fosfat și gliceraldehidă-3-fosfat urmând calea metabolică a gluconeogenezei . [50] În multe țesuturi, în special inima, acizii grași sunt defalcați printr-un proces cunoscut sub numele de beta-oxidare , care produce acetil-CoA, care este el însuși interiorizat în ciclul Krebs. Beta-oxidarea poate genera, de asemenea, propionil-CoA , care la rândul său poate fi alimentat înapoi în calea gluconeogenetică hepatică pentru a genera glucoză după ce a fost convertită în succinil-CoA. [51]
În avalul ciclului Krebs
Ciclul Krebs este întotdeauna urmat de fosforilarea oxidativă , obținută dintr-un lanț de transport al electronilor : unul nu ar avea sens fără celălalt, deoarece ATP și GTP produse de ciclul în sine sunt rare, iar producția de NADH și FADH 2 ar duce la o reducere excesivă. mediu mitocondrial, în timp ce lanțul respirator singur ar avea nevoie de o sursă de cofactori reduși, altfel mediul ar fi oxidat. Această „respirație celulară” extrage energie din NADH și FADH 2 , recreând NAD + și FAD, permițând astfel ciclului să continue. Ciclul Krebs nu folosește oxigen , care este folosit în schimb în fosforilarea oxidativă. [52]
Reacții în care sunt implicați intermediarii ciclului
Intermediarii ciclului Krebs sunt implicați în numeroase alte căi metabolice. Căile în care sunt implicați metaboliții ciclului sunt rezumate mai jos. [53]
- Acetil CoA:
- beta oxidare ;
- biosinteza acizilor grași ;
- degradarea lizinei ;
- degradarea valinei și izoleucinei ;
- metabolismul fenilalaninei .
- α-cetoglutarat:
- biosinteza lizinei ;
- metabolismul acidului ascorbic ;
- metabolismul glutamatului .
- Succinil CoA:
- metabolismul propanoatului ;
- sinteza porfirinelor ;
- degradarea leucinei și izoleucinei ;
- metabolismul fenilalaninei .
- Sucinați:
- metabolismul butanoatului ;
- metabolismul tirozinei .
- Fumarat:
- ciclul ureei ;
- metabolismul argininei și prolinei ;
- metabolismul tirozinei .
- Oxaloacetat:
- metabolismul glioxilatului ;
- metabolismul glutamatului și aspartatului ;
- gluconeogeneză .
Ciclul glioxilat
Multe plante și bacterii sunt capabile să crească în soluri care conțin acetat sau alți compuși convertibili în acetil CoA, utilizează o cale absentă la majoritatea ființelor vii, cunoscută sub numele de ciclul glioxilat, și prin acest ciclu pot converti moleculele în doi atomi de carbon (cum ar fi acetilul) din moleculele cu patru carbon (în special succinat ) necesare pentru producerea de energie prin ciclul Krebs, precum și pentru numeroasele procese biosintetice în care este implicat. [54]
Rezultatul net al ciclului de glioxalat este următorul: [55]
- 2 acetil CoA + 2 NAD + + FAD → oxaloacetat + 2 CoA + FADH 2 + 2 H +
Condiții medicale legate de ciclul Krebs
Tulburările legate de ciclul Krebs conduc la stabilirea unor stări patologice foarte rare și dificil de înțeles: aceste cazuri se datorează foarte adesea unor defecte, care provin din mutații dăunătoare ale genelor , enzimelor implicate în ciclu și implică afectări specifice organelor, în special ale sistemul neuromuscular. [56]
Foarte puține cazuri izolate și aparent primare de modificări ale ciclului Krebs au fost descrise în literatură: un studiu din 1997 a raportat trei cazuri de pacienți cu deficit de a-ketoglutarat dehidrogenază, șapte cu deficit de succinat dehidrogenază și paisprezece cu deficit de fumarază [56] și, în plus, defecte legate de alte enzime implicate în alte căi metabolice pot afecta funcționarea corectă a ciclului prin influențarea enzimelor specifice. [57] [58]
Printre principalele afecțiuni legate de o funcționare incorectă a ciclului Krebs, deficitele neurologice, cu sau fără afectare musculară, sunt cele care pot fi găsite cel mai frecvent (85%), urmate de encefalopatie și sindromul Leigh . În plus, pot fi observate cazuri de cardiomiopatie hipertrofică sau tulburări pluritissutale. De asemenea, a fost raportat un caz al unui pacient cu deficit de fumarază care, totuși, nu avea probleme cardiace. [59]
Vârsta de apariție a semnelor și simptomelor deficitului de fumarază și α-cetoglutarat dehidrogenază este în mod constant mai mică decât primul an de viață și începe cu hipotonie , întârziere a creșterii și acidoză lactică . În schimb, pacienții cu deficit de succinat dehidrogenază sunt diagnosticați la o vârstă mai înaintată, chiar și între 20 și 23 de ani. [60] Pentru deficiența acestei enzime, se pot observa întârzierea creșterii, edem pulmonar , bronșiolită , rigiditate corporală sau atrofie optică . [56]
S-a observat adesea o excreție urinară anormală a acizilor organici la pacienții cu deficit de enzime specifice ciclului Krebs. [56]
Notă
- ^ Augusto Innocenti, Principiile nutriției umane , Compania Editura Esculapio, 2013, p. 177, ISBN 978-88-7488-595-4 .
- ^ Voet & Voet , p. 582 .
- ^ (EN) Premiul Nobel pentru fiziologie sau medicină 1937 , pe nobelprize.org, Fundația Nobel. Adus la 26 octombrie 2011 .
- ^ (EN) Stubbs Marion și Geoff Gibbons, Hans Adolf Krebs (1900-1981) ... Viața și vremurile sale , în IUBMB Life , vol. 50, nr. 3, 2000, pp. 163-166, DOI : 10.1080 / 152165400300001462 .
- ^ Voet & Voet , p. 585 .
- ^ (EN) ȘI Merkley, TO Metz, RD Smith, JW Baynes și N. Frizzell, Proteomulsuccinat , în Mass Spectrometry Reviews , vol. 33, nr. 2, 2014, pp. 98-109, DOI : 10.1002 / max.2188 , PMC 4038156 , PMID 24115015 .
- ^ Grisham & Garett , pp. 507 .
- ^ a b Anna Atlante, Ciclul Krebs , pe treccani.it , Enciclopedia Treccani . Adus la 26 octombrie 2014 .
- ^ Grisham & Garett , pp. 506-508 .
- ^ David L. Nelson și Michael M. Cox ,, Principiile de biochimie ale lui Lehninger ISBN 978-88-08-06403-5 . , Bologna, Zanichelli, 634 2010, p. Fila 634. 16.1.
- ^ (EN) KC Usher, SJ Remington, Martin DP și DG Drueckhammer, O legătură de hidrogen foarte scurtă Oferă doar stabilizarea moderată a unui complex enzimă-inhibitor al citratului sintază, în Biochimie , vol. 33, nr. 25, 28 iunie 1994, pp. 7753-7759, PMID 8011640 .
- ^ a b ( EN ) G. Wiegand e SJ Remington, Citrate synthase: structure, control, and mechanism , in Annual Review of Biophysics and Biophysical Chemistry , vol. 15, 1986, pp. 97-117, DOI : 10.1146/annurev.bb.15.060186.000525 , PMID 3013232 .
- ^ a b c Garet & Grisham , p. 501 .
- ^ ( EN ) MJ MacDonald, H. Al-Masri, M. Jumelle-Laclau e MO Cruz, Oscillations in activities of enzymes in pancreatic islet subcellular fractions induced by physiological concentrations of effectors , in Diabetes , vol. 46, n. 12, dicembre 1997, pp. 1996-2001, PMID 9392486 .
- ^ ( EN ) Hanspeter Lauble e Charles David Stout, Steric and conformational features of the aconitase mechanism , in Proteins , vol. 22, n. 1, maggio 1995, pp. 1-11, DOI : 10.1002/prot.340220102 , PMID 7675781 .
- ^ Ricciotti , p. 216 .
- ^ ( EN ) Takusagawa F., Chapter 16: Citric Acid Cycle ( PDF ), su crystal.res.ku.edu , Department of Molecular Biosciences - University of Kansas. URL consultato il 31 gennaio 2015 (archiviato dall' url originale il 12 aprile 2015) .
- ^ ( EN ) University of London, IUBMB Enzyme Nomenclature - EC 4.2.1.3 , su chem.qmul.ac.uk . URL consultato il 31 gennaio 2015 (archiviato dall' url originale il 14 luglio 2007) .
- ^ a b Garret & Grisham , p. 502 .
- ^ a b ( EN ) AH Robbins e CD Stout, The structure of aconitase , in Proteins , vol. 5, n. 4, 1989, pp. 289-312, DOI : 10.1002/prot.340050406 , PMID 2798408 .
- ^ a b ( EN ) H. Beinert e MC Kennedy, Aconitase, a two-faced protein: enzyme and iron regulatory factor , in The FASEB Journal , vol. 7, n. 15, dicembre 1993, pp. 1442-1449, PMID 8262329 .
- ^ ( EN ) Andrew D. Mesecar, Barry L. Stoddard e Daniel E. Koshland Jr., Orbital steering in the catalytic power of enzymes: small structural changes with large catalytic consequences , in Science , vol. 277, n. 5323, 11 luglio 1997, pp. 202–206, PMID 9211842 .
- ^ ( EN ) Michael Cox, David R. Nelson e Albert L. Lehninger,Lehninger Principles of Biochemistry , San Francisco, WH Freeman, 2005, pp. 609 -611, ISBN 0-7167-4339-6 .
- ^ ( EN ) Y. Yasutake, S. Watanabe, M. Yao, Y. Takada, N. Fukunaga e I. Tanaka, Crystal Structure of the Monomeric Isocitrate Dehydrogenase in the Presence of NADP + , in Journal of Biological Chemistry , vol. 278, n. 38, 2003, pp. 36897-36904, DOI : 10.1074/jbc.M304091200 , PMID 12855708 .
- ^ Ricciotti , p. 217 .
- ^ Garret & Grisham , pp. 502-503 .
- ^ ( EN ) JE Knapp, D. Carroll, JE Lawson, SR Ernst, LJ Reed e ML Hackert, Expression, purification, and structural analysis of the trimeric form of the catalytic domain of the Escherichia coli dihydrolipoamide succinyltransferase , in Protein Science , vol. 9, n. 1, gennaio 2000, pp. 37-48, DOI : 10.1110/ps.9.1.37 , PMC 2144448 , PMID 10739245 .
- ^ a b Garret & Grisham , p. 503 .
- ^ a b Voet & Voet , p. 595 .
- ^ ( EN ) Marie E. Fraser, Michael NG James, William A. Bridger e William T. Wolodko, Phosphorylated and dephosphorylated structures of pig heart, GTP-specific succinyl-CoA synthetase , in Journal of Molecular Biology , vol. 299, n. 5, 23 giugno 2000, pp. 1325-1339, DOI : 10.1006/jmbi.2000.3807 , PMID 10873456 .
- ^ a b c d Garrett & Grisham , p. 504 .
- ^ Voet & Voet , pp. 595-596 .
- ^ Voet & Voet , p. 597 .
- ^ ( EN ) V. Yankovskaya, R. Horsefield, S. Törnroth e et al. , Architecture of succinate dehydrogenase and reactive oxygen species generation , in Science , vol. 299, n. 5607, 31 gennaio 2003, pp. 700-704, DOI : 10.1126/science.1079605 , PMID 12560550 .
- ^ Voet & Voet , pp. 597-598 .
- ^ a b Garrett & Grisham , pp. 504-505 .
- ^ ( EN ) KS Oyedotun e BD Lemire, The quaternary structure of the Saccharomyces cerevisiae succinate dehydrogenase. Homology modeling, cofactor docking, and molecular dynamics simulation studies , in Journal of Biological Chemistry , vol. 279, n. 10, 5 marzo 2004, pp. 9424-9431, DOI : 10.1074/jbc.M311876200 , PMID 14672929 .
- ^ ( EN ) T. Weaver, M. Lees, V. Zaitsev e et al. , Crystal structures of native and recombinant yeast fumarase , in Journal of Molecular Biology , vol. 280, n. 3, 17 luglio 1998, pp. 431-442, DOI : 10.1006/jmbi.1998.1862 , PMID 9665847 .
- ^ a b c Garrett & Grisham , p. 505 .
- ^ ( EN ) Allison M. Lynch AM e Cynthia C. Morton, FH (fumarate hydratase) , in Atlas of Genetics and Cytogenetics in Oncology and Haematology , vol. 10, n. 4, luglio 2006, pp. 247-250.
- ^ ( EN ) M. Estévez, J. Skarda, J. Spencer, L. Banaszak e TM Weaver, X-ray crystallographic and kinetic correlation of a clinically observed human fumarase mutation , in Protein Science , vol. 11, n. 6, giugno 2002, pp. 1552-1557, DOI : 10.1110/ps.0201502 , PMC 2373640 , PMID 12021453 .
- ^ ( EN ) M. Nishiyama, JJ Birktoft e T. Beppu, Alteration of coenzyme specificity of malate dehydrogenase from Thermus flavus by site-directed mutagenesis [ collegamento interrotto ] , in Journal of Biological Chemistry , vol. 268, n. 7, marzo 1993, pp. 4656-4660, PMID 8444839 .
- ^ Voet & Voet , p. 601 .
- ^ a b c Voet & Voet , pp. 602-603 .
- ^ ( EN ) JM Berg, JL Tymoczko e L. Stryer, Section 17.2 Entry to the Citric Acid Cycle and Metabolism Through It Are Controlled , in Biochemistry , 5ª ed., New York, WH Freeman, 2002, ISBN 0-7167-3051-0 .
- ^ Garrett & Grisham , pp. 470-471 .
- ^ Garrett & Grisham , pp. 498-499 .
- ^ Garrett & Grisham , pp. 668-670 .
- ^ Garrett & Grisham , pp. 604-605 .
- ^ Garrett & Grisham , p. 490 .
- ^ Garrett & Grisham , p. 607 .
- ^ Voet & Voet , pp. 613-616, 627-629 .
- ^ ( EN ) Interconnessioni del ciclo di Krebs con altri pathways cellulari , su genome.jp , KEGG PATHWAY Database . URL consultato il 10 ottobre 2014 .
- ^ ( EN ) FA Kondrashov, EV Koonin, IG Morgunov, TV Finogenova e MN Kondrashova, Evolution of glyoxylate cycle enzymes in Metazoa: evidence of multiple horizontal transfer events and pseudogene formation , in Biology Direct , vol. 1, n. 31, 2006, DOI : 10.1186/1745-6150-1-31 , PMC 1630690 , PMID 17059607 .
- ^ Voet & Voet , p. 655 .
- ^ a b c d ( EN ) P. Rustin, T. Bourgeron, B. Parfait, D. Chretien, A. Munnich e A. Rötig, Inborn errors of the Krebs cycle: a group of unusual mitochondrial diseases in human , in Biochimica et Biophysica Acta , vol. 1361, n. 2, 22 agosto 1997, pp. 185-197, DOI : 10.1016/S0925-4439(97)00035-5 , PMID 9300800 .
- ^ ( EN ) BH Robinson, Cell culture studies on patients with mitochondrial diseases: molecular defects in pyruvate dehydrogenase , in Journal of Bioenergetics and Biomembranes , vol. 20, n. 3, giugno 1988, pp. 313-323, PMID 3136149 .
- ^ ( EN ) RE Hall, KG Henriksson, SF Lewis, RG Haller e NG Kennaway, Mitochondrial myopathy with succinate dehydrogenase and aconitase deficiency. Abnormalities of several iron-sulfur proteins , in Journal of Clinical Investigation , vol. 92, n. 6, dicembre 1993, pp. 2660-2666, DOI : 10.1172/JCI116882 , PMC 288463 , PMID 8254022 .
- ^ ( EN ) JP Bonnefont, D. Chretien, P. Rustin e et al. , Alpha-ketoglutarate dehydrogenase deficiency presenting as congenital lactic acidosis , in The Journal of Pediatrics , vol. 121, n. 2, agosto 1992, pp. 255-258, DOI : 10.1016/S0022-3476(05)81199-0 , PMID 1640293 .
- ^ ( EN ) N. Guffon, C. Lopez-Mediavilla, R. Dumoulin e et al. , 2-Ketoglutarate dehydrogenase deficiency, a rare cause of primary hyperlactataemia: report of a new case , in Journal of Inherited Metabolic Disease , vol. 16, n. 5, 1993, pp. 821-830, PMID 8295396 .
Bibliografia
- Donald Voet e Judith G. Voet, Fondamenti di biochimica , Bologna, Zanichelli, 2002, ISBN 88-08-09151-1 .
- David L. Nelson e Michael M. Cox, Principi di biochimica , Bologna, Zanichelli, 2002, ISBN 88-08-09035-3 .
- Jeremy M. Berg, John L. Tymoczko e Lubert Stryer, Biochimica , Bologna, Zanichelli, 2003, ISBN 88-08-07893-0 .
- RH Garret e CM Grisham, Principi di Biochimica , Padova, Piccin Nuova Libraria, 2004, ISBN 88-299-1693-5 .
- Giuliano Ricciotti, Biochimica di base , Italo Bovolenta, 2008, ISBN 978-88-08-01182-4 .
- Augusto Innocenti, Principi di Nutrizione Umana , Società Editrice Esculapio, 2013, ISBN 978-88-7488-595-4 .
Voci correlate
- Catena di trasporto degli elettroni
- Decarbossilazione ossidativa del piruvato
- Fosforilazione ossidativa
- Glicolisi
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file sul ciclo di Krebs
Wikimedia Commons contiene immagini o altri file sul ciclo di Krebs
Collegamenti esterni
- ( EN ) Jeremy M. Berg, John L. Tymoczko e Lubert Stryer, Biochemistry – Fifth Edition , su whfreeman.com , WH Freeman and Company. URL consultato il 28 settembre 2006 (archiviato dall' url originale il 29 ottobre 2006) .
- ( EN ) Le tappe del ciclo di Krebs , su ncbi.nlm.nih.gov .
- ( EN ) Ingresso di altre molecole nel ciclo di Krebs , su ncbi.nlm.nih.gov .
- ( EN ) Il ciclo di Krebs come produttore di precursori biosintetici , su ncbi.nlm.nih.gov .
- ( EN ) Il ciclo del gliossalato , su ncbi.nlm.nih.gov .
| Controllo di autorità | LCCN ( EN ) sh85073260 · GND ( DE ) 4148058-2 |
|---|