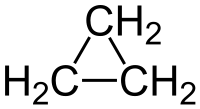
Ciclopropan
| Ciclopropan | |
|---|---|
| Caracteristici generale | |
| Formula moleculară sau brută | C 3 H 6 |
| Masa moleculară ( u ) | 42 |
| Aspect | gaz incolor |
| numar CAS | |
| Numărul EINECS | 200-847-8 |
| PubChem | 6351 |
| DrugBank | DB13984 |
| ZÂMBETE | C1CC1 |
| Proprietăți fizico-chimice | |
| Temperatură de topire | −127 ° C (146 K) |
| Temperatura de fierbere | −32,8 ° C (240,4 K) |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
  | |
| Pericol | |
| Fraze H | 220 - 280 |
| Sfaturi P | 210 - 410 + 403 [1] [2] |
Ciclopropanul este o hidrocarbură ciclică formată din trei atomi de carbon și șase atomi de hidrogen (C 3 H 6 ) sau (CH 2 ) 3 , de unde vechiul nume de trimetilenă pe care i l-a dat descoperitorul A. Freund în 1882. [3] Este o moleculă de înaltă simetrie ( D 3h ) și cea mai simplă dintre cicloalcani . La temperatura camerei este un gaz incolor, ușor de lichefiat, cu un miros dulce de hidrocarbură, foarte inflamabil. A fost folosit ca anestezic. [4]
Structura
Cei trei atomi de carbon ai ciclului se află în vârfurile unui triunghi echilateral, dar unghiurile rezultate de 60 ° sunt considerabil diferite de unghiul ideal de legătură al carbonului hibridizat sp 3 care este 109,5 °; aceasta generează o tensiune unghiulară puternică care implică îndoirea legăturilor CC către exterior ( legături banane ), slăbindu-le.Toți atomii de hidrogen sunt apoi necesari menținuți într-o poziție eclipsată ( unghi diedru HCCH = 0) și acest lucru dă naștere la torsiune tensiune (sau eclipsare).
Suma acestor două tensiuni (unghiulară și torsională) constituie tensiunea inelară , care corespunde unui surplus de energie potențială din moleculă și, prin urmare, o stabilitate mai mică. Această destabilizare se ridică la 27,5 kcal / mol, puțin mai mare decât cea a ciclobutanului (26,5 kcal / mol). [5] Toate acestea se reflectă într-un comportament chimic care diferă de cicloalcani cu inele cu cel puțin cinci membri; în special, pentru o anumită ușurință în reacții de deschidere a inelului prin adăugarea H derulate 2 ( hidrogenare catalitică ), HX halogen acizi și de asemenea X 2 halogeni pentru a se obține derivați ai deschis cu lanț: propan , 1- propil halogenuri și 1,3-dihalogenopropane respectiv. În astfel de reacții, ciclopropanul seamănă parțial cu comportamentul alken i. Diferă de acestea în ceea ce privește oxidarea la rece: nu reacționează cu permanganat diluat sau cu ozon. [6] Radicalul său, ciclopropil ( c- C 3 H 5 -) seamănă de asemenea cu vinilul prin capacitatea sa de a stabiliza o carbocație adiacentă (ciclopropilmetil vs. alil sau benzil ).
Sinteză
- Rezumat Wurtz :
Br-CH 2 -CH 2 -CH 2 -Br + 2Na → CH 2 --CH 2 + 2 NaBr
\ /
CH 2
Această reacție poate avea loc și cu alte halogenuri de alchil bi-substituite (1,3-dicloro propan, de exemplu) și poate fi catalizată și de alte metale (de exemplu zinc ).
- Adăugarea de carben la alchene :
CH 2 = CH 2 + CH 2 N 2 → CH 2 - CH 2
\ /
CH 2
De fapt CH 2 N 2 este o moleculă de diazometan , un compus care generează lumină în prezența carbenului (. CH 2.), care este un radical cu doi electroni nepereche. Acesta din urmă este capabil să se introducă în dubla legătură care formează ciclul.
Reacții
CH 2 --CH 2 + 9/2 O 2 → 3 CO 2 + 3 H 2 O + căldură
\ /
CH 2
- Hidrogenare pentru a da propan liniar:
CH 2 --CH 2 + H 2 → CH 3 -CH 2 -CH 3
\ /
CH 2
- Tratamentul cu acizi halogenhidrici (HCI, HBr, HI) pentru a da halogenura de alchil corespunzătoare :
CH 2 --CH 2 + HX → CH 3 -CH 2 -CH 2 -X
\ /
CH 2
Notă
- ^ Foaie informativă ciclopropan pe IFA-GESTIS Arhivat 16 octombrie 2019 la Arhiva Internet .
- ^ Sigma Aldrich; rev. din 13.01.2012
- ^ ( DE ) August Freund, [ http://link.springer.com/10.1007/BF01516828 „Trimethylen”, în Monatshefte f Chem Chem , vol. 3, nr. 1, 1882-12, pp. 625-635, DOI : 10.1007 / BF01516828 . Adus la 8 decembrie 2020 .
- ^ (EN) Edmond I. Eger, Bernard Brandstater și Lawrence J. Saidman, echipotent Concentrații alveolare de metoxifluran, halotan, dietil eter, fluroxen, ciclopropan, xenon și oxid de azot la câine în anestezie, vol. 26, n. 6, 1 noiembrie 1965, pp. 771–777, DOI : 10.1097 / 00000542-196511000-00012 . Adus la 8 decembrie 2020 .
- ^ FA Carey și RJ Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms , Ediția a cincea, Springer Science + Business Media, LLC, 2007, ISBN 978-0-387-68346-1 .
- ^ R. Fusco, G. Bianchetti și V. Rosnati, CHIMIE ORGANICĂ , al doilea, LG Guadagni, 1975, p. 3.
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe ciclopropan
Wikimedia Commons conține imagini sau alte fișiere pe ciclopropan
linkuri externe
- ( EN ) Cyclopropane , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | Thesaurus BNCF 22886 · LCCN (EN) sh85035101 · GND (DE) 4148622-5 · BNF (FR) cb121769798 (data) |
|---|