Clorofilă
| Clorofilă | |
|---|---|
| Denumiri alternative | |
| Clorofilă | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 55 H 72 O 5 N 4 Mg |
| Masa moleculară ( u ) | 893,49 |
| Aspect | verde, lichid |
| numar CAS | (clorofila a ) |
| Numărul EINECS | 215-800-7 |
| Proprietăți fizico-chimice | |
| Temperatură de topire | 150 ° C - 153 ° C |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| Fraze H | --- |
| Sfaturi P | --- [1] |
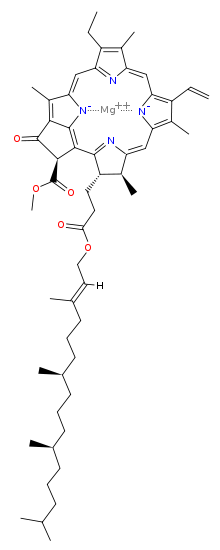
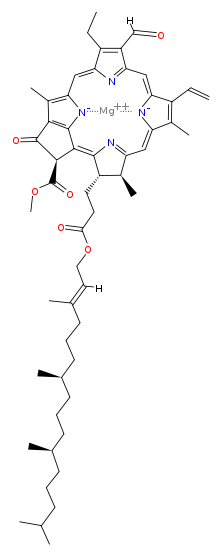
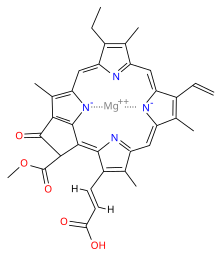
Clorofila (din greaca χλωρός, chloros = verde și φύλλον, phyllon = frunză) este un pigment izolat în 1817 de Joseph Bienaimé Caventou și Pierre-Joseph Pelletier. De culoare verde, [2] este prezent în boabele cloroplastice ale celulelor vegetale sau în organismele procariote care realizează fotosinteza clorofilei . Structura moleculei se caracterizează prin prezența unui heterociclu de porfirină, în centrul căruia este coordonat un ion Mg (atomul verde din ilustrație).
În eucariote , clorofilele nu sunt de fapt prezente, dar având în vedere cele ale cianobacteriilor plastide ale archeplastidelor („plante”) s-ar putea spune în mod greșit că sunt prezente două tipuri diferite de clorofilă:
- clorofila a, care în principal , absoarbe lumina albastru-violet și roșu
- clorofila b , care absoarbe în principal lumina albastră și portocalie.
Alți pigmenți minoritari sunt carotenoizii , care absorb un spectru larg de lumină albastră și reflectă lumina portocalie.
Plantele par verzi, deoarece lungimile de undă verzi sunt cele mai puțin absorbite de cianobacteriile plastidice ale plantelor. Clorofilele altor eubacterii (cum ar fi cianobacteriile cu viață liberă și multe proteobacterii) sunt mai mult sau mai puțin ușor diferite.
Structura moleculară
Clorofila este un clor produs prin același proces metabolic ca porfirinele, cum ar fi hemul , cu care este similar din punct de vedere structural. Molecula are o structură inelară, în centrul căreia există un atom de magneziu care are funcția de a menține structura rigidă pentru a preveni dispersarea energiei solare sub formă de căldură înainte de a putea fi utilizată pentru procesul fotosintetic. Un lanț lung hidrofob sau hidrofug începe apoi de la inel care servește la ancorarea moleculei de clorofilă la membranele tilacoide. Există câteva forme diferite care apar în mod natural, dar cea mai răspândită universal printre plantele terestre este clorofila a , a cărei structură a fost decodificată de Hans Fischer în 1940 și, din 1978, când a fost cunoscută stereochimia clorofilei, Robert Burns Woodward a publicat un sinteza completă a moleculei așa cum este cunoscută astăzi. [3] În 1967, elucidările stereochimice reziduale au fost perfecționate de Ian Fleming [4], iar în 1990 Woodward și co-autorii au publicat un rezumat actualizat. [5]
Diferitele structuri ale clorofilei sunt rezumate mai jos:
| Clorofila a | Clorofila b | Clorofila c1 | Clorofila c2 | Clorofila d | |
|---|---|---|---|---|---|
| Formulă moleculară | C 55 H 72 O 5 N 4 Mg | C 55 H 70 O 6 N 4 Mg | C 35 H 30 O 5 N 4 Mg | C 35 H 28 O 5 N 4 Mg | C 54 H 70 O 6 N 4 Mg |
| Masa moleculara | 893.509 | 907.492 | 610,96 | 608,94 | 893,48 |
| Grupa C3 | -CH = CH2 | -CH = CH2 | -CH = CH2 | -CH = CH2 | -CHO |
| Grupa C7 | -CH 3 | -CHO | -CH 3 | -CH 3 | -CH 3 |
| Grupa C8 | -CH 2 CH 3 | -CH 2 CH 3 | -CH 2 CH 3 | -CH = CH2 | -CH 2 CH 3 |
| Grupa C17 | CH2 - CH2 - COO-Fitil | CH2 - CH2 - COO-Fitil | -CH = CHCOOH | -CH = CHCOOH | CH2 - CH2 - COO-Fitil |
| Legătură C17-C18 | Singur | Singur | Dubla | Dubla | Singur |
| Difuzie | universal | Majoritatea plantelor | Diverse alge | Diverse alge | cianobacterii |
Până când frunzele devin galbene, clorofila se transformă într-un grup de tetrapiroli incolori cunoscuți sub numele de cataboliți fluorescenți ai clorofilei (NCC). Acești compuși au fost identificați și în diferite fructe coapte. [6]
Clorofila în fotosinteză
Clorofila este vitală pentru fotosinteza, care permite plantelor să obțină energie din lumină.
Moleculele de clorofilă sunt poziționate în mod specific și înconjurate de complexe proteice numite fotosisteme care sunt închise în tilacoidele cloroplastelor . În aceste complexe, clorofila îndeplinește două funcții principale. Funcția majorității clorofilei, până la câteva sute pe fotosistem, este de a absorbi lumina și de a transfera energie către o pereche specifică de clorofile din centrul de reacție al fotosistemului. Datorită selectivității clorofilei în raport cu lungimea de undă absorbită, zonele frunzei care conțin molecula par verzi.
Există două tipuri de sisteme foto:
- fotosistemul I sau P700
- fotosistem II sau P680
„700” și „680” indică lungimea de undă în nanometri la care cei doi acceptori primari diferiți își au vârful de absorbție. [7] Identitatea, funcția și proprietățile spectrale ale tipurilor de clorofilă din fiecare fotosistem sunt distincte și determinate de fiecare și de structura proteică din jur. Odată extrase din proteină într-un solvent (cum ar fi acetonă sau metanol ), acești pigmenți pot fi separați într-un simplu experiment de cromatografie pe hârtie și, pe baza numărului de grupări polare dintre clorofila a și b, vor fi separați chimic pe hârtie. .
Funcția centrului de reacție al clorofilei este de a folosi energia absorbită și transferată de cealaltă clorofilă din fotosistem pentru a provoca o separare a sarcinilor, o reacție redox specifică în care clorofila donează un electron unei serii de intermediari moleculari pe so- numitlanț de transport de electroni . Clorofila centrului de reacție încărcat (P680 + ) este apoi redusă din nou la starea de echilibru prin achiziționarea unui electron. În fotosistemul II, electronul care reduce P680 + provine în cele din urmă din oxidarea apei în O 2 și 4H + de către complexul de oxigen în evoluție . Printre altele, datorită acestei reacții, organismele fotosintetice produc oxigen gazos constituind sursa a aproape tot oxigenul prezent în atmosfera terestră. Fotosistemul I funcționează de obicei în serie cu fotosistemul II, astfel încât P700 + al fotosistemului I este produs în mod normal de fotosistemul II prin intermediari în membrana tilacoidă. Cu toate acestea, reacțiile de transfer de electroni din membrana tilacoidă sunt complexe și sursa electronilor utilizați pentru a reduce P700 + poate varia.
Fluxul de electroni produs de clorofila centrului de reacție este utilizat pentru a transporta ionii H + peste membrana tilacoidă, creând un potențial chemosmotic utilizat pur pentru a produce energie chimică din ATP . Acești electroni reduc în cele din urmă NADP + la NADPH , un agent de reducere universal folosit pentru a reduce CO 2 în zaharuri, precum și alte reduceri biosintetice.
Complexele clorofilă-proteină ale centrului de reacție sunt capabile să absoarbă direct lumina și să producă separarea sarcinii fără alți pigmenți clorofilici, dar probabilitatea de a absorbi un foton sub o radiație luminoasă dată este scăzută. Astfel, clorofila rămasă în fotosistem și complexele de antenă pigmentară proteică asociate cu fotosistemul absorb și canalizează energia luminii către centrul de reacție. Pe lângă clorofila a, există și alți pigmenți, numiți accesorii , care sunt implicați în aceste complexe de antene.
Spectrofotometrie

Clorofila, de orice tip este, are o culoare verde - gălbuie , vizibilă dintr-o cromatografie simplă pe hârtie . Din punct de vedere fizic, acest lucru înseamnă că clorofila absoarbe toate lungimile de undă ale spectrului vizibil, cu excepția celor din vecinătatea de 490-590 nm .
În perioada de toamnă , concentrația de clorofilă în frunziș scade, deci aceasta capătă o culoare maro-roșiatică dată de prezența carotenoidelor .
Măsurarea spectrului de absorbție sau a culorii clorofilei se efectuează cu metode de spectrofotometrie .
Măsurarea absorbanței luminii este complicată de solventul utilizat pentru extragerea clorofilei din materialul vegetal, care influențează rezultatele obținute;
- În dietil eter, clorofila a prezintă absorbție maximă aproximativă la 430 nm și 662 nm, în timp ce clorofila b le prezintă la 453 nm și 642 nm. [8]
- Vârfurile de absorbție ale clorofilei sunt la 665 nm și 465 nm. Clorofila a fluorescă la 673 nm. Vârful coeficientului de absorbție molar al clorofilei depășește 10 5 M -1 cm -1 , care este cel mai mare dintre compușii organici.
Faptul că clorofila a și b au spectre diferite de absorbție are ca rezultat o mai bună absorbție a radiației solare pentru fotosinteza clorofilei .
Următoarele tabele indică lungimile de undă în nanometri corespunzătoare maximului vârfurilor primare de absorbție și extinderii vârfurilor (indicate între paranteze):
| Clorofila a | Clorofila b | Clorofila c | Clorofila d | Clorofila e | |
|---|---|---|---|---|---|
| Vârful 1 | 430 nm | 480 nm | 434 nm | (aproximativ 400-470 nm) | - |
| Vârful 2 | 663 nm | 650 nm | 666 nm | 700 nm (700-730 nm) | (715-725 nm) |
Valorile afișate sunt valori aproximative. De fapt, există rezultate diferite în funcție de faptul dacă testele se fac in vivo sau in vitro și în funcție de solventul utilizat.
Biosinteza
La plante , clorofila este sintetizată din succinil-CoA și glicină , deși precursorul imediat al clorofilei a și b este protoclorofila .
Cloroza este o afecțiune în care frunzele nu produc suficientă clorofilă, devenind galbene. Cloroza poate fi cauzată de deficiențe alimentare, inclusiv deficiențe de fier și într-o măsură mai mică magneziu și azot. PH-ul solului joacă uneori un rol în cloroza alimentelor: multe plante s-au adaptat să crească în sol cu pH-uri specifice și capacitatea lor de a absorbi nutrienți din sol poate depinde de pH-ul solului. [9] Cloroza poate fi cauzată și de organisme patogene, cum ar fi viruși , bacterii și ciuperci sau paraziți care suge sucul.
Notă
- ^ Sigma Aldrich; rev. din 10.10.2012
- ^ Pentru o explicație științifică a culorii verzi a clorofilei, consultați secțiunea „Spectrofotometrie”.
- ^ RB Woodward, WA Ayer, JM Beaton, F. Bickelhaupt, R. Bonnett, P. Buchschacher, GL Closs, H. Dutler, J. Hannah, FP Hauck, S. Itô, A. Langemann, E. Le Goff, W Leimgruber, W. Lwowski, J. Sauer, Z. Valenta și H. Volz, The total synthesis of chlorophyll ( PDF ), în Journal of the American Chemical Society , vol. 82, 1960, pp. 3800-3802, DOI : 10.1021 / ja01499a093 .
- ^ Ian Fleming, Configurația absolută și structura clorofilei , în natură , vol. 216, octombrie 1967, pp. 151–152, DOI : 10.1038 / 216151a0 .
- ^ Robert Burns Woodward, William A. Ayer, John M. Beaton, Friedrich Bickelhaupt, Raymond Bonnett, Paul Buchschacher, Gerhard L. Closs, Hans Dutler, John Hannah, Fred P. Hauck și colab. , Sinteza totală a clorofilei a , în Tetraedru , vol. 465378, nr. 22, 1990, pp. 7599-7659, DOI : 10.1016 / 0040-4020 (90) 80003-Z .
- ^ Catabolitii incolori tetrapirolitici ai clorofilei găsiți în fructele coapte sunt agenți antioxidanți Thomas Muller, Markus Ulrich, Karl-Hans Ongania și Bernhard Krautler Angew. Chem. Ed. Int. 2007 , 46, 8699 –8702 DOI : 10.1002 / an.200703587
- ^ Verde, 1984
- ^ Gross, 1991
- ^(EN) Cloroza de fier în gazon
Bibliografie
- Biochimie, L. Stryer (WH Freeman și Co, San Francisco, 1975)
- Introducere în chimia organică, Streitweiser și Heathcock (MacMillan, New York, 1981)
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « clorofilă »
Wikționarul conține dicționarul lema « clorofilă » -
 Wikimedia Commons conține imagini sau alte fișiere pe clorofilă
Wikimedia Commons conține imagini sau alte fișiere pe clorofilă
linkuri externe
- ( EN ) Clorofilă , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Clorofil d: puzzle-ul rezolvat ( PDF ), pe mbl.ku.dk. Adus la 18 iunie 2021 (Arhivat din original la 13 martie 2012) .
| Controlul autorității | Tezaur BNCF 12914 · LCCN (EN) sh85024579 · GND (DE) 4147817-4 · BNF (FR) cb120073259 (data) · NDL (EN, JA) 00.574.346 |
|---|