Cod genetic

Codul genetic este ansamblul de reguli prin care se traduc informațiile codificate în nucleotidele care constituie genele pentru sinteza proteinelor în celule .
Decodarea biologică este efectuată de un anumit ARN din ribozom , care asamblează o serie de aminoacizi într-o ordine specificată de ARNm . Acest lucru se face folosind ARN-ul de transfer (ARNt), care transportă aminoacizi și citește ARNm trei nucleotide la un moment dat, mai precis tripletul de bază sau codonul . Un codon corespunde unui singur aminoacid.
Deoarece majoritatea genelor se exprimă în conformitate cu același cod, acest lucru este adesea denumit „cod genetic genetic” sau „standard”, sau pur și simplu „cod genetic”, deși unele versiuni au evoluat de-a lungul timpului. De exemplu, sinteza proteinelor care apare în mitocondriile umane se bazează pe un cod genetic ușor diferit de cel standard. [1] [2] [3]
Bazele ARN sunt patru: adenină , guanină , citozină și uracil (în ADN uracilul este înlocuit cu timina ). Prin urmare, există 4 3 = 64 codoni posibili. 61 dintre ei codifică aminoacizi, în timp ce ceilalți trei (UAA, UAG, UGA) codifică semnale de oprire (adică stabilesc în ce moment trebuie să se oprească ansamblul lanțului polipeptidic). Deoarece aminoacizii care contribuie la formarea proteinelor sunt 20 și codonii 64, aceștia sunt în general codificați de mai mult de un codon (cu excepția triptofanului și metioninei ), prin urmare codul genetic este definit ca „degenerat”. Codonii diferiți care codifică același aminoacid se numesc sinonime.
Codul genetic este citit „fără punctuație”, care este liniar de trei baze în trei baze și nu este în general superpozabil (de exemplu, ultima bază a unui codon nu poate fi citită ca prima bază a codonului următor, cu toate acestea, în viruși, genele pot să fie suprapuse).
Descoperire
Eforturile serioase de a înțelege cum au fost codificate proteinele au început în urma descoperirii structurii ADN-ului în 1953. George Gamow a postulat că trebuiau utilizate grupuri de trei baze pentru a codifica cei 20 de aminoacizi standard folosiți de celulele vii pentru a-și construi propriile proteine. Având la dispoziție patru nucleotide diferite, un cod format din 2 nucleotide ar permite doar maximum 4 2 = 16 aminoacizi. În caz contrar, un cod cu 3 nucleotide poate codifica până la 4 3 = 64 aminoacizi.[4]
În 1961, experimentul Crick, Brenner, Barnett, Watts-Tobin a fost primul care a demonstrat că codonii constau din trei baze ADN; în același an, Marshall Nirenberg și Heinrich Matthaei au fost, totuși, primii care au clarificat natura unui codon, la National Institutes of Health . Ei au folosit un sistem liber de celule pentru a traduce o secvență de ARN poli- uracil ( și anume: uuuuuu ....) și așa a descoperit că polipeptida au sintetizat constat dintr -o singură fenilalanină (un aminoacid). [5] Apoi au dedus că codonul UUU era specific pentru acel aminoacid. Acest lucru a fost urmat de experimente în laboratorul Severo Ochoa care au condus la demonstrația că secvența ARN poliadenină (AAAAA ...) codifică polipeptida polilizină [6] și că secvența ARN citozină (CCCCC). ..) a codificat polipeptida poliprolină. [7] Prin urmare, codonul AAA a specificat lizina și codonul CCC a specificat prolina . Folosind copolimeri diferiți, majoritatea codonilor rămași au fost apoi determinați. Lucrările ulterioare realizate de Har Gobind Khorana au condus la identificarea restului codului genetic. La scurt timp după aceea, Robert W. Holley a determinat structura ARN-ului de transfer (ARNt), molecula adaptor care facilitează procesul de traducere a ARN-ului în proteină. Această lucrare s-a bazat pe studii anterioare ale lui Severo Ochoa, care a primit Premiul Nobel pentru medicină în 1959 pentru munca sa privind enzimologia sintezei ARN. [8]
Extinzând această lucrare, Nirenberg și Philip Leder au demonstrat natura tripletă a codului genetic și au descifrat codonii codului genetic standard. În aceste experimente, diferite combinații de ARNm au fost trecute printr-un filtru care conținea ribozomi , organitele conținute în celule care efectuează translația ARN-ului în proteine. Triplete unice promovează legarea unor ARNt specifice la ribozom. Leder și Nirenberg, grație experimentelor lor, au reușit să determine secvențele a 54 din 64 de codoni. [9] În 1968, Khorana, Holley și Nirenberg au primit premiul Nobel pentru medicină pentru munca lor. [10]
Caracteristici importante
Cadrul de lectură
Un codon este definit de nucleotida de pornire de la care începe translația. De exemplu, șirul GGGAAACCC, dacă este citit din prima poziție, conține codonii GGG, AAA și CCC; dacă este citit din a doua poziție, acesta conține codonii GGA și AAC; dacă este citit începând cu poziția a treia, GAA și ACC. Fiecare secvență poate fi, prin urmare, citită în trei faze diferite, fiecare dintre acestea producând o secvență de aminoacizi diferită (în exemplul dat, Gly-Lys-Pro, Gly-Asn, respectiv Glu-Thr). În dubla helică ADN, există șase "cadre de citire" posibile, trei indicând o orientare înainte pe un capăt al firului și trei în direcția inversă pe celălalt fir. [11]
Porniți și opriți codonii
Traducerea începe la un codon de pornire, dar, spre deosebire de termenul de codon, nu este suficient pentru a începe procesul de sinteză; de fapt, unele secvențe tipice care permit ARNm să se lege de ribozomi trebuie, de asemenea, să fie găsite lângă codonul de start. Secvențe particulare, cum ar fi secvența Shine-Dalgarno din Escherichia coli și factorii de inițiere , sunt, de asemenea, necesare pentru inițierea traducerii. Cel mai comun codon de pornire este AUG, care codifică și metionina sau, în bacterii, formilmetionina . În funcție de organism, codonii inițiali alternativi pot fi GUG sau UUG; acești codoni reprezintă în mod normal valină și respectiv leucină , dar ca codoni de inițiere sunt traduși în metionină sau formilmetionină. [12] Alți codoni de inițiere sunt CUG, UUG și, în procariote, GUG și AUU. [13]
Celor trei codoni de oprire li s-au atribuit nume: codon UAG sau Amber , codon UAA sau Ocher și codon UGA sau Opal . Codonul de chihlimbar a fost numit după descoperitorii Richard Epstein și Charles Steinberg, în cinstea lui Harris Bernstein care l-a descoperit și al cărui nume de familie înseamnă chihlimbar în germană. Ceilalți doi codoni de terminare au fost numiți să rămână în tema culorilor ( ocru și respectiv opal ). [14] Codonii stop sunt numiți și codoni „încetare” sau codoni „aiurea”. Scopul lor este de a se asigura că există eliberarea polipeptidei născute din ribozom și acest lucru se întâmplă deoarece nu există nici un ARNt înrudit care să aibă anticodoni complementari la aceste secvențe de stop și, prin urmare, un factor de eliberare este legat în ribozom. [15]
Efectul mutațiilor
În timpul procesului de replicare a ADN-ului , pot apărea ocazional erori în polimerizarea celei de-a doua catene. Aceste erori, numite mutații , pot avea un impact asupra fenotipului (adică caracteristicile observabile) ale unui organism, mai ales dacă apar în secvența genei care codifică o proteină. Ratele de eroare sunt de obicei foarte scăzute, estimate la 1 eroare la fiecare 10-100 milioane de baze, datorită capacității de „revizuire” a ADN polimerazei . [16] [17]
Mutațiile fără sens și mutațiile fără sens sunt exemple de mutații punctuale , care pot provoca boli genetice, cum ar fi anemia falciformă și, respectiv, talasemia . [18] [19] [20] Mutațiile Missense sunt, în general, importante din punct de vedere clinic, deoarece implică modificarea proprietăților aminoacidului codificat, inclusiv dacă este esențial, acid, polar sau nepolar, în timp ce mutațiile fără sens implică formarea unui codon de oprire. [11]
Mutațiile cadrului se datorează ștergerii sau inserțiilor ( indel ) a unui număr de nucleotide nedivizibile cu 3, rezultând în deplasarea cadrului de citire în aval de mutație și, prin urmare, codificarea unei secvențe de aminoacizi care nu corespunde cu cea a transcriere originală. Consecința este producerea de proteine anormale sau non-exportul sau traducerea mARN-ului mutant. [21] Moștenirea mutațiilor frame-shift este rară, deoarece absența rezultată a unei proteine funcționale poate determina moartea prematură a organismului. [22] O boală gravă datorată unei mutații de acest tip este boala Tay-Sachs . [23]
Deși majoritatea mutațiilor care implică schimbarea secvențelor de proteine sunt dăunătoare sau, cel puțin, neutre, unele pot avea un efect benefic asupra unui organism [24] permițându-i să suporte mai bine stresurile de mediu deosebite decât organismele de tip sălbatic (cu gene mai comune) ), sau pentru a se reproduce mai repede. În aceste cazuri, mutația va tinde să devină din ce în ce mai frecventă în populație prin selecția naturală . [25] Virușii care utilizează ARN ca material genetic au rate de mutație foarte rapide, [26] și acest lucru poate fi un avantaj pentru ei, deoarece vor evolua constant și rapid și vor putea astfel să se sustragă de răspunsurile defensive ale sistemului . Imun uman. [27] La populațiile mari compuse din organisme cu reproducere asexuată , de exemplu în Escherichiacoli coli , pot coexista multiple mutații benefice. Acest fenomen se numește interferență clonală și implică competiții între mutații. [28]
Degenerare
Prin degenerare înțelegem redundanța codului genetic, adică doi sau mai mulți codoni corespund aceluiași aminoacid. Codul genetic este redundant, dar, totuși, nu există nicio ambiguitate (vezi tabelele de mai jos). De exemplu, atât codonii GAA cât și GAG specifică acid glutamic (redundanță), dar niciunul nu specifică alți aminoacizi (fără echivoc). Codonii care codifică un aminoacid pot diferi în una din cele trei poziții ale acestora. De exemplu, leucina este specificată de codonii Y UR sau C U N (UUA, UUG, CUU, CUC, CUA sau CUG), cu diferențe în prima sau a treia poziție, în timp ce aminoacidul serin este specificat de codonii UC N sau AG Y (UCA, UCG, UCC, UCU, AGU sau AGC), cu o diferență în prima, a doua sau a treia poziție). [29]
Se spune că un codon este „de patru ori degenerat” dacă orice nucleotidă din a treia poziție codifică același aminoacid (de exemplu, UCA, UCC, UCG și UCU, toate corespunzând serinei ); se numește „de două ori degenerat” dacă doar două din cele patru baze aflate în a treia poziție codifică același aminoacid (de exemplu AAA și AAG, corespunzător lizinei ). În codonii de două ori degenerați, nucleotidele echivalente în poziția a treia sunt întotdeauna fie două purine (A / G), fie două pirimidine (C / U).
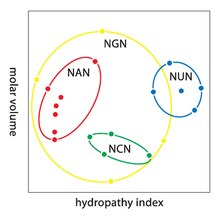
Redundanța face codul genetic mai puțin vulnerabil la mutațiile cauzale. Un codon de patru ori redundant poate suferi orice mutație la a treia poziție și un codon de două ori redundant poate suferi una dintre cele trei mutații posibile la a treia poziție fără aminoacidul pe care îl exprimă - și astfel structura proteinei în care va fi aminoacidul inserat - modificări. Mai mult, din moment ce mutațiile de tranziție (de la o purină la alta sau de la o pirimidină la alta) sunt mai probabile decât mutațiile transversale (de la purină la pirimidină sau invers), echivalența dintre purine sau pirimidine din cei doi codoni degenerează uneori și mai multă rezistență. De fapt, orice erori plasate în a treia poziție a unui triplet provoacă doar o mutație silențioasă sau o eroare, fără ca proteina să fie compromisă, deoarece hidrofilitatea sau hidrofobia sunt menținute prin substituirea echivalentă a aminoacizilor; de exemplu, un codon de NUN (unde N este orice nucleotidă) tinde să codifice aminoacizii hidrofobi; NAN codifică reziduuri hidrofile de dimensiuni medii. Codul genetic este atât de bine structurat pentru hidropatie încât o analiză matematică ( descompunere la valori singulare ) a 12 variabile (4 nucleotide x 3 poziții) produce o corelație remarcabilă (C = 0,95) pentru predicția hidropatiei aminoacizilor codificați direct de secvența de nucleotide, fără traducere. [30] [31] După cum se poate vedea din tabelul de mai jos, opt aminoacizi nu sunt afectați de nicio mutație în poziția a treia a codonului, în timp ce o mutație în a doua poziție riscă să provoace o schimbare radicală a proprietăților fizico-chimice ale aminoacid codat.
Transferul de informații prin codul genetic
Genomul unui organism se găsește în ADN sau, în cazul unor viruși, în ARN. Porțiunea genomului care codifică unul sau mai multe lanțuri polipeptidice sau ARN se numește genă . Genele care codifică proteinele sunt compuse din unități de trei nucleotide numite codoni , fiecare dintre acestea codificând un singur aminoacid. Fiecare nucleotidă constă dintr-un fosfat , un zahăr dezoxiriboză și una dintre cele patru baze azotate . Bazele purinice, adenina (A) și guanina (G), sunt cele mai mari și constau din două inele aromatice . Bazele pirimidinei, citozina (C) și timina (T), sunt mai mici și constau dintr-un singur inel aromatic. În configurația cu dublă helică, cele două catene de ADN sunt unite între ele prin legături de hidrogen într-o formă cunoscută sub numele de pereche de baze . Aceste legături se formează aproape întotdeauna între baza adeninei pe o catenă și o bază timină pe cealaltă sau între o bază citozină și o bază guanină. Aceasta înseamnă că, într-o anumită catenă dublu-catenară, numărul bazelor A și T va fi același, la fel și numărul bazelor G și C. [29] În ARN, timina (T) este înlocuită cu uracil (U ) și dezoxiriboză se înlocuiește cu riboză . [29]
Fiecare genă care codifică proteina este transcrisă într-o moleculă de polimer ARN. La procariote , acest ARN funcționează ca ARN mesager sau ARNm; în eucariote , transcrierea trebuie procesată pentru a produce ARNm matur. ARN-M interacționează cu ARN-R în citoplasmă. În acest moment, ARN-T care poartă un aminoacid specific cu el se leagă de ARN-M, permițând formarea unui lanț de aminoacizi. Interacțiunea are loc prin recunoașterea primei baze a anticodonului prezent pe ARN-T cu ultima bază a codonului plasată pe ARN-M: legătură complementară și antiparalelă .
Există 4 3 = 64 posibile combinații diferite de codoni formați din trei nucleotide; toți cei 64 de codoni corespund unui aminoacid sau unui semnal de oprire. Dacă, de exemplu, este luată în considerare o secvență de ARN UUUAAACCC și cadrul de citire începe cu primul U (prin convenție, 5 'la 3'), există trei codoni, și anume UUU, AAA și CCC, fiecare dintre care specifică un amino acid. Prin urmare, această secvență de ARN cu 9 baze va fi tradusă într-o secvență de trei aminoacizi. [29] Un aminoacid dat poate fi codificat de una până la șase secvențe diferite de codoni.
Codul genetic standard este prezentat în tabelele următoare. Tabelul 1 arată ce aminoacid este codificat de fiecare dintre cei 64 de codoni. Tabelul 2 arată ce codoni specifică cei 20 de aminoacizi standard implicați în traducere. De exemplu, codonul „AAU” reprezintă aminoacidul asparagină, iar „UGU” și „UGC” reprezintă cisteină (în denumirile standard din trei litere, Asn și respectiv Cys). [29]
Tabel de codare codon în ADN
| apolar | polar | de bază | acid | opriți codonul |
| Inainte de baza | A doua bază | Al treilea baza | |||||||
|---|---|---|---|---|---|---|---|---|---|
| T. | C. | LA | G. | ||||||
| T. | TTT | (Phe / F) Fenilalanină | TCT | (Ser / S) Serine | TAT | (Tyr / Y) Tirozină | TGT | (Cys / C) Cisteină | T. |
| TTC | TCC | Scanare CT | TGC | C. | |||||
| TTA | (Leu / L) Leucina | TCA | TAA | Stop ( Ocru ) | TGA | Stop ( Opal ) | LA | ||
| TTG | TCG | ETICHETĂ | Stop ( chihlimbar ) | TGG | (Trp / W) Triptofan | G. | |||
| C. | CTT | CCT | (Pro / P) Proline | PISICĂ | (His / H) Histidina | CGT | (Arg / R) Arginină | T. | |
| CTC | CCC | CAC | CGC | C. | |||||
| CTA | CCA | CAA | (Gln / Q) Glutamină | CGA | LA | ||||
| CTG | CCG | CAG | CGG | G. | |||||
| LA | ATT | (Ile / I) Isoleucină | ACT | (Thr / T) Treonină | AAT | (Asn / N) Asparagine | AGT | (Ser / S) Serine | T. |
| ATC | ACC | AAC | AGC | C. | |||||
| LA UN | ACA | AAA | (Lys / K) Lizină | AGA | (Arg / R) Arginină | LA | |||
| ATG | (Met / M) Metionină | ACG | AAG | ADĂUGA | G. | ||||
| G. | GTT | (Val / V) Valina | GCT | (Ala / A) Alanină | GAT | (Asp / D) Acid aspartic | GGT | (Gly / G) Glicină | T. |
| GTC | GCC | GAC | GGC | C. | |||||
| GTA | GCA | GAA | (Glu / E) Acid glutamic | GGA | LA | ||||
| GTG | GCG | GAG | DD | G. | |||||
Tabelul de codoni ARN este în esență identic cu cel pentru ADN, dar cu T înlocuit cu U.
Codare inversă
| Aripa | LA | GCU, GCC, GCA, GCG | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG |
| Arg | R. | CGU, CGC, CGA, CGG, AGA, AGG | Lys | K. | AAA, AAG |
| Asn | Nu. | AAU, AAC | Întâlnit | M. | AUG |
| Asp | D. | GAU, GAC | Phe | F. | UUU, UUC |
| Cys | C. | UGU, UGC | Pro | P. | CCU, CCC, CCA, CCG |
| Gln | Î | CAA, CAG | Ser | S. | UCU, UCC, UCA, UCG, AGU, AGC |
| Glu | ȘI | GAA, GAG | Thr | T. | ACU, ACC, ACA, ACG |
| Gly | G. | GGU, GGC, GGA, GGG | Trp | W | UGG |
| A lui | H. | CAU, CAC | Tyr | Da | UAU, UAC |
| Ile | THE | AUU, AUC, AUA | Val | V. | GUU, GUC, GUA, GUG |
| start | AUG, GUG | Stop | UAG, UGA, UAA |
Variații ale codului genetic standard
Deși au fost anticipate ușoare variații ale codului standard încă de la început, [32] nu au fost descoperite până în 1979, când cercetătorii care studiau genele mitocondriale umane au descoperit că folosesc un cod alternativ. Multe alte variante mici au fost descoperite de atunci, [33] incluzând diverse coduri alternative mitocondriale [34] și variante mici, cum ar fi traducerea codonului UGA la triptofan în speciile Mycoplasma și traducerea CUG ca serină, mai degrabă decât ca leucină în drojdii din „ clada CTG” ( Candida albicans face parte din acest grup). [35] [36] [37] Deoarece virușii trebuie să utilizeze același cod genetic ca și gazdele lor, modificările aduse codului genetic standard ar putea interfera cu sinteza sau funcționarea proteinelor virale. Cu toate acestea, unii viruși (cum ar fi totivirusurile ) au adaptat codul pentru a găzdui modificări genetice. [38] În bacterii și arhaea , GUG și UUG sunt codoni de inițiere obișnuiți, dar în cazuri rare, unele proteine pot folosi codoni de inițiere alternativi care nu sunt utilizați în mod normal de astfel de specii. [33]
Protozoarele ciliate prezintă, de asemenea , unele modificări: la ele (precum și la unele specii de alge verzi) UAG și, adesea, UAA codifică glutamina și UGA codifică cisteina. La unele specii de drojdie , CUG codifică serina. La alte specii de bacterii și arhee, codonii de oprire codifică în schimb aminoacizi mai puțin frecvenți: UGA codifică selenocisteina și UAG codifică pirolizina . Este posibil să existe și alți aminoacizi nestandardici a căror codare este încă necunoscută. Mai mult, pot exista, de asemenea, variații foarte diferite ale codului genetic mitocondrial, care are, de asemenea, rate de evoluție mai mari ca urmare a ineficienței mecanismelor de reparare a ADN-ului. De exemplu, pe lângă vertebratele deja menționate (CGM 2), și grupurile apropiate filogenetic, cum ar fi ascidienii , au un cod genetic mitocondrial particular.
În anumite proteine, aminoacizii nestandard sunt înlocuiți cu codoni stop, în funcție de secvențele semnal asociate cu ARN-ul mesager. De exemplu, UGA poate codifica selenocisteina și UAG poate codifica pirolizina . Selenocisteina este clasificată ca aminoacid 21 și pirolizină ca 22. [33] Spre deosebire de selenocisteină, pirolizina codificată prin UAG este tradusă datorită participării unei ARNt sintetaze specifice. [39] Atât selenocisteina, cât și pirolizina pot fi prezente în același organism. [40] Deși codul genetic dintr-un organism este în mod normal imuabil, în unele cazuri acest lucru poate să nu fie adevărat: de exemplu, archaea acetohalobium arabaticum își poate extinde codul genetic de la 20 la 21 de aminoacizi (prin adăugarea de pirolizină ) atunci când se constată că sunt în creștere. condiții. [41]
În ciuda acestor diferențe, toate codurile genetice cunoscute prezente în formele de viață ale Pământului sunt foarte similare.Mecanismul de codificare este același pentru toate organismele: codoni cu trei baze, ARNt, ribozomi, citirea codului în aceeași direcție și traducerea codului în trei litere în secvențe de aminoacizi. Având în vedere că există multe coduri genetice posibile și potențial adecvate pentru viață, teoria evoluției sugerează că acest cod genetic a fost definit foarte devreme în istoria vieții pe această planetă. Presiunile care ar fi putut duce la evoluția codurilor genetice necanonice au fost cu siguranță secundare, în special se crede că sunt legate de fenomene de rezistență la transferul de gene sau la atacul viral.
Extinderea codului genetic
Din 2001, 40 de aminoacizi nenaturali au fost adăugați la proteine creând un codon unic (recodare) și un ARN de transfer corespunzător. Acest lucru a făcut posibilă studierea diferitelor proprietăți fizico-chimice și biologice și explorarea structurii proteinelor, funcția acestora sau crearea altora noi sau mai bune care există deja. [42] [43]
H. Murakami și M. Sisido au extins niște codoni la patru și cinci baze. Steven A. Benner a sintetizat un al 65-lea codon funcțional ( in vivo ). [44]
Origine
Dacă aminoacizii au fost repartizati aleatoriu la codonii, atunci ar fi de 1,5 x 10 84 posibile coduri genetice pentru a alege. [45] Acest număr se găsește calculând câte modalități există de poziționare a 21 de elemente (20 aminoacizi plus o oprire) în 64 de poziții, unde fiecare element este utilizat cel puțin o dată. Codul genetic folosit de toate formele de viață cunoscute este aproape universal, cu doar câteva variații minore. Prin urmare, s-ar putea întreba dacă toate formele de viață de pe Pământ provin dintr-un singur strămoș care a suferit mutații care au optimizat codul genetic. S-au formulat mai multe ipoteze cu privire la originile și evoluția codului genetic.
Multe ipoteze pot fi grupate în patru teme principale referitoare la evoluția codului genetic: [46]
- Principiile chimice guvernează interacțiunile specifice ale ARN-ului cu aminoacizii. Experimentele efectuate pe aptameri au arătat că unii aminoacizi au o afinitate chimică selectivă pentru tripletul de bază care îi codifică. [47] Experimente recente arată că dintre cei 8 aminoacizi testați, 6 prezintă unele asociații triplet-aminoacizi. [45] [48]
- Expansiunea biosintetică . Codul genetic standard modern este rezultatul evoluției unui cod anterior mai simplu grație unui proces de „expansiune biosintetică”. De aici ideea că viața primordială a „descoperit” noi aminoacizi (de exemplu ca subproduse ale metabolismului ) care au fost apoi încorporați în mecanismul de codificare genetică. Deși multe dovezi circumstanțiale au sugerat că în trecut s-au folosit mai puțini aminoacizi diferiți decât astăzi, [49] ipotezele precise și detaliate despre aminoacizii care au intrat în cod s-au dovedit a fi mult mai controversate. [50] [51]
- Selecția naturală a condus la atribuirea codonilor codului genetic pentru a minimiza efectele mutațiilor . [52] O ipoteză recentă [53] sugerează că codul triplet este derivat din alte coduri mai lungi (cum ar fi codonii cuaternari). Un sistem de codificare mai lung decât un triplet ar asigura un grad mai mare de redundanță a codonilor și ar fi mai rezistent la erori. Această caracteristică ar fi permis decodificarea precisă în absența unor sisteme extrem de complexe, cum ar fi ribozomul de care primele celule au lipsit.
- Canale de informații : modelul teoriei informației constă în traducerea codului genetic în aminoacizi corespunzători ca un canal de informație predispus la erori. [54] Zgomotul intrinsec (adică eroarea) în canale ridică problema cum este posibil ca codul genetic să tolereze influența zgomotului [55] prin posibilitatea de a traduce informațiile cu acuratețe și eficiență. Modelele [56] sugerează că codul genetic a apărut ca rezultat al interacțiunii a trei forțe evolutive conflictuale: nevoile diferiților aminoacizi, [57] toleranța la erori [52] și cheltuielile minime de resurse.
Moleculele de ARN de transfer par să se fi dezvoltat înainte de sintetazele moderne de aminoacil-ARNt , deci acestea din urmă nu pot face parte din explicația diferitelor modele propuse. [58]
În plus, au fost explorate modele care includ aspecte care adaugă două sau mai multe dintre temele de mai sus. De exemplu, modelele bazate pe semnalizare combină elemente ale teoriei jocurilor, selecției naturale și teoriei informației . Astfel de modele au fost folosite pentru a sugera că polipeptidele timpurii erau probabil scurte și aveau alte funcții decât enzimatică. Modelele teoretice au sugerat, de asemenea, că organizarea șirurilor de ARN în celule poate fi necesară pentru a evita utilizarea „înșelătoare” a codului genetic, adică prevenirea echivalentului ancestral al virusului de a perturba secvența ARN. [59]
Distribuirea atribuțiilor de codoni în codul genetic nu este aleatorie. [60] De exemplu, anumite grupuri de cod genetic codifică anumite aminoacizi. Aminoacizii care au aceeași cale biosintetică tind să aibă aceeași bază în codonii lor. [61] Aminoacizii cu proprietăți fizice similare tind să aibă codoni similari, [62] [63] pentru a reduce problemele cauzate de mutațiile punctuale și erorile de traducere. [60] O ipoteză coerentă pentru a explica originea codului genetic ar trebui, de asemenea, să abordeze sau să prezică următoarele caracteristici: [64]
- absența codonilor pentru D-aminoacizi
- modele de codoni secundari pentru unii aminoacizi
- limitarea pozițiilor sinonime pentru a treia poziție
- limitarea la 20 de aminoacizi în loc de un număr mai apropiat de 64
- relația dintre modelele de codon stop cu modelele de codificare a aminoacizilor
Notă
- ^ Jukes TH, Osawa S, Codul genetic în mitocondrii și cloroplaste , în Experientia , vol. 46, nr. 11-12, 1990, pp. 1117-26, PMID 2253709 .
- ^ (EN) NCBI, pagina Codului genetic în secțiunea NCBI Taxonomy de pe ncbi.nlm.nih.gov. Accesat la 2 septembrie 2015 .
- ^ Turanov AA, Lobanov AV, Fomenko DE, Morrison HG, Sogin ML, Klobutcher LA, Hatfield DL, Gladyshev VN, Codul genetic susține inserția țintită a doi aminoacizi printr-un codon , în Science , vol. 323, nr. 5911, 2009, pp. 259-61, DOI : 10.1126 / science.1164748 , PMC 3088105 , PMID 19131629 .
- ^ Crick, Francis, Capitolul 8: Codul genetic , în Ce urmărire nebună: o viziune personală a descoperirilor științifice , New York, Basic Books, 1988, pp. 89-101, ISBN 0-465-09138-5 .
- ^ Nirenberg MW și Matthaei JH, Dependența sintezei proteinelor fără celule în E. coli de polirribonucleotide naturale sau sintetice , în Proc. Natl. Acad. Sci. SUA , vol. 47, nr. 10, octombrie 1961, pp. 1588-1602, DOI : 10.1073 / pnas.47.10.1588 , PMC 223178 , PMID 14479932 .
- ^ Gardner RS, Wahba AJ, Basilio C, Miller RS, Lengyel P și Speyer JF, polinucleotide sintetice și codul aminoacizilor. VII , în Proc. Natl. Acad. Sci. SUA , vol. 48, nr. 12, decembrie 1962, pp. 2087-94, Bibcode : 1962PNAS...48.2087G , DOI : 10.1073/pnas.48.12.2087 , PMC 221128 , PMID 13946552 .
- ^ Wahba AJ, Gardner RS, Basilio C, Miller RS, Speyer JF e Lengyel P, Synthetic polynucleotides and the amino acid code. VIII , in Proc. Natl. Acad. Sci. USA , vol. 49, n. 1, gennaio 1963, pp. 116-22, Bibcode : 1963PNAS...49..116W , DOI : 10.1073/pnas.49.1.116 , PMC 300638 , PMID 13998282 .
- ^ The Nobel Prize in Physiology or Medicine 1959 , su nobelprize.org , The Royal Swedish Academy of Science, 1959. URL consultato il 27 febbraio 2010 .
«The Nobel Prize in Physiology or Medicine 1959 was awarded jointly to Severo Ochoa and Arthur Kornberg 'for their discovery of the mechanisms in the biological synthesis of ribonucleic acid and deoxyribonucleic acid'.» . - ^ Nirenberg M, Leder P, Bernfield M, Brimacombe R, Trupin J, Rottman F e O'Neal C, RNA codewords and protein synthesis, VII. On the general nature of the RNA code , in Proc. Natl. Acad. Sci. USA , vol. 53, n. 5, maggio 1965, pp. 1161-8, Bibcode : 1965PNAS...53.1161N , DOI : 10.1073/pnas.53.5.1161 , PMC 301388 , PMID 5330357 .
- ^ The Nobel Prize in Physiology or Medicine 1968 , su nobelprize.org , The Royal Swedish Academy of Science, 1968. URL consultato il 27 febbraio 2010 .
«The Nobel Prize in Physiology or Medicine 1968 was awarded jointly to Robert W. Holley, Har Gobind Khorana and Marshall W. Nirenberg 'for their interpretation of the genetic code and its function in protein synthesis'.» . - ^ a b Pamela K. Mulligan, King, Robert C. e Stansfield, William D., A dictionary of genetics , Oxford [Oxfordshire], Oxford University Press, 2006, p. 608, ISBN 0-19-530761-5 .
- ^ Touriol C, Bornes S, Bonnal S, Audigier S, Prats H, Prats AC e Vagner S, Generation of protein isoform diversity by alternative initiation of translation at non-AUG codons , in Biol. Cell , vol. 95, 3–4, 2003, pp. 169-78, DOI : 10.1016/S0248-4900(03)00033-9 , PMID 12867081 .
- ^ Wei J, Zhang Y, Ivanov IP, Sachs MS, The stringency of start codon selection in the filamentous fungus Neurospora crassa , in J. Biol. Chem. , vol. 288, n. 13, 2013, pp. 9549-62, DOI : 10.1074/jbc.M112.447177 , PMC 3611022 , PMID 23396971 .
- ^ Edgar B,The genome of bacteriophage T4: an archeological dig , in Genetics , vol. 168, n. 2, 2004, pp. 575-82, PMC 1448817 , PMID 15514035 .
- ^ Maloy S, How nonsense mutations got their names , su Microbial Genetics Course , San Diego State University, 29 novembre 2003. URL consultato il 10 marzo 2010 .
- ^ Anthony JF Griffiths, Jeffrey H. Miller, David T. Suzuki, Richard C. Lewontin e Gelbart (a cura di), Spontaneous mutations , in An Introduction to Genetic Analysis , 7th, New York, WH Freeman, 2000, ISBN 0-7167-3520-2 .
- ^ Freisinger E, Grollman AP, Miller H e Kisker C, Lesion (in)tolerance reveals insights into DNA replication fidelity , in The EMBO Journal , vol. 23, n. 7, 2004, pp. 1494-505, DOI : 10.1038/sj.emboj.7600158 , PMC 391067 , PMID 15057282 .
- ^ Boillée, 2006 , p. 39 .
- ^ Chang JC e Kan YW, beta 0 thalassemia, a nonsense mutation in man , in Proc. Natl. Acad. Sci. USA , vol. 76, n. 6, giugno 1979, pp. 2886-9, Bibcode : 1979PNAS...76.2886C , DOI : 10.1073/pnas.76.6.2886 , PMC 383714 , PMID 88735 .
- ^ Boillée S, Vande Velde C e Cleveland DW, ALS: a disease of motor neurons and their nonneuronal neighbors , in Neuron , vol. 52, n. 1, ottobre 2006, pp. 39-59, DOI : 10.1016/j.neuron.2006.09.018 , PMID 17015226 .
- ^ Isbrandt D, Hopwood JJ, von Figura K e Peters C, <361::AID-HUMU12>3.0.CO;2-0 Two novel frameshift mutations causing premature stop codons in a patient with the severe form of Maroteaux-Lamy syndrome , in Hum. Mutat. , vol. 7, n. 4, 1996, pp. 361-3, DOI : 10.1002/(SICI)1098-1004(1996)7:4<361::AID-HUMU12>3.0.CO;2-0 , PMID 8723688 .
- ^ Crow JF, How much do we know about spontaneous human mutation rates? , in Environ. Mol. Mutagen. , vol. 21, n. 2, 1993, pp. 122-9, DOI : 10.1002/em.2850210205 , PMID 8444142 .
- ^ Lewis, Ricki, Human Genetics: Concepts and Applications , 6th, Boston, Mass, McGraw Hill, 2005, pp. 227-228, ISBN 0-07-111156-5 .
- ^ Sawyer SA, Parsch J, Zhang Z e Hartl DL,Prevalence of positive selection among nearly neutral amino acid replacements in Drosophila , in Proc. Natl. Acad. Sci. USA , vol. 104, n. 16, 2007, pp. 6504-10, Bibcode : 2007PNAS..104.6504S , DOI : 10.1073/pnas.0701572104 , PMC 1871816 , PMID 17409186 .
- ^ Bridges KR, Malaria and the Red Cell , in Harvard , 2002 (archiviato dall' url originale il 27 novembre 2011) .
- ^ Drake JW e Holland JJ, Mutation rates among RNA viruses , in Proc. Natl. Acad. Sci. USA , vol. 96, n. 24, 1999, pp. 13910-3, Bibcode : 1999PNAS...9613910D , DOI : 10.1073/pnas.96.24.13910 , PMC 24164 , PMID 10570172 .
- ^ Holland J, Spindler K, Horodyski F, Grabau E, Nichol S e VandePol S, Rapid evolution of RNA genomes , in Science , vol. 215, n. 4540, 1982, pp. 1577-85, Bibcode : 1982Sci...215.1577H , DOI : 10.1126/science.7041255 , PMID 7041255 .
- ^ de Visser JA e Rozen DE,Clonal Interference and the Periodic Selection of New Beneficial Mutations in Escherichia coli , in Genetics, the Genetics Society of America , vol. 172, n. 4, 2006, pp. 2093-2100, DOI : 10.1534/genetics.105.052373 , PMC 1456385 , PMID 16489229 .
- ^ a b c d e Watson JD, Baker TA, Bell SP, Gann A, Levine M e Oosick R., Molecular Biology of the Gene , San Francisco, Pearson/Benjamin Cummings, 2008, ISBN 0-8053-9592-X .
- ^ Yang et al. (1990) in Michel-Beyerle, ME, ed. Reaction centers of photosynthetic bacteria: Feldafing-II-Meeting 6. Berlin: Springer-Verlag. pp. 209–18. ISBN 3-540-53420-2 .
- ^ Füllen G, Youvan DC (1994). "Genetic Algorithms and Recursive Ensemble Mutagenesis in Protein Engineering". Complexity International 1.
- ^ Crick FHC e Orgel LE, Directed panspermia , in Icarus , vol. 19, n. 3, 1973, pp. 341–6, 344, Bibcode : 1973Icar...19..341C , DOI : 10.1016/0019-1035(73)90110-3 .
«It is a little surprising that organisms with somewhat different codes do not coexist.» . ( Further discussion ) - ^ a b c Elzanowski A e Ostell J, The Genetic Codes , su ncbi.nlm.nih.gov , National Center for Biotechnology Information (NCBI), 7 aprile 2008. URL consultato il 10 marzo 2010 .
- ^ Jukes TH e Osawa S, The genetic code in mitochondria and chloroplasts , in Experientia , vol. 46, 11–12, dicembre 1990, pp. 1117-26, DOI : 10.1007/BF01936921 , PMID 2253709 .
- ^ Fitzpatrick DA, Logue ME, Stajich JE e Butler G,A fungal phylogeny based on 42 complete genomes derived from supertree and combined gene analysis , in BMC Evolutionary Biology , vol. 6, 1º gennaio 2006, p. 99, DOI : 10.1186/1471-2148-6-99 , PMC 1679813 , PMID 17121679 .
- ^ Santos MA e MF Tuite, The CUG codon is decoded in vivo as serine and not leucine in Candida albicans , in Nucleic Acids Research , vol. 23, n. 9, 1995, pp. 1481-6, DOI : 10.1093/nar/23.9.1481 , PMC 306886 , PMID 7784200 .
- ^ Butler G, Rasmussen MD, Lin MF, Santos MA, Sakthikumar S, Munro CA, Rheinbay E, Grabherr M, Forche A, Reedy JL, Agrafioti I, Arnaud MB, Bates S, Brown AJ, Brunke S, Costanzo MC, Fitzpatrick DA, de Groot PW, Harris D, Hoyer LL, Hube B, Klis FM, Kodira C, Lennard N, Logue ME, Martin R, Neiman AM, Nikolaou E, Quail MA, Quinn J, Santos MC, Schmitzberger FF, Sherlock G, Shah P, Silverstein KA, Skrzypek MS, Soll D, Staggs R, Stansfield I, Stumpf MP, Sudbery PE, Srikantha T, Zeng Q, Berman J, Berriman M, Heitman J, Gow NA, Lorenz MC, Birren BW, Kellis M, Cuomo CA, Evolution of pathogenicity and sexual reproduction in eight Candida genomes , in Nature , vol. 459, n. 7247, 2009, pp. 657-62, DOI : 10.1038/nature08064 , PMC 2834264 , PMID 19465905 .
- ^ Taylor DJ, Ballinger MJ, Bowman SM e Bruenn JA,Virus-host co-evolution under a modified nuclear genetic code , in PeerJ , vol. 1, 2013, pp. e50, DOI : 10.7717/peerj.50 , PMC 3628385 , PMID 23638388 .
- ^ Krzycki JA, The direct genetic encoding of pyrrolysine , in Current Opinion in Microbiology , vol. 8, n. 6, 2005, pp. 706-712, DOI : 10.1016/j.mib.2005.10.009 , PMID 16256420 .
- ^ Zhang Y, Baranov PV, Atkins JF e Gladyshev VN, Pyrrolysine and Selenocysteine Use Dissimilar Decoding Strategies , in Journal of Biological Chemistry , vol. 280, n. 21, 2005, pp. 20740-20751, DOI : 10.1074/jbc.M501458200 , PMID 15788401 .
- ^ Prat L, Heinemann IU, Aerni HR, Rinehart J, O'Donoghue P e Söll D,Carbon source-dependent expansion of the genetic code in bacteria , in Proceedings of the National Academy of Sciences , vol. 109, n. 51, 2012, pp. 21070-21075, DOI : 10.1073/pnas.1218613110 , PMC 3529041 , PMID 23185002 .
- ^ Xie J e Schultz PG, Adding amino acids to the genetic repertoire , in Current Opinion in Chemical Biology , vol. 9, n. 6, dicembre 2005, pp. 548-54, DOI : 10.1016/j.cbpa.2005.10.011 , PMID 16260173 .
- ^ Wang Q, Parrish AR e Wang L,Expanding the genetic code for biological studies , in Chem. Biol. , vol. 16, n. 3, marzo 2009, pp. 323-36, DOI : 10.1016/j.chembiol.2009.03.001 , PMC 2696486 , PMID 19318213 .
- ^ Simon M, Emergent computation: emphasizing bioinformatics , New York, AIP Press/Springer Science+Business Media, 2005, pp. 105-106, ISBN 0-387-22046-1 .
- ^ a b Yarus M, Life from an RNA World: The Ancestor Within , Cambridge, Harvard University Press, 2010, p. 163, ISBN 0-674-05075-4 .
- ^ Knight RD, Freeland SJ e Landweber LF, Selection, history and chemistry: the three faces of the genetic code , in Trends Biochem. Sci. , vol. 24, n. 6, giugno 1999, pp. 241-7, DOI : 10.1016/S0968-0004(99)01392-4 , PMID 10366854 .
- ^ Knight RD e Landweber LF, Rhyme or reason: RNA-arginine interactions and the genetic code , in Chem. Biol. , vol. 5, n. 9, settembre 1998, pp. R215–20, DOI : 10.1016/S1074-5521(98)90001-1 , PMID 9751648 .
- ^ Yarus M, Widmann JJ e Knight R, RNA-amino acid binding: a stereochemical era for the genetic code , in J. Mol. Evol. , vol. 69, n. 5, novembre 2009, pp. 406-29, DOI : 10.1007/s00239-009-9270-1 , PMID 19795157 .
- ^ Brooks DJ, Fresco JR, Lesk AM e Singh M, Evolution of amino acid frequencies in proteins over deep time: inferred order of introduction of amino acids into the genetic code , in Mol. Biol. Evol. , vol. 19, n. 10, ottobre 2002, pp. 1645-55, DOI : 10.1093/oxfordjournals.molbev.a003988 , PMID 12270892 .
- ^ Amirnovin R, An analysis of the metabolic theory of the origin of the genetic code , in J. Mol. Evol. , vol. 44, n. 5, maggio 1997, pp. 473-6, DOI : 10.1007/PL00006170 , PMID 9115171 .
- ^ Ronneberg TA, Landweber LF e Freeland SJ, Testing a biosynthetic theory of the genetic code: fact or artifact? , in Proc. Natl. Acad. Sci. USA , vol. 97, n. 25, dicembre 2000, pp. 13690-5, Bibcode : 2000PNAS...9713690R , DOI : 10.1073/pnas.250403097 , PMC 17637 , PMID 11087835 .
- ^ a b Freeland SJ, Wu T e Keulmann N, The case for an error minimizing standard genetic code , in Orig Life Evol Biosph , vol. 33, 4–5, ottobre 2003, pp. 457-77, DOI : 10.1023/A:1025771327614 , PMID 14604186 .
- ^ Baranov PV, Venin M e Provan G,Codon size reduction as the origin of the triplet genetic code , in Neil John (a cura di), PLoS ONE , vol. 4, n. 5, 2009, pp. e5708, Bibcode : 2009PLoSO...4.5708B , DOI : 10.1371/journal.pone.0005708 , PMC 2682656 , PMID 19479032 .
- ^ Tlusty T, A model for the emergence of the genetic code as a transition in a noisy information channel , in J Theor Biol , vol. 249, n. 2, Nov 2007, pp. 331-42, DOI : 10.1016/j.jtbi.2007.07.029 , PMID 17826800 .
- ^ Sonneborn TM, Evolving genes and proteins , a cura di Bryson, V. e Vogel, H., New York, Academic Press, 1965, pp. 377-397.
- ^ Tlusty T, Rate-distortion scenario for the emergence and evolution of noisy molecular codes , in Phys. Rev. Lett. , vol. 100, n. 4, Feb 2008, p. 048101, Bibcode : 2008PhRvL.100d8101T , DOI : 10.1103/PhysRevLett.100.048101 , PMID 18352335 , arXiv : 1007.4149 .
- ^ Sella G e Ardell DH, The coevolution of genes and genetic codes: Crick's frozen accident revisited , in J. Mol. Evol. , vol. 63, n. 3, Jul 2006, pp. 297-313, DOI : 10.1007/s00239-004-0176-7 , PMID 16838217 .
- ^ Ribas de Pouplana L, Turner RJ, Steer BA e Schimmel P, Genetic code origins: tRNAs older than their synthetases? , in Proc. Natl. Acad. Sci. USA , vol. 95, n. 19, settembre 1998, pp. 11295-300, Bibcode : 1998PNAS...9511295D , DOI : 10.1073/pnas.95.19.11295 , PMC 21636 , PMID 9736730 .
- ^ Jee J, Sundstrom A, Massey SE e Mishra B,What can information-asymmetric games tell us about the context of Crick's "Frozen Accident?" , in JR Soc Interface , vol. 10, n. 88, 2013, p. 20130614, DOI : 10.1098/rsif.2013.0614 , PMC 3785830 , PMID 23985735 .
- ^ a b Freeland SJ e Hurst LD, The genetic code is one in a million , in J. Mol. Evol. , vol. 47, n. 3, settembre 1998, pp. 238-48, DOI : 10.1007/PL00006381 , PMID 9732450 .
- ^ Taylor FJ e Coates D, The code within the codons , in BioSystems , vol. 22, n. 3, 1989, pp. 177-87, DOI : 10.1016/0303-2647(89)90059-2 , PMID 2650752 .
- ^ Di Giulio M, The extension reached by the minimization of the polarity distances during the evolution of the genetic code , in J. Mol. Evol. , vol. 29, n. 4, ottobre 1989, pp. 288-93, DOI : 10.1007/BF02103616 , PMID 2514270 .
- ^ Wong JT, Role of minimization of chemical distances between amino acids in the evolution of the genetic code , in Proc. Natl. Acad. Sci. USA , vol. 77, n. 2, febbraio 1980, pp. 1083-6, Bibcode : 1980PNAS...77.1083W , DOI : 10.1073/pnas.77.2.1083 , PMC 348428 , PMID 6928661 .
- ^ Erives A,A Model of Proto-Anti-Codon RNA Enzymes Requiring L-Amino Acid Homochirality , in J Molecular Evolution , vol. 73, 1–2, 2011, pp. 10-22, DOI : 10.1007/s00239-011-9453-4 , PMC 3223571 , PMID 21779963 .
Bibliografia
- ( EN ) Crick, Francis, Chapter 8: The genetic code , in What mad pursuit: a personal view of scientific discovery , New York, Basic Books, 1988, pp. 89-101, ISBN 0-465-09138-5 .
- ( EN ) Anthony JF Griffiths, Jeffrey H. Miller, David T. Suzuki, Richard C. Lewontin e Gelbart (a cura di), Spontaneous mutations , in An Introduction to Genetic Analysis , 7th, New York, WH Freeman, 2000, ISBN 0-7167-3520-2 .
- ( EN ) Pamela K. Mulligan, King, Robert C. e Stansfield, William D., A dictionary of genetics , Oxford [Oxfordshire], Oxford University Press, 2006, p. 608, ISBN 0-19-530761-5 .
- ( EN ) Lewis, Ricki, Human Genetics: Concepts and Applications , 6th, Boston, Mass, McGraw Hill, 2005, pp. 227-228, ISBN 0-07-111156-5 .
- ( EN ) Yang et al. (1990) in Michel-Beyerle, ME, ed. Reaction centers of photosynthetic bacteria: Feldafing-II-Meeting 6. Berlin: Springer-Verlag. pp. 209–18. ISBN 3-540-53420-2 .
- ( EN ) Watson JD, Baker TA, Bell SP, Gann A, Levine M e Oosick R., Molecular Biology of the Gene , San Francisco, Pearson/Benjamin Cummings, 2008, ISBN 0-8053-9592-X .
- ( EN ) Simon M, Emergent computation: emphasizing bioinformatics , New York, AIP Press/Springer Science+Business Media, 2005, pp. 105-106, ISBN 0-387-22046-1 .
- ( EN ) Yarus M, Life from an RNA World: The Ancestor Within , Cambridge, Harvard University Press, 2010, p. 163, ISBN 0-674-05075-4 .
- ( EN ) Crick, Francis, Chapter 8: The genetic code , in What mad pursuit: a personal view of scientific discovery , New York, Basic Books, 1988, pp. 89-101, ISBN 0-465-09138-5 .
- ( EN ) Anthony JF Griffiths, Jeffrey H. Miller, David T. Suzuki, Richard C. Lewontin e Gelbart (a cura di), Spontaneous mutations , in An Introduction to Genetic Analysis , 7th, New York, WH Freeman, 2000, ISBN 0-7167-3520-2 .
Voci correlate
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su codice genetico
Wikimedia Commons contiene immagini o altri file su codice genetico
Collegamenti esterni
- Online DNA → Convertitore on-line di sequenze di DNA in sequenze di amminoacidi , su geneseo.edu . URL consultato il 12 febbraio 2005 (archiviato dall' url originale il 12 febbraio 2005) .
| Controllo di autorità | LCCN ( EN ) sh85053852 · GND ( DE ) 4156624-5 |
|---|