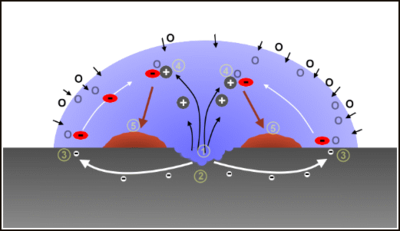
Coroziune
Coroziunea pe termen lung (de particula com- latinesc care indică insistența și roade, pentru a „consuma“ [1] ) indică un proces natural și ireversibil de consum continuă și lentă a unui material de care are ca rezultat deteriorarea caracteristicilor sau a proprietăților fizice ale materialul implicat inițial. Coroziunea este un fenomen electrochimic care determină o interacțiune chimico-fizică a materialului metalic cu mediul înconjurător.
Multe tipuri de materiale pot fi implicate în acest fenomen, deși termenul „coroziune” este în mod obișnuit asociat cu materiale metalice (adică metale și aliajele acestora). Coroziunea metalelor poate fi definită ca un proces de degradare și recompunere cu alte elemente prezente în mediu: metalele și aliajele sunt la un nivel de energie mai ridicat decât mineralele corespunzătoare, astfel încât, în anumite condiții de mediu, acestea tind să reia starea cea mai stabilă prezentă în natură, de obicei cea de oxid, hidrat sau sare.
Tratamentul electrochimic al fenomenelor de coroziune

Indiferent de mecanismul de declanșare specific, pentru ca coroziunea să aibă loc, este necesar ca procesele electrochimice să aibă loc în care să ia parte materialul metalic (care acționează ca un electrod ) și mediul de coroziune (care acționează ca un electrolit ). [2] Sistemul astfel constituit poate fi schematizat cu o celulă galvanică în condiții de scurtcircuit , adică o celulă galvanică în care electrozii sunt pe o parte separată de electrolit (în interiorul căreia există transportul sarcinii electrice prin intermediul ionilor ) și de cealaltă parte sunt în contact printr-un circuit electric extern (unde transportul sarcinii este asigurat de mișcarea electronilor ). [3]
Coroziunea este cauzată de efectuarea unei reacții de oxidare , care are loc la anodul celulei care reprezintă sistemul de coroziune, în timp ce o reacție de reducere are loc la catod . În toate procesele corozive, pe lângă o jumătate - reacție de oxidare a materialului metalic, are loc o jumătate de reacție de reducere . Specia chimică implicată în jumătatea reacției de oxidare este în principal metalul , în timp ce speciile chimice implicate în jumătatea reacției de reducere depind de mediul de reacție .
Jumătatea reacției de oxidare poate fi schematizată după cum urmează: [3]
-
M → M z+ + ze -
Unde z este sarcina ionului metalic (M z + ) care se formează în urma oxidării metalului M, îndepărtând z electroni (e - ).
În plus față de studiul celulei electrochimice reprezentative a fenomenului, alte instrumente teoretice dezvoltate în domeniul electrochimiei sunt utilizate în timpul investigației fenomenelor de coroziune, inclusiv diagrame Pourbaix (utilizate pentru a arăta efectul pH-ului asupra fenomenului de coroziune odată ce reacția a avut loc mediul este cunoscut) și diagramele Evans (utilizate pentru a ipoteza rata de coroziune odată cunoscută etapa determinantă cinetic ).
Mediul de coroziune
Coroziunea materialelor metalice poate fi clasificată în funcție de mediul în care are loc coroziunea: [4] [5]
- coroziune umedă : dacă apare în prezența apei sau a altui electrolit ;
- coroziune uscată : în alte cazuri (de exemplu în oxidarea la cald a metalelor sau oxidarea într-o atmosferă uscată).
Mecanisme de coroziune
În funcție de mecanismul prin care apare coroziunea, vorbim despre: [5]
- coroziune prin atac direct (sau coroziune chimică ): dacă materialul metalic este atacat de anumite substanțe chimice în prezența apei (sub formă de apă lichidă sau vapori de apă ); un exemplu de coroziune prin atac direct este coroziunea materialelor metalice expuse aerului , numită coroziune atmosferică ; [6]
- coroziune electrochimică : dacă se produce coroziune între două părți metalice puse în contact; dacă metalele puse în contact sunt de altă natură, vorbim în special de coroziune galvanică ; [7]
- coroziune mecanico-chimică : dacă coroziunea este cauzată de participarea unor cauze de natură electrochimică și de solicitări mecanice. Putem distinge în continuare:
- coroziune prin frecare : dacă efectele coroziunii sunt sporite prin aplicarea forțelor de frecare care acționează pe suprafața piesei;
- fisurarea prin coroziune la stres (sau fisurarea prin coroziune la stres): dacă efectele de coroziune sunt sporite prin aplicarea unei constante de sarcină în timp;
- coroziune datorată oboselii : dacă efectele coroziunii sunt îmbunătățite prin aplicarea unei sarcini care variază în timp.
Morfologia fenomenelor corozive
În funcție de partea de material metalic afectată de coroziune, vorbim despre: [8]
- coroziune difuză (sau coroziune generalizată ): dacă întreaga suprafață a materialului este afectată de coroziune;
- coroziune uniformă : dacă coroziunea afectează întreaga suprafață a materialului și întinderea efectelor corozive este aceeași în fiecare punct al suprafeței;
- coroziune neuniformă : dacă coroziunea afectează întreaga suprafață a materialului și întinderea efectelor corozive este mai mult sau mai puțin accentuată în diferite puncte ale suprafeței; [9]
- coroziune localizată : dacă coroziunea afectează numai unele zone ale materialului; zona afectată de coroziune poate avea morfologii diferite, de exemplu:
- ulcere
- cratere
- caverne ( "cavernizing pitting ")
- puncte de fixare („penetrare penetrantă”)
- fisuri (împărțite în intergranulare sau transgranulare în funcție de faptul dacă fisurile urmează limitele granulelor sau traversează boabele cristaline );
- coroziune selectivă : dacă coroziunea are loc în zone specifice ale materialului. Putem distinge în continuare:
- coroziune intragranulară (sau cristalografică ): există coroziune a boabelor monocristaline )
- coroziune intergranulară : apare la limitele granulelor
- coroziune interdendritică: asociată cu formațiuni dendritice din material;
- dezamorsare: constă în separarea componentelor care alcătuiesc aliajele metalice.
Coroziune intergranulară
Coroziunea intergranulară (sau intercristalină) apare la limitele granulelor unei soluții solide , în special a oțelului inoxidabil austenitic sau feritic care a fost sensibilizat prin încălzirea la peste 500 ° C.
De fapt, în aceste condiții există precipitarea carburilor de crom , care, datorită temperaturii ridicate, se difuzează către zonele distorsionate (limitele granulelor), unde există o concentrație mai mare de carbon .
Acest lucru creează o situație în care limitele granulelor sunt bogate în carburi de crom, care acționează ca un catod și în matricea înconjurătoare cu un procent de crom mai mic de 12%, care nu mai este pasivat și, prin urmare, acționează ca un anod : poate avea astfel loc coroziune umedă. Un bob fin în această situație este contraproductiv, deoarece o extindere mai mare a limitelor granulelor implică o extindere mai mare a zonelor supuse coroziunii.
Pentru a reduce această coroziune, este recomandabil să traversați rapid intervalul de temperatură critic (de exemplu, prin răcire în apă ) sau să prelungiți încălzirea: aceasta pentru a preveni sau favoriza difuzia cromului . O altă soluție, adesea adoptată în oțelurile inoxidabile austenitice, constă în adăugarea unor cantități relativ mici de metale mai mult combustibil decât cromul ( Ti , Nb sau Ta ) la aliaj, care, prin formarea propriilor carburi, previn carburarea cromului.
O soluție larg utilizată constă în decarbonizarea oțelului, aducând procentul de carbon sub 0,03%, astfel încât să se limiteze formarea de carburi de crom. Materialele astfel realizate se disting prin inițialele "EL" ( Extra Low Carbon ), în timp ce un procent de carbon între 0,03% și 0,08% caracterizează oțelurile "L" ( Low Carbon ).
Coroziune prin ventilație diferențială
Coroziunea localizată prin aerare diferențială apare atunci când există zone pe suprafața materialului metalic care au o permeabilitate diferită față de oxigen.
Partea suprafeței metalice care este mai puțin permeabilă la oxigen acționează ca o regiune anodică, prin urmare este sediul procesului de dizolvare a metalului; de exemplu în cazul oțelului există următorul proces de oxidare: [3]
- Fe → Fe ++ + 2e -
în timp ce partea din suprafața metalică cea mai permeabilă la oxigen acționează ca o regiune catodică, de aceea este sediul procesului de reducere a oxigenului: [3]
- 1 ⁄ 2 O 2 + H 2 O + 2e - → 2 OH -
Acest tip de coroziune apare în structuri metalice subterane care traversează straturi de sol de natură diferită (de exemplu argilă , mai puțin permeabilă la oxigen și nisip , mai permeabilă la oxigen) sau în cazul în care suprafața metalului este parțial umedă ( deoarece apa nu este foarte permeabilă la oxigen [3] ), de exemplu în interiorul conductelor de apă atunci când se formează buzunare de aer din cauza unei defecțiuni a dispozitivelor de aerisire .
Coroziunea atmosferică

În general, materialele metalice expuse atmosferei și la temperatura camerei tind să se corodeze formând oxizi ; stabilitatea acestor oxizi scade odată cu creșterea temperaturii. Acest lucru se datorează faptului că la temperatura camerei aproape toate metalele au o afinitate chimică pozitivă pentru oxigen , adică tind să reacționeze cu oxigenul, oxidându-se.
În special, în cazul unui aliaj bimetalic, există următoarele cazuri:
- oxidarea metalului dizolvat , dacă aceasta are o afinitate mai mare pentru oxigen și difuzia acestuia din urmă în aliaj este bună;
- oxidarea metalului solvent : se formează un strat de oxid de solvent cu particule de substanță dizolvată în interior;
- oxidarea ambelor metale din aliaj.
Prin urmare, din punct de vedere termodinamic , este favorizată coroziunea atmosferică. Cu toate acestea, este posibil să se exploateze fenomenul pasivării pentru a contracara progresul coroziunii. Pasivarea unui material metalic constă în formarea unui film de oxid deosebit de stabil și subțire (cu câțiva micrometri grosime); formarea acestui film depinde de condițiile externe (inclusiv umiditatea și temperatura atmosferică) și de natura materialului metalic.
Dacă acest film este capabil să blocheze difuzia oxigenului în materialul metalic, apare fenomenul de pasivare ; dacă, pe de altă parte, acest strat de oxid nu acoperă în mod adecvat suprafața materialului, oxigenul are posibilitatea de a reacționa cu metalul și fenomenul de coroziune nu este blocat.
În cazul cuprului sau aluminiului , oxidul are o greutate specifică mai mică decât greutatea specifică a metalului în sine, prin urmare, pentru aceeași greutate oxidul ocupă un volum mai mare și protejează materialul de bază. Pe de altă parte, în cazul oțelului , oxidul are o greutate specifică mai mare decât greutatea specifică a metalului în sine, prin urmare, pentru aceeași greutate, oxidul ocupă un volum mai mic și se micșorează și creează fisuri acolo unde pătrunde mai mult oxigen, ceea ce continuă procesul.coroziv în partea de bază. Prin urmare, pelicula de oxid de fier (denumită în mod obișnuit „ rugină ”), fiind friabilă și nu este suficient de aderentă, nu poate fi considerată protecție.
Prin adăugarea altor metale (precum cromul și nichelul) la oțel este posibil să se obțină o peliculă pasivantă foarte aderentă, obținându-se așa-numitul „ oțel inoxidabil ”. [10]
Factorii care afectează rata de creștere a stratului de oxid sunt:
- raportul dintre volumul oxidului care se formează și cel al metalului de bază oxidat, care determină starea filmului de oxid: tensionat, sub ușoară compresie, încrețit;
- permeabilitatea la oxigen;
- conductivitatea electrică a oxidului;
- pe măsură ce temperatura crește, energia eliberată de metal în procesul de coroziune scade, prin urmare, energia care poate trece la oxigenul molecular scade astfel încât să se disocieze în oxigen atomic și să se lege de atomii de metal; în general, însă, rata de creștere a stratului de oxid crește odată cu temperatura, dar nu întotdeauna cu o tendință liniară; prin urmare, sunt preferate metalele care respectă legile logaritmice și cubice ( aluminiu și aliajele sale, adaosuri de crom ).
Coroziune galvanica
Mecanismul de coroziune galvanică [11] este produs în conformitate cu un proces umed și este declanșat atunci când două materiale, având o valoare nobiliară diferită (sau două părți ale aceluiași material expuse la condiții diferite), sunt plasate în contact direct (formând un cuplaj galvanic ), în prezența pe ambele a unui al treilea element (numit „ electrolit ”).
Se formează o celulă galvanică scurtcircuitată (numită macrocuplu ) în care electrozii sunt alcătuiti din cele două materiale cuplate.
Un flux de electroni este generat din materialul mai puțin nobil (cu potențial mai mic), numit anod (sau pol negativ) care se oxidează , către cel mai nobil cu potențial mai mare, numit catod (sau pol pozitiv), unde reducerea cationilor are loc loc, care poate fi acoperit cu straturi metalice.
Reacțiile care au loc în timpul procesului de coroziune sunt toate redox (din engleză red uction and ox idation ). Prin convenție, se presupune că direcția curentului electric este opusă fluxului de electroni, astfel încât un curent continuu de intensitate i circulă din zona catodică către zona anodică; același curent circulă în direcția opusă în electrolit, purtat de ionii dizolvați.
Metalele mai puțin nobile (de exemplu zinc , fier , nichel ) au o tendință mai mare de coroziune decât metalele mai nobile (de exemplu cupru , argint , oțel inoxidabil ), astfel încât punerea în contact a unui metal mai puțin nobil și a unui metal mai nobil va fi metalul mai puțin nobil care se corodează (acționând ca un anod) și coroziunea vor fi accelerate, în timp ce metalul mai nobil va rămâne intact datorită unui fenomen de protecție.
Conceptele care stau la baza coroziunii prin contactul galvanic al metalelor pot fi, de asemenea, extinse la cuplarea metalelor și aliajelor cu materiale diferite de acestea, cum ar fi oxizii și sulfurii, atâta timp cât au conductivitate electronică (de exemplu magnetit , sulfuri de cupru și fier, grafit ).
Gradul de coroziune depinde de:
- din diferența de potențial care se creează între cele două elemente, care este mai mare cu cât elementele în sine sunt mai îndepărtate în scara potențialelor standard (sau scara galvanică);
- cantitatea de oxigen prezentă în mediu;
- din raportul dintre suprafața totală a celor două metale și cea a metalului mai puțin nobil.
Nobilimea relativă a diferitelor materiale metalice ia în considerare factorii cinetici, prin urmare nu corespunde valorilor termodinamice raportate în seria electrochimică a potențialilor de echilibru redox pentru reacțiile de ionizare ale diferitelor metale.
De fapt, este, de asemenea, necesar să cunoaștem valorile potențialelor pe care diferitele materiale le asumă odată cufundate în medii „reale” agresive, stabilind astfel serii galvanice „practice”, legate de comportamentul diferitelor materiale metalice dacă acestea sunt cuplat în medii diferite.examinat.
Nobilimea unui material metalic poate varia, de fapt, pe o gamă largă de potențial, în funcție de condițiile atât ale mediului (compoziția, valoarea pH-ului, temperatura, prezența sau absența condițiilor de schimb de căldură, agitație), cât și ale materialului metalic (pasivitatea la în urma prezenței filmelor sau activităților de suprafață de protecție atunci când suprafața metalică este direct în contact cu mediul agresiv).
Realizarea cuplajelor de materiale apropiate unele de altele în seria galvanică este, prin urmare, considerată favorabilă, deoarece aceste materiale sunt „compatibile galvanic” între ele, în timp ce utilizarea materialelor care sunt îndepărtate unele de altele în seria galvanică de interes ar trebui să fie evitat.
În procesul de coroziune de contact, în unele
Un exemplu clasic este cel al cuplului Zn-Fe în apele naturale la temperaturi ridicate; zincul, un metal mai puțin nobil și inițial anodic în comparație cu fierul, în urma formării unui film pasivabil stabil de oxid de zinc cu conductivitate electronică, va prelua în timp un comportament catodic față de fier.
Printre factorii care reglează coroziunea prin contact, trebuie amintită conductivitatea electrică a mediului agresiv. De fapt, la vehiculele cu conductivitate mare atacul este intens și se face simțit la distanțe mari, în timp ce în mediile cu rezistivitate ridicată coroziunea este limitată la zona anodică din apropierea joncțiunii cu zona catodică. Din acest motiv, acest tip de coroziune este deosebit de grav în apa de mare, dar nu și în apa dulce, cu o conductivitate de cel puțin două ordine de mărime mai mică.
Un alt factor important în reglarea coroziunii galvanice îl reprezintă relația dintre zonele catodice și anodice; cele mai nefavorabile condiții apar atunci când zona anodică este mică în comparație cu cea catodică, deoarece atacul coroziv este concentrat pe zona limitată. Un exemplu tipic ar putea fi utilizarea elementelor de îmbinare din fier (cuie sau șuruburi) pe structuri din cupru sau (așa cum se întâmplă adesea în construcțiile hidraulice) șuruburi din oțel inoxidabil pe țevi din oțel carbon sau fontă.
Prevenirea sau reținerea coroziunii prin contact poate fi realizată prin evitarea contactului între materiale de nobilime foarte diferită sau prin izolarea diferitelor materiale metalice între ele, acolo unde este posibil. Utilizarea de acoperiri sau inhibitori de protecție poate reduce, de asemenea, riscul de coroziune de contact. Dacă este imposibil să se evite utilizarea unei perechi de materiale metalice care nu sunt compatibile între ele, lanțul galvanic poate fi extins prin introducerea unui al treilea metal, mai puțin nobil decât cele care alcătuiesc perechea, acționând astfel ca un anod de sacrificiu .
Nobilimea metalelor

Metalele se caracterizează prin nobilimea lor, [12] care indică facilitatea mai mare sau mai mică a materialelor de a elibera un anumit număr de electroni.
Cu cât metalele mai nobile (de exemplu, cuprul și argintul) sunt mai greu de eliberat electroni decât metalele mai puțin nobile (de exemplu, fierul și zincul).
Din punct de vedere pur calitativ, scara galvanică (referită la electrodul de hidrogen) a celor mai comune metale și aliaje (începând de la cele mai puțin nobile) este prezentată mai jos:
- Litiu
- Sodiu
- Magneziu
- Aluminiu
- Mangan
- Zinc
- Crom
- Fier - ( oțel carbon, fontă )
- Cadmiu
- Nichel
- Iazul
- Conduce
- Cupru
- Oțel inoxidabil
- Titan
- Argint
- Mercur
- Platină
- Aur
Comportamentul electrochimic al metalelor
La metale, se disting două comportamente electrochimice:
- comportamentul activ electrochimic este caracteristic acelor metale, cum ar fi oțelul carbon, care prin oxidare dau naștere la produse de coroziune insolubile (de exemplu rugină ), care odată depuse pe material formează un film spongios și nu foarte compact, nepotrivit pentru prevenirea procesului anodic și, prin urmare, pentru a pasiva metalul subiacent;
- comportamentul electrochimic pasiv este caracteristic acelor metale, precum oțelul inoxidabil , care prin oxidare dau naștere la produse de coroziune insolubile care formează un strat subțire, compact și continuu capabil să prevină procesul anodic și, în consecință, coroziunea materialului subiacent.
Coroziunea fierului și a aliajelor sale

În aliajele feroase, cum ar fi oțelurile cu carbon și cele slab aliate și fontele, așa cum vom vedea mai jos, produsele insolubile care se formează ca urmare a coroziunii electrochimice nu sunt de protecție pentru materialul subiacent și, prin urmare, aceste aliaje au un comportament electrochimic activ .
Condiția necesară pentru ca coroziunea electrochimică a fierului să apară, la temperatura normală, este ca produsul să fie în prezența apei și a oxigenului.
Într-un metal M izolat, scufundat într-o soluție apoasă, are loc în mod natural următoarea reacție:
- M → M n + + ne -
Aceasta înseamnă că metalul M are tendința de a face unii atomi dispuși pe suprafața sa să treacă în soluție sub formă de ioni M n + .
Deoarece ionii care trec în soluție își lasă electronii cei mai exteriori ne - în metal, metalul însuși devine încărcat negativ.
În această situație, unii ioni M n + vor fi atrași de metal și vor depune pe suprafața acestuia sub formă metalică în funcție de reacție:
- M n + + ne - → M
Atunci când cele două reacții ating aceeași viteză, există un echilibru dinamic în care numărul de atomi care părăsesc metalul este egal cu numărul de ioni care se repun pe el.
În acest moment, metalul își va asuma un anumit potențial electric de echilibru E eq ( potențial redox ).
Dacă două metale (sau părți ale aceluiași metal) cu potențial diferit sunt aduse în contact în prezența unui electrolit, se formează o celulă galvanică .
Procesul menționat mai sus depinde de natura chimico-fizică a metalului și de tipul de mediu în care este scufundat. Pe suprafața produselor din oțel, datorită proceselor supuse, există întotdeauna zone sau puncte care diferă fizic sau chimic între ele și, prin urmare, au un potențial diferit.
Între două dintre aceste puncte, în ciuda diferenței de potențial (ΔE), nu există curent de curent dacă mediul este uscat, chiar și în prezența oxigenului, deoarece nu se poate crea un conductor ionic.
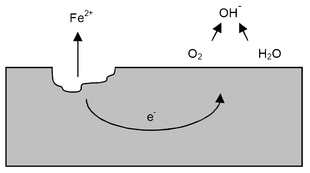
Dacă, pe de altă parte, pe suprafața produsului se depune un strat de apă sau un voal ușor de umiditate, conținut în mod normal în atmosferă, se formează miriade de grămezi mici între cele două puncte cu o diferență de potențial, deoarece :
- se generează un circuit ionic corespunzător vălului de apă sau umidității ( conductor de tip II )
- se generează un circuit electronic corespunzător metalului ( conductor de primul fel ).
De fapt, datorită caracterului său amfoteric , apa este slab disociată în ioni de hidrogen H + și hidroxili OH - :
- H 2 O → H + + OH -
Prin urmare, chiar dacă apa este foarte pură, are o conductivitate electrică mică, dar măsurabilă. Pentru cele de mai sus, coroziunea în fier urmează următorul proces. În zona anodică, fierul trece în soluție cedând ionul Fe ++ apei sau filmului de umiditate și eliberând în același timp electroni: [13]
- Fe → Fe ++ + 2e -
Electronii eliberați de atomii de fier din anod migrează prin metal ( circuit electronic ) către catod, unde reacționează cu ionii de hidrogen H + provenind din circuitul ionic : [13]
- 2H + + 2e - → H 2
Această reacție are un efect dublu: scade concentrația de H + față de cea a ionilor hidroxil OH - , făcând apa în contact cu catodul alcalină ; formarea bulelor de hidrogen gazos împiedică apropierea de noi ioni de hidrogen la suprafața catodului, prevenind evadarea altor electroni.
În acest moment intervine oxigenul dizolvat în apă (sau în pelicula de umiditate) care, reacționând cu hidrogenul gazos, formează apă și depolarizează catodul:
- 2H 2 + O 2 → 2H 2 O
În același timp, în zona anodică, ionii hidroxil care vin din catod prin circuitul ionic întâlnesc ionii feroși Fe ++ care difuzează din anod în apă sau în pelicula de umiditate, formând hidrat feros:
- 2Fe ++ + 4OH - → 2Fe (OH) 2
În prezența unui oxigen suficient în zona anodică, ionul feros este oxidat în ion feric cu formarea oxidului feric hidratat (care constituie chimic rugină ), [10] nu foarte solubil, care precipită pe metal:
- 2Fe (OH) 2 + ½O 2 → Fe 2 O 3 .nH 2 O + H 2 O
Având în vedere tendința ionilor feroși de a se difuza din anod înainte de a se combina și de a forma rugina, acesta depus pe suprafața produsului din fier apare ca un produs spongios cu aderență labilă pe metal la anod.
Prin urmare, acțiunea sa de protecție ( pasivare ) nu este suficientă pentru a inhiba sau opri procesul coroziv, așa cum se întâmplă în cazul oțelului inoxidabil (sau a aliajelor de cupru și aluminiu) pentru care produsele de coroziune, formând o peliculă de oxizi continui și aderând la suprafața material, acestea inhibă procesul anodic în așa fel încât rata de coroziune să devină complet neglijabilă ( comportament electrochimic pasiv ).
Pierderea continuă de metal la anod poate duce la cavități adânci și chiar perforarea elementului de oțel în sine. Cele de mai sus se aplică acțiunii apei și oxigenului asupra coroziunii oțelului.
Conductivitatea electrică a apei și, prin urmare, rata de coroziune, crește în funcție de cantitatea de săruri dizolvate.
În atmosfera marină sau în apa de mare, conductivitatea electrică atinge valori mult mai mari decât cele găsite în apa chimic pură.
În această situație, mecanismul văzut mai sus rămâne valabil, dar ionii feroși care difuzează din anod sunt mai ușor combinați cu ionii de clor produși prin disocierea electrolitică a clorurii de sodiu în apă sau în pelicula de umiditate, formând clorură de fier :
- 4NaCl → 4Na + + 4Cl -
- 2Fe ++ + 4Cl - → 2FeCl 2
În același timp, în zona catodică, ionii de sodiu se combină cu ionii hidroxil (OH - ) formând hidrat de sodiu:
- 4Na + + 4OH - → 4NaOH
Reacția ulterioară dintre clorură feroasă, hidrat de sodiu și oxigen, prezentă în apă sau în pelicula de umiditate, determină formarea oxidului feric:
- 4FeCl 2 + 8NaOH + O 2 → 2Fe 2 O 3 + 8NaCl + 4H 2 O
Deoarece și în acest caz atât clorura feroasă, cât și hidratul de sodiu sunt foarte solubile, răspândindu-se în circuitul ionic atât în zona anodică, cât și în cea catodică, rugina care se depune pe suprafața materialului feros este încă foarte spongioasă și foarte labilă și, prin urmare, nu poate pasiva metalul.
Mai mult, procesul de coroziune este facilitat în continuare de regenerarea clorurii de sodiu.
Coroziunea tijelor de armare a structurilor din beton armat

Anche l'armatura del calcestruzzo armato, pur essendo immersa nella matrice cementizia, può essere soggetta a fenomeni corrosivi. Questo avviene quando nel calcestruzzo, a seguito del processo di carbonatazione che si innesca per la diffusione dell'anidride carbonica all'interno della pasta cementizia, si ha una diminuzione del pH che determina l'ambiente ideale per l'innesco della corrosione dei ferri di armatura (per un calcestruzzo completamente carbonatato, il pH scende a circa 8,5).
Infatti esistono varie forme di idrossido di ferro che si genera a seguito dell'ossidazione del ferro metallico; in particolare in ambiente molto basico con pH > 11 (come si verifica nel calcestruzzo per effetto della presenza della calce), si forma un tipo di idrossido denominato lapidocrocite , il quale si presenta stabile, denso, compatto e aderente al sottostante supporto metallico creando una barriera impenetrabile all'ossigeno e all'umidità a tal punto che il processo di ossidazione avviene a una velocità trascurabile (ferro passivato ).
In ambienti meno basici con pH < 11 (come si verifica nel calcestruzzo quando la calce è stata neutralizzata per effetto della carbonatazione) o, come vedremo in seguito, in ambienti contenenti cloruro, l'idrossido di ferro diviene poroso, permeabile all'ossigeno e all'umidità e quindi non più protettivo per il ferro sottostante (depassivazione del ferro) e pertanto si può innescare la corrosione.
In generale è possibile individuare due differenti periodi dell'attacco corrosivo:
- inizio che coincide con la costruzione dell'opera e si completa con la totale carbonatazione del copriferro o con il raggiungimento del limite di cloruri nel calcestruzzo (il pH <8,5)
- propagazione che inizia con l'innesco del fenomeno corrosivo che riduce le prestazioni strutturali fino a portare al non soddisfacimento degli stati limite di esercizio e/o ultimi.
Per effetto della corrosione i ferri d'armatura presentano sostanzialmente i seguenti fenomeni degradanti:
- la diminuzione della sezione resistente del tondino con conseguente riduzione del suo carico portante e della sua resistenza a fatica;
- la fessurazione del copriferro, che si forma in genere parallelamente alla direzione delle armature, con conseguente espulsione locale del copriferro (cricca o spalling se l'espulsione è angolare) o totale delaminazione (quando l'effetto di dirompente interessa più ferri vicini); questo avviene quando le tensioni che si generano nel calcestruzzo a causa dei fenomeni espansivi che accompagnano la formazione della ruggine, superano la resistenza a trazione del materiale. Naturalmente l'espulsione del copriferro provoca la completa esposizione dei ferri all'azione aggressiva dell'ambiente che viene pertanto accelerata.
- la riduzione di aderenza acciaio - calcestruzzo che può addirittura causare la perdita di ancoraggio con gravissime conseguenze.
- nel caso di acciai a elevato limite di snervamento ( acciai armonici ), cedimenti improvvisi per infragilimento da idrogeno .
In presenza di ioni cloro Cl - , la corrosione dei ferri di armatura può innescarsi anche con pH elevati (> 9), in questo caso si ha una corrosione localizzata detta corrosione per pitting (o vaiolatura ). Questo tipo di corrosione può attaccare anche l'acciaio inox.
Protezione delle armature
La protezione delle armature d'acciaio contro la corrosione dipende dalla massa volumica del calcestruzzo, dalla qualità e dallo spessore del copriferro e dal grado di fessurazione del copriferro stesso.
La massa volumica e la qualità del copriferro si ottengono controllando il massimo rapporto acqua/cemento e il minimo contenuto di cemento. [14]
La fessurazione del copriferro può essere provocata da fenomeni come la variazione di temperatura, il ritiro , tanto plastico quanto igrometrico, lo scorrimento viscoso , e alle fessurazioni indotte nelle strutture in servizio da carichi dinamici e ciclici o da sollecitazioni termiche. Gli stessi prodotti espansivi della corrosione possono indurre fessurazioni aggiuntive del copriferro quando la corrosione viene innescata dalla penetrazione degli agenti aggressivi attraverso un calcestruzzo eccessivamente poroso.
Inoltre, nelle strutture in calcestruzzo prefabbricato, le fessure possono essere prodotte anche da urti meccanici o sollecitazioni flessionali indotte durante il trasporto, il sollevamento e il montaggio.
Un altro possibile mezzo di protezione e prevenzione dalla corrosione delle armature è quello di ricorrere a protezioni aggiuntive delle armature stesse, come l'utilizzo di tondini in acciaio zincato o acciaio inox.
Corrosione dei manufatti in ferro interrati
In assenza dell' azione dei batteri , la velocità di corrosione delle strutture interrate a matrice ferrosa (ghisa, acciaio) decresce al crescere della resistività dei terreni .
La resistività dipende da diversi fattori e in particolare da:
- struttura geologica
- dimensioni delle particelle
- porosità
- permeabilità
- contenuto di acqua.
Pertanto di norma i terreni che garantiscono un maggiore tenore di ossigeno, un idoneo contenuto di acqua (non asciutti ne troppo saturi) e un idoneo contenuto di sali elettroliti risultano a più alta corrosività.
La velocità di corrosione dipende inoltre da altri fattori quali:
- il pH : più acido è il terreno maggiore è l'azione corrosiva del terreno;
- il contenuto di cloruri e solfati, i quali esplicano un effetto depassivante e danno luogo a sali con il ferro con scarse proprietà protettive.
Corrosione dei manufatti in ghisa interrati
La ghisa, sia grigia sia sferoidale , insieme all'acciaio è il materiale più impiegato per la fabbricazione di tubi metallici.
Però mentre nell'acciaio il ferro passa in soluzione nell'elettrolita lasciando dei crateri visibili sulla superficie del metallo, nelle ghise i prodotti della corrosione della ferrite non si allontanano e restano frammisti alla grafite .
Questo fenomeno è noto come grafitizzazione ./
I tubi grafitizzati mantengono spesso l'aspetto di quelli integri e una indicazione sull'estensione dell'attacco si può avere solo dopo la rimozione dei prodotti di corrosione.
Questi tubi danno un suono sordo quando sono percossi e possono essere facilmente incisi con una punta metallica.
In questa situazione il tubo può rompersi improvvisamente anche a basse pressioni, a seguito di sollecitazioni (quali ad esempio colpo d'ariete , traffico stradale o vibrazioni).
Una serie di prove effettuate negli Stati Uniti dal National Bureau of Standards (attualmente noto come National Institute of Standards and Technology o NIST) ha dimostrato che l'acciaio, la ghisa grigia e la ghisa sferoidale negli stessi terreni si corrodono pressoché con uguale velocità. [ senza fonte ]
Corrosione di materiali non metallici
Incidenti dovuti alla corrosione
Di seguito sono riportati alcuni incidenti storici dovuti alla corrosione:
- 1967 : crollo del ponte sospeso Silver Bridge traPoint Pleasant (Virginia Occidentale) e Kanauga (Ohio) ; causò la morte di 46 persone oltre a un grave danno economico di milioni di dollari; [15]
- 1988 incidente del volo Aloha Airlines 243 : attribuito alla corrosione di una parte della fusoliera ; [16] [17]
- 1991 : disastro della petroliera Kirki , che portò la morte di 120 persone; [18]
- 1992 : la corrosione di una tubazione sotterranea contenente una miscela idrocarburica e il conseguente riversamento nelle condotte della rete fognaria provoca la morte di 230 persone a Guadalajara , in Messico . [19] [20]
Pratiche contro la corrosione
Prove di corrosione
Durante le prove di corrosione il materiale viene sottoposto a particolari condizioni che ne dovrebbero provocare la corrosione ea prova eseguita (o anche durante la prova) se ne misurano gli effetti.
Un esempio di prova di corrosione è la camera a nebbia salina : si tratta di un'apparecchiatura all'interno della quale il materiale che si vuole testare è sottoposto a un ambiente a elevata concentrazione salina; in questa maniera è possibile simulare il comportamento del materiale in ambienti marini.
Le camere cicliche di corrosione (o CCT, dall'inglese Cyclic Corrosion Test Chambers ) permettono di simulare anche ambienti salini (come nel caso delle camere a nebbia salina), secchi o umidi ed è possibile modificare ciclicamente le condizioni all'interno della camera, in modo da simulare l'utilizzo del materiale in una molteplicità di possibili condizioni reali.
Tabelle di corrosione
Un modo immediato per prevedere se un materiale a contatto di una determinata sostanza è soggetto a corrosione consiste nell'utilizzo di "tabelle di corrosione", [21] le quali indicano alcune combinazioni materiale-elettrolita e per ciascuna di tali combinazioni indicano se il materiale è corrodibile o no.
Tali tabelle possono essere utilizzate in una prima fase della progettazione per scegliere il materiale più adatto per una determinata applicazione all'interno di una ristretta selezione di materiali.
Metodi di protezione dalla corrosione
Per arrestare la corrosione si possono utilizzare una protezione di tipo passivo e/o di tipo attivo.
Nel primo caso la protezione serve a isolare la superficie del metallo dall'ambiente esterno mediante il suo rivestimento (previo accurata pulizia della stessa) con ad esempio:
- un film di pittura protettiva;
- manti protettivi a base di polietilene (secondo la UNI 9099), bitume (secondo la norma UNI 5256) e poliuretano , frequentemente usati come rivestimento esterno delle tubazioni in acciaio interrate; spesso si utilizzano anche nastri di polietilene autoadesivi applicati a freddo; [22]
- prodotti di ossidazione ottenuti ad esempio mediante l'ossidazione anodica, utilizzata per metalli come l' alluminio , il nichel o il cobalto ; gli ossidi di tali materiali sono molto tenaci e aderenti allo strato superficiale e pertanto passivano il metallo;
- metalli meno nobili, quali lo zinco; in questo caso si parla della zincatura , usata per proteggere il ferro, effettuata immergendo il metallo, in un bagno fuso di zinco; poiché lo zinco è più riducente del ferro, anche se una parte della superficie ferrosa rimane scoperta, l'ossidazione procede sullo zinco (con formazione di ruggine bianca costituita prevalentemente da idrossido di zinco e in minima parte da ossido e carbonato) e il ferro rimane protetto fino a quando non è stato consumato tutto lo zinco;
- metalli più nobili, quali il cromo; in questo caso si parla di cromatura che viene utilizzata per proteggere i manufatti di ferro; il rivestimento della superficie del ferro avviene per lo più per via elettrolitica .

Le protezioni attive sono chiamate protezioni catodiche e sono utilizzate per eliminare i fenomeni di corrosione dei manufatti di ferro interrati.
Si possono distinguere due tipi di protezioni catodiche:
- a corrente impressa : consiste nell'applicare dall'esterno una fem contraria, ossia collegare il manufatto al polo negativo di un generatore esterno il cui polo positivo è a sua volta collegato a un elettrodo inerte (esempio grafite ) interrato in prossimità del manufatto. L'umidità del terreno funge da elettrolita.
- ad anodo sacrificale o ad accoppiamento galvanico : consiste nel collegare direttamente il manufatto in ferro a un elettrodo interrato costituito da un metallo meno nobile (più riducente) del ferro stesso, quali lo zinco o il magnesio . Si viene a creare una cella galvanica in cui il ferro funge da catodo e l'elettrodo da anodo che di conseguenza si corrode preservando così l'integrità del manufatto in ferro fino a quando l'anodo non si consuma completamente. [10]
Monitoraggio della corrosione
Il monitoraggio della corrosione consiste nel misurare l'entità dei fenomeni corrosionistici durante l'utilizzo del materiale.
Ad esempio nel caso di sistemi di tubazioni si possono applicare dei sensori che forniscono una misura indiretta della velocità di corrosione, misurando ad esempio lo spessore o la resistività elettrica del materiale. In questa maniera è possibile pianificare eventuali attività di manutenzione o sostituzione dei tubi.
Note
- ^ Davis , p. 2 .
- ^ Ullmann's , cap. 1.
- ^ a b c d e Ullmann's , cap. 2.
- ^ Pedeferri , p. 27 .
- ^ a b Davis , p. 4 .
- ^ http://www.euroviti.it/200mantec/PDFDOC/Sezione_06_3.pdf
- ^ ( EN ) IUPAC Gold Book, "contact corrosion"
- ^ Pedeferri , pp. 23-25 .
- ^ IUPAC Gold Book , Non-uniform corrosion .
- ^ a b c The Columbia Encyclopedia .
- ^ L'acciaio inox a contatto con altri materiali metallici ( PDF ), su euro-inox.org . URL consultato il 2 aprile 2014 (archiviato dall' url originale il 24 settembre 2015) .
- ^ Esistono due definizioni di "metallo nobile": un metallo è detto nobile se appartiene al gruppo 11 della tavola periodica oppure se è posto in cima alla scala di nobiltà dei metalli (definita in termini di facilità alla corrosione).
- ^ a b Concise Encyclopedia of Science and Technology .
- ^ vedere UNI EN 206-1:2001 e UNI 11104:2004
- ^ Davis , p. 3 .
- ^ Aloha Incident - Corrosion AH - NACE International Archiviato il 4 maggio 2011 in Internet Archive .
- ^ Roberge , pp. 3-4 .
- ^ Roberge , p. 4 .
- ^ Corriere della Sera, Nel cerchio della morte di Guadalajara
- ^ Roberge , p. 3 .
- ^ Copia archiviata ( PDF ), su oleodinamicatoscana.it . URL consultato il 6 giugno 2011 (archiviato dall' url originale il 27 febbraio 2012) .
- ^ Questo tipo di rivestimento esterno è molto utilizzato in cantiere, dove viene applicato a mano, per proteggere esternamente le zone di giunzione saldate, normalmente sprovviste di rivestimento esterno per circa 10+10 cm a cavallo della saldatura, oppure nel rivestite i pezzi speciali in acciaio(curve, T, ecc.) costruiti in cantiere, al fine di garantire la continuità dielettrica esterna all'intera condotta interrata; raramente vengono applicati in stabilimento mediante macchina avvolgitrice. Normalmente si procede nel seguente modo a) asportazione di ogni scoria, impurità ecc. dalla zona da rivestire mediante spazzole o attrezzi analoghi; b) applicazione a pennello del primer bituminoso; c) avvolgimento a spirale di nastri adesivi di protezione dalla corrosione ( inner tape ), normalmente di colore nero, con una sovrapposizione minima di 25 mm tra gli avvolgimenti contigui e di almeno 100 mm sul manto protettivo esterno esistente; d) avvolgimento a spirale di nastri adesivi di protezione meccanica ( outer tape ), normalmente di colore bianco, procedendo nel medesimo modo del punto c) ma sovrapponendolo al rivestimento esterno esistente per almeno 50 mm.
Bibliografia
- Pietro Pedeferri, Corrosione e protezione dei materiali metallici , 2ª ed., CittàStudi, 1978, ISBN 88-251-0130-9 .
- Luciano Lazzari, Pedeferri Pietro, Ormellese Marco, Protezione catodica , Polipress, 2006, ISBN 88-7398-028-7 .
- Michele Cioffi, La pitturazione delle costruzioni di acciaio , CISIA, 1973.
- Adriano Sacco, Chimica , Adriatica Editrice.
- Pietro Pedeferri, L. Bertolini, La corrosione nel calcestruzzo e negli ambienti naturali , McGraw-Hill.
- ( EN ) Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler, Ullmann's Encyclopedia of Industrial Chemistry, "Corrosion" , 7ª ed., Wiley-VCH, 2004, DOI : 10.1002/14356007.b01_08 .
- ( EN ) Joseph R. Davis, Corrosion: understanding the basics , ASM International, 2000, ISBN 0-87170-641-5 .
- ( EN ) Pierre R. Roberge, Handbook of corrosion engineering , McGraw-Hill Professional, 2000, ISBN 0-07-076516-2 .
- ( EN ) M. McNaught, A. Wilkinson, IUPAC. Compendium of Chemical Terminology ("Gold Book") , 2ª ed., Oxford, Blackwell Scientific Publications, 1997, DOI : 10.1351/goldbook , ISBN 0-9678550-9-8 .
- ( EN ) The Columbia Encyclopedia , New York, Columbia University Press, 2008.
- ( EN ) Concise Encyclopedia of Science and Technology , New York, McGraw-Hill, 2006.
Voci correlate
- Biocorrosione
- Erosione
- Inibitore di corrosione
- Passivabilità
- Potenziale standard di riduzione
- Ruggine
- Tensocorrosione
- Inibitore volatile di corrosione
- Corrosione per turbolenza
- Sostanza corrosiva
- Corrosione del vetro
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su corrosione
Wikimedia Commons contiene immagini o altri file su corrosione
Collegamenti esterni
- ( EN ) Corrosione , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Modi di guasto per corrosione. , su materials.open.ac.uk .
- Tabella qualitativa di resistenza alla corrosione di alcuni materiali. , su engineeringtoolbox.com .
- Elettrochimica della corrosione. , su electrochem.cwru.edu . URL consultato il 16 novembre 2008 (archiviato dall' url originale il 22 ottobre 2008) .
- Corrosione dell'acciaio. , su azom.com .
- La corrosione dell'acciaio , su infobuilddossier.it (archiviato dall' url originale il 28 novembre 2011) .
- Corrosione ( PDF ) [ collegamento interrotto ] , su dim.unipd.it .
- Principali forme di corrosione ( PDF ), su unibg.it .
- ( EN ) Electrochemistry of corrosion , su electrochem.cwru.edu . URL consultato il 21 maggio 2011 (archiviato dall' url originale il 3 maggio 2009) .
- ( EN ) Kinetics of Aqueous Corrosion , su doitpoms.ac.uk .
| Controllo di autorità | Thesaurus BNCF 37941 · LCCN ( EN ) sh85033050 · GND ( DE ) 4032518-0 · BNF ( FR ) cb11975888z (data) · NDL ( EN , JA ) 00563793 |
|---|