Criptarea
Criptandii sunt compuși analogi, dar cu o structură tridimensională, eterilor coronii . Au fost descoperite de Donald J. Cram , Jean-Marie Lehn și Charles J. Pedersen , cărora le-a fost acordat Premiul Nobel pentru chimie pentru această lucrare în 1987 . Termenul „criptare” derivă din faptul că aceste lianți încorporează (sau mai degrabă retrogradează) substratul într-o criptă, îngropând-o ca într-un mormânt.
Structura
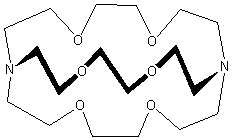
Primul și cel mai important dintre criptanzi este cel prezentat în imagine, al cărui nume IUPAC este 1,10-diaza-4,7,13,16,21,24-hexaoxabicycle [8.8.8] hexacosane. Preferăm să folosim denumirea practică Encrypting [2.2.2], unde numerele indică numărul de oxigeni (și, prin urmare, de situri de legare) în fiecare dintre cele trei brațe dintre azotii din capul de pod . Multe cripte sunt vândute sub denumirea comercială „Kriptofix”. Toate criptandele aminice prezintă o afinitate deosebită pentru metalele alcaline , o caracteristică care a permis izolarea anionilor alcaluri Na - și K - . [1] JM Lehn a realizat că prezența unei cavități macrociclice tridimensionale într-o moleculă a permis cationului nu numai să fie complexat, ci să fie „încapsulat” în interiorul cavității. Termenul „criptare” derivă din acest aspect pentru sistemele macrociclice care conțin o cavitate tridimensională. Prin urmare, din punct de vedere structural, diferența majoră dintre un macrociclu și un criptand este prezența a cel puțin unui al treilea lanț, care convertește un sistem bidimensional într-un liant tridimensional. Într-un mod destul de simplificat, este legitim să privim criptandul ca pe o moleculă macrociclică, care conține mai multe unități ciclice condensate. Caracteristica fundamentală a acestor compuși este aceea de a deține o cavitate tridimensională, în interiorul căreia pot fi încorporate molecule sau ioni, cu formarea consecventă a compușilor de incluziune . Reacțiile de coordonare sunt conduse de natura cavității, forma și dimensiunea acesteia, tipul de atomi donatori și dispunerea relativă a acestora.
Proprietate
Cavitatea internă a criptorilor funcționează ca un site de legare - sau nișă - pentru ionii „găzduiți”. Complexul cationului găzduit și al criptării gazdei se numește criptat . Criptatele formează complexe cu cationi duri , inclusiv NH 4 + , lantanide , metale alcaline și alcalino-pământoase . Spre deosebire de eterii corona tipici, criptandii se leagă atât la azot, cât și la oxigen. Mai mult, dimensiunile nișei îi conferă o selectivitate dimensională, permițând distincția între cationii metalelor alcaline.
Creșterea stabilității termodinamice a complexelor metalice, care se manifestă prin trecerea liganzilor de la monodentați la chelatori și, ulterior, la liganzi și criptanzi macrociclici este legată de structurarea progresivă a liganzilor și se datorează unei serii de cauze care contribuie .
Atât factorii topologici, care iau în considerare dispunerea spațială a ionului metalic și atomii donatorului, cât și factorii dimensionali, care afectează adaptarea ionului la cavitatea macrociclică, trebuie luați în considerare. Parametrii importanți sunt, de asemenea, rigiditatea ligandului și complementaritatea dintre atomii donatorului și ionul metalic în ceea ce privește teoria hard-soft .
Examinarea mai detaliată a proprietăților unui complex, format dintr-un macrociclu și un metal, necesită să ne gândim la un parametru structural de primă importanță: cavitatea macrociclică. Prin cavitatea unui macrociclu înțelegem, în general, acea porțiune de spațiu definită de atomii donatorilor atunci când molecula ligandului este aranjată într-o conformație adecvată pentru coordonare (atomi convergenți de donator), dar în absența ionului metalic. În general, dimensiunile depind de numărul de atomi care alcătuiesc inelul macrociclic, iar stabilitatea complexelor depinde de raportul dintre dimensiunile cavității și ionul metalic.
Într-un mod simplu și foarte schematic, se poate afirma că stabilitatea unei anumite clase de complexe devine din ce în ce mai mare odată cu creșterea numărului de inele chelate ale liganzilor considerați: vorbim despre efectul chelat. Mai mult, numeroase studii confirmă o creștere suplimentară a stabilității complexelor, la trecerea de la un ligand cu lanț deschis la un ligand macrociclic: în acest caz vorbim despre un efect macrociclic.
Model invitat-gazdă
Ca și în natura Enzimele , anticorpii , ionoforii și alte sisteme biologice sunt capabile să lege în mod selectiv substanțe specifice cu legături intermoleculare necovalente, incluzându-le în ele, același tip de selecție poate fi, de asemenea, reprodus de molecule mai mici, cum ar fi criptanzi. Această caracteristică specială este studiată în chimia gazdă / gazdă .
Utilizări
Criptandele, în ciuda costului lor și a dificultății de sinteză, oferă o selectivitate și o stabilitate de legare mai bune decât alți agenți de complexare pentru ioni alcalini, cum ar fi eterii corona. Acestea fac posibilă extragerea sărurilor altfel insolubile în solvenți organici ; cresc reactivitatea anionilor sărurilor deoarece sunt capabili să rupă perechile ionice; Ele pot fi, de asemenea, utilizate ca catalizatori ai fazei de transfer, transferând ioni de la o fază la alta. Criptandele au permis sinteza alcalinilor (conținând anioni Na - și K - ) și electridelor (unde anionul este un electron ). Acestea au fost folosite pentru a cristaliza ioni cluster cum ar fi Sn 9 2- . Mai mult, capacitatea lor de a izola ionul gazdă din blocul solventului (toate moleculele de apă din afara sferei de coordonare) și de a preveni coordonarea directă a moleculelor de apă, au permis exploatarea caracteristicilor emițătorului europiumului (o cripto- antenă numită trisbipy este folosit ).
Notă
- ^ Kim, J.; Ichimura, AS; Huang, RH; Redko, M.; Phillips, RC; Jackson, JE și Dye, JL, "Săruri cristaline de Na- și K- (alcalide) care sunt stabile la temperatura camerei", Journal of the American Chemical Society, 1999, volumul 121, paginile 10666-10667.
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre Criptando
Wikimedia Commons conține imagini sau alte fișiere despre Criptando
linkuri externe
- ( RO ) IUPAC Gold Book, „cryptand” , pe goldbook.iupac.org .