Cromat

Cromatul este anionul , rezultat din disocierea acidului cromic , în soluție apoasă este în echilibru cu dicromat sau dicromat :
La ambele specii, starea de oxidare a cromului este +6 și acestea sunt cele la care se face referire prin termenul de crom hexavalent , cunoscut de majoritatea cazurilor de poluare a mediului.
Prezența cromatului sau a dicromatului este strâns legată de pH : într-un mediu de bază predomină cromatul (galben) în timp ce la valori ridicate ale activității ionice de hidrogen (pH sub 7) predomină dicromatul portocaliu.
Pregătirea
Compușii care conțin acești anioni sunt preparați în general prin oxidarea cromului trivalent:
Reactivitate
Cromatii si dicromatii sunt oxidanti puternici ( Eº = 1,33 V ) și din acest motiv sunt utilizate pe scară largă în laboratorul de sinteză și analiză .
Împreună cu permanganat , dicromat este unul dintre principalii reactanți în redox titrari . Titrările dicromatometrice , spre deosebire de cele permanganometrice , necesită utilizarea indicatorilor, deoarece reducerea dicromatului duce la formarea Cr 3+ , ceea ce conferă soluției o culoare verde nu foarte intensă. Printre cei mai utilizați indicatori: feroina , acidul N- fenilantanilic și difenilaminosulfonatul .
Cromatul formează cu Ag + o sare insolubilă care este exploatată pentru determinarea punctului final în argentometrie conform lui Mohr . Cromul (VI) este capabil să oxideze difenilcarbazida . Produsele reacției redox, Cr (III) și difenilcarbazonă, reacționează între ele formând un complex magenta utilizat în analiza spectrofotometrică .
Compușii utilizați sunt în general săruri de potasiu .
Cromații și dicromatele reacționează cu peroxidul de hidrogen H 2 O 2 atât în medii alcaline, cât și acide, oferind produse în care una sau mai multe unități de peroxid [-O - O-] înlocuiesc unul sau mai mulți oxigen [-O -] [1] . În soluție acidă, peroxocomplexul CrO 5 albastru închis se formează imediat, adică O = Cr (O 2 ) 2 ; acest lucru în soluție apoasă este destul de instabil, dar, fiind neutru și acid Lewis , poate fi extras în eter care formează un aduct labil cu acesta. Această procedură constituie, de asemenea, o analiză pentru recunoașterea cromatilor și dicromatelor (Barresville) [2] . Prin adăugarea de piridină , care este o bază Lewis mai bună, deplasează eterul, oferind un complex de același tip, dar mai stabil.
Structura
Cromatul este un tetraedru : 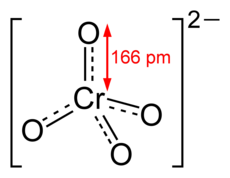
Dicromatul este format din doi tetraedri care au un vârf comun ( legătura Cr - O - Cr): 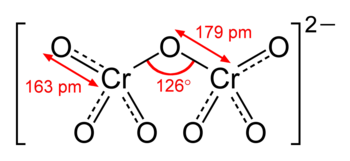
Notă
- ^ FA Cotton și G. Wilkinson,CHIMIE INORGANICĂ AVANȚATĂ , Ediția a V-a, Wiley Interscience, 1988, pp. 695 -6, ISBN 0-471-84997-9 .
- ^ G. Gioia Lobbia și G. Novara, ANALIZA CALITATIVĂ ȘI COMPLEMENTE CHIMICE , Bulgarini, 1988, p. 253.
Bibliografie
- I. Bertini și F. Mani, Chimie anorganică , CEDAM, ISBN 88-13-16199-9 .
- GD Christian, Chimie analitică , Piccin, ISBN 88-299-0464-3 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe cromat
Wikimedia Commons conține imagini sau alte fișiere pe cromat




