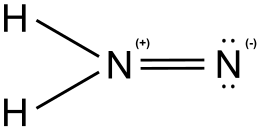
Diazen
| Diazen | |||
|---|---|---|---|
| Numele IUPAC | |||
| Diazen [1] | |||
| Denumiri alternative | |||
| Diimidă | |||
| Caracteristici generale | |||
| Formula moleculară sau brută | H 2 N 2 | ||
| Masa moleculară ( u ) | 30.02936 [2] | ||
| numar CAS | Image_3D_isodiazine | ||
| PubChem | 123195 | ||
| ZÂMBETE | N=N | ||
| Informații de siguranță | |||
| Simboluri de pericol chimic | |||
  | |||
| Atenţie | |||
| Fraze H | --- | ||
| Sfaturi P | --- [3] | ||
Diazenul , numit și diimidă sau diimină în cazul compușilor organici, este un compus anorganic de azot cu hidrogen cu formula chimică N 2 H 2 cu dublă legătură N = N, spre deosebire de hidrazină cu o legătură NN simplă. Termenul diazen este mai utilizat pentru derivații organici decât termenul diimidă. Prin urmare, azobenzen (C 6 H 5 N = NC 6 H 5) este un exemplu de diazenă organice.
Diazenul formează structura de bază a compușilor organici numiți azo . Este instabil la temperatura camerei. Diazenul solid metastabil, sub -180 ° C, are o culoare galben strălucitor. Compusul nu este sublimabil, este foarte sensibil la lumină și se descompune disproporționat în azot și hidrazină.
2 N 2 H 2 → N 2 + N 2 H 4
Structura
Există în doi izomeri geometrici , E ( trans ) și Z ( cis ) și un izomer structural numit iso .
Structura compusului E (trans) -diazen | Structura compusului Z (cis ) -diazen | Structura compusului izo-diazenic |
Sinteza și revelația
Metoda standard pentru producerea diazenă este oxidarea hidrazinei cu peroxid de hidrogen (H 2 O 2) sau cu aer. [4]
O altă metodă este decarboxilarea acidului azodicarboxilic (HOOC-N = N-COOH) conform reacției chimice: [5]
- (NCOOH) 2 → (NH) 2 + 2 CO 2
Sau prin eliminarea sulphonohydrazide (un grup de compuși organici cu R-SO 2 - NH-NH2 structură) utilizând o bază Lewis adecvat. De exemplu, folosind 2,4,6-triisopropilbenzensulfonohidrazidă hidrazidă:
(CH3 CHCH3) 3 C 6 H 2 -SO2 - NH-NH2
și prin tratarea cu bicarbonat de sodiu bază (NaHCO 3) se elimină diazenă.
Fiind un compus instabil, diazenul este generat și utilizat in-situ . Se produce un amestec de izomeri cis ( Z- ) și trans ( E- ). Acestea sunt instabile și suferă o interconversie lentă. Izomerul trans este mai stabil, dar izomerul cis este cel care reacționează cu substraturi nesaturate, deci echilibrul merge în direcția izomerului cis conform principiului lui Le Châtelier . Unele proceduri necesită adăugarea acidului carboxilic, care catalizează izomerizarea cis-trans. [6] Diazenul se descompune imediat. Mai mult, la temperaturi scăzute (aproximativ -130 ° C), izomerul trans mai stabil suferă rapid reacții de disproporționare, formând în principal hidrazină și azot gazos : [5]
- 2 HN = NH → H 2 N - NH 2 + N 2
Datorită acestei reacții de descompunere pentru a concura, reducerile cu diazen necesită de obicei o cantitate mare de reactiv precursor.
Revelatie
Substanța a fost izolată pentru prima dată în 1972 de Nils Wiberg și colaboratori. În acest caz, o termoliză a compusului de tosilhidrazidă de sodiu (un compus organic din genul sulfonohidrazidă ) a fost efectuată sub vid la 60 ° C. Tosylhydrazide a fost descompus cu un randament de 80% în diazenă și toluenesulfate de sodiu (formula Na (SO 2 C 6 H 4 CH3)). Diazenul a fost depus ca un strat galben strălucitor la -196 ° C pe un instrument de laborator numit deget rece [7] . Detectarea în gaz a fost spectrometria de masă. Prepararea a avut succes, de asemenea, cu alte tosilhidrazide ale metalelor alcaline, dar cu un randament mai mic. [8]
Diazenul poate fi dezvăluit prin reacții chimice, cum ar fi stereospecifice, cel foarte selectiv al cis-hidrogenării legăturilor C = C prin hidrazină și oxidant, mai mult, poate fi dezvăluit prin spectrometrie de masă în descompunerea în faza gazoasă și în amoniac ( NH 3 ) ambele hidrazinei (N 2 H 4 ) pe o suprafață de rodiu. [9]
Aplicații
Sinteza organică
Diazenul este uneori util ca reactiv în sinteza organică . [6]
Acest alchene hydrogenic și alchine cu eliberare selectivă a hidrogenului dintr - o parte a substratului datorită stereoselectivitate ca un adaos de H2 catalizată de sin metal. Singurul co-produs eliberat este azot gazos (N2). Deși este un sistem care necesită mai multe instrumente de laborator, utilizarea diazenului neagă necesitatea unor presiuni ridicate atunci când se utilizează hidrogen gazos și un catalizator metalic, care sunt metode costisitoare. [10]
Mecanismul de hidrogenare implică o stare de tranziție cu șase membri (C 2 H 2 N 2 ):
Reducerea selectivă
Diazenul oferă avantajul reducerii selective a alchenelor și alchinelor și nu reacționează față de multe grupuri funcționale care pot influența procesul de hidrogenare catalitică . Prin urmare, peroxizii , halogenurile de alchil și tiolii sunt tolerate de diazen, dar pot fi de obicei degradate de catalizatori metalici. Reactivul tinde să reducă alchinele și alchenele fără obstacole sau constrângeri [4] la alchena și alcanul corespunzător. [6]
Compuși derivați
Anorganic
- Un derivat al diazenului este acidul hiponitru numit și diazendiol (HO-N = N-OH).
- Compusul gazos difluor dinitrogen sau difluorodiazen (N 2 F 2 ). Are structura F - N = N - F și are izomeri geometrici.
Organic
- Compuși acizi azoici precum acidul azodicarboxilic sau diazendicarboxilic (HOOC-N = N-COOH sau N 2 (COOH) 2 ) sau amidele și esterii lor stabili, de exemplu azodicarboxilat de dietil (H 5 C 2 -OOC-N = N- COO- C 2 H 5 sau C 6 H 10 N 2 O 4 ).
- Azosilanes sunt cunoscute, cum ar fi trans-bis (trimetilsilil) diimină ((CH3) 3Si-N = N-Si (CH3) 3).
Ioni înrudiți
Diazenă are o anumită tendință de a protona ; în funcție de caz, poate suferi o protonare simplă sau dublă cu formarea cationului diazenio și respectiv a dictionului diazenio.
diazenio
Ionul diazoniu are formula chimică N 2 H + 3 cu structurile:
are o sarcină pozitivă deplasată pe atomul de azot derivat din protonația diazenului
- HN = NH + H + → H 2 N + = NH
diazenio dicatione
Ionul de diazenio dicare are formula chimică N 2 H 2+ 4 cu structurile:
are două sarcini pozitive nete situate pe atomii de azot, sarcini care derivă din dubla protonație a diazenului
- HN = NH + 2 H + → H 2 N + = N + H 2
Comparându-le cu dicationul de diazoniu , HNNH 2+ , admite cea mai puternică legătură chimică cunoscută. Acest ion provine dintr-o dublă protonație a moleculei de azot. Ordinea puterii relative a legăturii (RBSO) este de 3,38. [11]
Singurii ioni cunoscuți, dicările diazohidrofluoroniului și diazofluoroniului FNNH 2+ și FNNF 2+ , admit o rezistență a legăturii ușor mai mică. [11]
Notă
- ^(EN) Nomenclatura chimiei anorganice (Recomandările IUPAC 2005). 6ed, Cambridge (Marea Britanie), RSC / IUPAC (2005). ISBN 0-85404-438-8 . Versiune electronica.
- ^ (EN) IUPAC , Greutățile atomice ale elementelor 2017 , de la Universitatea Queen Mary din Londra.
- ^(EN) a cardului compus Depus la 16 octombrie 2019 în Internet Archive ., GESTIS .
- ^ A b (EN) Ohno, M; Okamoto, M., cis-ciclododecen , în Org. Sintetizator. , vol. 49, 1969, pp. 30, DOI : 10.15227 / orgsyn.049.0030 . Vol. Col. , vol. 5, 1973, pp. 281.
- ^ a b ( EN ) Wiberg, E.; Holleman, AF, 1.2.7: diimină, N 2 H 2 , în Inorganic Chemistry, Elsevier , 2001, p. 628, ISBN 9780123526519 .
- ^ a b c ( EN ) DJ Pasto, Diimide , Encyclopedia of Reagents for Organic Synthesis, Hoboken (New Jersey, SUA), John Wiley & Sons , 2001, DOI : 10.1002 / 047084289X.rd235 .
- ^ Vezi degetul rece
- ^ ( DE ) Nils Wiberg , Heinz Bachhuber, Gerd Fischer, Isolierung von Diimin (Izolarea diiminului) , în Angew. Chem. Ed. Int. , Vol. 84, nr. 18, 1972, pp. 889-890, DOI : 10.1002 / ange . 19720841808 .
- ^ (EN) J. Prasad; JL Gland, formarea diimidei pe suprafețele de rodiu: un studiu de spectroscopie de reacție programat de temperatură , în J. Am. Chem. Soc. , Vol. 113, nr. 5, 1991, pp. 1577-1579, DOI : 10.1021 / ja00005a020 .
- ^ (EN) Miller, EC, Hidrogenarea cu diimidă , în J. Chem. Educ , vol. 42, n. 5, 1965, pp. 254-259, DOI : 10.1021 / ed042p254 .
- ^ a b ( EN ) Kalescky Robert; Kraka Elves; Cremer Dieter, Identificarea celor mai puternice legături din chimie , în J. Phys. Chem. A , vol. 117, nr. 36, 2013, pp. 8981-8995, DOI : 10.1021 / jp406200w .
Bibliografie
- ( EN ) Frank A. Cotton , Geoffrey Wilkinson , Carlos A. Murillo și Manfred Bochmann, Advanced Inorganic Chemistry , ediția a 6-a, New York, Wiley-Interscience, 1999, ISBN 0-471-19957-5 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe diazen
Wikimedia Commons conține imagini sau alte fișiere pe diazen