heliu
| heliu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspect | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generalitate | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numele, simbolul, numărul atomic | heliu, He, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | gaze nobile | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup , punct , bloc | 18 (VIIIA) , 1 , s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitate | 0,1785 kg / m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurare electronică | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termen spectroscopic | 1 S 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți atomice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Greutate atomica | 4.002602 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raza atomică (calc.) | 128 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raza covalentă | Ora 32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raza Van der Waals | Ora 140 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configurare electronică | 1s 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| și - după nivelul de energie | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stări de oxidare | 0 (necunoscut) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structură cristalină | hexagonal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Proprietăți fizice | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stare a materiei | gazos | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fuziune | 0,95 K (-272.200 ° C ) a 2,5 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punct de fierbere | 4,24 K (-268,91 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volumul molar | 21,0 × 10 −6 m³ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia vaporizării | 84,5 J / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Căldura de fuziune | 5,23 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Viteza sunetului | 970 m / s la 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alte proprietăți | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numar CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Căldura specifică | 5193 J / (kg K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitate termică | 0,152 W / (m K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energia primei ionizări | 24,6 eV (2372 kJ / mol) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A doua energie de ionizare | 54,4 eV (5251 kJ / mol) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi mai stabili | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Pentru a afla mai multe, consultați intrarea izotopilor heliului . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| iso: izotop NA: abundență în natură TD: timpul de înjumătățire DM: modul de descompunere DE: energia de descompunere în MeV DP: produs de descompunere | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Heliul (din grecescul ἥλιος, hèlios , "soare") este elementul chimic al tabelului periodic care are He ca simbol și număr atomic 2. Este un gaz nobil incolor, inodor, insipid, netoxic și inert . Apare ca un gaz monoatomic, acest lucru se explică prin analiza diagramelor de energie OM pentru molecula (fictivă) He 2 , de fapt cei doi electroni din OM-ul anti-legătură destabilizează legătura într-o asemenea măsură încât nu este formată.
După hidrogen, acesta este al doilea cel mai ușor element și al doilea cel mai abundent din universul observabil , [1] fiind prezent în aproximativ 24% din masa elementară totală, care este de peste 12 ori masa tuturor celor mai grele elemente împreună: abundența este similară cu aceste date atât la Soare, cât și la Jupiter ; acest lucru se datorează energiei de legare nucleară foarte mare (pe nucleon ) a heliului-4 ( 4 He) în raport cu cele trei elemente care urmează heliului; această energie de legare explică, de asemenea, de ce este un produs atât al fuziunii nucleare, cât și al dezintegrării radioactive . Cea mai mare parte a heliului din univers este heliu-4 și se crede că s-a format în timpul Big Bang-ului ; cantități mari de heliu nou sunt create continuu de fuziunea nucleară a hidrogenului care are loc în stele . Este numit după zeul grec al soarelui, Helios .
Este elementul cu cel mai scăzut punct de fierbere dintre toate elementele. Se poate solidifica numai dacă este supus unor presiuni foarte mari.
Sub formă lichidă este utilizat în criogenică (cea mai mare utilizare a sa, care folosește aproximativ un sfert din producție), în special la răcirea magneților supraconductori , cu principala aplicație comercială reprezentată de echipamentele de rezonanță magnetică nucleară ; alte utilizări industriale ale heliului sunt presurizarea și purjarea gazelor, crearea unei atmosfere de protecție pentru sudarea cu arc și pentru procese particulare, cum ar fi creșterea cristalelor de siliciu ; o utilizare minoră este aceea de a ridica gazul pentru a suna baloane și dirijabile sau ca gaz în amestecuri pentru scufundări profunde. [2] La fel ca în cazul oricărui gaz a cărui densitate este diferită de cea a aerului, inhalarea unui volum mic de heliu modifică temporar timbrul și calitatea vocii umane. În cercetarea științifică, comportamentul celor două faze fluide ale heliului-4 (heliu I și heliu II), este important pentru cercetătorii care studiază mecanica cuantică (în special proprietatea superfluidității) și pentru cei care experimentează anumite fenomene, cum ar fi superconductivitatea și produsele materiei aproape de zero absolut .
Pe Pământ este relativ rar: 5,2 ppm (părți pe milion) în volum în atmosferă. Cea mai mare parte a heliului Pământului prezent astăzi a fost creată de degradarea radioactivă naturală a elementelor radioactive grele ( toriu și uraniu , în special), deoarece particulele alfa emise de aceste dezintegrări sunt compuse din nuclee de heliu-4. Acest heliu radiogen este prins în gazele naturale în concentrații mari, în jur de 7% din volum, din care este extras comercial folosind un proces de separare la temperatură scăzută numit distilare fracționată . În trecut, se credea că heliul este o resursă a pământului neregenerabilă, deoarece odată eliberat în atmosferă a scăpat cu ușurință în spațiu . [3] [4] [5] Cu toate acestea, studii recente sugerează că heliul produs adânc în pământ prin degradarea radioactivă este capabil să se colecteze în rezervele de gaze naturale în doze mai mari decât se aștepta; [6] [7] în unele cazuri poate fi eliberat prin activitate vulcanică . [8]
Istorie
Heliul a fost descoperit de francezul Jules Janssen și de englezul Norman Lockyer , independent unul de celălalt, în 1868 . Ambii studiau lumina soarelui în timpul unei eclipse și, analizând spectrul acesteia, au găsit linia de emisie a unui element necunoscut. Edward Frankland a confirmat descoperirea lui Janssen și a propus că numele elementului seamănă cu Helios zeul grec al soarelui, cu adăugarea sufixului -ium (în engleză), deoarece noul element era de așteptat să fie un metal. În 1881, Luigi Palmieri a dezvăluit pentru prima dată heliu pe Pământ din linia sa spectrală D 3 , în timp ce efectua sublimarea unui produs al erupției Vezuvului . [9] A fost izolată de Sir William Ramsay în 1895 din cleveită [1] și definitiv clasificată ca nemetalică. Chimiștii suedezi Nils Langlet și Per Theodor Cleve , care lucrau independent de Ramsay, au reușit să izoleze heliul de cleveită în același timp.
În 1907 Ernest Rutherford și Thomas Royds au reușit să demonstreze că particulele alfa sunt nuclee de heliu. În 1908 , fizicianul olandez Heike Kamerlingh Onnes a produs primul heliu lichid prin răcirea acestuia 0,9 K , o ispravă care i-a adus premiul Nobel . În 1926, unul dintre studenții săi, Willem Hendrik Keesom, a fost primul care a solidificat heliul.
Caracteristici
La temperatura și presiunea standard , heliul există doar ca gaz monatomic. Se condensează numai în condiții extreme.
Are cel mai scăzut punct de fierbere dintre toate elementele și este singurul lichid care nu poate fi solidificat doar prin scăderea temperaturii sale; rămâne lichid până la zero absolut la presiunea standard (se poate solidifica numai prin creșterea presiunii). De fapt, temperatura critică , la care nu există nicio diferență între starea lichidă și cea gazoasă, este soarele 5,3 K. Izotopul solid 3 He și izotopul 4 He sunt unice prin faptul că, prin aplicarea unei presiuni mai mari, își schimbă volumul cu mai mult de 30%.
Heliul solid există doar la o presiune de aprox 100 MPa a 15 K ; la aproximativ această temperatură, heliul suferă o tranziție între formele de temperatură înaltă și joasă, în care atomii strâns împachetați își asumă o configurație cubică , respectiv hexagonală . Toate aceste aranjamente sunt similare din punct de vedere energetic și densitate, iar motivele tranziției constau în modul în care interacționează atomii.
Heliul în mecanica cuantică

Din punct de vedere al mecanicii cuantice , heliul este al doilea cel mai simplu atom care poate fi modelat după atomul de hidrogen . Heliul este compus din doi electroni într-un orbital atomic în jurul unui nucleu care conține doi protoni și (de obicei) doi neutroni . La fel ca în mecanica clasică , niciun sistem format din mai mult de două particule nu poate fi rezolvat cu o abordare matematică analitică exactă (vezi problema cu trei corpuri ) și heliul nu face excepție. Prin urmare, este necesar să se utilizeze metode numerice și pentru a rezolva sistemul unui nucleu și a doi electroni. Această metodă de chimie computațională a fost utilizată pentru a descrie în mecanica cuantică legătura electronilor cu nucleul cu o precizie mai bună de 2% din valoarea măsurată experimental. [10] Acest model arată că fiecare electron protejează parțial nucleul de celălalt electron, astfel încât sarcina efectivă Z pe care o vede fiecare electron este de aproximativ 1,69 e , nu 2 e ca nucleu izolat.
Nucleii atomici de heliu-4 sunt emiși sub forma unei particule α de elemente radioactive care urmează acelei descompuneri. Experimentele de împrăștiere a electronilor cu energie ridicată arată că sarcina scade exponențial de la maxim la centru, la fel ca densitatea de încărcare a norului de electroni. Această simetrie reflectă un comportament fizic similar: perechea de neutroni și perechea de protoni ai nucleului respectă aceeași regulă mecanică cuantică pe care o respectă perechea de electroni (chiar dacă particulele nucleare sunt supuse unei energii de legare nucleare foarte diferite), în consecință toate aceste fermiuni ocupă o pereche de 1s orbital atomic , niciuna dintre aceste perechi orbital moment unghiular, deoarece își anulează rotirea reciprocă. Adăugarea alteia dintre oricare dintre aceste două particule necesită unghi unghiular și ar fi instabilă (de fapt nu există nuclei cu nucleoni stabili). Această configurație cu patru nucleoni este extrem de stabilă din punct de vedere energetic, iar această stabilitate explică multe dintre proprietățile heliului din natură.
Din punctul de vedere al norului de electroni, atomul de heliu este inert, adică nu formează molecule stabile. Energia de ionizare a heliului 25,6 eV este cea mai mare dintre elemente. Interacțiunea slabă dintre norii de electroni ai atomilor de heliu are ca rezultat cea mai mică temperatură de fierbere dintre toate elementele. Mai mult, este nevoie de presiune ridicată, chiar și la o temperatură apropiată de zero absolut , pentru a solidifica heliul datorită energiei punctului zero .
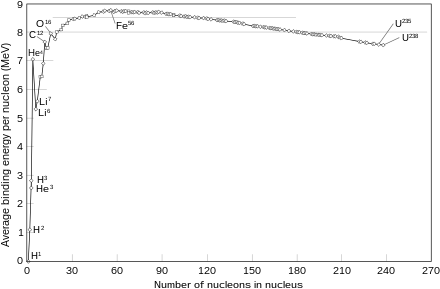
Stabilitatea particulară a nucleului de heliu-4 produce efecte similare în reacțiile atomice în care sunt implicate elemente grele sau au loc fuziuni de nuclee: în general se produc particule alfa. În reacția de fuziune a atomilor de hidrogen, producția de atomi de heliu-3 este foarte rară, deși este un izotop stabil, producția de heliu-4 este mult mai probabilă.
Stabilitatea neobișnuită a nucleului de heliu-4 este de asemenea importantă în cosmologie : explică faptul că în primele câteva minute după Big Bang , din supa inițială de protoni și neutroni liberi care a fost creată inițial în raport 6: 1 când a fost răcită la Deoarece a fost posibil să se formeze nuclei, aproape toți primii nuclei compuși formați au fost nuclei de heliu-4. Legătura cu heliu-4 a fost atât de puternică încât producția de heliu-4 a consumat aproape toți neutronii liberi în câteva minute, înainte ca aceștia să poată avea degradarea β și lăsând, de asemenea, foarte puțini care ar putea forma elemente mai grele, cum ar fi litiu , beriliu și bor . De fapt, energia de legare pe nucleon a heliului-4 este mai mare decât cea a tuturor acestor elemente, de fapt, odată ce heliul este format din punct de vedere energetic, nu este posibil să se formeze elementele 3, 4 și 5. Este nu este posibil din punct de vedere energetic ca doi atomi de heliu să se contopească în elementul următor cu cea mai mică energie pe nucleon, carbonul . Cu toate acestea, acest proces, din cauza lipsei de elemente intermediare, necesită ca trei atomi de heliu să se ciocnească simultan (a se vedea procesul trei alfa ). Dar, în realitate, în câteva minute după Big Bang, nu s-a putut forma o cantitate semnificativă de carbon, înainte ca expansiunea universului să-l aducă la o temperatură și presiune în care fuziunea heliului în carbon nu mai era posibilă. Acest lucru a făcut universul timpuriu cu un raport hidrogen / heliu similar cu universul așa cum se observă în prezent (3 părți de hidrogen la o parte de heliu-4 în masă), cu aproape toți neutronii din univers prinși în interiorul heliului-4 .
Toate elementele mai grele (inclusiv cele pe care se bazează planete solide precum Pământul, dar și pur și simplu carbonul necesar vieții) au fost produse după Big Bang în stele suficient de fierbinți pentru a contopi atomii de heliu. Toate elementele, altele decât hidrogenul și heliul, reprezintă în prezent doar 2% din masa nucleară a universului. Heliul-4, pe de altă parte, reprezintă 23% din toată materia obișnuită, fără a lua în considerare materia întunecată .
Disponibilitate
În univers
Heliul este al doilea cel mai răspândit element din univers după hidrogen, formează peste 25% din masă în stele și joacă un rol important în reacțiile responsabile de cantitatea de energie pe care o produc. Abundența heliului este prea mare pentru a fi explicată doar de reacțiile din stele, dar este în concordanță cu modelul Big Bang și se crede că cea mai mare parte a heliului din univers s-a format în următoarele trei minute. .
Pe pamant
Acest element este prezent în atmosfera terestră într-un raport de 5 ppm și se găsește ca produs al degradării unor minerale radioactive. Mai exact, se găsește în minereuri de uraniu și toriu , inclusiv cleveita (primul mineral în care s-a descoperit prezența heliului), pitchblendă , carnotită și monazit ; este produs din aceste elemente prin dezintegrare radioactivă, sub formă de particule alfa. Se găsește și în unele ape minerale (1 parte de heliu la o mie de apă în unele izvoare islandeze), în gaze vulcanice și în anumite zăcăminte de gaze naturale din Statele Unite (din care provine cea mai mare parte a heliului produs comercial). Heliul poate fi sintetizat prin bombardarea atomilor de litiu sau bor cu protoni la viteză mare.
În timpul unei forări petroliere din 1903 în Kansas , s-a obținut un gheizer gazos format din azot (72%), metan (15%), hidrogen (1%) și 12% dintr-un gaz neidentificat. [11] Datorită analizei ulterioare, Cady și McFarland au descoperit că 1,84% din această probă era heliu. [12] [13] Acest lucru a arătat că, în ciuda penuriei sale pe Pământ, heliul a fost concentrat în cantități mari în Marea Câmpii SUA, disponibile pentru extracție ca subprodus al gazelor naturale . [14] Această descoperire a permis Statelor Unite să devină cel mai mare producător de heliu din lume.
De mulți ani, Statele Unite au produs mai mult de 90% din heliu din lume, utilizabil comercial; restul cantităților provin de la plante din Canada , Polonia , Rusia și alte țări. La mijlocul anilor nouăzeci, o nouă fabrică de 17 milioane de metri cubi în Arzew , Algeria , a început operațiunile cu producție suficientă pentru a satisface întreaga cerere europeană.
În 2004-2006 au fost construite încă două fabrici, una în Ras Laffan în Qatar și cealaltă în Skikda în Algeria , deși la începutul anului 2007 Ras Laffen funcționa la 50%, iar Skikda încă nu a început producția. Algeria a devenit rapid al doilea mare producător de heliu. [15]
În această perioadă a crescut atât consumul, cât și costul producerii heliului. [16]
Potrivit lui Robert Coleman Richardson de la Universitatea Cornell din Ithaca , având în vedere ratele actuale ale consumului de heliu și disponibilitatea limitată a acestui element pe Pământ, există riscul ca rezervele de heliu să se epuizeze până în 2040. [17]
Compuși
Heliul este cel mai inert dintre elemente, dar sub influența descărcărilor electrice sau a bombardamentului de electroni formează compuși alături de tungsten , iod , fluor , sulf și fosfor . De asemenea, poate da naștere la excimeri și excimlex dacă este supus excitației.
Compușii de heliu deosebit de instabili sunt numiți " heliide ". [1]
Forme
Heliul lichid ( 4 He ) vine sub două forme: 4 He I și 4 He II, care au un punct de tranziție la 2,174 K. 4 He I peste acest punct este un lichid normal, dar 4 He II sub această temperatură este diferit de orice alt fluid obișnuit.
Când este răcit sub 2,189 K la presiune normală, așa-numitul punct lambda , devine un superfluid cunoscut sub numele de heliu lichid II. Contrar heliului lichid I normal, acesta are multe caracteristici neobișnuite datorită efectelor cuantice; comportamentul său a fost unul dintre primele exemple ale unui efect cuantic care operează pe o scară macroscopică care au fost observate. Această tranziție are loc la o temperatură și mai scăzută în 3 He , deoarece efectul se bazează pe condensarea bosonilor , dar nucleii de 3 He sunt fermioni care nu se pot condensa individual, ci doar în perechi bosonice. Deoarece transformarea este de ordinul al doilea superior, fără căldură latentă în punctul lambda, cele două forme lichide nu coexistă niciodată.
Heliul II are o vâscozitate foarte scăzută [1] și o conductivitate termică mult mai mare decât toate celelalte substanțe (de aproximativ 800 de ori mai mare decât cea a cuprului [1] ). Mai mult, heliul II prezintă un efect termomecanic (efect de fântână): dacă două vase care conțin heliu II sunt conectate printr-un capilar și unul dintre cele două vase este încălzit, se obține un flux de heliu către vasul încălzit. Pe de altă parte, în efectul mecanocaloric, un flux forțat de heliu II printr-un capilar produce răcirea heliului II părăsind capilarul. Impulsurile de căldură introduse în heliu II se propagă prin lichid în același mod ca impulsurile sonore, fenomen care a fost supranumit „al doilea sunet”. Suprafețele solide în contact cu heliul II sunt acoperite cu o peliculă cu grosime cuprinsă între 50 și 100 de atomi, acest film produce un flux fără frecare al lichidului; în consecință, este imposibil să se conțină heliu II într-un vas deschis fără ca lichidul să curgă din el. Transportul masei prin pelicula de heliu II are loc la o cantitate constantă care depinde de temperatură. În cele din urmă, o masă de heliu II nu se rotește unitar, încearcă să-l rotească produc mici vârtejuri fără frecare prin lichid.
Izotopi
Cel mai comun izotop al heliului este 4 He , care are un nucleu format din doi protoni și doi neutroni . Această configurație este extraordinar de stabilă prin faptul că are un număr magic de nucleoni , adică un număr pentru care sunt dispuși să formeze o coajă completă. Multe nuclee grele se descompun emițând nuclee de 4 He în conformitate cu un proces numit descompunere alfa și, prin urmare, nucleele de heliu sunt numite și particule alfa ; cea mai mare parte a heliului de pe Pământ este generată de acest proces. Izotopul 3 He este mai ușor decât cel mai comun 4 He, deoarece nucleul său este compus din 2 protoni și un neutron (3 nucleoni) împotriva celor 2 protoni și 2 neutroni (4 nucleoni) din 4 He. 3 El nu este radioactiv și este practic necunoscut pe suprafața Pământului, deoarece sursele de heliu produc doar 4 He ca particule alfa și heliul atmosferic scapă în spațiu în timpuri geologice relativ scurte. He-6, un izotop extrem de instabil care se descompune în Li-6 în 806,7 ms de radiația beta negativă, este, de asemenea, sintetizat în laborator.
Aplicații

Deși cel mai cunoscut domeniu de utilizare a heliului este umflarea baloanelor, acesta este, însă, utilizarea care beneficiază de el într-o măsură mai mică. Aplicația principală este în criogenie: în principal pentru răcirea magneților supraconductori pentru imagistica prin rezonanță magnetică (RMN) și spectrometre RMN .
Enumerăm unde este utilizat în principal heliul [18] (se referă la prognozele din SUA în 2014).
Criogenica Atmosferă controlată Sudare Măsurarea scurgerilor de gaz Amestecuri pentru scafandri Alte
Criogenica
Punctul său de fierbere extrem de scăzut face ca heliul lichid să fie un agent frigorific ideal pentru multe aplicații cu temperatură extrem de scăzută, cum ar fi magneții supraconductori și cercetarea criogenică , unde sunt necesare temperaturi apropiate de zero absolut . Amestecurile de 3 He și 4 He sunt utilizate în răcitoarele de diluare .
Atmosferă controlată
Heliul este utilizat ca gaz inert în creșterea cristalelor de siliciu și germaniu și în producția de titan și zirconiu . Fiind un gaz ideal , inert, cu o viteză ridicată a sunetului și un coeficient ridicat de expansiune adiabatică, este utilizat și în tunelurile de sunet supersonice . [19]
Sudarea cu tungsten cu gaz inert
Heliul este utilizat ca gaz de protecție în sudarea cu arc pe materiale care sunt la temperatura de sudare sau contaminate sau slăbite de aer sau azot. Pentru unele materiale care au o conductivitate termică ridicată, cum ar fi cuprul și aluminiul, se preferă utilizarea heliului în loc de argonul mai ieftin.
Măsurarea scurgerilor de gaz
Heliul este utilizat în mod obișnuit pentru localizarea scurgerilor în sistemele de vid. Heliul difuzează prin solide de trei ori mai repede decât aerul, este utilizat ca gaz de urmărire pentru a detecta scurgerile de gaz în sistemele cu vid ridicat. Instrumentul utilizat este un spectrometru de masă cvadrupolar plasat în camera de vid. În exterior, heliul este pulverizat în diferite părți, iar spectrometrul de masă detectează rapid prezența heliului. Chiar și găurile care au un debit de numai 10 −9 mbar · L / s (10 −10 Pa · m 3 / s) pot fi găsite. Spectrometrele de masă pentru heliu sunt simple prin faptul că având o mică masă de heliu, este ușor deviat. În cazul unor scurgeri mult mai mari, camera de vid este presurizată cu heliu și găura este căutată cu un instrument manual extern. În sistemele de vid, utilizarea contoarelor de scurgere este o practică obișnuită: acestea sunt adesea numite detectoare de scurgere în jargon sau mai des cu denumirea în engleză de scurgere de scurgere . Majoritatea materialelor izolatoare din sticlă și plastic sunt permeabile la heliu, care uneori creează confuzie între defecte reale și aparente.
Amestecuri pentru scafandri
Heliul utilizat în respirație nu provoacă narcoză în ape adânci precum azotul, din acest motiv amestecuri precum trimix , heliar sau heliox sunt utilizate pentru scufundări la adâncime mare pentru a reduce efectele narcozei, care se agravează odată cu adâncimea. [20] [21] Un efect nedorit al heliului este schimbarea tonului vocii, așa-numitul „efect de rață”, care face ca comunicările cu scafandrii să fie dificil de înțeles. Odată cu adâncimea crește presiunea și, de asemenea, crește densitatea gazului respirat, iar utilizarea heliului care are o greutate atomică redusă reduce considerabil efortul respirator prin scăderea densității amestecului. Acest lucru reduce numărul Reynolds al debitului, care reduce debitul turbulent și crește debitul laminar, prin urmare este nevoie de mai puțină muncă pentru respirație. [22] [23] La adâncimi mai mari de 120m, scafandrii care respiră amestecul de heliu-oxigen încep să tremure și au capacitate psihomotorie scăzută, simptome ale sindromului nervos de înaltă presiune . [24]
A zbura

Deoarece heliul este mai ușor decât aerul, aeronavele și baloanele sunt umflate cu heliu pentru a le ridica. Hidrogenul ar fi mai ușor și, prin urmare, ar oferi o împingere mai mare în sus și, de asemenea, are o permeabilitate mai mică între membrane, dar heliul este neinflamabil [1] și este un gaz ignifug . În rachete, heliul este utilizat ca mijloc de separare și mișcare între combustibil și combustibil. De asemenea, este utilizat pentru curățarea rezervoarelor de combustie și combustibil înainte de lansare și pentru răcirea în prealabil a hidrogenului lichid înainte de lansare. Pentru a-și face o idee, Saturn V din programul Apollo avea nevoie de 370.000 m 3 de heliu înainte de lansare.
Utilizări științifice
- Heliul este utilizat ca gaz inert în cromatografia de gaze . [1]
- Heliul este utilizat ca gaz pentru măsurători de densitate absolută, în picnometre speciale de heliu care măsoară volumul obiectelor mai mic decât porozitatea realizabilă de heliu.
- L'uso dell'elio riduce l'effetto distorcente delle variazioni di temperatura tra le lenti in alcuni telescopi , dovuto a estremamente basso indice di rifrazione . Questo metodo è usato specialmente nei telescopi solari in cui un tubo sotto vuoto sarebbe troppo pesante. [25]
- L'età delle rocce e dei minerali che contengono uranio e torio possono essere misurate dalla quantità di elio intrappolato, è questa una tecnica recente. [26]
- Nei laboratori scientifici si fa largo uso di elio liquido per studiare le proprietà dei solidi a bassa temperatura. Il Large Hadron Collider (LHC) al CERN usa 96 tonnellate di elio per mantenere a 1,9 K i magneti superconduttori nel tunnel di 27 km che contiene l'acceleratore. [27]
Usi vari
- I laser a elio-neon è un piccolo tipo di laser a gas che produce un raggio rosso, è stato molto utilizzato nel passato come lettore di codice a barre e puntatore laser , prima di essere rimpiazzato quasi dappertutto dai più economici diodi laser .
- Essendo un gas inerte con elevata conducibilità termica , trasparente ai neutroni, e che non forma isotopo radioattivi all'interno dei reattori nucleari , l'elio è usato come mezzo di trasporto del calore in alcuni reattori raffreddati a gas. [1]
- L'elio mescolato con un gas inerte più pesante come lo xeno , è utilizzato per refrigerazione termoacustica in quanto ha un elevato coefficiente di dilatazione adiabatica e un piccolo numero di Prandtl . [28] L'uso di un gas inerte come l'elio ha vantaggi per l'ambiente sui sistemi di refrigerazione tradizionali che contribuiscono alla distruzione dell'ozono e causano il riscaldamento globale. [29]
- L'elio è anche usato in alcuni dischi rigidi . [30]
- Viene anche utilizzato per gonfiare palloncini in mylar o lattice per usi ludici. Data la sua scarsa densità è un ottimo (ma costoso) sostituto dell'idrogeno. A differenza dell'idrogeno presenta il vantaggio di non essere infiammabile.
- Viene utilizzato in campo medico diluito con l'aria ambientale per effettuare dei test spirometrici per verificare la capacità di riempimento dei polmoni.
- L'elio liquido trova un utilizzo crescente nell' imaging a risonanza magnetica , in quanto l'applicazione medica di questa tecnologia si sta diffondendo nell'ultimo periodo.
Fenomeni acustici
Dal momento che la velocità del suono è inversamente proporzionale alla radice quadrata della massa molecolare , nell'elio si ha una velocità che è circa tre volte quella nell'aria. L' altezza (o la frequenza fondamentale) di un suono prodotto da una cavità riempita da un gas è proporzionale alla velocità del suono in quel gas. Inalando dell'elio si innalza la frequenza di risonanza della laringe, rendendo la voce acuta e stridula. [31] Al contrario, inalando gas dal peso molecolare più elevato come lo xeno o l' esafluoruro di zolfo si ha l'effetto opposto.
Precauzioni
Un ambiente saturo di elio, come di altri gas, è, per converso, povero di ossigeno, tale condizione indipendentemente dalla tossicità del gas anche se assente come in questo caso, può portare all' asfissia . Contenitori riempiti con elio gassoso a 5–10 K devono essere conservati come se contenessero elio liquido a causa dell'alto incremento di pressione che risulta dal riscaldamento del gas a temperatura ambiente . L'elio liquido ha un calore latente di evaporazione molto piccolo per cui è praticamente impossibile ustionarsi con esso, né è facile venirne a contatto: ma oggetti che si sono portati alla temperatura dell'elio liquido ed estratti rapidamente possono causare ustioni.
Note
- ^ a b c d e f g h elio , in Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana.
- ^ Helium: Up, Up and Away? Melinda Rose, Photonics Spectra, October 2008. Accessed February 27, 2010. For a more authoritative but older 1996 pie chart showing US helium use by sector, showing much the same result, see the chart reproduced in "Applications" section of this article.
- ^ Steve Connor, Why the world is running out of helium , in The Independent , London, 23 agosto 2010. URL consultato il 16 settembre 2013 .
- ^ Ethan Siegel, Why the World Will Run Out of Helium , su Starts With A Bang , Scienceblogs.com, 12 dicembre 2012. URL consultato il 16 settembre 2013 .
- ^ Witchalls, Clint (18 August 2010) Nobel prizewinner: We are running out of helium . New Scientist .
- ^ David Szondy, We may not be running out of helium after all , su www.gizmag.com . URL consultato il 1º aprile 2016 .
- ^ Press release: The unbearable lightness of helium... , su EurekAlert , European Association of Geochemistry, 19 agosto 2015. URL consultato il 1º aprile 2016 (archiviato dall' url originale il 6 settembre 2015) .
- ^ Ian Sample, Huge helium gas find in east Africa averts medical shortage , in The Guardian , 28 giugno 2016.
- ^ Luigi Palmieri, La riga dell'Helium apparsa in una recente sublimazione vesuviana , in Rendiconto dell'Accademia delle scienze fisiche e matematiche (Napoli) , vol. 20, 1881, p. 223.
« Raccolsi alcun tempo fa una sostanza amorfa di consistenza butirracea e di colore giallo sbiadato sublimata sull'orlo di una fumarola prossima alla bocca di eruzione. Saggiata questa sublimazione allo spettroscopio, ho ravvisato le righe del sodio e del potassio ed una lineare ben distinta che corrisponde esattamente alla D 3 che è quella dell'Helium. Do per ora il semplice annunzio del fatto, proponendomi di ritornare sopra questo argomento, dopo di aver sottoposta la sublimazione ad una analisi chimica. » . - ^ Thayer Watkins, The Old Quantum Physics of Niels Bohr and the Spectrum of Helium: A Modified Version of the Bohr Model , su sjsu.edu , San Jose State University.
- ^ McFarland, DF, Composition of Gas from a Well at Dexter, Kan , in Transactions of the Kansas Academy of Science , vol. 19, 1903, pp. 60–62, DOI : 10.2307/3624173 . URL consultato il 22 luglio 2008 .
- ^ The Discovery of Helium in Natural Gas , su acswebcontent.acs.org , American Chemical Society , 2004. URL consultato il 20 luglio 2008 (archiviato dall' url originale il 20 maggio 2006) .
- ^ Cady, HP, McFarland, DF, Helium in Natural Gas , in Science , vol. 24, n. 611, 1906, p. 344, DOI : 10.1126/science.24.611.344 , PMID 17772798 .
- ^ Cady, HP; McFarland, DF, Helium in Kansas Natural Gas , in Transactions of the Kansas Academy of Science , vol. 20, 1906, pp. 80–81, DOI : 10.2307/3624645 . URL consultato il 20 luglio 2008 (archiviato dall' url originale il 27 maggio 2012) .
- ^ Smith, EM; Goodwin, TW; Schillinger, J., Challenges to the Worldwide Supply of Helium in the Next Decade ( PDF ), in Advances in Cryogenic Engineering , 49 A, n. 710, 2003, pp. 119–138, DOI : 10.1063/1.1774674 . URL consultato il 20 luglio 2008 (archiviato dall' url originale il 25 giugno 2008) .
- ^ Karen H. Kaplan, Helium shortage hampers research and industry , in Physics Today , vol. 60, n. 6, American Institute of Physics , giugno 2007, pp. 31–32, DOI : 10.1063/1.2754594 . URL consultato il 20 luglio 2008 (archiviato dall' url originale il 4 dicembre 2008) .
- ^ Allarme elio, riserve agli sgoccioli , su corriere.it , Corriere della Sera .
- ^ US Department of the Interior, US Geological Survey, Helium , in Mineral Commodity Summaries 2014 , 2015, pp. 72–73.
- ^ IE Beckwith e CG Miller, Aerothermodynamics and Transition in High-Speed Wind Tunnels at Nasa Langley , in Annual Review of Fluid Mechanics , vol. 22, 1990, pp. 419–439, Bibcode : 1990AnRFM..22..419B , DOI : 10.1146/annurev.fl.22.010190.002223 .
- ^ B. Fowler, KN Ackles e G. Porlier, Effects of inert gas narcosis on behavior—a critical review , in Undersea Biomedical Research Journal , vol. 12, 1985, pp. 369–402, PMID 4082343 . URL consultato il 23 novembre 2017 (archiviato dall' url originale il 25 dicembre 2010) .
- ^ Thomas, JR, Reversal of nitrogen narcosis in rats by helium pressure , in Undersea Biomed. Res. , vol. 3, 1976, pp. 249–59, PMID 969027 . URL consultato il 6 agosto 2008 (archiviato dall' url originale il 6 dicembre 2008) .
- ^ SJ Butcher, L. Richard L., JR Mayne, TC Hartley, SR Petersen, Impaired exercise ventilatory mechanics with the self-contained breathing apparatus are improved with heliox ,European Journal of Applied Physiology, 101 , pp. 659–69, (2007)
- ^ Heliox21 , su bochealthcare.co.uk , Linde Gas Therapeutics, 27 gennaio 2009.
- ^ WL, Jr. Hunger e PB Bennett, The causes, mechanisms and prevention of the high pressure nervous syndrome , in Undersea Biomed. Res. , vol. 1, 1974, pp. 1–28, ISSN 0093-5387 , OCLC 2068005 , PMID 4619860 . URL consultato il 23 novembre 2017 (archiviato dall' url originale il 25 dicembre 2010) .
- ^ Jakobsson, H., Simulations of the dynamics of the Large Earth-based Solar Telescope , in Astronomical & Astrophysical Transactions , vol. 13, 1997, pp. 35–46, Bibcode : 1997A&AT...13...35J , DOI : 10.1080/10556799708208113 .
- ^ http://www.geo.arizona.edu/~reiners/arhdl/longer.htm U-Th/He dating, the University of Arizona Geochronology Lab
- ^ LHC: Facts and Figures ( PDF ), su visits.web.cern.ch , CERN (archiviato dall' url originale il 6 luglio 2011) .
- ^ Belcher, James R., Slaton, William V., Raspet, Richard, Bass, Henry E. e Lightfoot, Jay, Working gases in thermoacoustic engines , in The Journal of the Acoustical Society of America , vol. 105, 1999, pp. 2677–2684, Bibcode : 1999ASAJ..105.2677B , DOI : 10.1121/1.426884 , PMID 10335618 .
- ^ Makhijani, Arjun e Gurney, Kevin,Mending the Ozone Hole: Science, Technology, and Policy , MIT Press, 1995, ISBN 0-262-13308-3 .
- ^ HGST balloons disk capacity with helium-filled 6TB drive
- ^ Andrea Frova, La scienza di tutti i giorni , BUR Biblioteca Univ. Rizzoli, 2010, p. 164, ISBN 978-88-17-04442-4 .
Bibliografia
- Francesco Borgese, Gli elementi della tavola periodica. Rinvenimento, proprietà, usi. Prontuario chimico, fisico, geologico , Roma, CISU, 1993, ISBN 88-7975-077-1 .
- R. Barbucci, A. Sabatini e P. Dapporto, Tavola periodica e proprietà degli elementi , Firenze, Edizioni V. Morelli, 1998 (archiviato dall' url originale il 22 ottobre 2010) .
Altri progetti
-
 Wikiquote contiene citazioni di o su elio
Wikiquote contiene citazioni di o su elio -
 Wikizionario contiene il lemma di dizionario « elio »
Wikizionario contiene il lemma di dizionario « elio » -
 Wikimedia Commons contiene immagini o altri file su elio
Wikimedia Commons contiene immagini o altri file su elio
Collegamenti esterni
- Elio , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- Elio , su sapere.it , De Agostini .
- ( EN ) Elio , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 19752 · LCCN ( EN ) sh85060043 · GND ( DE ) 4132459-6 · BNF ( FR ) cb11978648w (data) · NDL ( EN , JA ) 00563132 |
|---|








