Metilen glicol
| Metilen glicol | |
|---|---|
| Numele IUPAC | |
| metandiol | |
| Denumiri alternative | |
| Metilen glicol Formaldehidă monohidrat | |
| Caracteristici generale | |
| Formula moleculară sau brută | CH 4 O 2 |
| Masa moleculară ( u ) | 48,041 g / mol |
| Aspect | lichid incolor |
| numar CAS | |
| Numărul EINECS | 207-339-5 |
| PubChem | 79015 |
| ZÂMBETE | C(O)O |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.199 g / cm −3 (la -19 ° C) |
| Constanta de disociere a acidului (pKa) la {{{Ka_temperature}}} K. | 13.29 |
| Temperatura de fierbere | 193 ° C () |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
   | |
| Pericol | |
| Fraze H | 350 - 341 - 301 + 311 + 331 - 314 - 317 - 335 - 370 |
| Sfaturi P | 201 - 280 -304 + 310 + 340 - 303 + 361 + 353 - 305 + 351 + 338 -308 + 310 [1] |
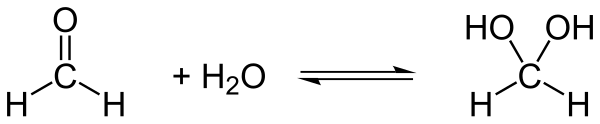
Metilenglicol, pe scurt GM, cu numele metandiol sistematic, este un compus organic descris cu formula structurală HO-CH2 - OH sau H 2 C (OH) 2 sau H (H 2 CO) OH. Este cel mai simplu diol geminal . Metanediolul este considerat a fi forma hidratată a formaldehidei H 2 CO. La temperatura camerei nu se întâlnește sub formă pură, ci ca soluții apoase, unde coexistă cu concentrații minime de formaldehidă , pe scurt FA, și diverși oligomeri și polimeri . Compusul este bine caracterizat chimic, dar așa cum este tipic pentru diolii geminali, este chimic instabil și reactiv, în ciuda faptului că este stabil termodinamic la temperaturi ≤ 300 K. [2] În apă este stabilizat de legăturile de hidrogen ale moleculelor de apă din jur. Datorită instabilității sale inerente, nu poate fi izolat ca compus părinte din soluțiile sale apoase. De asemenea, din acest motiv, este considerat echivoc de către comunitatea științifică ca o „ soluție de formaldehidă” în apă. [3] [4]
Clarificarea cu privire la adevărata natură a „soluțiilor de formaldehidă” în apă și distincția clară între metilen glicol și formaldehidă a apărut când între 2007 și 2010, pentru a nu fi supus restricțiilor de reglementare [5] referitoare la prezența formaldehidei în produse cosmetice, pentru îndreptarea părului, unii producători au declarat metilen glicol ca ingredient, cu denumirea INCI : METILEN GLICOL. [6] [7] [8] [9] [10]
Dificultatea de a izola compusul, precum și suprapunerea analitică cu formaldehidă au determinat, de asemenea, ambiguitatea în definirea caracteristicilor sale fizico-chimice. Temperatura sa de fierbere calculată teoretic este de 193,7 ± 8,0 ° C la 760 mmHg sau 131,16 în funcție de metoda de calcul, comparativ cu 94 ÷ 100 ° C detectată experimental în soluția sa saturată în apă, fără metanol.
Soluțiile apoase de GM sunt incolore și au un miros caracteristic înțepător. Sunt comercializate sub denumirea de "formalină" și clasificate în mod convențional ca soluții de formaldehidă în apă; în mod eronat, deoarece formaldehida din apă nu este într-adevăr o soluție și că solubilitatea formaldehidei în apă este de fapt minimă. Motivul acestei erori este că formaldehida, puternic electrofilă, datorită densității scăzute a electronilor pe atomul de carbon, reacționează ușor chiar și cu nucleofili slabi și, în absența altor parteneri nucleofili, reacționează foarte repede cu apa, formând GM pe care îl dizolvă mult mai bine în apă decât formaldehida.
Formalina, produsă tehnic prin oxidarea catalitică a metanolului , conține de obicei aproximativ 59% metilen glicol, produs prin hidratarea a aproximativ 37% (greutate / greutate) de formaldehidă (gazoasă). Procentul diferit depinde de greutatea moleculară diferită a celor 2 compuși, 48 pentru GM versus 30 pentru AF.
Reacția de hidratare a formaldehidei este foarte rapidă: timpul de înjumătățire al formaldehidei gazoase în contact cu apa este de 70 de milisecunde. [11] [12]
Orice eliminare a formaldehidei dintr-o soluție apoasă de GM, de exemplu prin metoda analitică comună bazată pe prinderea cu 2,4-dinitrofenilhidrazină (2,4-DNPH) care are o afinitate mare pentru formaldehidă și nu are afinitate pentru GM, schimbă imediat echilibru prin forțarea eliberării de formaldehidă din metilen glicol producând o reducere a concentrației acestuia din urmă. Reacția de deshidratare a GM, cu eliberarea consecventă de formaldehidă, este simultană, dar mult mai lentă. [13] [14] Poate fi accelerat, la temperaturi mai ridicate și pH mai mic. [14] [15] [16] [17]
Echilibru
GM este un produs al hidratării formaldehidelor și acționează ca un rezervor de formaldehidă în apă, deoarece hidratarea sa este reversibilă în diferite condiții.
Constanta de echilibru pentru hidratarea formaldehidei a fost calculată în diferite studii, variind de la 1000 la 2400 la temperatura camerei . [6] [18] [12] [19] [20] [21] [22] Variația mare a rezultatelor este atribuită dificultăților analitice în detectarea concentrației AF în apă, calculate înainte de anul 2000, în special cu absorbția vârful grupării carbonil din banda UV. Toate cele mai recente cercetări și cu RMN spectroscopica măsurătorile au raportat valori ale constantei de echilibru K h ≥ 2000 la 20 ° C [23] [24]
Echilibrul metandiol / formaldehidă este dinamic și depinde, în special, de temperatură, densitatea soluției, pH-ul și prezența altor substanțe dizolvate sau solvenți.
| Formaldehidă / metandiol în echilibru în apă în funcție de temperatură. [11] | |||||
|---|---|---|---|---|---|
| Temperatura (° C) | 20 | 30 | 40 | 50 | 60 |
| Formaldehidă (%) | 0,06 | 0,1 | 0,14 | 0,21 | 0,3 |
| Metanediol (%) | 99,94 | 99,9 | 99,86 | 99,79 | 99,7 |
| Notă: - K h constantă de echilibru chimic calculată ca raportul dintre viteza de hidratare și cea a deshidratării. | |||||
Polimerizare
În soluții apoase, metilen glicolul H (H 2 CO) OH, mai lent, polimerizează formând oligomeri relativ solubile și polimeri insolubil în apă.
Având în vedere reactivitatea FA mai mare decât cea a GM, este probabil ca FA să participe la reacțiile de oligomerizare ale GM
Formarea oligomerilor și polimerilor depinde de concentrația de GM în apă. În soluțiile cu concentrații scăzute nu se formează polimeri. [27]
Oligomerul predominant este di-oximetilen glicolul [28] : .
Constanta de echilibru în dimerizarea GM a fost estimată a fi egală cu: 5 ÷ 7. [29]
Într-un mediu acid, acești oligomeri liniari pot cicliza.
Formele ciclice ar fi stabilizate prin legături de hidrogen intramoleculare fără a necesita participarea moleculelor de apă din jur.
Trioxanul (H 2 CO) 3 ar fi rezultatul ciclizării intramoleculare a unui trimer liniar de metilen glicol. [30] [31] [32]
Pentru a inhiba polimerizarea cu apă a GM, se folosesc în general săruri de metanol și tampon.
Sistemul (formaldehidă, metilen glicol, oligomeri, apă) este complex și reglementat prin echilibrări multiple între diferiții compuși și diferitele faze. Adăugarea de metanol duce la formarea altor compuși și a altor echilibre.
Analize
S-a susținut că metodele analitice oficiale pentru determinarea formaldehidei libere ar produce rezultate artificiale ridicate, deoarece GM se transformă în FA în timpul analizei și, prin urmare, valorile măsurate nu reflectă nivelurile reale de formaldehidă liberă.
În sistemele apoase, tehnicile normale în care FA este prins cu un reactiv care produce compuși detectabili cu spectrofotometrie furnizează substanțial valori ale FA eliberate de GM.
Datele din literatura de specialitate cu privire la constanta de echilibru chimic a hidratării formaldehidei au fost obținute din absorbția UV specifică a grupării carbonil la aproximativ 290 nm [18] [21] , polarografia pulsului [33] [34] , datele termochimice [22] sau din raportul constantelor ratei de hidratare și deshidratare care au fost determinate prin metode independente. [14] Rata de deshidratare a GM a fost măsurată prin diferite grupuri prin prinderea chimică a formaldehidei, prin derivați de hidrazină și prin măsurarea spectrofotometrică a produselor de hidrazină.
Pentru a măsura procentul real de conversie GM în FA, se pot utiliza concentrațiile exacte de GM, FA "libere", precum și dimerii, trimerii și oligomerii pentru lanț mai lung în soluții GM în apă 13 C-RMN și 1 H -RMN, deoarece este standardizat pentru titrarea cu formiat de sodiu . [35] [36] [37] [38]
Această tehnică de analiză care nu perturbă echilibrul chimic, în plus față de care necesită costuri ridicate și perioade, pentru analiza 13C-RMN durează câteva ore, produce relativ confuz spectrele în soluții de concentrație ridicată, de aceea pentru a detecta vârfuri relativ clare și distincte se folosesc soluții diluate.
Existența formaldehidei libere în faza de vapori în soluție apoasă nu a fost raportată, dar nu poate fi exclusă din cauza limitărilor analitice. [39]
Formol
Formalina, descrisă în general și denumită o soluție de formaldehidă 35/37% în apă, la temperatura camerei este de fapt un sistem complex cu mai multe substanțe în echilibru în care formaldehida este la concentrații minime, mai mici de 0,5%. Pentru a reduce formarea de polimeri insolubili, 7/15% metanol este de obicei adăugat la sistemul formaldehidă / apă. Formalina fără metanol trebuie păstrată la temperaturi> 30 ° C pentru a inhiba polimerizarea.
Nu există o definiție specifică a compoziției formalinei în care prezența și concentrația metanolului sunt arbitrare. Mai multe farmacopee (USP, PhEU, BP etc.) au inclus „soluția de formaldehidă” printre monografiile reactivilor, cu teste de identificare pe bază de azotat de argint și amoniac.
Formaldehida reacționează nu numai cu apa, ci și cu metanolul, formând alte substanțe dintre care principala este hemiforma. [40] [41] [42]
Prezența metanolului reduce polimerizarea GM în apă, dar introduce noi oligomeri metoxilați.
Alți alcooli cu lanț scurt au fost de asemenea utilizați pentru a reduce polimerizarea în apă. [43] [4]
În funcție de utilizări specifice, de exemplu ca fixativ, formalina poate fi diluată și tamponată cu săruri tampon , de exemplu. hidrogen fosfat disodic + dihidrogen fosfat de sodiu . Formalin, pe lângă faptul că este unul dintre cele mai importante produse intermediare ale industriei chimice, este utilizat pe scară largă: în industria hârtiei pentru a îmbunătăți rezistența și calitatea hârtiei; în tabacarie, pentru tăbăcirea pieilor; în industria textilă, pentru a crește rezistența produselor la cute și contracții; în producția de rășini și îngrășăminte, în agricultură, pentru prelucrarea semințelor și rădăcinilor, dezinfectarea solului și a animalelor; în medicină și pentru îmbălsămare ca dezinfectant și pentru conservarea preparatelor anatomice sau a țesuturilor biologice.
Compoziţie
Compoziția efectivă a formalinei tipice nu este ușor de definit. Cu concentrații de metanol de la 7 la 15%, se stabilesc echilibre multiple între AF și monomeri și oligomeri care se formează în amestecul apă / metanol. Prezența metanolului inhibă polimerizarea în apă, dar favorizează formarea speciilor metoxilate.
Aceste echilibre multiple sunt dinamice, iar concentrația oligomerilor detectabilă fără a perturba echilibrul cu spectrometrie RMN variază în funcție de temperatură, pH și concentrația GM. Rata de polimerizare atât în apă cât și în metanol scade prin diluarea formalinei.
Principalele componente sunt metilen glicol, apă, metanol , hemiformal, di-oximetilen glicol, metoxiglicol, polioximetilen glicoli, polimetoxiglicol. [44] [45] [46] [47] [48] [49]
| Concentrațiile (mol / dm 3 ) în formalină diluate în apă la diferite temperaturi [44] | |||||||
|---|---|---|---|---|---|---|---|
| diluare formalină / apă | 1: 3 | 1: 6 | |||||
| Temperatura | 20 ° C | 283 K | 293 K | 303 K | 313 K | 323 K | |
| Cascadă | H 2 O | 47.4 | 50.6 | 50,7 | 50.6 | 50.3 | 50.4 |
| Metilen glicol | OH-CH2 - OH | 1,67 | 1.306 | 1.182 | 1.343 | 1.393 | 1.518 |
| Metanol | CH 3 OH | 0,356 | 0,203 | 0,273 | 0,215 | 0,226 | 0,258 |
| Hemifomal | CH3 O-CH2 - OH | 0,590 | 0,281 | 0,295 | 0,215 | 0,216 | 0,241 |
| Di-oximetilen glicol | HO-CH 2 -O-CH 2 -OH | 0,339 | 0.130 | 0,157 | 0,090 | 0,389 | 0,207 |
| Di-metoxiglicol | CH3 O-CH2-CH2 - OH | 0,0965 | 0,025 | 0,025 | 0,019 | 0,021 | 0,018 |
Prezență în natură
GM este practic omniprezent în lumea animalelor și a plantelor; fiind găsit la toate speciile în care a fost detectată prezența formaldehidei în apă. Dianionul, metandiolatul, este considerat a fi un intermediar în reacția încrucișată Cannizzaro.
Compusul are o anumită relevanță pentru astrochimie. În spațiu este stabil termodinamic. [2] [50]
Disputele toxicologice
Definiția unui profil toxicologic al metilenglicolului distinct de cel al formaldehidei a făcut obiectul unor controverse. În concluzie, metilen glicolul și formaldehida sunt molecule diferite și se pot distinge clar; unul la temperatura camerei este un gaz, celălalt un lichid; una aparține familiei aldehidelor, cealaltă celei a glicolilor; una este foarte reactivă, cealaltă este relativ stabilă atât din punct de vedere chimic, cât și termodinamic [14] ; unul este clasificat ca fiind cancerigen pentru o formă specifică de cancer nazal, celălalt nu.
Până în 2019, în UE și în multe țări din întreaga lume care au adoptat restricții similare cu cele din regulamentul european privind produsele cosmetice, formaldehida a fost expres interzisă ca ingredient cosmetic, în timp ce metilen glicolul nu a fost. Metilen glicolul nu a trebuit nici măcar să respecte restricțiile pentru conservanții "care eliberează formaldehidă".
Între 2010 și 2014, diferite organisme de reglementare pentru siguranța produselor cosmetice, datorită strânsei relații dintre formaldehidă și metilen glicol și conversia lor reciprocă rapidă într-un echilibru dinamic, au definit metilen glicol și diferiți oligomeri prezenți în formalină ca „echivalent formaldehidic” din punct de vedere toxicologic, deoarece acestea sunt disponibile imediat pentru orice reacții tipice de formaldehidă în soluții apoase, inclusiv orice sistem biologic care conține apă. Prin urmare, din punct de vedere practic și de precauție, este justificat să se considere orice amestec apos de formaldehidă gazoasă și metilen glicol ca conținând „echivalenți de formaldehidă”, de preferință exprimat ca concentrație de formaldehidă. [7] [6] [3] Termenul „echivalenți formaldehidici” ar descrie în mod adecvat faptul că metilen glicolul este transformat continuu în formaldehidă gazoasă în soluție apoasă și invers și că echilibrul poate fi ușor mutat prin încălzire, vaporizare și orice altă afecțiune care crește sau scade cantitatea de gaz formaldehidic. [7] [3] [6]
Abia în 2019, metilen glicolul și paraformaldehida au fost introduse printre substanțele expres interzise în produsele cosmetice din UE [9] , în timp ce FDA din SUA nu a adoptat restricții specifice. [51]
„Echivalența” toxicologică între metilen glicol și formaldehidă ar depinde practic de dificultatea analitică de a distinge cele două substanțe fără a perturba echilibrul care le leagă și de faptul că în trecut s-au efectuat multe teste toxicologice cu soluții în apă de metilen glicol. , considerate totuși soluții de formaldehidă.
Contestarea conceptului de echivalență se bazează pe diferența substanțială chimico-fizică dintre cele două substanțe, precum și pentru reactivitatea mai mică a GM comparativ cu cea a FA. Chiar și în faza de vapori la 200 ° C doar 49% din GM se deshidratează formând FA. [52] Mai mult, diverse studii ar concluziona că tocmai umiditatea și absorbția formaldehidei în apă reduc unele dintre riscurile specifice ale substanței gazoase. [53] [54]
Notă
- ^ card de formalină saturat cu cel puțin 10% metanol pe [Gestis https://gestis-database.dguv.de/data?name=010520 ]
- ^ a b David R. Kent, Susanna L. Widicus și Geoffrey A. Blake, Un studiu teoretic al conversiei metandiolului în fază gazoasă în formaldehidă , în The Journal of Chemical Physics , vol. 119, nr. 10, 8 septembrie 2003, pp. 5117-5120, DOI : 10.1063 / 1.1596392 . Adus la 14 februarie 2021 .
- ^ a b c Declarația de poziție a panoului de formaldehidă al Consiliului american de chimie privind conținutul de formaldehidă al anumitor produse de îngrijire a părului ( PDF ), la americanchemistry.com .
- ^ a b Walker, J. Frederic (Joseph Frederic), (1903- ...)., Auteur., Formaldehidă , Robert E. Krieger, 1975,OCLC 491563407 . Adus la 18 februarie 2021 .
- ^ CosIng - Cosmetics - FORMALDEHYDE- Comisia Europeană , pe ec.europa.eu . Adus la 16 februarie 2021 .
- ^ a b c d ( EN ) Ivan J. Boyer, Bart Heldreth și Wilma F. Bergfeld, Evaluare modificată a siguranței formaldehidei și metilenglicolului utilizate în cosmetică , în International Journal of Toxicology , vol. 32, 6_suppl, 1 noiembrie 2013, pp. 5S - 32S, DOI : 10.1177 / 1091581813511831 . Adus la 13 februarie 2021 .
- ^ a b c ( EN ) (PDF) Comitetul științific pentru siguranța consumatorilor. Avizul SCCS privind metilenglicolul care trebuie considerat echivalent cu formaldehida , pe ResearchGate . Adus la 13 februarie 2021 .
- ^ (EN) Center for Food Safety and Applied Nutrition, Hair-Smoothing Products that Release Formaldehyde When Heating in FDA, 8 septembrie 2020. Accesat la 13 februarie 2021.
- ^ a b CosIng - Cosmetice - METILEN GLICOL - Comisia Europeană , pe ec.europa.eu . Adus la 18 februarie 2021 .
- ^ Uniunea Europeană - Comitetul științific: Metilen glicol în plăcile de îndreptat părul ( PDF ), pe ec.europa.eu .
- ^ a b ( NL ) Absorbția formaldehidei în apă - [Document PDF] , pe fdocuments.nl . Adus pe 9 februarie 2021 .
- ^ a b JGM Winkelman, OK Voorwinde și M Ottens, Cinetica și echilibrul chimic al hidratării formaldehidei , în Chemical Engineering Science , vol. 57, nr. 19, 2002-10, pp. 4067-4076, DOI : 10.1016 / s0009-2509 (02) 00358-5 . Adus pe 9 februarie 2021 .
- ^ S. Inaba, Studiu teoretic al descompunerii metandiolului în soluție apoasă. , în Revista de chimie fizică. A , 2015, DOI : 10.1021 / acs.jpca.5b02846 . Adus la 8 februarie 2021 .
- ^ a b c d ( EN ) JG M Winkelman, M Ottens și AAC M Beenackers, Cinetica deshidratării metilen glicolului , în Chemical Engineering Science , vol. 55, nr. 11, 1 iunie 2000, pp. 2065-2071, DOI : 10.1016 / S0009-2509 (99) 00498-4 . Adus la 8 februarie 2021 .
- ^ MG Burnett, Mecanismul reacției cu ceas de formaldehidă: deshidratarea cu metilen glicol , în Journal of Chemical Education , vol. 59, nr. 2, 1982-02, p. 160, DOI : 10.1021 / ed059p160 . Adus la 8 februarie 2021 .
- ^ (EN) Michael Albert, Baudilio Coto García și Cornelius Kreiter, Vapor-lichid și echilibrele chimice ale amestecurilor formaldehidă-apă , în Jurnalul AIChE, vol. 45, n. 9, 1999-09, pp. 2024-2033, DOI : 10.1002 / aic.690450919 . Adus la 11 februarie 2021 .
- ^ N. Matubayasi, Saiko Morooka și M. Nakahara, Echilibru chimic al formaldehidei și metandiolului în apă fierbinte: Analiza energiei libere a efectului solventului , 2007, DOI : 10.1016 / J.MOLLIQ.2006.12.002 . Adus la 8 februarie 2021 .
- ^ a b c Iliceto, A. (1954). Pe sistemul apă-formaldehidă. Nota VI. Echilibrul fazelor lichide și gazoase. Gazz.Chim. Ital., 84, 536-552.
- ^ WAE McBryde, Determinarea spectrofotometrică a constantelor de echilibru în soluție ☆ , în Talanta , vol. 21, n. 10, 1974-10, pp. 979-1004, DOI : 10.1016 / 0039-9140 (74) 80130-x . Adus la 12 februarie 2021 .
- ^ HC Sutton și TM Downes, Rata de hidratare a formaldehidei în soluție apoasă , în Journal of the Chemical Society, Chemical Communications , n. 1, 1972, p. 1, DOI : 10.1039 / c39720000001 . Adus la 12 februarie 2021 .
- ^ a b Andreas A. Zavitsas, Mark Coffiner și Thomas Wiseman, Hidratare reversibilă a formaldehidei. Parametri termodinamici , în Jurnalul de chimie fizică , vol. 74, nr. 14, 1970-07, pp. 2746-2750, DOI : 10.1021 / j100708a003 . Adus la 14 februarie 2021 .
- ^ a b ( EN ) WMD Bryant și John B. Thompson, Termodinamica chimică a polimerizării formaldehidei într-un mediu apos , în Journal of Polymer Science Partea A-1: Polymer Chemistry , vol. 9, nr. 9, 1971, pp. 2523-2540, DOI : 10.1002 / pol.1971.150090909 . Adus la 14 februarie 2021 .
- ^ Edwards, J., 2013. Analiza cantitativă 1 H RMN Formalin - Observarea formaldehidei libere ca metanal, Process NMR Associates LLC.
- ^ a b Michal Rivlin, Uzi Eliav și Gil Navon, Studii RMN privind echilibrul și ratele de reacție în soluții apoase de formaldehidă , în Jurnalul de chimie fizică B , vol. 119, nr. 12, 12 martie 2015, pp. 4479-4487, DOI : 10.1021 / jp513020y . Adus la 14 februarie 2021 .
- ^ J.Masamoto, K. Matsuzaki - Un studiu al echilibrului vapor-lichid al amestecurilor de formaldehidă-apă folosind teoria chimică , la jstage.jst.go.jp .
- ^ Michael Ott, Reaktionskinetik und Destillation formaldehydhaltiger Mischungen , 2004, ISBN 978-3-8322-3336-5 ,OCLC 76544476 . Adus la 16 februarie 2021 .
- ^ Raphael Kircher, Niklas Schmitz și Jürgen Berje, Constantă de echilibru chimic generalizat a oligomerizării formaldehidelor , în Industrial & Engineering Chemistry Research , vol. 59, nr. 25, 24 iunie 2020, pp. 11431-11440, DOI : 10.1021 / acs.iecr.0c00974 . Adus la 8 februarie 2021 .
- ^ Numit și dimetilen glicol de către unii autori
- ^ (EN) Michal Rivlin, Uzi Eliav și Gil Navon, Studii RMN ale ratelor de reacție și ale echilibrului în soluțiile apoase de formaldehidă , în Jurnalul de chimie fizică B, vol. 119, nr. 12, 26 martie 2015, pp. 4479-4487, DOI : 10.1021 / jp513020y . Adus la 14 februarie 2021 .
- ^ (EN) IN Balashov, Krasnov și VL SM Danov, Formarea oligomerilor ciclici în soluții apoase concentrate de formaldehidă în Journal of Structural Chemistry, vol. 42, n. 3, 1 mai 2001, pp. 398-403, DOI : 10.1023 / A: 1012408904389 . Adus la 12 februarie 2021 .
- ^ Thomas Grützner, Hans Hasse și Neven Lang, Dezvoltarea unui nou proces industrial pentru producerea trioxanului , în Știința ingineriei chimice , vol. 62, nr. 18-20, 2007-09, pp. 5613-5620, DOI : 10.1016 / j.ces.2007.01.047 . Adus la 12 februarie 2021 .
- ^ (EN) Michael Maiwald, Thomas Grützner și Eckhard Ströfer, Spectroscopia cantitativă RMN a amestecurilor tehnice complexe utilizând o referință virtuală: echilibrele chimice și cinetica reacției formaldehide-apă-1,3,5-trioxan , în Chimie analitică și bioanalitică, vol. . 385, nr. 5, pp. 910-917. Adus la 16 februarie 2021 .
- ^ Nils Landqvist, Agnar P. Nygaard și Roger Bonnichsen, Despre polarografia formaldehidei. , în Acta Chemica Scandinavica , vol. 9, 1955, pp. 867-892, DOI :10.3891 / acta.chem.scand.09-0867 . Adus la 16 februarie 2021 .
- ^ Valenta, P. Oszillographischestrom-Spannungs-Kurven III. Un- tersuchung Des Formaldehyds in Gepuffertem Milieu. Colectarea. Ceh.Chem. Comun. 1960,25, 853−86
- ^ Michal Rivlin, Uzi Eliav și Gil Navon, studii RMN despre cinetica schimbului de protoni în soluții apoase de formaldehidă , în Journal of Magnetic Resonance , vol. 242, 2014-05, pp. 107-112, DOI : 10.1016 / j.jmr.2014.02.021 . Adus la 12 februarie 2021 .
- ^ ( EN ) 1- (13) -C-SODIUM-FORMATE - 13C RMN - Schimbări chimice - SpectraBase , pe spectrabase.com . Adus la 16 februarie 2021 .
- ^ Spectroscopie RMN , pe organicchemistrydata.org . Adus la 16 februarie 2021 .
- ^ Detlef Emeis, Willem Anker și Klaus-Peter Wittern, Quantitative13C RMN Spectroscopic Studies on the Equilibrium of Formaldehyde with its Releasing Cosmetic Conservants , în chimia analitică , vol. 79, nr. 5, 2007-03, pp. 2096-2100, DOI : 10.1021 / ac0619985 . Adus la 16 februarie 2021 .
- ^ (EN) Michael Albert, Baudilio Coto García și Cornelius Kreiter, Vapor-lichid și echilibrele chimice ale amestecurilor formaldehidă-apă , în Jurnalul AIChE, vol. 45, n. 9, 1999, pp. 2024-2033, DOI : 10.1002 / aic.690450919 . Adus la 8 februarie 2021 .
- ^ (EN) Liuyi Yin, Li Yongbo și Yanlin He, Modelarea echilibrului fazei vapor-lichid pentru soluțiile apoase de formaldehidă și electrolit , în The Journal of Chemical Thermodynamics, vol. 150, 2020-11, p. 106181, DOI : 10.1016 / j.jct.2020.106181 . Adus la 11 februarie 2021 .
- ^ (EN) Xianming Zhang Yufeng Hu și Weiting But, echilibre vapori-lichide și model chimic pentru formaldehidă + 1,3,5-trioxan + metanol + sare + apă sistem , în echilibru de fază fluidă, vol. 507, 2020-03, p. 112434, DOI : 10.1016 / j.fluid.2019.112434 . Adus la 11 februarie 2021 .
- ^ (EN) Detcheberry M., P. dEstrac și X. -M. Meyer, Echilibru de fază al soluțiilor apoase de formaldehidă și metanol: abordare îmbunătățită folosind UNIQUAC cuplat la echilibre chimice , în Fluid Phase Equilibria , vol. 392, 25 aprilie 2015, pp. 84-94, DOI : 10.1016 / j.fluid.2015.02.011 . Adus la 18 februarie 2021 .
- ^ (EN) Jürgen Berje, Jakob Burger și Hans Hasse, studiu spectroscopic RMN al echilibrelor chimice în soluții de formaldehidă, apă și butinediol , în AIChE Journal, vol. 63, nr. 10, 2017-10, pp. 4442-4450, DOI : 10.1002 / aic.15788 . Adus la 16 februarie 2021 .
- ^ a b Katarzyna Z. Gaca, John A. Parkinson și Leo Lue, Speciația de echilibru în formaldehidă moderat concentrată - metanol - soluții de apă investigate folosind spectroscopia de rezonanță magnetică nucleară 13C și 1H , în cercetarea chimiei industriale și inginerești , vol. 53, nr. 22, 18 februarie 2014, pp. 9262-9271, DOI : 10.1021 / ie403252x . Adus la 8 februarie 2021 .
- ^ Stanley J. Green și Raymond E. Vener, Vapor-Liquid Equilibria of Formaldehyde-Metanol-Water , în Industrial & Engineering Chemistry , vol. 47, nr. 1, 1955-01, pp. 103-109, DOI : 10.1021 / ie50541a037 . Adus pe 9 februarie 2021 .
- ^ Michael Ott, Hartmut Schoenmakers și Hans Hasse, Distilarea amestecurilor care conțin formaldehidă: experimente de laborator, modelare și simulare a stadiului de echilibru , în Inginerie chimică și procesare: intensificarea proceselor , vol. 44, nr. 6, 2005-06, pp. 687-694, DOI : 10.1016 / j.cep.2003.09.011 . Adus la 11 februarie 2021 .
- ^ (EN) Stefano Brandani Brandani Vincenzo și Gabriele Di Giacomo, Sistemul formaldehidă-apă-metanol: termodinamica soluțiilor solvatate și asociate în cercetarea chimiei industriale și inginerești, vol. 31, n. 7, 1992-07, pp. 1792-1798, DOI : 10.1021 / ie00007a026 . Adus la 11 februarie 2021 .
- ^ ( EN ) Michael Albert, Baudilio Coto García e Christian Kuhnert, Vapor–liquid equilibrium of aqueous solutions of formaldehyde and methanol , in AIChE Journal , vol. 46, n. 8, 2000-08, pp. 1676-1687, DOI : 10.1002/aic.690460818 . URL consultato l'11 febbraio 2021 .
- ^ Niklas Schmitz, Fabian Homberg e Jürgen Berje, Chemical Equilibrium of the Synthesis of Poly(oxymethylene) Dimethyl Ethers from Formaldehyde and Methanol in Aqueous Solutions , in Industrial & Engineering Chemistry Research , vol. 54, n. 25, 1º luglio 2015, pp. 6409-6417, DOI : 10.1021/acs.iecr.5b01148 . URL consultato l'11 febbraio 2021 .
- ^ ( EN ) Robin T. Garrod, Susanna L. Widicus Weaver e Eric Herbst, Complex Chemistry in Star‐forming Regions: An Expanded Gas‐Grain Warm‐up Chemical Model , in The Astrophysical Journal , vol. 682, n. 1, 20 luglio 2008, pp. 283-302, DOI : 10.1086/588035 . URL consultato il 13 febbraio 2021 .
- ^ ( EN ) FDA Emails: Scientists Pushed To Ban Formaldehyde-Based Hair-Smoothing Treatments as Early as 2015 , su EWG . URL consultato il 18 febbraio 2021 .
- ^ ( EN ) R. Golden e M. Valentini, Formaldehyde and methylene glycol equivalence: Critical assessment of chemical and toxicological aspects , in Regulatory Toxicology and Pharmacology , vol. 69, n. 2, 2014-07, pp. 178-186, DOI : 10.1016/j.yrtph.2014.03.007 . URL consultato il 12 febbraio 2021 .
- ^ E. Priha, J. Liesivuori e H. Santa, Reactions of hydrated formaldehyde in nasal mucus , in Chemosphere , vol. 32, n. 6, 1996-03, pp. 1077-1082, DOI : 10.1016/0045-6535(96)00015-x . URL consultato il 14 febbraio 2021 .
- ^ Jeffry D. Schroeter, Jerry Campbell e Julia S. Kimbell, Effects of endogenous formaldehyde in nasal tissues on inhaled formaldehyde dosimetry predictions in the rat, monkey, and human nasal passages , in Toxicological Sciences: An Official Journal of the Society of Toxicology , vol. 138, n. 2, 2014-04, pp. 412-424, DOI : 10.1093/toxsci/kft333 . URL consultato il 14 febbraio 2021 .
Voci correlate
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su Metandiolo
Wikimedia Commons contiene immagini o altri file su Metandiolo


![{\ displaystyle {\ ce {H2CO + H2O <=> [1: 2000] H2C (OH) 2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f00bf5aca3ff2cf6c7ee0bb92bb394b2ca46b6f)





![{\ displaystyle {\ ce {H (H2CO) OH + H (H2CO) OH << => [6: 1] H (OCH2) 2 OH + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/617ffdf9525610770aac5d0088d7075f780946cb)
![{\ displaystyle {\ ce {H (H2CO) _3OH <=> [H +] (H2CO) _3 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20e5053027d726c27c8143b87b3913e6c91e71e3)

