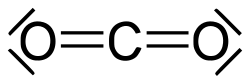Gilbert Lewis
Această intrare sau secțiune referitoare la chimiștii americani nu citează sursele necesare sau cei prezenți sunt insuficienți . |
Gilbert Newton Lewis ( 23 octombrie 1875 Weymouth - 23 martie 1946 Berkeley ) a fost un chimist american .
Biografie
A fost școlit acasă de părinți în stilul englezesc de sistem de îndrumare. La vârsta de 24 de ani a absolvit licența în chimie la Universitatea Harvard. După studii s-a mutat în Germania, unde a rămas doi ani, după care a fost angajat de guvernul filipinez. A petrecut 7 ani în Filipine în calitate de superintendent al Biroului de greutăți și măsuri, unde a găsit tineri talentați interesați să facă cercetări. Acest grup a fost reunit de Richard M. Noyes, care își obținuse doctoratul la Ostwald de la Universitatea din Leipzig. Acest centru de cercetare a oferit un mediu stimulativ în care Lewis a petrecut șapte ani în care a muncit din greu și a făcut cercetări cu privire la determinarea sistematică a potențialilor de electrod ai atomilor.
La întoarcerea în Statele Unite, a început să lucreze la Massachusetts Institute of Technology . A părăsit Institutul de Tehnologie din Massachusetts când a fost numit președinte al Departamentului de Chimie și Decan al Colegiului de Chimie al Universității din California în 1912, funcție pe care a ocupat-o 34 de ani până la moartea sa. Lewis credea că un departament de chimie ar trebui să predea și să avanseze simultan știința, amintindu-și întotdeauna că trebuie acordată mult mai multă atenție principiilor fundamentale decât aplicațiilor tehnice; de fapt, lecțiile sale s-au bazat în principal pe bazele chimiei, mai degrabă decât pe experimente. În timpul prelegerilor și experimentelor sale, Lewis a ales să lucreze cu cei mai remarcabili studenți decât cu studenții obișnuiți.
În jurul anului 1902, Lewis a început să folosească desene cu atomi cubici în notele sale de curs, în care colțurile cubului reprezintă pozițiile posibile ale electronilor. În 1916, Lewis a publicat o teorie despre unele legături chimice numite legături covalente (pure, polare și ionice), care sunt generate de metale care nu au patru sau mai mulți electroni de valență și nu ajung la opt. Cercetările lui Lewis vor fi publicate și diseminate de Irving Langmuir în jurul anului 1923.
Această teorie se bazează pe dispunerea electronilor în jurul nucleului. Lewis a aplicat această teorie mai întâi hidrogenului, care poate avea cel mult doi electroni care înconjoară nucleul, legătura dintre doi atomi este rezultatul împărțirii unei perechi de electroni aduși de cei doi atomi. Potrivit lui Lewis, teoriile legăturilor covalente pentru atomul de hidrogen ar putea fi valabile și generalizabile pentru restul atomilor. Atomii cu mai mulți electroni pot împărți electroni de valență pentru a forma legături covalente prin completarea octetului lor de electroni. Legătura covalentă poate fi simplă dacă se împarte o singură pereche de electroni, dublă dacă se împart două perechi de electroni și triplă dacă se împart trei perechi. De exemplu, molecula de hidrogen creează o legătură simplă, cea a dublului carbon și cea a azotului triplu. Aceste legături se pot forma și între diferiți atomi, respectând în același timp regula octetului.
Gilbert Lewis, împreună cu Merle Randall , au publicat în 1923 celebra carte despre termodinamică care reprezintă și astăzi un exemplu de neegalat de claritate și rigoare științifică. El a introdus termenul fugacitate pentru a descrie comportamentul gazelor reale și regula Lewis și Randall este utilizată pentru a descrie comportamentul amestecurilor ideale de gaze reale. În același an și-a dezvoltat celebra sa teorie despre acizi și baze . În 1926 Lewis a inventat termenul de foton pentru a indica cuantumul de lumină al lui Einstein.
În 1933 a exploatat electroliza apei obișnuite pentru a produce apă grea pentru prima dată, care joacă un rol important în tehnologia centralelor nucleare de fisiune. Încă din 1902 descoperise că chimia elementelor grupurilor principale putea fi explicată printr-un model în care electronii din atomi erau dispuși la vârfurile cuburilor concentrice. Astfel, cu nouă ani înainte de modelul atomic al lui Rutherford , s-a născut regula octetului .
În ciuda numeroaselor investigații științifice, Lewis a devenit faimos pentru teoria legăturilor chimice și pentru definiția acidului și a bazei. În istoria americană nu există un om de știință care să fi contribuit cel mai mult la toate domeniile chimiei decât Gilbert Newton Lewis. Gândirea sa era cu mult înaintea timpului său și teoriile sale au avut o influență profundă asupra chimiei moderne. Spre deosebire de unii dintre contemporanii săi, măreția lui Gilbert Newton Lewis nu a fost niciodată suficient de celebrată și nu a câștigat niciodată Premiul Nobel.
Lewis și-a continuat cercetările până la moartea bruscă a unui atac de cord pe 23 martie 1946, în laboratorul său, înconjurat de pahare și eprubete.
Regula octetului
Regula octetului s-a aplicat unui atom de oxigen . Regula octetului este o regulă generală introdusă de Gilbert Newton Lewis pentru a explica într-un mod aproximativ formarea legăturilor chimice între atomi, strict utilizabile doar pentru atomii grupurilor principale (cele cu numerotare romană) ale tabelului periodic. Aceasta explică starea particulară a stabilității unui atom, adică atunci când acesta are nivelul electronic complet complet.
Această regulă ne permite să cunoaștem numărul de electroni pe care un atom îl are în interiorul unui orbital . Se afirmă că primul orbital nu trebuie să conțină mai mult de 2 electroni, în timp ce orbitalele ulterioare nu trebuie să conțină mai mult de 8 electroni. Electronii prezenți în ultimul orbital sunt numiți „ electroni de valență ”.
De exemplu, regula octetului afirmă că oxigenul trebuie să aibă 6 electroni de valență, deoarece are 8 electroni care trebuie aranjați pe 2 orbitali: primul are 2 electroni și al doilea are 6. Există atomi care au o configurație electronică instabilă, ei sunt numite elemente de tranziție , adică numărul electronilor lor de valență poate varia, un exemplu este fierul : poate avea 2 sau 3 electroni de valență. Pentru a cunoaște numărul de electroni de valență dintr-un atom nu este necesar să se aplice de fiecare dată regula octetului: puteți căuta atomul pe tabelul periodic al elementelor și puteți vedea cărui grup îi aparține (este indicat prin cifra romană) .
Structura lui Lewis
Structura Lewis a fost proiectată și denumită în onoarea chimistului Gilbert Lewis. Propune să reprezinte cu un desen bidimensional structura unei molecule bazată în principal pe regula octetului .
Este posibil să trasați o moleculă cu structura Lewis urmând trei puncte:
- atomii sunt dispuși aproximativ în spațiu, indicat pur și simplu de litera (ele) elementului lor. Este important să urmați o anumită geometrie, aranjând eventual elementul cu un singur atom în centru și cele legate de acesta cu simetrie centrală față de acel atom;
- legăturile sunt reprezentate de o linie (inițial întotdeauna simplă, apoi dublă sau triplă în funcție de tipul legăturii) care leagă un atom de altul; fiecare legătură reprezintă, de asemenea, doi electroni;
- electronii de valență sunt trasați ca puncte și sunt punctul culminant al teoriei structurii Lewis: trebuie numărat numărul total de electroni disponibili în nivelurile de valență (de exemplu, în H 2 O, electronii sunt 1 + 1 + 6 = 8, în NO 2 - , electronii sunt 5 + 6 + 6 + 1 = 18), apoi scalați cei utilizați pentru a construi legăturile și începeți să distribuiți electronii în jurul fiecărui atom pentru a satisface regula octetului pentru fiecare (adică fiecare atom, între legături și electroni nepartajați, trebuie să ajungă la numărarea a opt). În acest scop, fiecare legătură pe care o face atomul satisface deja doi dintre cei opt electroni necesari. Pentru a aranja electronii nepartajați, este necesar să începeți mai întâi cu satisfacerea elementelor mai electronegative. În caz de defecțiuni, eșecul în atingerea octetului este compensat prin realizarea de legături duble sau triple sau prin mutarea atomului în poziții mai ușoare.
Viata privata
La 21 iunie 1912, s-a căsătorit cu Mary Hinckley Sheldon, fiica unui profesor de limbi romanice de la Harvard. Au avut doi fii, care amândoi au devenit profesori de chimie, și o fiică.
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre Gilbert Lewis
Wikimedia Commons conține imagini sau alte fișiere despre Gilbert Lewis
linkuri externe
- Gilbert Lewis , pe Sapienza.it , De Agostini .
- ( EN )Gilbert Lewis , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- (EN) Gilbert Lewis , de la Mathematics Genealogia Project , North Dakota State University.
- ( RO ) Lucrări de Gilbert Lewis , în Open Library , Internet Archive .
| Controlul autorității | VIAF (EN) 30.534.916 · ISNI (EN) 0000 0001 1050 2475 · LCCN (EN) n86864516 · GND (DE) 118 976 575 · NLA (EN) 35.303.406 · NDL (EN, JA) 00.447.581 · WorldCat Identities (EN) lccn- n86864516 |
|---|