Glicoliza
Glicoliza este un proces metabolic prin care, în condiții de anaerobioză nestrictă , o moleculă de glucoză este împărțită în două molecule de piruvat pentru a genera molecule cu energie mai mare, cum ar fi 2 molecule de ATP și 2 molecule de NADH pentru fiecare glucoză moleculă utilizată. Termenul derivă din greaca veche , γλυκύς ( glykýs ), care înseamnă „dulce”, și λύσις ( lýsis ), care înseamnă „despărțire”. [1]
Glicoliza sau calea Embden - Meyerhof - Parnas este cel mai exploatat mijloc de a obține energie în natură, în principal datorită anaerobioticității sale, deși nu este cea mai eficientă . [2] Probabil s-a dezvoltat odată cu primii procarioti [3] [4] în urmă cu aproximativ 3,5 miliarde de ani. [5] [6]
Într-o primă fază a procesului, constând în cinci etape, se consumă energie (faza de consum energetic) pentru a obține molecule ale unui derivat de glucoză cu energie mai mare ( gliceraldehidă-3-fosfat ) din glucoză, care va fi apoi transformată în faza următoare , compus din alte cinci etape, în molecule semnificativ mai puțin energetice de piruvat , cu o producție de energie mai mare decât cea consumată în prima fază. Prin urmare, procesul în ansamblu este de tip catabolic , adică în care moleculele mai complexe și energetice sunt transformate în molecule mai simple și mai puțin energice, cu acumulare de energie.
Reacțiile care alcătuiesc glicoliza, fiecare catalizată de o anumită enzimă , au loc în citoplasma celulelor ; numai în unele protozoare [7], cum ar fi tripanosomii [8] [9] și leishmanii [10], apar într-un organet special, numit glicozom . [11] [12]
Termenul „glicoliză” se referă de obicei la ruta Embden-Meyerhof-Parnas , numită după Gustav Embden , [13] Otto Meyerhof [14] [15] [16] și Jakub Parnas , [17] [18] [19] cele trei biochimiști care au contribuit cel mai mult la clarificarea mecanismului, dar ne putem referi și la calea Entner-Doudoroff și la diverse căi metabolice heterofermentative și homofermentative.
Descoperirea glicolizei
Identificarea modului de degradare a carbohidraților a fost una dintre primele probleme majore abordate în secolul al XIX-lea de biochimia naștentă. [20] [21] [22] Se poate spune că disciplina s-a dezvoltat mână în mână odată cu descoperirea progresivă a detaliilor din ce în ce mai mari despre fermentații , din care glicoliza este o parte integrantă.
Primele studii privind aceste procese au început în anul 1860 , când Louis Pasteur [23] [24] [25] [26] a identificat microorganismele ca fiind responsabile de fermentații. [27] În 1897 Hans și Eduard Buchner [28] [29] [30] au descoperit prin pură șansă că fermentațiile pot apărea chiar și în prezența unor simple extracte celulare [31] , respingând dogma ipotezată de Pasteur, conform căreia procesele procesele metabolice erau posibile numai în cadrul unei structuri vii , cum ar fi o celulă. [27]
În 1905 Arthur Harden [32] [33] [34] și William Young , [35] [36] intrând în detaliu, au identificat cele două fracții subcelulare necesare pentru efectuarea unei fermentații: o fracție termosensibilă cu greutate moleculară mare enzime ) și o greutate moleculară mică non-termosensibilă (care conține ADP , ATP , NAD + și alți cofactori ).
În primele decenii ale secolului al XX-lea , au fost studiate intens extractele celulare ale mușchilor și drojdiilor , responsabile de fermentațiile lactice și alcoolice , care ulterior s-au descoperit că împărtășesc majoritatea enzimelor și metaboliților. Dificultățile majore din aceste studii au fost în esență legate de timpul de înjumătățire scurt al intermediarilor metabolici, care a împiedicat analizarea procesului într-un mod stabil . Calea , în orice caz, a fost complet caracterizată în 1940 , prin diferitele contribuții ale lui Gustav Embden, Otto Meyerhof, Jakub Parnas, Carl Neuberg , [37] [38] [39] Otto Warburg [40] [41] [42] , Gerty și Carl Cori . [43] [44] [45]
Note generale
Reacția completă a glicolizei este următoarea: [46]
- Glucoza + 2 NAD + + 2 ADP + 2 P i → 2 NADH + 2 piruvat + 2 ATP + 2 H 2 O + 2 H + .
În toate organismele, care nu prevăd degradarea ulterioară a piruvatului , procesul are un randament energetic de două molecule de ATP pentru fiecare moleculă de glucoză (Glc) sau pentru orice alt zahăr care este degradabil prin această cale metabolică . [47] Catabolismul glucozei al organismelor care efectuează în mod obișnuit fermentații , cum ar fi drojdiile , se oprește, așadar, la piruvat (care este de obicei transformat în alte forme fără ca acest lucru să ducă la câștiguri energetice suplimentare).
Pe de altă parte, pentru organismele superioare, cum ar fi mamiferele , glicoliza este doar primul pas în degradarea zaharurilor. [48] Cele două molecule ATP obținute din aceasta sunt doar o mică parte din totalul moleculelor ATP care pot fi obținute pornind de la o moleculă de glucoză, care poate ajunge până la 36/38. [47] Celulele capabile să efectueze căi aerobice ulterioare (cum ar fi ciclul Krebs ), prin urmare, sunt capabile să proceseze piruvatul, oxidându-l pentru a obține dioxid de carbon și apă (lanțul de transport al electronilor). [49] Chiar și în aceste organisme, în orice caz, glicoliza poate deveni singura cale , fără ca piruvatul să fie oxidat în continuare. Acest lucru se poate întâmpla în caz de efort intens (în special în țesuturile cele mai solicitante energetic, cum ar fi mușchii ): în acest caz, piruvatul este transformat în acid lactic pentru a reconverti NADH în NAD + și pentru a echilibra concentrațiile celulare. [46]
Glicoliza poate fi împărțită în două faze: prima fază se numește faza de investiție , a doua este faza de randament .
Faza de investiții
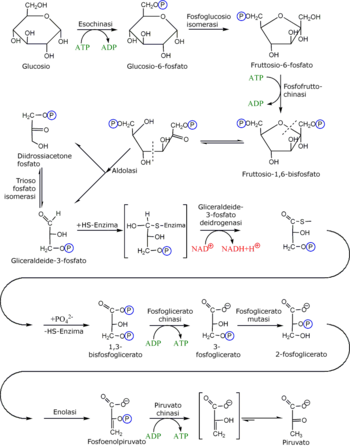
În faza de investiții, glucoza este fosforilată în glucoză-6-fosfat și în cele din urmă se împarte în două molecule de gliceraldehidă-3-fosfat; acest lucru se întâmplă prin utilizarea a două molecule de ATP . Prin urmare, primii cinci pași ai căii metabolice implică un consum net de energie. [50]
| Fază | Substrat | Enzimă | Clasa de enzime | Descriere | ||
|---|---|---|---|---|---|---|
| 1 | Glucoză | Glc | Exokinază | HK | Transferasis | Acest pas folosește ATP pentru a fosforila glucoza. Această reacție are un ΔG foarte scăzut: din acest motiv, reacția este ireversibilă. Este necesară prezența Mg 2+ , ceea ce face posibilă reacția prin sechestrarea sarcinilor negative ale fosfaților ATP într-un complex. [51] |
| 2 | Glucoza-6-fosfat | G6P | Fosfoglucoză izomerază | IGP | Izomeraza | Schimbarea structurii se realizează printr-o reacție redox , în care aldehida este redusă la alcool și carbonul adiacent este oxidat pentru a deveni cetonă . Deși reacția nu are o ΔG foarte favorabilă, este foarte eficientă datorită concentrațiilor scăzute de fructoză-6-fosfat, care se metabolizează foarte repede în etapa următoare (acest fenomen este de înțeles prin legea acțiunii în masă ). [52] |
| 3 | Fructoza-6-fosfat | F6P | Fosfructructinază | PFK-1 | Transferasis | În acest pas există din nou o risipă de energie printr-o altă moleculă de ATP . Această cheltuială poate fi justificată în două moduri: procesul glicolitic de aici înainte este ireversibil și energia furnizată carbohidraților o destabilizează. [53] Reacția este activată de niveluri ridicate de AMP și Pi (deci energia necesară celulei) în timp ce este inhibată de concentrații mari de ATP și citrat. Și aici prezența Mg 2+ este importantă. |
| 4 | Fructoză 1,6-bisfosfat | F1.6BP | Aldolaza | ALDO | Lioza | Molecula, destabilizată de reacția anterioară, este supusă scindării aldolazei în două molecule de glucoză cu trei atomi de carbon: dihidroxiacetonă fosfat și gliceraldehidă 3-fosfat . [54] |
| 5 | Fosfat de dihidroxiacetonă | DHAP | Triose fosfat izomeraza | TPI | Izomeraza | Triosa fosfat izomeraza transformă rapid DHAP în gliceraldehidă 3-fosfat. [55] |
Faza de performanță
În a doua fază, cea a eficienței, cele două molecule de gliceraldehidă-3-fosfat sunt transformate în două molecule de piruvat cu producerea consecventă a patru molecule de ATP și două de NADH (prin reducerea NAD + ), care permit regenerarea chiar rezerva de molecule reducătoare prezente în celulă. Prin urmare, această a doua fază vede o recuperare a energiei, care conduce întreaga cale glicolitică către un câștig net de energie. [56]
| Fas | Substrat | Enzimă | Clasa de enzime | Descriere | ||
|---|---|---|---|---|---|---|
| 6 | 3-fosfat gliceraldehidă | GADP | Gliceraldehidă 3-fosfat dehidrogenază | DECALAJ | Oxidoreductaza | Triozele sunt oxidate (prin îndepărtarea unui hidrogen ) și adăugate cu un fosfat anorganic. Hidrogenul este utilizat pentru a reduce două molecule de NAD + , care devin NADH + H + . [57] [58] [59] |
| 7 | 1,3-bifosfoglicerat | 1.3BPG | Fosfoglicerat kinază | PGK | Transferasis | Reacția mediază conversia ADP în ATP , prin transferul enzimatic al unei grupări fosfat prezente pe glucidă. Este un exemplu de fosforilare la nivel de substrat . [60] [61] [62] |
| 8 | 3-fosfoglicerat | 3PG | Fosfoglicerat mutaza | PGAM | Izomeraza | Reacția mediază deplasarea grupării fosfat din poziția 3 în poziția 2 pentru a-l pune într-o poziție mai favorabilă. [63] [64] [65] |
| 9 | 2-fosfoglicerat | 2PG | Enolază | SI NU | Lioza | O moleculă de H 2 O este îndepărtată din poziția 2 pentru a concentra energia chimică suplimentară în vecinătatea grupării fosfat. [66] [67] |
| 10 | Fosfoenolpiruvat | PEP | Piruvat kinaza | PK | Transferasis | Acesta este un alt exemplu de fosforilare la nivel de substrat, care transformă o moleculă de ADP într-una de ATP , formând piruvat ( Pyr ) . [68] [69] [70] |
Rezultatul net al glicolizei
Producția finală de piruvat este necesară pentru ciclul Krebs (numit și ciclul acizilor tricarboxilici sau acid citric), unde se produc coenzime reduse ( NAD redus și FAD redus) care, reoxidând în lanțul respirator, vor produce molecule de ATP .
Câștigul global al glicolizei este, prin urmare, de două molecule de ATP și două de NADH, după cum se indică prin reacția generală menționată mai sus: [46]
- Glucoza + 2 NAD + + 2 ADP + 2 P i → 2 NADH + 2 piruvat + 2 ATP + 2 H 2 O + 2 H +
Etapele glicolizei
Prima parte (faza de investiții)
Prima parte a glicolizei constă în primul rând în conversia glucozei în glucoză-6-fosfat, prin adăugarea unei grupări fosfat la carbonul 6, pentru a împiedica părăsirea moleculelor din celulă. În acest moment Glucoza-6-fosfatul se transformă în fructoză 1,6-bisfosfat : această conversie generează de fapt o captare a moleculei de glucoză din celulă ( fosfatul încarcă molecula, împiedicând-o să traverseze membrana celulei ). [46] Fructoza 1,6-bisfosfat, pe lângă faptul că este o moleculă încărcată, este ușor împărțită în două molecule mai mici de trei atomi de carbon: aceste două molecule vor fi substraturile celei de-a doua faze a căii metabolice. Etapele enzimatice ale primei faze sunt prezentate mai jos.
Reacția 1: hexokinază
Glucoza intracelulară este fosforilată prin acțiunea enzimei hexokinazei și transformată în glucoză-6-fosfat cu consumul unei molecule ATP . [50] Această etapă este una dintre cele trei etape cheie ale întregii căi , deoarece molecula de glucoză fosforilată, pe lângă faptul că nu poate părăsi membrana celulară, este destabilizată, devenind mai predispusă să continue calea catabolică .
Hexokinaza este o enzimă a cărei activitate depinde de prezența ionilor de magneziu . Un ion de magneziu divalent este prezent în situsul activ al enzimei și acționează prin formarea unui complex ternar hexokinază-ATP-Mg 2+ . Dar , spre deosebire de alte enzime specifice, aceasta are , de asemenea , o afinitate pentru alte zaharuri, cum ar fi manoză (sau K M este de aproximativ 10 -6). [71]
Glucoza-6-fosfatul intracelular poate avea destine diferite. De fapt, în ficat și mușchi poate lua calea glicogenosintezei pentru a sintetiza glicogen , respectiv hepatic și muscular. Mai mult, aproximativ 3% din glucoza intracelulară este oxidată pe calea pentozei-fosfat, care este în principal responsabilă pentru sinteza NADPH (NAD-fosfat redus) și sinteza ribozei-5-fosfat. NADPH este utilizat de celulă pentru propriile sale procese biosintetice; riboză-5-fosfat este utilizat pentru sinteza tuturor nucleotidelor.
Reacția 2: fosfoglucoză izomerază
Următorul pas în glicoliză este izomerizarea glucozei-6-fosfat în fructoză-6-fosfat . Enzima fosfoglucoză izomerază (sau fosfoglucoizomerază ), de asemenea dependentă de Mg, catalizează această reacție de conversie a unui carbohidrat aldoză într-o cetoză . [50]
În realitate, această reacție necesită mai mulți pași intermediari decât ne putem imagina: enzima este de fapt capabilă să deschidă structura ciclică a glucozei (inel cu șase atomi de carbon), să izomerizeze molecula și să o închidă înapoi în structura ciclică a fructozei (cinci -inel de termen).
Reacția 3: fosfofructokinază
După izomerizare, fructoza 6-fosfat suferă o altă fosforilare. Enzima fosfofructokinază1 catalizează această reacție până la producerea de fructoză-1,6-bisfosfat [72] , transferând un fosfat din ATP în poziția 1 a moleculei de fructoză. [73]
De asemenea, această reacție, datorită hidrolizei ATP , nu este reversibilă. Fosfructructinaza este o enzimă alosterică , dependentă de Mg 2+ . [71] Poate fi inhibat de ATP , [74] de citrat [74] și de produsul său, fructoză 1,6-bisfosfat. În schimb, este activat de ADP , [74] de AMP [74] și de fructoză-2,6-bifosfat. [75] Ultima moleculă este obținută prin fosforilarea fructozei-6-fosfatului de către o altă fosfofructokinază, fosfofructocinaza 2 .
Tocmai datorită acestei reglări foarte fine, a treia fază a glicolizei este, de asemenea, una dintre cele trei etape cheie ale întregii căi metabolice.
Reacția 4: aldolază
Fructoza-1,6-bisfosfatul produs de etapa anterioară este, de fapt, versiunea activă a glucozei, astfel glicoliza poate iniția degradarea efectivă, producând două trioze având câte un fosfat fiecare.
A patra reacție a glicolizei, catalizată de enzimă, dependentă de Mg 2+ , [71] aldolază , constă, prin urmare, în divizarea fructozei-1,6-bisfosfatului în dihidroxiacetonă fosfat și gliceraldehidă-3-fosfat .
Reacția 5: trioză fosfat izomerază
Aldolaza a împărțit hexoza în două trioze diferite: întrucât urmărirea a două căi metabolice diferite pentru ambele molecule obținute ar fi energetic foarte costisitoare, evoluția căii glicolitice a selectat o enzimă capabilă să uniformizeze degradarea ulterioară a celor două trioze. De fapt, triosa fosfatul izomerază este enzima responsabilă de transformarea fosfatului dihidroxiacetonă în gliceraldehidă-3-fosfat , singurul substrat al etapei următoare. [73]
Enzima este de fapt capabilă să ia un H + dintr-un atom de carbon, mutându-l pe altul din apropiere: în acest fel triozele trec de la cetonică la forma aldehidă .
ΔG ° de reacție este de fapt deplasat spre formarea dihidroxiacetonă fosfat, dar, prin legea acțiunii de masă, echilibrul reacției este deplasat spre dreapta, deoarece concentrația celulară de gliceraldehidă-3-fosfat este foarte mică (rezultatul procentele sunt 96% din DHAP, 4% din G3P). De fapt, gliceraldehida-3-fosfatul este metabolizat rapid prin trecerea ulterioară a căii metabolice.
A doua parte (faza de performanță)
Etapele anterioare ale glicolizei au produs două molecule de gliceraldehidă-3-fosfat , dar încă nu au extras nicio energie din proces. Dimpotrivă, până acum s-au consumat două molecule de ATP . Reacțiile celei de-a doua faze permit celulei să obțină energie din degradarea gliceraldehidei-3-fosfatului.
Reacția 6: gliceraldehidă-3-fosfat dehidrogenază

Gliceraldehidă-3-fosfat este transformat în 1,3-bisfosfoglicerat de gliceraldehidă-3-fosfat dehidrogenază .
Această reacție constă în suma a două procese: oxidarea aldehidei în acid carboxilic mediată de coenzima NAD + (care este redusă la NADH) și fosforilarea (adică atașarea unei grupări fosfat ) la grupa carboxilică. Prima reacție este destul de favorizată din punct de vedere termodinamic (ΔG ° de aproximativ -43 kJ / mol), [76] în timp ce a doua este nefavorabilă, deoarece ΔG ° este de semn opus. [76] Dacă aceste două reacții s-ar produce într-o succesiune simplă, a doua ar avea o energie de activare atât de mare încât este practic imposibilă. Aceste două reacții sunt cuplate de fapt prin enzima gliceraldehidă-3-fosfat dehidrogenază, ceea ce face posibilă fosforilarea.
Potențialul de oxidare este conservat sub forma reducerii potențialului prezent pe NADH, care își va elibera electronii în lanțul respirator pentru producerea moleculelor de ATP . 1,3-bifosfogliceratul este un compus cu energie foarte ridicată, cu o hidroliză ΔG ° de aproximativ -49,3 kJ / mol. [77]
Reacția 7: fosfoglicerat kinază
A șaptea etapă a glicolizei constă în începutul fazei reale de recuperare, care constă în producerea de ATP . Prin intermediul enzimei, fosfoglicerat kinazei dependente de Mg 2+ , [71] , de fapt, 1,3-bisfosfogliceratul transferă o grupare fosfat la un ADP , care este astfel reîncărcat la ATP . Acest tip de producție de ATP se numește fosforilare la nivel de substrat , deoarece molecula donatoare, 1,3-bisfosfogliceratul, este un substrat cu un potențial ridicat de transfer al unei grupări fosfat.
Ca și în cazul hexokinazei , fosforilarea ADP trebuie să aibă loc și în afara mediului apos. Din acest motiv, fosfogliceratul kinază are un buzunar capabil să repare substraturi din mediul extern.
Reacția 8: fosfoglicerat mutază
Ultimele trei reacții ale glicolizei constau în conversia 3-fosfogliceratului în piruvat , printr-o conversie concomitentă a unei alte molecule de ADP în ATP .
Prima reacție este o rearanjare . Poziția grupării fosfat se schimbă din carbon în poziția 3 în poziția 2, prin cataliza fosfogliceratului mutază [78] (la fel ca alte mutaze, este o enzimă implicată în rearanjarea internă a moleculelor). Cu toate acestea, reacția nu este o simplă schimbare.
De fapt, enzima funcționează în primul rând ca fosfatază , îndepărtând fosfatul din poziția 3 dintr-o moleculă de 2,3-bifosfoglicerat și generând produsul 2-fosfoglicerat . Acest fosfat rămâne legat de un reziduu de histidină al enzimei și este atașat ulterior la molecula de 3-fosfoglicerat (substratul de reacție), care regenerează astfel 2,3-bisfosfogliceratul. [78] Prin urmare, enzima necesită o cantitate de 2,3-bisfosfoglicerat, astfel încât reziduul de histidină, esențial pentru reacție, să fie întotdeauna fosforilat. [78]
Enzima implicată este, de asemenea, dependentă de magneziu. [78]
Reacția 9: enolază
Penultima reacție este în esență o deshidratare a 2-fosfogliceratului care duce la formarea fosfoenolpiruvatului , un compus cu energie ridicată și apă . Această deshidratare, catalizată de enzima enolază , [79] crește semnificativ potențialul de transfer al grupării fosfat. Dacă ΔG ° ´ de hidroliza unui fosfat legat de un alcool este de fapt aproximativ - 13 kJ mol -1 , cel al fosfoenolpiruvatului atinge - 62 kJ mol -1 . [80] Această valoare se datorează instabilității puternice a formei enolice a moleculei, care încetează numai atunci când ajunge la o formă cetonică mai stabilă (adică piruvatul ).
Enolaza este un lyase[81] a cărei activitate este stimulată de potasiu și / sau magneziu [82] [83]
Reacția 10: piruvat kinază
În ultima etapă, fosfoenolpiruvatul , de piruvat kinaza , dependent de Mg 2+ , [71] este în primul rând hidrolizat în enolpiruvat. Grupul fosfat este transferat la un ADP pentru a forma ATP . Energia necesară pentru producerea de ATP provine din conversia enolpiruvatului în piruvat, o reacție puternic exergonică. Forma enolică a piruvatului are, de fapt, un potențial energetic ridicat, dar este foarte instabilă, prin urmare, printr-un tautomerism ceto-enolic, cu dislocarea electronilor de la atomul de oxigen la atomul de carbon, se transformă în piruvat.
Piruvat kinaza este o enzimă foarte reglementată: este de fapt inhibată de acizi grași, citrat și ATP sau de produsele sale ( feedback ). [84] Un astfel de control din aval asigură faptul că ATP este produs numai atunci când există o nevoie reală. Există, de asemenea, o reglare în amonte efectuată de fructoză 1-6 bisfosfat, care anulează inhibarea (reglarea feed-forward). [84]
Piruvatul este produsul final al glicolizei și, în funcție de organisme și condițiile fiziologice, se poate confrunta cu destine diferite, inclusiv transformarea sa în acetil-CoA prin decarboxilare oxidativă .
Intrarea pe calea hexozelor alternative la glucoză
Deși glucoza este monozaharida cea mai utilizată de glicoliză, alte zaharuri pot fi utilizate și pe calea metabolică. Luați în considerare, de exemplu, intrările în calea glicolitică a altor doi carbohidrați foarte abundenți în alimente: fructoza și galactoza .
Intrarea fructozei
Majoritatea fructozei ingerate în dietă [85] este metabolizată în ficat , prin așa-numita cale de fructoză-1-fosfat . De fapt, enzima fructokinază fosforilează fructoza, producând o moleculă de fructoză-1-fosfat . [86] Această moleculă este transformată ulterior într-un dihidroxiacetonă fosfat , un intermediar al glicolizei și într-o gliceraldehidă , printr-o aldolază specifică ( fructoză-1-fosfat aldolază ). Gliceraldehida este fosforilată în continuare de o kinază ( trioz kinază ) pentru a deveni gliceraldehidă-3-fosfat [86] , care poate pătrunde pe calea glicolitică împreună cu dihidroxiacetonă fosfat.
O altă cale de intrare a fructozei poate fi fosforilarea sa în fructoză-6-fosfat prin enzima hexokinază . [86] Cu toate acestea, afinitatea glucozei pentru enzimă este de 20 de ori mai mare decât fructoza. O cantitate foarte mică de fructoză-6-fosfat este produsă în ficat, [86] deoarece glucoza din acesta este mult mai abundentă decât fructoza. La fel, glucoza este imediat prinsă și în mușchi, din nou prin hexokinază . Din aceste motive, se constată că țesuturile mai puțin metabolice active, cum ar fi țesutul adipos, metabolizează mai multă fructoză , hexoză la care sunt cel mai expuși. Formarea fructozei-6-fosfatului, care nu mai este inhibată competitiv de glucoză, este astfel mai favorizată în aceste țesuturi. [86]
Intrarea în galactoză
Nu există căi capabile să metabolizeze galactoza , deci strategia celulară pentru degradarea sa constă în conversia sa în glucoză. Molecula este transformată mai precis în glucoză-6-fosfat , prin cele patru etape ale așa-numitei căi de interconversie glucoză-galactoză .
- În prima reacție, galactoza este transformată de enzima galactokinază în galactoză-1-fosfat. [87]
- Galactoză-1-fosfat este legat de o moleculă de uridină , pornind de la o molecula de UDP -Glucoză (UDP-glucoză), un intermediar în sinteza glicogenului . Produsele acestei reacții sunt glucoza-1-fosfat și o moleculă de UDP-galactoză. Această reacție este catalizată de galactoză-1-fosfat uridil transferază. [87]
- Prin urmare, scheletul UDP-galactoză este epimerizat în UDP-glucoză. Configurația hidroxilului în poziția 4 este inversată de enzima UDP-galactoză 4-epimerază [87] (cunoscută și sub numele de galactowaldenază sau pur și simplu waldenază, numită după chimistul Paul Walden).
- În cele din urmă, glucoza-1-fosfatul produs din galactoză este izomerizat în glucoză-6-fosfat de către fosfoglucomutază, o altă enzimă utilizată în sinteza glicogenului.
Trebuie remarcat faptul că nu se consumă molecule UDP-glucoză în conversia galactozei în glucoză: este regenerată pur și simplu din UDP-galactoză prin epimerază.
Controlul debitului
Debitul în calea glicolitică este capabil să se adapteze foarte bine ca răspuns la stimulii din interiorul și exteriorul celulei. Essa è regolata per massimizzare la presenza di due metaboliti principali: l' ATP ed i mattoni fondamentali per le reazioni di biosintesi, come gli amminoacidi . Nella glicolisi, solo le reazioni catalizzate da esochinasi , fosfofruttochinasi e piruvato chinasi sono effettivamente irreversibili. Nelle comuni vie metaboliche, enzimi di questo tipo sono solitamente potenziali siti di controllo: in effetti, nella glicolisi il controllo del flusso è del tutto legato alla regolazione dell'attività di questi tre enzimi.
Esistono diversi modi per regolare l'attività di un enzima. Un meccanismo immediato di controllo è quello che avviene attraverso regolazione allosterica o attraverso modificazioni covalenti (come una fosforilazione ). Una forma più lenta di controllo coinvolge invece direttamente l' espressione genica dei singoli enzimi del pathway .
Controllo dell'esochinasi
La esochinasi è inibita da elevate concentrazioni di glucosio-6-fosfato , il prodotto da essa generato in seguito alla fosforilazione del glucosio . Tale inibizione è necessaria per prevenire l'accumulo di questo metabolita nella cellula nei casi in cui la velocità di flusso complessiva del pathway è bassa. Il glucosio entrato nella cellula, infatti, fintantoché non viene processato dalla esochinasi, è libero di diffondere nuovamente verso il circolo sanguigno (rendendosi disponibile eventualmente ad altri distretti dell'organismo), a differenza di quanto avviene per il glucosio-6-fosfato, carico e dunque impossibilitato a passare la membrana. Un suo eccessivo accumulo, inoltre, causerebbe un elevato rigonfiamento della cellula per osmosi .
Nelle cellule epatiche, il glucosio-6-fosfato in eccesso viene accumulato come glicogeno . In queste cellule, come già detto, non è presente la comune esochinasi, ma la glucochinasi . [88] Essa non viene inibita dal G6P, dunque può continuare a produrlo liberamente, dal momento che l'eccesso viene indirizzato a diventare glicogeno. Questo meccanismo è fondamentale nei casi in cui la glicemia è alta [89] (ad esempio al termine di un pasto), ma anche quando la glicemia è molto bassa (a digiuno), dal momento che il glicogeno può essere nuovamente convertito a glucosio-6-fosfato entrando nella via glicolitica oppure tornando a glucosio (attraverso l'enzima glucosio-6-fosfatasi), che viene re-immesso nel circolo sanguigno.
Controllo della fosfofruttochinasi
La fosfofruttochinasi [90] è probabilmente il più importante sito di controllo del pathway , dal momento che si trova immediatamente a valle del punto di ingresso nella via metabolica degli esosi alternativi al glucosio (come fruttosio e galattosio ). [91] [92]
Alti livelli di ATP [74] inibiscono la fosfofruttochinasi, riducendone l'affinità per il fruttosio-6-fosfato . Questo effetto viene raggiunto attraverso il legame dell' ATP a specifiche regioni di regolazione allosterica (distinte dai siti catalitici). L' AMP ha invece l'effetto opposto, attivando l'enzima. [74] Per questo motivo, l'attività della fosfofruttochinasi è saldamente legata al bilancio cellulare di ATP /AMP, [75] che può essere a buon ragione inteso come la riserva corrente di energia cellulare , a cui le vie energetiche come la glicolisi sono tenute ad adattarsi.
Dal momento che la glicolisi è anche una fonte di scheletri carboniosi per la biosintesi, un controllo a feedback negativo della glicolisi viene anche da molecole come il citrato : questa molecola, infatti, è in grado di aumentare l'effetto inibitorio esercitato dall' ATP sull'enzima. [74] Il citrato, infatti, è un intermedio precoce del ciclo di Krebs : un alto livello di citrato, dunque, implica un'alta quantità cellulare di precursori biosintetici.
Anche i bassi livelli di pH inibiscono l'attività della fosfofruttochinasi, prevenendo così una eccessiva produzione di acido lattico , in grado di generare un crollo ulteriore del pH, condizione molto grave per l'organismo.
Il fruttosio 2,6-bisfosfato è infine un potente attivatore della fosfofruttochinasi (in particolare della fosfofruttochinasi-1). [75] Tale molecola viene prodotta dalla fosforilazione del fruttosio-6-fosfato da parte della fosfofruttochinasi-2. Questo secondo enzima è inattivo qualora i livelli di cAMP siano alti, correlando così la via glicolitica al sistema ormonale . [75] Sia il glucagone che l' adrenalina , infatti, generano alti livelli di cAMP e bassi di fruttosio 2,6-bisfosfato: ciò conduce nel fegato ad una elevata gluconeogenesi , in grado di rendere disponibile per l'organismo grandi quantità di glucosio. [93]
Controllo della piruvato chinasi
La piruvato chinasi è l'enzima che catalizza la terza reazione irreversibile della via metabolica, che produce ATP e piruvato , l'intermedio metabolico centrale per una successiva ossidazione o per numerosi pathway anabolici . Esistono tre isoforme dell'enzima nei mammiferi : il tipo L è predominante nel fegato , il tipo M nel muscolo e nel cervello e il tipo A negli altri tessuti. [47]
Tutte le forme appena descritte, legano il fosfoenolpiruvato cooperativamente . Il fruttosio-1,6-bisfosfato , il prodotto della precedente reazione irreversibile, è in grado di attivare questi isoenzimi. L' ATP invece, come avviene anche per la fosfofruttochinasi , inibisce allostericamente entrambe le isoforme, riducendo la velocità della glicolisi. [94] Anche l' alanina , prodotta in un solo passaggio a partire dal piruvato, inibisce allostericamente entrambe le isoforme (segnalando in questo caso l'abbondanza di amminoacidi per la sintesi proteica ).
La regolazione delle due isoforme differisce invece a livello della loro suscettibilità alle modificazioni covalenti . [95] Le proprietà catalitiche del tipo L possono essere modulate anche da una fosforilazione reversibile. Se c'è una bassa glicemia , infatti, il glucagone , i glucocorticoidi e le catecolamine sono in grado di innalzare i livelli cellulari di cAMP , inducendo la fosforilazione della piruvato chinasi.[96] Questa fosforilazione, così come il controllo della fosfofruttochinasi legato al fruttosio-2,6-bisfosfato impedisce al fegato di consumare inutilmente glucosio, soprattutto se è necessario nei muscoli o nel cervello (nei quali infatti non si verifica alcuna inibizione della piruvato chinasi in caso di bassa glicemia). [97]
Aumento della glicolisi nei tumori
In condizioni anaerobiche , la glicolisi è l'unico meccanismo in grado di fornire rapidamente ATP (attraverso le fermentazioni tipiche dei batteri e dei lieviti anaerobici). In ogni caso, nell'uomo la glicolisi è accoppiata alla respirazione aerobica. In presenza di ossigeno, il mitocondrio internalizza il piruvato , ossidandolo ulteriormente ad ottenere CO 2 e acqua . Per questo motivo, l'attività glicolitica nei mammiferi è minore di quella dei microrganismi anaerobici: il numero di molecole di ATP che possono essere ottenute dalla ossidazione completa del piruvato, infatti, è 18-19 volte maggiore di quello proveniente dalla sola glicolisi. [47]
Le cellule tumorali possono presentare livelli di attività glicolitica [98] fino a 200 volte superiori a quelli dei tessuti sani, anche in presenza di grandi concentrazioni di ossigeno. Ciò può essere spiegato attraverso un elevato consumo locale di ossigeno, che ne genera concretamente una carenza nelle cellule tumorali, [99] con conseguente innalzamento dei livelli di glicolisi. Questo fenomeno è stato descritto per la prima volta nel 1930 da Otto Warburg [100] ed è quindi per questo motivo che è chiamato effetto Warburg . L'interruttore glicolitico dell'effetto Warburg osservato nei tessuti maligni è attivato dal danno ossidativo mitocondriale e/o dall'attivazione di fattori di trascrizione redox-sensibili, che si traduce in un aumento della resistenza delle cellule agli ossidanti. [101]
In ogni caso, ciò è stato spiegato anche dalla presenza in quantità maggiori di una particolare forma di esochinasi legata ai mitocondri, che genera un aumento dell'attività glicolitica senza che l'ossigeno sia necessariamente consumato [102] ; l'esochinasi e più in generale l'effetto Warburg potrebbe diventare un target per un'efficace terapia dei tumori. [103] [104] [105] [106] [107]
Recentemente è stato visto che nei soggetti diabetici v'è un aumento dell'incidenza dei tumori per un incremento della produzione di chetoni, che insieme al lattato si comportano da combustibile per le cellule tumorali e le metastasi per un effetto Warbur inverso . [108]
Il vantaggio biologico che le cellule tumorali acquisiscono con questo tipo di metabolismo non è del tutto chiaro, ma sembra che l' effetto Warburg serva in realtà tutte le cellule proliferanti come adattamento per agevolare la diffusione e l'incorporazione di sostanze nutritive nella biomassa (ad esempio, i nucleotidi, aminoacidi e lipidi) necessari per produrre una nuova cellula. [109]
Questo effetto ha delle conseguenze molto rilevanti in alcune applicazioni biomediche. L'elevata glicolisi delle cellule tumorali, infatti, può essere utilizzato come fattore diagnostico di un tumore, come fattore per la valutazione di efficacia del trattamento, nonché per una esatta localizzazione della massa tumorale attraverso tecniche di imaging [110] mediate da un radiotracciante per PET [111] [112] come il fluorodesossiglucosio[113] (un substrato modificato della esochinasi ).
Note
- ^ Nelson e Cox , p. 531 .
- ^ ( EN ) F. Marini, S. Radin; P. Tenchini, [The story of oxygen (2)] , in Chir Ital , vol. 37, n. 2, aprile 1985, pp. 129-38, PMID 4017137 .
- ^ ( EN ) JF. Kasting, DH. Eggler; SP. Raeburn; JF. Kasting, Mantle redox evolution and the oxidation state of the Archean atmosphere. , in J Geol , vol. 101, n. 2, marzo 1993, pp. 245-57, PMID 11537741 .
- ^ ( EN ) RS. Ronimus, HW. Morgan, Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism. , in Archaea , vol. 1, n. 3, ottobre 2003, pp. 199-221, PMID 15803666 .
- ^ Romano AH, Conway T. (1996) Evolution of carbohydrate metabolic pathways. Res Microbiol. 147(6-7):448-55 PMID 9084754
- ^ ( EN ) LA. Fothergill-Gilmore, PA. Michels, Evolution of glycolysis. , in Prog Biophys Mol Biol , vol. 59, n. 2, 1993, pp. 105-235, PMID 8426905 .
- ^ W. de Souza, Special organelles of some pathogenic protozoa. , in Parasitol Res , vol. 88, n. 12, dicembre 2002, pp. 1013-25, DOI : 10.1007/s00436-002-0696-2 , PMID 12444449 .
- ^ JR. Haanstra, A. van Tuijl; P. Kessler; W. Reijnders; PA. Michels; HV. Westerhoff; M. Parsons; BM. Bakker, Compartmentation prevents a lethal turbo-explosion of glycolysis in trypanosomes. , in Proc Natl Acad Sci USA , vol. 105, n. 46, novembre 2008, pp. 17718-23, DOI : 10.1073/pnas.0806664105 , PMID 19008351 .
- ^ M. Parsons, Glycosomes: parasites and the divergence of peroxisomal purpose. , in Mol Microbiol , vol. 53, n. 3, agosto 2004, pp. 717-24, DOI : 10.1111/j.1365-2958.2004.04203.x , PMID 15255886 .
- ^ JM. Silverman, SK. Chan; DP. Robinson; DM. Dwyer; D. Nandan; LJ. Foster; NE. Reiner, Proteomic analysis of the secretome of Leishmania donovani. , in Genome Biol , vol. 9, n. 2, 2008, pp. R35, DOI : 10.1186/gb-2008-9-2-r35 , PMID 18282296 .
- ^ M. Parsons, T. Furuya; S. Pal; P. Kessler, Biogenesis and function of peroxisomes and glycosomes. , in Mol Biochem Parasitol , vol. 115, n. 1, giugno 2001, pp. 19-28, PMID 11377736 .
- ^ FR. Opperdoes, Compartmentation of carbohydrate metabolism in trypanosomes. , in Annu Rev Microbiol , vol. 41, 1987, pp. 127-51, DOI : 10.1146/annurev.mi.41.100187.001015 , PMID 3120638 .
- ^ F. Lipmann, G. Embden, Reminiscences of Embden's formulation of the Embden-Meyerhof cycle. , in Mol Cell Biochem , vol. 6, n. 3, marzo 1975, pp. 171-5, PMID 165399 .
- ^ N. Kresge, RD. Simoni; RL. Hill; OF. Meyerhof, Otto Fritz Meyerhof and the elucidation of the glycolytic pathway. , in J Biol Chem , vol. 280, n. 4, gennaio 2005, pp. e3, PMID 15665335 .
- ^ HG. Schweiger, O. Meyerhof, Otto Meyerhof 1884-1951. , in Eur J Cell Biol , vol. 35, n. 2, novembre 1984, pp. 147-8, PMID 6394328 .
- ^ MA. Shampo, RA. Kyle; OF. Meyerhof, Otto Meyerhof--Nobel Prize for studies of muscle metabolism. , in Mayo Clin Proc , vol. 74, n. 1, gennaio 1999, p. 67, PMID 9987536 .
- ^ AP. BADAWCZE, JK. PARNAS, [Works of Jakub Karol Parnas presented during 1907-1939.] , in Acta Biochim Pol , vol. 3, n. 1, 1956, pp. 3-39, PMID 13338986 .
- ^ WS. Ostrowski, JK. Parnas, [Jakub Karol Parnas: his life and work] , in Postepy Biochem , vol. 32, n. 3, 1986, pp. 247-60, PMID 3554189 .
- ^ Z. Zielińska, JK. Parnas, Jakub Karol Parnas, 1884-1949. , in Acta Physiol Pol , vol. 38, n. 2, pp. 91-9, PMID 3314349 .
- ^ NG. Coley, Medical chemists and the origins of clinical chemistry in Britain (circa 1750-1850). , in Clin Chem , vol. 50, n. 5, maggio 2004, pp. 961-72, DOI : 10.1373/clinchem.2003.029645 , PMID 15105362 .
- ^ N. Mani, The historical background of clinical chemistry. , in J Clin Chem Clin Biochem , vol. 19, n. 6, giugno 1981, pp. 311-22, PMID 7024459 .
- ^ J. Büttner, From chemistry of life to chemistry of disease: the rise of clinical biochemistry. , in Clin Biochem , vol. 13, n. 5, ottobre 1980, pp. 232-5, PMID 6780238 .
- ^ :: Pasteur Foundation - The US nonprofit affiliate of the Institut Pasteur :: , su pasteurfoundation.org . URL consultato l'11 ottobre 2010 (archiviato dall' url originale il 14 ottobre 2010) .
- ^ LF. Haas, L. Pasteur, Louis Pasteur (1822-95). , in J Neurol Neurosurg Psychiatry , vol. 64, n. 3, marzo 1998, p. 330, PMID 9527143 .
- ^ J. Joaquín Izquierdo, [A flash of genius and the work of Louis Pasteur (1822-1895)] , in Gac Med Mex , vol. 100, n. 1, luglio 1973, pp. 79-80, PMID 4583346 .
- ^ A. Martínez-Palomo, L. Pasteur, The science of Louis Pasteur: a reconsideration. , in Q Rev Biol , vol. 76, n. 1, marzo 2001, pp. 37-45, PMID 11291570 .
- ^ a b Oeuvres de Pasteur. Tome 2 / réunies par Pasteur Vallery-Ra... - Gallica , su gallica.bnf.fr . URL consultato l'11 ottobre 2010 ( archiviato il 4 maggio 2012) .
- ^ L. Jaenicke, E. Buchner, Centenary of the award of a Nobel prize to Eduard Buchner, the father of biochemistry in a test tube and thus of experimental molecular bioscience. , in Angew Chem Int Ed Engl , vol. 46, n. 36, 2007, pp. 6776-82, DOI : 10.1002/anie.200700390 , PMID 17600804 .
- ^ F. Kohl, E. Buchner, [A milestone of biochemistry and enzyme research. 100 years ago the German physiologist and chemist Eduard Buchner demonstrated "cell-free fermentation" in yeast extracts] , in Dtsch Med Wochenschr , vol. 123, n. 25-26, giugno 1998, pp. 814-7, DOI : 10.1055/s-0029-1233241 , PMID 9672490 .
- ^ RA. Kyle, MA. Shampo; E. Buchner, Eduard Buchner. , in JAMA , vol. 245, n. 20, p. 2096, PMID 7014942 .
- ^ Per estratto cellulare si intende la raccolta del citoplasma e di tutto il contenuto di una cellula in seguito alla sua lisi.
- ^ RE. Kohler, A. Harden A, The background to Arthur Harden's discovery of cozymase. , in Bull Hist Med , vol. 48, n. 1, 1974, pp. 22-40, PMID 4370723 .
- ^ KL. Manchester, A. Harden, Arthur Harden: an unwitting pioneer of metabolic control analysis. , in Trends Biochem Sci , vol. 25, n. 2, febbraio 2000, pp. 89-92, PMID 10664590 .
- ^ KL. Manchester, E. Buchner; AC. Hill; A. Harden, Biochemistry comes of age: a century of endeavour. , in Endeavour , vol. 24, n. 1, 2000, pp. 22-7, PMID 10824440 .
- ^ Young, William John (1878 - 1942) Biographical Entry - Australian Dictionary of Biography Online , su adbonline.anu.edu.au . URL consultato l'11 ottobre 2010 ( archiviato il 23 giugno 2010) .
- ^ Young, William John - Biographical entry - Encyclopedia of Australian Science , su eoas.info . URL consultato l'11 ottobre 2010 ( archiviato il 10 agosto 2011) .
- ^ FF. NORD, C. NEUBERG, Carl Neuberg; 1877-1956. , in Adv Carbohydr Chem , vol. 13, 1958, pp. 1-7, PMID 13605967 .
- ^ A. GOTTSCHALK, C. NEUBERG, Prof. Carl Neuberg. , in Nature , vol. 178, n. 4536, ottobre 1956, pp. 722-3, PMID 13369516 .
- ^ AL. GRAUER, C. NEUBERG, [Carl Neuberg, 1877-1956.] , in Enzymologia , vol. 18, n. 1, gennaio 1957, pp. 1-2, PMID 13414707 .
- ^ OH. Warburg, The classic: The chemical constitution of respiration ferment. , in Clin Orthop Relat Res , vol. 468, n. 11, novembre 2010, pp. 2833-9, DOI : 10.1007/s11999-010-1534-y , PMID 20809165 .
- ^ O. Warburg, O. Warburg, [Otto Warburg: a biographical essay (author's transl)] , in Seikagaku , vol. 51, n. 3, marzo 1979, pp. 139-60, PMID 381542 .
- ^ RA. Brand, Biographical sketch: Otto Heinrich Warburg, PhD, MD. , in Clin Orthop Relat Res , vol. 468, n. 11, novembre 2010, pp. 2831-2, DOI : 10.1007/s11999-010-1533-z , PMID 20737302 .
- ^ FG. YOUNG, G. CORI, Gerty T. Cori. , in Br Med J , vol. 2, n. 5054, novembre 1957, pp. 1183-4, PMID 13472084 .
- ^ BA. HOUSSAY, CF. CORI, Carl F. and Gerty T. Cori. , in Biochim Biophys Acta , vol. 20, n. 1, aprile 1956, pp. 11-6, PMID 13315342 .
- ^ RD. Simoni, RL. Hill; M. Vaughan; CF. Cori; GT. Cori, Carbohydrate Metabolism: Glycogen Phosphorylase and the Work of Carl F. and Gerty T.Cori. 1928-1943. , in J Biol Chem , vol. 277, n. 29, luglio 2002, pp. 18e, PMID 12118037 .
- ^ a b c d Nelson e Cox , p. 534.
- ^ a b c d Tettamanti , p. 298.
- ^ Nelson e Cox , p. 533.
- ^ Nelson e Cox , p. 612.
- ^ a b c Nelson e Cox , p. 535.
- ^ Iynedjian PB,Molecular physiology of mammalian glucokinase , in Cell. Mol. Life Sci. , vol. 66, n. 1, gennaio 2009, pp. 27–42, DOI : 10.1007/s00018-008-8322-9 , PMC 2780631 , PMID 18726182 .
- ^ Yanagawa T, Funasaka T, Tsutsumi S, Hu H, Watanabe H, Raz A, Regulation of phosphoglucose isomerase/autocrine motility factor activities by the poly(ADP-ribose) polymerase family-14 , in Cancer Res. , vol. 67, n. 18, settembre 2007, pp. 8682–9, DOI : 10.1158/0008-5472.CAN-07-1586 , PMID 17875708 .
- ^ Rider MH, Bertrand L, Vertommen D, Michels PA, Rousseau GG, Hue L,6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis , in Biochem. J. , vol. 381, Pt 3, agosto 2004, pp. 561–79, DOI : 10.1042/BJ20040752 , PMC 1133864 , PMID 15170386 .
- ^ Kochman M, Dobryszycki P, Topography and conformational changes of fructose-1,6-bisphosphate aldolase , in Acta Biochim. Pol. , vol. 38, n. 4, 1991, pp. 407–21, PMID 1814134 .
- ^ Lee JC,Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates , in Acta Biochim. Biophys. Sin. (Shanghai) , vol. 40, n. 7, luglio 2008, pp. 663–9, PMC 2562701 , PMID 18604458 .
- ^ Nelson e Cox , p. 537.
- ^ MK. Kalyananda, R. Engel; BE. Tropp, Metabolism of L-glyceraldehyde 3-phosphate in Escherichia coli. , in J Bacteriol , vol. 169, n. 6, giugno 1987, pp. 2488-93, PMID 3294792 .
- ^ J. Jeffery, Kinetic aspects of soluble dehydrogenases requiring nicotinamide coenzymes. , in Experientia Suppl , vol. 36, 1980, pp. 1-39, PMID 6987074 .
- ^ FL. Crane, H. Goldenberg; DJ. Morré; H. Löw, Dehydrogenases of the plasma membrane. , in Subcell Biochem , vol. 6, 1979, pp. 345-99, PMID 377585 .
- ^ E. Beutler, PGK deficiency. , in Br J Haematol , vol. 136, n. 1, gennaio 2007, pp. 3-11, DOI : 10.1111/j.1365-2141.2006.06351.x , PMID 17222195 .
- ^ L. Busque, DG. Gilliland, The PGK-PCR clonality assay (PPCA). , in Methods Mol Biol , vol. 31, 1994, pp. 237-46, DOI : 10.1385/0-89603-258-2:237 , PMID 7921021 .
- ^ HC. João, RJ. Williams, The anatomy of a kinase and the control of phosphate transfer. , in Eur J Biochem , vol. 216, n. 1, agosto 1993, pp. 1-18, PMID 8365395 .
- ^ J. Puttick, EN. Baker; LT. Delbaere, Histidine phosphorylation in biological systems. , in Biochim Biophys Acta , vol. 1784, n. 1, gennaio 2008, pp. 100-5, DOI : 10.1016/j.bbapap.2007.07.008 , PMID 17728195 .
- ^ MJ. Jedrzejas, P. Setlow, Comparison of the binuclear metalloenzymes diphosphoglycerate-independent phosphoglycerate mutase and alkaline phosphatase: their mechanism of catalysis via a phosphoserine intermediate. , in Chem Rev , vol. 101, n. 3, marzo 2001, pp. 607-18, PMID 11712498 .
- ^ MJ. Jedrzejas, Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase. , in Prog Biophys Mol Biol , vol. 73, n. 2-4, 2000, pp. 263-87, PMID 10958932 .
- ^ JA. Gerlt, PC. Babbitt; I. Rayment, Divergent evolution in the enolase superfamily: the interplay of mechanism and specificity. , in Arch Biochem Biophys , vol. 433, n. 1, gennaio 2005, pp. 59-70, DOI : 10.1016/j.abb.2004.07.034 , PMID 15581566 .
- ^ JM. Brewer, Yeast enolase: mechanism of activation by metal ions. , in CRC Crit Rev Biochem , vol. 11, n. 3, 1981, pp. 209-54, PMID 7030619 .
- ^ JC. Lee, Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates. , in Acta Biochim Biophys Sin (Shanghai) , vol. 40, n. 7, luglio 2008, pp. 663-9, PMID 18604458 .
- ^ TE. Roche, Y. Hiromasa, Pyruvate dehydrogenase kinase regulatory mechanisms and inhibition in treating diabetes, heart ischemia, and cancer. , in Cell Mol Life Sci , vol. 64, n. 7-8, aprile 2007, pp. 830-49, DOI : 10.1007/s00018-007-6380-z , PMID 17310282 .
- ^ MC. Sugden, MJ. Holness, Mechanisms underlying regulation of the expression and activities of the mammalian pyruvate dehydrogenase kinases. , in Arch Physiol Biochem , vol. 112, n. 3, luglio 2006, pp. 139-49, DOI : 10.1080/13813450600935263 , PMID 17132539 .
- ^ a b c d e L. Garfinkel, D. Garfinkel, Magnesium regulation of the glycolytic pathway and the enzymes involved. , in Magnesium , vol. 4, n. 2-3, 1985, pp. 60-72, PMID 2931560 .
- ^ Il prefisso bis- si riferisce alla presenza di due gruppi fosfato in posizioni diverse; il prefisso di- (usato ad esempio per la molecola di ADP ) è invece da evitare in questo caso, perché si riferisce alla presenza di due fosfati nella stessa posizione della molecola.
- ^ a b Nelson e Cox , p. 536.
- ^ a b c d e f g Tettamanti , p. 288.
- ^ a b c d Tettamanti , p. 289.
- ^ a b c Campbell e Farrell , p. 505.
- ^ Nelson e Cox , p. 538.
- ^ a b c d Nelson e Cox , p. 541.
- ^ A. HOLT e F. WOLD, The isolation and characterization of rabbit muscle enolase. , in J Biol Chem , vol. 236, dicembre 1961, pp. 3227-31, PMID 13908561 .
- ^ Nelson e Cox , p. 542.
- ^ F. Sanguinetti, M. Dompé e S. Mantovani, [Circadian rhythms in urinary coproporphyrin and delta-aminolevulinic acid] , in Ann Ist Super Sanita , vol. 14, n. 3, 1978, pp. 601-5, PMID 755411 .
- ^ DP. Hanlon e EW. Westhead, Kinetic studies on the activation of yeast enolase by divalent cations. , in Biochemistry , vol. 8, n. 11, novembre 1969, pp. 4255-60, PMID 5353098 .
- ^ IR. Hamilton, Effects of fluoride on enzymatic regulation of bacterial carbohydrate metabolism. , in Caries Res , 11 Suppl 1, 1977, pp. 262-91, PMID 318573 .
- ^ a b Tettamanti , p. 294.
- ^ RH. Lustig, Fructose: metabolic, hedonic, and societal parallels with ethanol. , in J Am Diet Assoc , vol. 110, n. 9, settembre 2010, pp. 1307-21, DOI : 10.1016/j.jada.2010.06.008 , PMID 20800122 .
- ^ a b c d e Tettamanti , p. 344.
- ^ a b c Nelson e Cox , p. 547.
- ^ PB. Iynedjian, Molecular physiology of mammalian glucokinase. , in Cell Mol Life Sci , vol. 66, n. 1, gennaio 2009, pp. 27-42, DOI : 10.1007/s00018-008-8322-9 , PMID 18726182 .
- ^ M. Pal, Recent advances in glucokinase activators for the treatment of type 2 diabetes. , in Drug Discov Today , vol. 14, n. 15-16, agosto 2009, pp. 784-92, DOI : 10.1016/j.drudis.2009.05.013 , PMID 19520181 .
- ^ JP. Bolaños, A. Almeida; S. Moncada, Glycolysis: a bioenergetic or a survival pathway? , in Trends Biochem Sci , vol. 35, n. 3, marzo 2010, pp. 145-9, DOI : 10.1016/j.tibs.2009.10.006 , PMID 20006513 .
- ^ PA. Michels, DJ. Rigden, Evolutionary analysis of fructose 2,6-bisphosphate metabolism. , in IUBMB Life , vol. 58, n. 3, marzo 2006, pp. 133-41, DOI : 10.1080/15216540600688280 , PMID 16766380 .
- ^ G. Wegener, U. Krause, Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle. , in Biochem Soc Trans , vol. 30, n. 2, aprile 2002, pp. 264-70, DOI : 10.1042/ , PMID 12023862 .
- ^ Tettamanti , p. 290.
- ^ MS. Patel, LG. Korotchkina, Regulation of the pyruvate dehydrogenase complex. , in Biochem Soc Trans , vol. 34, Pt 2, aprile 2006, pp. 217-22, DOI : 10.1042/BST20060217 , PMID 16545080 .
- ^ MC. Sugden, MJ. Holness, Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs. , in Am J Physiol Endocrinol Metab , vol. 284, n. 5, maggio 2003, pp. E855-62, DOI : 10.1152/ajpendo.00526.2002 , PMID 12676647 .
- ^ ( EN ) S. Jitrapakdee, JC. Wallace, Structure, function and regulation of pyruvate carboxylase. , in Biochem J , 340 ( Pt 1), maggio 1999, pp. 1-16, PMID 10229653 .
- ^ ( EN ) T. Noguchi, [Regulation of pyruvate kinase gene expression and its clinical application] , in Rinsho Byori , vol. 38, n. 8, agosto 1990, pp. 868-75, PMID 2232246 .
- ^ CX. Bittner, A. Loaiza; I. Ruminot; V. Larenas; T. Sotelo-Hitschfeld; R. Gutiérrez; A. Córdova; R. Valdebenito; WB. Frommer; LF. Barros, High resolution measurement of the glycolytic rate. , in Front Neuroenergetics , vol. 2, 2010, DOI : 10.3389/fnene.2010.00026 , PMID 20890447 .
- ^ R. Diaz-Ruiz, M. Rigoulet; A. Devin, The Warburg and Crabtree effects: On the origin of cancer cell energy metabolism and of yeast glucose repression. , in Biochim Biophys Acta , settembre 2010, DOI : 10.1016/j.bbabio.2010.08.010 , PMID 20804724 .
- ^ O. Warburg, F. Wind; E. Negelein, THE METABOLISM OF TUMORS IN THE BODY. , in J Gen Physiol , vol. 8, n. 6, marzo 1927, pp. 519-30, PMID 19872213 .
- ^ G. Pani, T. Galeotti; P. Chiarugi, Metastasis: cancer cell's escape from oxidative stress. , in Cancer Metastasis Rev , vol. 29, n. 2, giugno 2010, pp. 351-78, DOI : 10.1007/s10555-010-9225-4 , PMID 20386957 .
- ^ Bustamante and Pedersen, High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase, PNAS, 2005, 74 (9): 3735 , su pnas.org . URL consultato il 3 settembre 2006 ( archiviato il 4 maggio 2008) .
- ^ SP. Mathupala, YH. Ko; PL. Pedersen, Hexokinase-2 bound to mitochondria: cancer's stygian link to the "Warburg Effect" and a pivotal target for effective therapy. , in Semin Cancer Biol , vol. 19, n. 1, febbraio 2009, pp. 17-24, DOI :10.1016/j.semcancer.2008.11.006 , PMID 19101634 .
- ^ Z. Chen, W. Lu; C. Garcia-Prieto; P. Huang, The Warburg effect and its cancer therapeutic implications. , in J Bioenerg Biomembr , vol. 39, n. 3, giugno 2007, pp. 267-74, DOI : 10.1007/s10863-007-9086-x , PMID 17551814 .
- ^ H. Pelicano, DS. Martin; RH. Xu; P. Huang, Glycolysis inhibition for anticancer treatment. , in Oncogene , vol. 25, n. 34, agosto 2006, pp. 4633-46, DOI : 10.1038/sj.onc.1209597 , PMID 16892078 .
- ^ N. Serkova, LG. Boros, Detection of resistance to imatinib by metabolic profiling: clinical and drug development implications. , in Am J Pharmacogenomics , vol. 5, n. 5, 2005, pp. 293-302, PMID 16196499 .
- ^ RH. Xu, H. Pelicano; Y. Zhou; JS. Carew; L. Feng; KN. Bhalla; MJ. Keating; P. Huang, Inhibition of glycolysis in cancer cells: a novel strategy to overcome drug resistance associated with mitochondrial respiratory defect and hypoxia. , in Cancer Res , vol. 65, n. 2, gennaio 2005, pp. 613-21, PMID 15695406 .
- ^ G. Bonuccelli, A. Tsirigos; D. Whitaker-Menezes; S. Pavlides; RG. Pestell; B. Chiavarina; PG. Frank; N. Flomenberg; A. Howell; UE. Martinez-Outschoorn; F. Sotgia, Ketones and lactate "fuel" tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism. , in Cell Cycle , vol. 9, n. 17, settembre 2010, pp. 3506-14, PMID 20818174 .
- ^ MG. Vander Heiden, LC. Cantley; CB. Thompson, Understanding the Warburg effect: the metabolic requirements of cell proliferation. , in Science , vol. 324, n. 5930, maggio 2009, pp. 1029-33, DOI : 10.1126/science.1160809 , PMID 19460998 .
- ^ 64Cu-1,4,7,10-Tetraazacyclododecane-1,4,7-Tris-acetic acid-10-maleimidoethylacetamide-ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGTG -- Molecular Imaging and Contrast Agent Database (MICAD) -- NCBI Bookshelf , su ncbi.nlm.nih.gov . URL consultato il 12 ottobre 2010 ( archiviato il 27 settembre 2009) .
- ^ IF. Robey, RM. Stephen; KS. Brown; BK. Baggett; RA. Gatenby; RJ. Gillies, Regulation of the Warburg effect in early-passage breast cancer cells. , in Neoplasia , vol. 10, n. 8, agosto 2008, pp. 745-56, PMID 18670636 .
- ^ GJ. Kelloff, JM. Hoffman; B. Johnson; HI. Scher; BA. Siegel; EY. Cheng; BD. Cheson; J. O'shaughnessy; KZ. Guyton; DA. Mankoff; L. Shankar, Progress and promise of FDG-PET imaging for cancer patient management and oncologic drug development. , in Clin Cancer Res , vol. 11, n. 8, aprile 2005, pp. 2785-808, DOI : 10.1158/1078-0432.CCR-04-2626 , PMID 15837727 .
- ^ E. Bustamante, PL. Pedersen, High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase. , in Proc Natl Acad Sci USA , vol. 74, n. 9, settembre 1977, pp. 3735-9, PMID 198801 .
Bibliografia
- JW Baynes e MH Dominiczak, Biochimica per le discipline biomediche , Casa Editrice Ambrosiana, 2006 ISBN 88-408-1353-5
- MK Campbell e SO Farrell, Biochemistry , Cengage Learning, 2007 ISBN 9780495390411
- V. Donald, Voet Judith G. e Pratt Charlotte W., Fondamenti di biochimica , Bologna, Zanichelli, 2001 ISBN 88-08-09151-1
- RH Garret, CM Grisham Principi di Biochimica Padova, Ed. PICCIN, 2004 ISBN 88-299-1693-5
- Berg Jeremy M., Tymoczko John L. e Stryer Lubert Biochimica , Bologna, Zanichelli, 2003 ISBN 88-08-07893-0
- Nelson David L. e Cox Michael M., Principi di biochimica , Bologna, Zanichelli, 2002 ISBN 88-08-09035-3
- Siliprandi & Tettamanti, Biochimica medica ,Ed. Piccin ISBN 978-88-299-1750-1
Voci correlate
- Decarbossilazione ossidativa del piruvato
- Ciclo di Krebs
- Gluconeogenesi
- Glicogenosintesi
- Glicogenolisi
- Via dei pentoso fosfati
Altri progetti
-
 Wikizionario contiene il lemma di dizionario « glicolisi »
Wikizionario contiene il lemma di dizionario « glicolisi » -
 Wikiversità contiene risorse su glicolisi
Wikiversità contiene risorse su glicolisi -
 Wikimedia Commons contiene immagini o altri file su glicolisi
Wikimedia Commons contiene immagini o altri file su glicolisi
Collegamenti esterni
- Glicolisi , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- ( EN ) Glicolisi , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Glicolisi , su muscolab.net . URL consultato l'11 settembre 2007 (archiviato dall' url originale il 29 agosto 2007) .
- Glicolisi e ciclo di Krebs (con animazioni) , su my-personaltrainer.it .
- Gli enzimi della glicolisi , su pianetachimica.it .
- ( EN ) Berg Jeremy M., Tymoczko John L. and Stryer Lubert Biochemistry - Fifth Edition - WH Freeman and Company , su whfreeman.com . URL consultato il 29 luglio 2006 (archiviato dall' url originale il 29 ottobre 2006) .
- ( EN ) Le tappe della via metabolica , su ncbi.nlm.nih.gov .
- ( EN ) Il controllo della glicolisi , su ncbi.nlm.nih.gov .
| Controllo di autorità | Thesaurus BNCF 33873 · LCCN ( EN ) sh85055402 · GND ( DE ) 4157742-5 |
|---|