Glioblastom
| Glioblastom | |
|---|---|
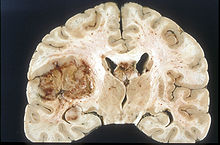
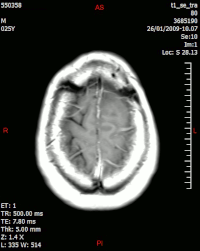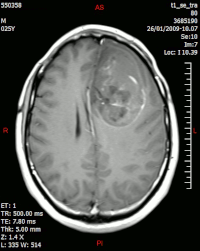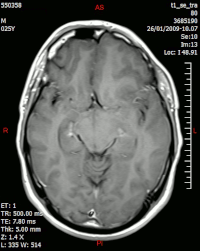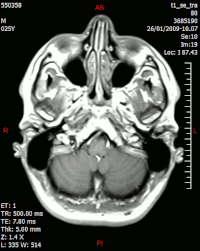
 În imaginea MR , notați inelul de îmbunătățire (cea mai proeminentă parte a tumorii) din jurul zonei centrale a necrozei. | |
| Tip | Malign |
| Factori de risc | radiații ionizante |
| Vârsta medie la diagnostic | 53 de ani |
| Raportul M: F | 1,5: 1 |
| Abrevieri | GBM |
| Sinonime | |
| Glioblastom multiform, Astrocitom de gradul IV | |
| Clasificare și resurse externe | |
| Neurooncologie | |
| Tumori de țesut neuroepitelial └► Tumori astrocitice └► Glioblastom | |
| ICD-O | 9440/3 |
| Gradul OMS | IV |
Glioblastomul (cunoscut și sub denumirea de glioblastom multiform sau cu abrevierea GBM, mai puțin cunoscut sub numele de glioblastom multiform) este cel mai frecvent și cel mai malign tumor al tumorilor din glia . Numele său a fost stabilit de standardul OMS-2000 și confirmat de standardul OMS-2007 . [1]
Compus dintr-un set eterogen de celule tumorale astrocitice slab diferențiate , glioblastomul afectează în principal adulții și apare de obicei în emisferele cerebrale; mai rar la trunchiul creierului sau măduva spinării . Ca toate tumorile cerebrale, cu excepția cazurilor foarte rare, nu se extinde dincolo de structurile sistemului nervos central . [2]
Glioblastomul se poate dezvolta din astrocitom difuz (gradul II) sau astrocitom anaplastic (gradul III) (în acest caz se numește secundar , vezi mai jos), dar apare mai frecvent de novo , fără nicio dovadă de malignitate anterioară (se numește apoi primar ) . Tratamentul glioblastomului include intervenții chirurgicale , radiații și chimioterapie . Este dificil de vindecat și există puține cazuri de supraviețuire după trei ani. [3]
Clasificare
Acest articol sau secțiune despre medicamente este considerat a fi verificat . |
Conform penultimei clasificări a tumorilor sistemului nervos central (2007), glioblastomul face parte din tumorile astrocitice, împreună cu alte șase tipuri de neoplasme: numele oficial al OMS-2007 este prezentat în coloana din dreapta, împreună cu codul ICD-O ( Clasificarea internațională a bolilor pentru oncologie : Clasificarea internațională a bolilor pentru oncologie). [4] Se adaugă apoi la notare , ca „grad OMS” urmat de cifre romane. Este raportată cea mai frecvent utilizată versiune a definiției italiene. Altele, posibil prezente, sunt între paranteze drepte. Variantele sunt indicate cu caractere cursive.
| Astrocitom pilocitar | Astrocitom pilocitar , IDC-O 9421/1, clasa I a OMS Astrocitom pilomixoid , IDC-O 9425/3, clasa II a OMS |
| Astrocitom subependimal cu celule uriașe [Astrocitom cu celule uriașe subependente] | Astrocitom cu celule uriașe subependimale , IDC-O 9384/1, clasa I a OMS |
| Xantoastrocitom pleomorf | Xanthoastrocitom pleomorf , ICD-O 9424/3, OMS gradul II |
| Astrocitom difuz [Astrocitom] | Astrocitom difuz , IDC-O 9400/3, clasa II a OMS |
| Astrocitom anaplastic | Astrocitom anaplastic , IDC-O 9401/3, clasa III a OMS |
| Glioblastom [Glioblastom multiform, astrocitom de gradul IV] | Glioblastom , IDC-O 9440/3, clasa IV a OMS Glioblastom cu celule uriașe , IDC-O 9441/3, clasa IV a OMS Gliosarcom , IDC-O 9442/3, OMS gradul IV |
| Gliomatoza cerebrală | Gliomatoză cerebri, IDC-O 9381/3, OMS gradul III |
fundal
În prima jumătate a secolului al XIX-lea , glioblastomul a fost considerat de origine mezenchimală și, prin urmare, definit cu termenul de sarcom . [5] În 1863 Rudolf Virchow [6] și-a stabilit originea glială . FB Mallory, într-o memorie din 1914 , propune termenul de glioblastom multiform . [7] Cu toate acestea, trebuie să așteptăm până în 1925 pentru o descriere completă a neoplasmului de către JH Globus și I. Strass. [8] În acest moment, cea mai comună denumire a tumorii este spongioblastomul multiform . [8] În 1926, o publicație a lui P. Bailey și H. Cushing repetă cu succes dicția lui Mallory. [9] Clasificarea OMS din 2000 a tumorilor sistemului nervos fixează în cele din urmă denumirea de glioblastom . [1] (Pentru o relatare istorică mai detaliată, a se vedea KJ Zülch [10] și DS Russell și LJ Rubinstein [11] ).
În dezvoltarea conceptului că glioblastomul apare uneori prin progresia și malignitatea unei leziuni de grad inferior, studiile lui HJ Scherer (1940) [12] și JW Kernohan și colab. (1949). [13] Această viziune a primit un sprijin puternic din studiile genetice moleculare, care au arătat că există o acumulare secvențială caracteristică a modificărilor genetice de la astrocitoame difuze de gradul II la glioblastom (Vezi mai jos, secțiunea Patogeneză , Tab. 1 și 2).
Epidemiologie
Glioblastomul este cea mai frecventă tumoare cerebrală, [14] acoperind aproximativ 12-15% din toate neoplasmele intracraniene și 50-60% din toate tumorile astrocitice (a se vedea clasificarea ). [10]
În majoritatea țărilor europene și în America de Nord, incidența este de 2-3 cazuri noi pe an la 100 000 de locuitori. [15]
Glioblastomul poate apărea la orice vârstă, dar de preferință apare la adulți, atingând vârfurile între 45 și 70 de ani.[16] Aproximativ două treimi dintre pacienți (70%) au vârsta cuprinsă în intervalul de mai sus. Vârsta medie este de aproximativ 53 de ani, cu un raport bărbat / femeie de 1,5: 1. Aceste ultime date provin dintr-o lucrare pe 1003 biopsii pentru glioblastom, efectuată de Spitalul Universitar din Zurich. Acestea sunt menționate în P. Kleihues și colab. (2000).[16] Date similare sunt raportate de alți autori. [10]
Într-o lucrare care a implicat 488 de cazuri, GJ Dohrman și colab [17] au constatat că 8,8% dintre glioblastoame sunt pediatrice. Pe de altă parte, cazurile de glioblastoame congenitale [18] sunt rare, deși diagnosticul de gliom malign cu ultrasunete în uter [19] [20] [21] a arătat că glioblastomul prenatal poate apărea chiar la 29 de săptămâni de gestație. [21]
Glioblastoamele apar cel mai adesea în substanța albă subcorticală a emisferelor cerebrale . Cele mai frecvent afectate zone sunt lobul temporal (31%), lobul parietal (24%), frontal (23%) și occipital (16%). Combinația fronto-temporală este tipică. Neoplasmul se extinde adesea prin infiltrare la cortexul adiacent, la ganglionii bazali și apoi la emisfera contralaterală. Aceste date provin dintr-un raport asupra 987 glioblastoamelor, realizat de Spitalul Universitar din Zurich. Acestea sunt menționate în P. Kleihues și colab. (2000).[16]
Glioblastoamele intraventriculare sunt excepționale, [22] în timp ce glioblastoamele trunchiului cerebral sunt rare, deși afectează adesea copiii. [17] Cerebelul și coloana vertebrală sunt rareori afectate de acest neoplasm.[16]
Etiologie
Vedere tradițională
Tumorile se formează ca urmare a creșterii celulare anormale și nereglementate. Odată ce creierul uman își finalizează dezvoltarea, imediat după naștere, marea majoritate a celulelor sale intră într-o stare de liniște, în care nu se mai divid. Singura excepție de la această regulă este atunci când se dezvoltă o tumoare.
Celulele cerebrale canceroase reiau „ciclul celular” din cauza modificărilor unora dintre numeroasele gene care controlează diviziunea și creșterea celulară . Deși se știu multe despre modificările acestor gene în tumorile cerebrale, motivul principal pentru care apar modificările este în prezent necunoscut. [23]
Moştenire
Rețineți că , atunci când vine vorba de gene, aceasta nu înseamnă că tumorile cerebrale sunt ereditare. Deși există sindroame în care astfel de tumori sunt familiare, aceste situații ( neurofibromatoză , sindrom Turcot , sindrom Li-Fraumeni etc.) sunt foarte rare și cunoscute în mod normal în familie înainte ca o tumoare să se dezvolte la un membru al familiei. [23]
Factori de risc
Radiațiile ionizante sunt singurul factor de risc neechivoc care a fost identificat pentru neoplasmele gliale și meningeale . Iradierea craniului, chiar și la doze mici, poate crește incidența tumorilor gliale cu un factor de 3 până la 7 și a meningioamelor cu un factor de 10, cu o perioadă de latență de la 10 la mai mult de 20 de ani după expunere. [24] [25]
Nicio altă situație de mediu sau comportamentul pacientului nu a fost identificată în mod clar ca factor de risc. Este raportat pe scară largă că utilizarea telefoanelor mobile, apropierea de cablurile de înaltă tensiune, utilizarea vopselelor de păr, traumatismele capului, nutriția care conține N- nitrozamine sau alți factori nutriționali, toate cresc riscul apariției tumorilor cerebrale; [26] [27] [28] [29] cu toate acestea, aceste date sunt considerate contradictorii și neconvingătoare. [30]
Asocierea dintre tipul de ocupație profesională și apariția glioblastoamelor a făcut obiectul a numeroase studii. Lucrătorii expuși cronic la clorură de vinil , compuși pe bază de fenol și hidrocarburi aromatice s-au dovedit a fi cei mai expuși riscului. [31] [32] [33] [34] [35]
Celule stem neoplazice ale creierului

Din anii nouăzeci, studiile efectuate mai întâi pe animale și apoi pe oameni au arătat că în creier există o producție continuă de celule noi. În special, celulele stem neuronale multipotente au fost identificate în girusul dentat al hipocampului și în zona subventriculară a ventriculilor laterali, capabile să producă noi celule nediferențiate (celule stem) și celule mature, cum ar fi neuroni , astrocite și oligodendrocite . [36] [37] [38] [39] [40] [41] De asemenea, sunt capabili de auto-reînnoire, asigurându-se astfel că numărul total de celule rămâne constant. [42] Pe de altă parte, o linie de cercetare a descoperit, din 2002, că există o ierarhie a celulelor tumorale în tumorile cerebrale, în special glioblastoamele. În sensul că o parte (mică) a tumorii este formată din celule care au aceleași caracteristici ca și tulpina neuronală, astfel încât autorii au inventat numele de celule stem canceroase din creier (celule stem tumorale cerebrale). [43] [44] [45] Acestea sunt motorul cancerului: reproduc în mod continuu celule stem canceroase și celule canceroase (celule non-stem). Și sunt doar ultimii care sunt supuși atacurilor terapiilor. Celulele stem neoplazice sunt, de fapt, refractare la radioterapie și chimioterapie, deoarece sunt capabile să auto-repareze daunele produse de terapiile tradiționale în timp, înainte ca deteriorarea să devină ireversibilă și să facă celula inactivă. [46] [47] [48] [49] [50] Prin urmare, este suficient ca o singură celulă stem cerebrală neoplazică să scape de operație, ca mecanismul să fie repornit și boala să se reia. Se presupune că existența acestor celule stem neoplazice ale creierului rezultă dintr-o eroare de autoreglare a celulelor stem neuronale (auto-reînnoire), menționată mai sus. [42] Schema conceptuală raportată aici într-o formă foarte succintă, în literatură, poartă denumirea de „Ipoteza celulelor stem neoplazice”. Acest model este urmat de majoritatea covârșitoare a cercetătorilor. Cu toate acestea, există o minoritate mică, dar acerbă, care tinde să ofere o explicație diferită a fenomenelor descrise sau să le plaseze într-un cadru conceptual diferit. [51] [52] [53] [54] [55]
Patogenie
Secvența modificărilor genetice care duc la glioblastom este prezentată schematic mai jos, așa cum este descris în ultimele două ediții ale clasificării OMS a tumorilor SNC .[16][56]
Distingem două tipuri de modificări:
- activarea factorilor oncogeni :
- EGF / R (factor / receptor de creștere epidermică, factor de creștere epidermică )
- MDM2 (oncoproteina Double Mouse 2 Mouse promovează supraviețuirea celulară și progresia ciclului celular prin inhibarea oncosupresorului TP53 [57] )
- PDGF / R ( factor de creștere derivat din trombocite / receptor, factor de creștere derivat din trombocite )
- dezactivarea factorilor de supresie a tumorii :
- 10p , 10q , 19q ( cromozomi )
- DCC ( șters în gena supresoare tumorale a cancerului colorectal )
- p16 ( gena / proteina supresoare tumorale, antigenul tumorii celulare)
- TP53 ( genă / proteină supresoare tumorale, antigen tumoral celular)
- PTEN ( fosfataza și omologul TENsin este un supresor tumoral care controlează creșterea, proliferarea și supraviețuirea celulelor. Mutația sau inhibarea acestuia poate duce la apariția tumorilor, de exemplu, a prostatei, sânului, colonului și creierului. [58] [59] [ 60] )
- RB ( genă supresoare tumorale RetinoBlastoma , proteină retinoblastom )
Tabelul 1 (P. Kleihues și H. Ohgaki, 1999, [61] raportat în P. Kleihues și colab. , 2000,[16] cu modificări grafice) este preluat din clasificarea OMS din 2000 și prezintă mutațiile care apar din glioblastomul sănătos celule.
În partea stângă puteți vedea activarea leziunilor intermediare ( astrocitom difuz și astrocitom anaplastic ) înainte de a ajunge la așa-numitul glioblastom secundar (acest adjectiv aici nu are sensul obișnuit de metastatic, ci derivă din leziunile anterioare ). În partea dreaptă, tabelul prezintă mutațiile care de la celulele sănătoase duc direct ( de novo ) la glioblastom, așadar numit primar .
(În paranteze este procentul de prezență a modificării unice.)
| Tab. 1 Modificări genetice ale glioblastomului (2000)[16] | |
| Celule astrocitice diferențiate sau precursori neuroepiteliali | |
| Mutație TP53 (> 65%) Supraexprimarea PDGF-A , PDGFR-α (~ 60%) ↓ | EGFR: Amplificare (~ 40%) Supraexprimare (~ 60%) MDM2: Amplificare (<10%) Supraexprimare (~ 50%) Ștergerea p16 (30-40%) Pierderea heterozigozității la 10p și 10q Mutație PTEN (~ 30%) Modificarea RB ↓ |
| Astrocitom difuz | |
| Pierderea heterozigozității peste 19q (~ 50%) Modificare RB (~ 25%) ↓ | |
| Astrocitom anaplastic | |
| Pierderea heterozigozității pe 10q Mutație PTEN (5%) Pierderea expresiei DCC (~ 50%) Amplificare PDGFR-α (<10%) ↓ | |
| Glioblastom secundar | Glioblastom de novo |
Tabelul 2 (din P. Kleihues și colab. , 2007,[56] cu modificări grafice) este preluat din clasificarea OMS din 2007. Sunt rezumați ani de studiu și de analiză ulteriori. [62] [63]
Rețineți că asteriscul (*) indică modificări genetice care sunt semnificativ diferite în frecvență între glioblastoamele primare și secundare.
| Tab. 2 Modificări genetice ale glioblastomului (2007)[56] | ||
| Celule astrocitice diferențiate sau precursori sau celule stem | ||
| Mutație TP53 (59%) ↓ | Mutație TP53 (59%) ↓ | THE THE THE THE ↓ <3 luni (68%) <6 luni (84%) THE THE THE THE ↓ |
| Astrocitom difuz | Astrocitom difuz | |
| Mutație TP53 (53%) ↓ | THE THE ↓ 5,1 ani THE THE ↓ | |
| Astrocitom anaplastic | ||
| ↓ 1,9 ani ↓ | ||
| Pierderea heterozigozității peste 10q (63%) Amplificarea EGFR (8%) Ștergerea (19%) Mutație TP53 (65%) * Mutație PTEN (4%) ↓ | Pierderea heterozigozității peste 10q (70%) Amplificare EGFR (36%) * Ștergerea (31%) Mutație TP53 (28%) Mutație PTEN (25%) * ↓ | |
| Glioblastom secundar | Glioblastom primar | |
| 5% din cazuri Vârsta medie: 45 de ani Raport M / F: 0,65 | 95% din cazuri Vârsta medie: 62 de ani Raport M / F: 1,33 | |
Legăturile dintre cele două tabele pot fi deduse examinând referințele bibliografice indicate.
Cu toate acestea, trebuie evidențiat un fapt. O examinare chiar superficială a acestor tabele conduce la concluzia că glioblastoamele primare și secundare sunt două boli distincte (chiar dacă din punct de vedere histologic nu sunt foarte distincte), care afectează grupuri de pacienți diferiți în funcție de vârstă și sex și care se dezvoltă prin căi genetice diferite, cu proteine diferite și profiluri de expresie mARN. Aceste diferențe sunt importante, mai ales că pot influența răspunsul tumorii la radio și chimioterapie și pot fi ținta viitoarelor abordări terapeutice. [63]
Complicații
Mai jos este o listă rezumativă a complicațiilor legate de glioblastom, distingându-le pe cele datorate bolii de cele legate mai mult de terapii. [64]
Multe dintre aceste complicații nu sunt frecvente și un număr semnificativ dintre ele poate fi ținut sub control într-un mod eficient din punct de vedere terapeutic.
- Complicații legate de cancer:
- Edem cerebral
- Tulburări neurologice
- Tulburări vizuale
- Hidrocefalie
- Gliomatoza leptomeningiană
- Afectarea funcțiilor cognitive
- Deteriorarea stării psihologice ( anxietate etc.)
- Complicații legate de terapii:
- Boli legate de operație
- Infecții
- Tulburări neurologice
- Tulburări vizuale
- Patologii legate de radioterapie
- Tulburări neurologice
- Tulburări vizuale
- Afectarea funcțiilor cognitive
- Patologii legate de chimioterapie
- Disfuncții ale sângelui
- Tulburări ale sistemului respirator
- Diaree
- Epuizare
- Tulburări neurologice
- Disfuncții ale sângelui
- Patologii legate de medicamentele anticonvulsivante
- Patologii legate de medicamente antiinflamatoare
- Patologii legate de medicamentele citostatice
- Boli legate de operație
Anatomie patologică
Examen macroscopic
În ciuda duratei scurte a simptomelor, glioblastoamele au adesea dimensiuni mari în momentul prezentării și pot ocupa mai mult de un lob . Leziunea este de obicei unilaterală, dar cele ale trunchiului cerebral și ale corpului calos pot fi bilaterale simetrice. Tumora ocupă aceeași poziție în cele două emisfere și are un aspect de „fluture”. Extensia supra- tentorială bilaterală se datorează creșterii rapide de-a lungul structurilor mielinizate , în special prin corpul calos și de-a lungul fornixelor până la lobii temporali.
Limitele masei neoplazice, care nu este niciodată încapsulată, sunt estompate peste tot. Tenul este cenușiu, dar pot fi găsite variate abundente, cauzate de necroză sau hemoragii mai mult sau mai puțin recente, pentru care pe fundalul cenușiu apar zone gălbui, datorită degenerării grase sau necrozei și zone roșiatice sau negricioase datorate hemoragiilor.
Zona periferică a țesutului tumoral hipercelular apare ca o margine moale, gri. Țesutul necrotic poate, de asemenea, marginea structurilor cerebrale adiacente fără o zonă intermediară tumorală detectabilă macroscopic. Necroza centrală poate ocupa mai mult de 80% din masa tumorală totală.
Glioblastoamele sunt de obicei presărate cu pete de sângerare roșii și maronii, care sunt uneori suficient de mari pentru a provoca simptome asemănătoare accidentului vascular cerebral , care pot fi primul semn clinic al cancerului.
Chisturile macroscopice, atunci când sunt prezente, conțin lichid tulbure din țesutul tumoral necrotic lichefiat, în contrast puternic cu chisturile de retenție bine definite ale astrocitoamelor difuze de gradul II.
Majoritatea glioblastoamelor emisferelor cerebrale sunt clar intraparenchimale , cu un epicentru în substanța albă . Uneori, neoplasmul apare în mare măsură superficial și în contact cu leptomeningele și dura mater și poate fi confundat cu un carcinom metastatic sau cu o leziune extra-axială, cum ar fi meningiomul . [5][56]
Examinare microscopica
Glioblastomul este o neoplasmă anaplastică a gliei constând din celule tumorale astrocitice polimorfe slab diferențiate , cu atipie nucleară marcată și activitate mitotică intensă. Caracteristicile particulare în scopuri de diagnostic sunt, de asemenea, proliferarea microvasculară vizibilă [67] și prezența necrozei . După cum sugerează adjectivul „multiform” al sinonimului cel mai comun, morfologia histologică a glioblastomului este extrem de variabilă, cu celule rotunjite, în formă de fus, de dimensiuni destul de mici sau foarte mari.
În timp ce unele glioblastoame prezintă un grad ridicat de polimorfism celular și nuclear, cu numeroase celule gigantice plurinucleare, altele au o conformație caracterizată prin celularitate intensă, dar mai degrabă repetitivă. Natura astrocitară a neoplasmului poate fi destul de ușor de identificat, cel puțin local, în unele tumori, dar dificil de recunoscut în altele, datorită gradului ridicat de anaplazie . Heterogenitatea regiune-la-regiune a glioblastomului este semnificativă și face dificilă diagnosticarea specimenelor limitate, cum ar fi cele obținute prin biopsie stereotaxică [68] (Vezi ilustrația în secțiunea Chirurgie .). Deși prezența celulelor slab diferențiate predomină, astrocitele neoplazice mai diferențiate pot fi discernibile în unele locuri. Acest lucru este valabil mai ales în cazurile de glioblastom rezultat din progresia unui astrocitom difuz (clasa II a OMS). Tranziția între zonele care încă posedă diferențierea astrocitară recunoscută și zonele cu anaplazie celulară ridicată poate fi continuă sau bruscă. O schimbare bruscă a morfologiei reflectă de obicei apariția unei tumori diferite, născută din dobândirea uneia sau mai multor modificări genetice suplimentare. [69]
În contextul neoplaziei, se observă zone întinse de necroză, înconjurate de nuclee dispuse paralel între ele, formând „palisade” tipice. Există o proliferare marcată a celulelor endoteliale cu formarea a numeroase vase, uneori cu un aspect similar unui cluster sau bilă. Unele au pereți hialini [70], iar alții sunt trombozați . Cu toate acestea, proliferarea endotelială nu este răspândită, dar este concentrată în unele locuri. În jurul tumorii pot fi găsite zone de astrocite gemistocitice ( astrocitoame difuze de gradul II). [5][56]
Clinica
semne si simptome
Istoricul clinic al bolii este de obicei scurt (mai puțin de 3 luni, în mai mult de 50% din cazuri), cu excepția cazului în care cancerul se dezvoltă prin progresie dintr-un astrocitom de grad scăzut ( glioblastom secundar ; vezi secțiunea Patogeneză de mai sus).
Simptomele glioblastomului sunt nespecifice [71] ale unei mase în expansiune în interiorul craniului, deci de creștere a presiunii intracraniene. Frecvente sunt cefaleea , greața , vărsăturile , dilatarea vaselor cerebrale cu modificări ale retinei până la papilema , hemipareza , hemianestezia , hemianopsia , diplopia , afazia și convulsiile .
Procentul pacienților supuși convulsiilor ajunge până la o treime. În cele din urmă, trebuie remarcate simptomele neurologice nespecifice, cum ar fi tulburarea conștiinței și modificările personalității .[56]
Diagnosticarea tumorilor cerebrale și imagistică


Prezența unei tumori cerebrale poate fi dezvăluită în mod eficient prin tomografie computerizată (CT) și imagistica prin rezonanță magnetică nucleară (RMN).
RMN este mai sensibil decât CT în identificarea leziunilor; cu toate acestea, nu este întotdeauna ușor de accesat pentru pacient și are unele contraindicații: nu poate fi efectuat persoanelor cu stimulatoare cardiace, proteze incompatibile cu câmpul magnetic, cleme metalice etc. Scanarea CT rămâne metoda aleasă în detectarea calcificărilor interne la leziuni sau eroziuni osoase ale tecului sau bazei craniului.
Utilizarea mediului de contrast (iodat în cazul scanării CT, paramagnetic în cazul RMN ( gadoliniu )), permite achiziționarea de informații despre vascularizație și despre integritatea barierei hematoencefalice , o mai bună definiție a nodulului tumoral comparativ la edemul cerebral înconjurător și permite avansarea ipotezelor asupra gradului de malignitate.
Examenul radiologic permite, de asemenea, să evalueze efectele mecanice (și consecințele modificări ale relațiilor structurilor creierului) derivate din prezența masei „străine”: hidrocefalie și hernii, ale căror efecte pot fi chiar letale.
În cele din urmă, examinarea, având în vedere intervenția chirurgicală, specifică locul leziunii și proximitatea (sau chiar implicarea) tumorii în zone absolut vitale ale creierului (așa-numitele zone „elocvente”). În acest scop, RMN-ul este superior CT-ului datorită faptului că este capabil să furnizeze imagini tridimensionale. [72]
Înainte de a închide această secțiune, este util să atrageți atenția asupra unor concepte și termeni care vor fi utili pentru înțelegerea secțiunilor ulterioare.
Aspect radiologic al țesutului neoplazic
Vrem să evidențiem fenomenul de alterare din punct de vedere radiologic al țesutului neoplazic în raport cu parenchimul normal al creierului (modificări ale densității electronice a materialelor în cazul scanării CT și a intensității semnalului pentru RMN).
La fel ca majoritatea țesuturilor patologice, tumorile se caracterizează și printr-o acumulare crescută de apă intracelulară. La tomografie apar hipodense, adică de densitate mai mică decât parenchimul cerebral, la RMN apar hipointens în imaginile ponderate T1 și hiperintense în cele ponderate DP și T2. (A se vedea tomografia computerizată și imagistica prin rezonanță magnetică ). [34] [73]
Îmbunătățirea contrastului ( îmbunătățirea semnalului de contrast)
In una lastra radiografica la zona di cervello sano non dovrebbe segnalare particolari luminescenze. È naturale quindi che si ponga attenzione alle porzioni di maggior segnale di contrasto.
Nel tumore, in genere, la maggior quota di “contrast enhancement” è dovuta alla particolare barriera emato-tumorale, che permette il passaggio di iodio (TAC) e di gadolinio (RM) nello spazio interstiziale extravascolare intratumorale: aumenta così il segnale (densità o intensità) del tumore.
Si faccia comunque attenzione al fatto che il “contrast enhancement” non delimita con certezza il tumore dall'edema perilesionale: in effetti nei gliomi infiltranti maligni (quali, ad es., il glioblastoma e l'astrocitoma anaplastico) il reperto anatomo-patologico mostra tessuto neoplastico persino oltre l'edema vasogenico (quello cioè causato dalla distruzione della barriera emato-encefalica da parte del tumore), cosa questa che non è facilmente dimostrabile attraverso le immagini radiografiche. [34] [73]
Controllo post-chirurgico
Il controllo post-chirurgico tramite RM (o TAC) ai fini della determinazione della radicalità della rimozione di un tumore è ritenuto opinabile nella letteratura: l'esame dovrebbe essere eseguito entro 24 ore dalla chirurgia, prima cioè che si instaurino le alterazioni della barriera emato-encefalica sostenute dai fenomeni fibrotici-cicatriziali; in altre parole, la cicatrice fisiologica ha un “contrast enhancement” che può facilmente confondersi con un residuo o con una ricrescita di tumore.
Anche dopo trattamento radio-chirurgico, una radionecrosi (vedi più sotto la sezione omonima ) può presentare caratteristiche di “imaging” e di “contrast enhancement” con aspetto quasi sovrapponibile a quello di un glioma maligno. Solo mediante metodiche funzionali come la tomografia a emissione di positroni (PET) con fluorodesossiglucosio (FDG-PET), la quale dimostra una più elevata captazione di glucosio da parte del tumore rispetto al tessuto sano, è possibile valutare l'assenza di metabolismo nelle necrosi rispetto alla recidiva tumorale, (anche se è possibile che necrosi e recidiva coesistano).
In alternativa alla PET si può utilizzare l' analisi spettroscopica mediante RM (Vedi Spettroscopia di risonanza magnetica nucleare e Risonanza magnetica funzionale ): nella “mappa” dei metabolici di tale metodica è presente il picco della colina (Cho) che è associato alla sintesi delle membrane cellulari: un alto picco è indicativo di elevato turnover cellulare, come si verifica nei tumori. [34] [73]
Diagnostica per immagini e glioblastoma



La TAC evidenzia una lesione di morfologia irregolare, prevalentemente ipodensa, fortemente disomogenea per la presenza di vaste aree necrotiche di più netta ipodensità e di aree solide iperdense. Queste ultime sono espressione di un rapido accrescimento e conseguentemente di una elevata malignità.
Frequenti le zone emorragiche, variabili da piccoli foci a vaste aree ematiche che possono coinvolgere l'intera lesione.
Caratteristica è la morfologia a "farfalla" se presente l'interessamento di entrambi gli emisferi attraverso il corpo calloso.
Dopo contrasto compaiono grossolani cercini di impregnazione intorno alle aree necrotiche.
Alla RM la parte solida appare ipointensa in T1 e iperintensa in T2 con zone di segnale più elevato nelle parti a più forte cellularità. Le aree necrotiche, sempre iperintense in T2, possono presentarsi ipo-, iso- o iperintense in T1 in funzione del contenuto proteico o di prodotti di degradazione dell'emoglobina.
L' enhancement dopo mezzo di contrasto è in genere intenso e irregolare alla periferia del tumore e identifica soprattutto la componente cellulare “proliferativa” della neoplasia.
Comuni le aree puntiformi e serpiginose di assenza di segnale da flusso connesse alla presenza della ricca neovascolarizzazione. Questi vasi patologici neoformati sono privi di barriera ematoencefalica: ciò spiega sia l'impregnazione abbondante e grossolana sia l'edema vasogenico perilesionale (vedi la sezione precedente) dovuto al passaggio di liquido in sede extracellulare. [72] [73]
Diagnosi differenziale
La diagnosi differenziale si pone con: metastasi, emorragie cerebrali spontanee, ascessi, forme atipiche di sclerosi multipla, danno di barriera secondario a radioterapia. [72]
Diagnostica per immagini. Conclusioni
Si può concludere arguendo che il primo passo da considerare nella valutazione di un paziente nel quale si sospetti una neoplasia cerebrale è la risonanza magnetica.
Tale esame sarebbe altresì da consigliare a ogni paziente che soffra di crisi epilettiche, per le quali non vi siano immediate e plausibili giustificazioni .
Normalmente la risonanza rivela senza particolari difficoltà la presenza del glioblastoma quale causa dei sintomi lamentati e non sono necessari ulteriori esami. [74]
Trattamento
Nel trattamento del glioblastoma, come per qualunque altro tumore cerebrale, distinguiamo le terapie di supporto dalle terapie curative. [75] [76] [77]
Terapie di supporto
Il trattamento di supporto ha come scopo di alleviare i sintomi e di migliorare le funzioni neurologiche del paziente. Gli agenti di supporto primari sono i farmaci antiepilettici ei corticosteroidi.
Farmaci antiepilettici
I farmaci antiepilettici vengono somministrati a circa il 25% dei pazienti che hanno avuto crisi epilettiche alla presentazione della malattia. La fenitoina (300–400 mg/d) è il farmaco più comunemente usato, ma carbamazepina (600-1 000 mg/d), fenobarbital (90–150 mg/d) e acido valproico (750-1 500 mg/d) sono ugualmente efficaci. Le dosi di tutti questi anticonvulsionanti devono essere adattate ai livelli che si riscontrano poi nel sangue del paziente, per fornire la massima protezione.
Similmente efficaci sono gli antiepilettici di nuova concezione, quali levetiracetam , gabapentin , lamotrigina e topiramato . La maggior parte di questi nuovi principi attivi ha il vantaggio di causare scarsi effetti collaterali di tipo cognitivo e, per il fatto che non inducono il sistema epatico microsomiale , non alterano il metabolismo dei chemioterapici . Questi nuovi anticonvulsivi stanno rapidamente sostituendo i farmaci classici nella terapia antiepilettica di prima linea. [74]
Profilassi
Le sperimentazioni cliniche di tipo prospettico hanno dato risultati negativi nel tentativo di mostrare l'efficacia di un uso profilattico dei farmaci antiepilettici in caso di pazienti di tumori cerebrali che non avevano mai lamentato crisi epilettiche.
Di conseguenza, la letteratura medica ne sconsiglia l'uso per questo scopo eccetto che per il periodo relativo all'intervento chirurgico, quando il loro utilizzo può ridurre l'incidenza di crisi epilettiche post-operatorie.
Nei casi quindi di pazienti che non hanno mai avuto crisi è consigliabile che gli anticonvulsivi non siano più somministrati entro le 2 settimane dall'intervento. [74] [75] [78]
Corticosteroidi
I farmaci a base di corticosteroidi sono in grado di ridurre l'edema peritumorale, diminuendo l'effetto massa della neoplasia e riducendo la pressione endocranica. Come effetto immediato si ottiene un sollievo al mal di testa e un miglioramento dei segni “lateralizzanti” (vedi la sintomatologia descritta alla voce epilessia ).
Il corticosteroide di elezione è il desametasone , a motivo della sua minima attività mineralcorticoide. La dose di partenza è di circa 16 mg/d. Tale quantità può essere aumentata o diminuita fino a raggiungere la minima dose necessaria per tenere sotto controllo la sintomatologia neurologica.
L'uso prolungato di corticosteroidi è associato a ipertensione , diabete mellito , stato iperglicemico iperosmolare non chetosico (affezione a pericolo di vita), miopatia , aumento di peso, insonnia e osteoporosi . Talché nel paziente di tumore cerebrale la dose steroidea dev'essere ridotta gradualmente “il più rapidamente possibile”, una volta che sia iniziato il trattamento curativo.
Per la maggior parte dei pazienti si cessa la somministrazione dei corticosteroidi quando hanno completato la radioterapia.
Ai pazienti sotto steroidi per più di 6 settimane si consiglia una profilassi antibiotica per la polmonite da pneumocystis carinii , cura che dovrebbe continuare per 1 mese dalla cessazione della somministrazione di corticosteroidi. [74]
Terapie curative
Le terapie curative dei tumori cerebrali includono essenzialmente chirurgia, radioterapia e chemioterapia.
Il primo passo è, se possibile, di stendere un piano terapeutico generale che permetta di abbozzare la sequenza ei singoli elementi del trattamento multidisciplinare.
Chirurgia

L'approccio chirurgico dev'essere scelto accuratamente, allo scopo di ottenere la massima asportazione possibile del tumore, preservando le strutture vitali del cervello e minimizzando il rischio di deficit neurologico postoperatorio.
Gli obiettivi dell'intervento chirurgico sono:
- ottenere un'accurata diagnosi istologica;
- ridurre l'effetto massa sul cervello causato dal tumore e/o dall'edema peritumorale;
- se del caso, mantenere o ristabilire il flusso del liquido cefalorachidiano ;
- conseguire una (potenziale) guarigione attraverso la rimozione “totale” della neoplasia (nel caso di glioblastoma, l'operazione chirurgica molto raramente ottiene la guarigione, comunque riduce le dimensioni del tumore in maniera tale da renderlo più gestibile da radio- e chemio-terapia).
Un'asportazione maggiore del 98% del volume del tumore (resezione “totale”) aumenta la sopravvivenza rispetto a una resezione subtotale o parziale. La resezione subtotale “estesa” non sembra conferire alcun vantaggio di sopravvivenza rispetto alla biopsia o alla resezione parziale. [74] [79]
In caso di ripresentazione della malattia (e questo avviene nella quasi totalità dei glioblastomi), o di espansione della parte di tumore rimasta dall'operazione chirurgica, o di radionecrosi (sia la ripresa di malattia sia la radionecrosi causano effetto massa ed edema e, come detto in precedenti sezioni, non sono distinguibili alla risonanza classica) si ricorre a un secondo intervento, per ridurre gli effetti della massa neoformata sul parenchima cerebrale.
In situazione di ricorrenza difficilmente si ottiene la guarigione, comunque ne consegue di solito un miglioramento della qualità della vita e una modesta estensione di sopravvivenza media.
In generale, un secondo intervento viene escluso in pazienti con indice di Karnofsky (KPS) inferiore o uguale a 60 o in quei pazienti che non sono candidabili a terapie adiuvanti successive alla chirurgia. [74] [79] Prima di concludere questa sezione val la pena di accennare a studi clinici che prevedono durante l'operazione chirurgica la somministrazione intratecale di chemioterapici o immunoterapici ovvero di liquidi radianti. Questi studi sono nella fase di prima sperimentazione. [80] [81] [82]
Il posizionamento sul letto operatorio di “wafers” impregnati di carmustina è l'unico caso di chemioterapia intracavitaria attualmente (settembre 2008) approvata dalla FDA ( Food and Drug Administration ) per il caso di glioblastoma. [83] [84]
Negli anni 2010, l'intervento chirurgico si è evoluto andando a rimuovere il tumore del pazienze in awake , ovvero "da sveglio". Grazie a tale operazione si può sondare se una determinata parte del cervello si può rimuovere senza che il paziente ne possa subire conseguenze dopo la sua operazione. Si elettro-stimolano specifiche zone del cervello per comprendere se il paziente risponde man mano a una psicologa la quale comunica con i chirurghi per capire fino a quando è possibile rimuovere il tumore. [85] [86]
Radioterapia
La radioterapia, che normalmente viene effettuata dopo l'operazione chirurgica, riguarda la parte di encefalo interessata dall'intervento oltre a un leggero margine esterno, e ha lo scopo di danneggiare il DNA di eventuali cellule tumorali rimaste dopo l'operazione e sfuggite al chirurgo perché non visibili al microscopio (in quanto infiltratesi più o meno distanti dalla zona dell'operazione).
Se la radioterapia riesce a danneggiare tali cellule prima che esse abbiano la possibilità di riparare il DNA e di riprendere la moltiplicazione cellulare, il paziente ne guadagna in sopravvivenza.
Sperimentazioni cliniche sui gliomi di alto grado (astrocitoma anaplastico, oligodentroglioma anaplastico, oligostrocitoma anaplastico, glioblastoma) effettuate dal BTSG (Brain Tumor Study Group) statunitense hanno mostrato che la radioterapia postoperatoria a dosi superiori a 50 Gy fornisce un miglioramento della sopravvivenza rispetto a nessun trattamento postoperatorio e che 60 Gy danno come risultato una sopravvivenza significativamente più lunga rispetto ai 50 Gy . [87] [88]
Questa quantità di radiazione corrisponde a una dose appena al di sopra di quella necessaria alla formazione di radionecrosi, perciò si è scelto come standard il trattamento radioterapico di 60 Gy complessivi somministrati in 30-33 frazioni, una al giorno. [74] [88] [89]
Pazienti di glioblastoma di oltre 60 anni con una terapia abbreviata di 40 Gy in 15 frazioni mostrano sopravvivenza identica a quella ottenuta col regime standard. Perciò è ragionevole per tali pazienti l'uso di tale trattamento ridotto. [90]
Circa la metà dei pazienti con astrocitoma anaplastico “risponde” alla radioterapia con 60 Gy (dato verificabile tramite evidenza radiografica); la percentuale si riduce al 25% per i pazienti con glioblastoma. Per entrambe le neoplasie casi di guarigione completa per radioterapia sono molto rari. [74]
Nel tentativo di migliorare i risultati sunnominati, sono stati messi a punto un certo numero di nuovi approcci, quali la radioterapia iperfrazionata (HFRT), la brachiterapia (utilizzo di aghi radioattivi depositati direttamente), la radiochirurgia . Quest'ultima ha goduto nel recente passato di un certo interesse, in quanto trattasi di procedura non invasiva, da poter essere effettuata in certi casi anche in situazione di day-hospital . Richiede una selezione molto accurata dei pazienti, in quanto, tra l'altro, necessita che la neoplasia non sia estesa bensì altamente focalizzata.
A parte casi particolari, queste nuove tecniche non hanno mostrato di migliorare significativamente la sopravvivenza globale del paziente. [74] [88]
Radionecrosi
Si è già accennato in precedenti sezioni alla necrosi radioindotta. Questa complicanza è prodotta soprattutto dalla brachiterapia e dalla radiochirurgia e determina la sintomatologia da effetto massa, più sopra descritta, in circa il 50% dei pazienti di glioma maligno. Con il trattamento con corticosteroidi si riesce spesso a controllare l'edema circostante l'area radio-necrotica. Ciò, a lungo andare, a sua volta produce però dipendenza dagli steroidi, con tutte le complicazioni dell'uso prolungato a cui si è fatto cenno (nella sezione dei Corticosteroidi ). Nei casi più gravi occorre far ricorso alla operazione chirurgica per rimuovere la massa necrotica. [74]
Chemioterapia
Anche la chemioterapia ha lo scopo di danneggiare l'organizzazione del DNA delle cellule tumorali, eventualmente rimaste dopo l'operazione chirurgica e sfuggite alla radioterapia. Se il chemioterapico riesce a scardinare tale DNA, la cellula tumorale passa in fase di "morte programmata" ( apoptosi ).
La chemioterapia apporta benefici limitati ai pazienti di glioblastoma. Nelle sperimentazioni cliniche l'uso di nitrosuree non ha allungato significativamente la sopravvivenza media in tutti i pazienti, ma un sottogruppo di essi pare beneficiare di una sopravvivenza prolungata con l'aggiunta di chemioterapia alla radioterapia. Fattori prognostici quali l'età, l' indice di Karnofsy , ecc. non riescono a predire quali pazienti trarranno vantaggi dalla chemioterapia. [74] (Vedi però, più oltre, il caso della temozolomide ).
In una larga sperimentazione di fase III, i pazienti (con diagnosi di glioblastoma e senza alcun trattamento radio- chemio-terapico precedente) sono stati “randomizzati” per ricevere sola radioterapia (gruppo A) oppure radioterapia con contemporanea somministrazione giornaliera del farmaco temozolomide, seguita da somministrazione mensile sempre di temozolomide (gruppo B). Sul totale di 573 pazienti la sopravvivenza media è passata da 12,1 mesi (gruppo A) a 14,6 mesi (gruppo B). Ma, cosa ancor più significativa, la sopravvivenza a due anni è più che raddoppiata, passando da 10,4% del gruppo A a 26,5% per il gruppo B. [91]
Il trattamento in combinata radioterapia-temozolomide è risultato mediamente ben tollerato e con una tossicità aggiuntiva minimale, talché questo protocollo è diventato lo standard terapeutico di elezione per di tutti i nuovi pazienti di glioblastoma. [74]
Come prodotto collaterale dello studio di cui si diceva, è stata individuata una proteina tumorale (MGMT) in grado di predire, con un'approssimazione utile nella pratica, quali pazienti beneficeranno del protocollo combinato. Questa metodica è ancora in fase di prova da parte della comunità scientifica e qui viene solo citata per informazione. [92] [93] [94]
Cannabinoidi
Un discorso a parte meritano i cannabinoidi . Dei derivati della cannabis è nota l'efficacia in oncologia (attraverso capsule di tetraidrocannabinolo (THC) ovvero l'analogo sintetico nabilone ), da un lato per combattere la nausea e il vomito indotti dalla chemioterapia, dall'altro per stimolare l'appetito e attenuare il senso di angoscia ovvero il dolore vero e proprio. [95] [96]
Dimostrata è la loro capacità di inibire la crescita e l'angiogenesi nei gliomi maligni. [97] [98]
I risultati di uno studio pilota relativo all'uso di THC su pazienti (in fase terminale) affetti da glioblastoma ricorrente sono apparsi meritevoli di approfondimento. [99]
Ma estremamente interessante è la scoperta (per ora confermata su animali) che i cannabinoidi sono in grado di attaccare le cellule staminali neoplastiche del glioblastoma, col risultato da un lato di indurre la loro differenziazione in cellule più mature (e quindi più “trattabili”) e dall'altro di inibire la tumorigenesi. [100]
Ricorrenza
Nonostante i (limitati) successi iniziali delle terapie, praticamente tutti i glioblastomi si ripresentano.
In tale situazione il paziente può essere sottoposto a una seconda operazione (se è nelle condizioni previste) ovvero può beneficiare di tecniche radioterapiche focalizzate ( radiochirurgia , se la neoplasia risponde ai requisiti visti prima. Si osservi che, di solito, non è possibile effettuare un secondo ciclo di radioterapia standard a 60 Gy.), oppure gli possono essere somministrati chemioterapici diversi dalla temozolomide (a cui il paziente ”non risponde più”). [74]
Tipici chemioterapici di ricorrenza sono la procarbazina , le nitrosuree, il melphalan , il carboplatino e altri.
In studi clinici recenti hanno mostrato un'attività antitumorale di interessante significatività l'utilizzo di mitoxantrone [101] e il combinato di idrossiurea con imatinib mesilato . [102]
Altre sperimentazioni cliniche suggeriscono l'impiego di inibitori dei recettori del fattore di crescita dell'epidermide [103] o l'utilizzo di agenti anti- angiogenesi , [104] [105] [106] ovvero di terapie combinate di radiofarmaci iniettati localmente insieme a chemioterapici pure iniettati localmente. [107]
Tutti questi studi e protocolli sono al vaglio della comunità scientifica.
Un obiettivo comunque inseguito è l'individuazione di una metodica pratica per caratterizzare le classi di pazienti per le quali un protocollo dia i risultati migliori, in modo che assegnando il particolare paziente alla classe più opportuna gli venga praticato il protocollo di maggior efficacia, utilità e minimo impatto.
Prognosi
Sperimentazioni cliniche “randomizzate” del 1978 mostravano che la sopravvivenza media dopo la chirurgia, per pazienti in cura con soli corticosteroidi, era di 14 settimane, che salivano a 38 dopo la radioterapia. [108] La chemioterapia allunga la sopravvivenza. Pazienti trattati con chirurgia, radioterapia e chemioterapia avevano una sopravvivenza media di circa 1 anno, [74] salita a 15-18 mesi nel 2015. [109] . Uno studio del 1998 riguardante 279 pazienti, che avevano ricevuto un trattamento completo aggressivo, riporta che solo 5 di essi (l'1,8%) sono sopravvissuti oltre i 3 anni. [3]
In realtà ogni paziente reagisce in modo diverso alle terapie, talché per il singolo le probabilità di sopravvivenza (nel caso di trattamento completo, comprensivo di gestione della ricorrenza) risultavano nel 2008 pari al 57% a un anno, 16% a due anni e 7% a tre anni. [110] . Dati del 2014 confermano una scarsa sopravvivenza oltre i 2,5 anni, con solo il 5% dei pazienti trattati che sopravvive a 5 anni dalla diagnosi, [111] mentre per i pazienti non trattati la sopravvivenza media è di tre mesi dalla diagnosi. [112] Dopo i 3 anni in letteratura si parla di "lunga sopravvivenza".
La sopravvivenza dopo 3 anni è rara, più frequente nel glioblastoma secondario. Un caso limite di lunga sopravvivenza (11 anni) è costituito dal famoso medico psichiatra francese David Servan-Schreiber , sopravvissuto prima 8 anni ad astrocitoma di IV stadio e poi 11 anni a glioblastoma secondario di I stadio da esso derivato, per un totale di 19 anni di vita in buona qualità, dopo la diagnosi di tumore che nel 1992 gli aveva lasciato pochi mesi. Grazie a cure sperimentali, sopravvisse 1 anno al glioblastoma di IV stadio ai lobi frontali, in discrete condizioni (2010-2011). [113] [114] [115] [116] [117] [118]
Un dato importante deriva da uno studio del 2003: la probabilità di sopravvivere per un altro anno , essendo già sopravvissuti uno, due, tre, quattro o cinque anni dopo la craniotomia è, rispettivamente, del 64,8%, 58,7%, 85,7%, 80,0%, 75,0%. [119]
Note
- ^ a b ( EN ) Kleihues P, Cavenee WK, eds. (2000), Pathology and genetics of tumours of the nervous system, World Health Organization classification of tumours . Lyon, France: IARC Press, ISBN 92-832-2409-4 . Su Internet la classificazione WHO del 2000 è reperibile all'indirizzo
Copia archiviata , su brainlife.org . URL consultato il 31 dicembre 2010 (archiviato dall' url originale l'11 gennaio 2014) . . URL consultato il 31 dicembre 2010. - ^ A. Templeton, S. Hofer, M. Topfer, A. Sommacal, C. Fretz, T. Cerny, S. Gillessen, Extraneural Spread of Glioblastoma - Report of Two Cases , in Onkologie , vol. 31, n. 4, 20 marzo 2008, pp. 192-194. URL consultato il 4 ottobre 2008 ( archiviato il 16 marzo 2012) .
- ^ a b JN. Scott, NB. Rewcastle; PM. Brasher; D. Fulton; NA. Hagen; JA. MacKinnon; G. Sutherland; JG. Cairncross; P. Forsyth, Long-term glioblastoma multiforme survivors: a population-based study. , in Can J Neurol Sci , vol. 25, n. 3, agosto 1998, pp. 197-201, PMID 9706720 .
- ^ ICD-0-3 SEER SITE/HISTOLOGY VALIDATION LIST ( PDF ), su seer.cancer.gov . URL consultato il 2 febbraio 2011 (archiviato dall' url originale il 13 giugno 2011) .
- ^ a b c M. Stefani (1996). Lezioni di anatomia patologica . Piccin. ISBN 88-299-1184-4
- ^ ( DE ) Virchow R (1863) ne provata Die Krankhaften Geschwulste . Hirschwald: Berlin.
- ^ ( EN ) Mallory FB (1914). Principles of Pathologic Histology . Saunders: Pliladelphia
- ^ a b ( EN ) Globus JH, Strauss I (1925). Spongioblastoma multiforme . Arch. Neurol. Psychiatry 14:139-151
- ^ ( EN ) Bailey P, Cushing H (1926). A Classification of Tumors of the Glioma Group on a Histogenetic Basis with a Correlation Study of Prognosis . Lippincott: Philadelphia
- ^ a b c ( EN ) Zülch KJ (1986). Brain Tumors. Their Biology and Pathology . 3rd ed, Springer Verlag: Berlin Heidelberg.
- ^ ( EN ) Russell DS, Rubinstein LJ (1989). Pathology of Tumours of the Nervous System . 5th ed, Edward Arnold: London.
- ^ ( EN ) Scherer HJ (1940). Cerebral astrocytomas and their derivatives . Am. J Cancer 40: 159-198.
- ^ KERNOHAN JW, MABON RF, A simplified classification of the gliomas , in Proc Staff Meet Mayo Clin , vol. 24, n. 3, February 1949, pp. 71–5.
- ^ Il glioblastoma è il tumore più comune che colpisce il cervello. Si notino al proposito i dati riportati nella Tabella 1 della voce Neuro-oncologia . Il meningioma, più frequente del glioblastoma, è un tumore (normalmente a istologia benigna), che origina nell' aracnoide (che ricopre il cervello e il midollo spinale), comprime ma raramente invade il cervello. A rigor di termini non è un tumore cerebrale. Allo stesso modo dei tumori delle ghiandole pituitaria e pineale, le quali non fanno strettamente parte del cervello, ma risiedono nella cavità tecale. In effetti i tumori che si sviluppano nella teca andrebbero meglio denominati come tumori intracranici . (Si veda al proposito: DeAngelis LM, Gutin PH, Leibel SA, Posner JB (2002). Intracranial Tumors: Diagnosis and Treatment . Informa Health Care. ISBN 1-901865-37-1 .)
- ^ ( EN ) Lantos PL, VandenBerg SR, Kleihues P (1996). Tumours of the Nervous System . In: Greenfield's Neuropathology , Graham DI, Lantod PL (eds), 6th ed. Arnold: London. pp. 583-879
- ^ a b c d e f g ( EN ) Kleihues P et al (2000). Glioblastoma . In Kleihues P, Cavenee WK, eds (2000). Pathology and genetics of tumours of the nervous system, World Health Organization classification of tumours . Lyon, France: IARC Press, ISBN 92-832-2409-4 .
- ^ a b ( EN ) Dohrmann GJ, Farwell JR, Flannery JT (1976).
Glioblastoma multiforme in children Archiviato il 22 novembre 2018 in Internet Archive . .
J Neurosurg 44: 442-448. - ^ ( EN ) Buetow PC, Smirniotopoulos JG, Done S (1990).
Congenital brain tumors: a review of 45 cases Archiviato il 23 luglio 2008 in Internet Archive . .
AJR AM J Roentgenol 155: 587-593. - ^ ( EN ) Lee DY, Kim YM, Yoo SJ, Cho BK, Chi JG, Kim IO, Wang KC (1999).
Congenital glioblastoma diagnosed by fetal sonography .
Childs Nerv Syst 15: 197-201. - ^ ( EN ) Sylvestre G, Sherer DM (1998).
Prenatal sonographic findings associated with malignant astrocytoma following normal early third-trimester ultrasonography Archiviato il 22 novembre 2018 in Internet Archive . .
Am J Perinatal 15: 581-584. - ^ a b ( EN ) Doren M, Tercanli S, Gullotta F, Holzgreve W (1997).
Prenatal diagnosis of a highly undifferentiated brain tumour - a case report and review of the literature Archiviato il 21 novembre 2015 in Internet Archive . .
Prenat Diagn 17: 967-971. - ^ ( EN ) Lee TT, Manzano GR (1997).
Third ventricular glioblastoma multiforme: case report Archiviato il 22 novembre 2018 in Internet Archive . .
Neurosurg Rev 20: 291-294. - ^ a b ( EN ) Henson GW (1999).
Glioblastoma multiforme and anaplastic gliomas: A patient guide Archiviato il 16 febbraio 2012 in Internet Archive . .
URL consultato il 16 luglio 2008. - ^ ( EN ) Pollak L, Walach N, Gur R, Schiffer J. (1998). Meningiomas after radiotherapy for tinea capitis — still no history Archiviato il 22 novembre 2018 in Internet Archive . . Tumori 1998;84:65-8
- ^ ( EN ) Walter AW, Hancock ML, Pui CH, Hudson MM, Ochs JS, Rivera GK, Pratt CB, Boyett JM, Kun LE (1998).
Secondary brain tumors in children treated for acute lymphoblastic leukemia at St Jude Children's Research Hospital Archiviato il 22 maggio 2007 in Internet Archive . .
J Clin Oncol 1998;16:3761-7 - ^ ( EN ) Kaplan S, Novikov I, Modan B (1997) Nutritional factors in the etiology of brain tumors: potential role of nitrosamines, fat, and cholesterol Archiviato il 1º giugno 2010 in Internet Archive . .Am J Epidemiol 1997;146:832-41.
- ^ ( EN ) Salvatore JR, Weitberg AB, Mehta S (1996). Nonionizing electromagnetic fields and cancer: a review Archiviato il 22 novembre 2018 in Internet Archive . . Oncology (Huntingt) 1996;10:563-74.
- ^ ( EN ) Inskip PD, Mellemkjaer L, Gridley G, Olsen JH (1998). Incidence of intracranial tumors following hospitalization for head injuries (Denmark) .
Cancer Causes Control 1998;9:109-16. - ^ ( EN ) Inskip PD, Tarone RE, Hatch EE, Wilcosky TC, Shapiro WR, Selker RG, Fine HA, Black PM, Loeffler JS, Linet MS (2001). Cellular-telephone use and brain tumors Archiviato il 22 aprile 2007 in Internet Archive . .N Engl J Med 2001;344:79-86.
- ^ ( EN ) DeAngelis LM (2001).
Brain Tumors Archiviato il 2 gennaio 2008 in Internet Archive . .
N Engl J Med Vol. 344(2):114-123, January 11, 2001 - ^ Rice JM, Wilbourn JD, Tumors of the nervous system in carcinogenic hazard identification. , in Toxicol Pathol , vol. 28, n. 1, 2000, pp. 202-14, DOI : 10.1177/019262330002800125 , PMID 10669008 .
- ^ Cordier S, Monfort C, Filippini G, Preston-Martin S, Lubin F, Mueller BA, Parental exposure to polycyclic aromatic hydrocarbons and the risk of childhood brain tumors: The SEARCH International Childhood Brain Tumor Study. , in Am J Epidemiol , vol. 159, n. 12, 2004, pp. 1109-16, DOI : 10.1093/aje/kwh154 , PMID 15191928 .
- ^ G. Filippini (2006). Epidemiologia dei tumori cerebrali [ collegamento interrotto ] . Mediterranean School of Oncology, Roma 6-7 luglio 2006. URL consultato il 10-11-2008.
- ^ a b c d Macchi G. (1981 [I ed], 2005 [II ed]). Malattie del sistema nervoso . PICCIN Editore. ISBN 88-299-1739-7 .
- ^ Tomei G, Anzelmo V, Carbone M (2006). Agenti cancerogeni e sistema nervoso centrale [ collegamento interrotto ] 25 marzo 2006. XXI Giornata Romana di Medicina del Lavoro. Scuola di Specializzazione Medicina del Lavoro "La Sapienza".
- ^ ( EN ) Nottebohm F (2004).
The road we travelled: discovery, choreography, and significance of brain replaceable neurons .
Ann. NY Acad. Sci. 1016, 628–658. - ^ ( EN ) Reynolds BA & Weiss S (1992).
Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system Archiviato il 27 febbraio 2009 in Internet Archive . .
Science 255, 1707–1710. - ^ ( EN ) Gould E, McEwen BS, Tanapat P, Galea, LA & Fuchs E (1997).
Neurogenesis in the dentate gyrus of the adult tree shrew is regulated by psychosocial stress and NMDA receptor activation Archiviato l'11 ottobre 2008 in Internet Archive . .
J. Neurosci. 17, 2492–2498. - ^ ( EN ) Gould E, Tanapat P, McEwen, BS, Flugge G & Fuchs E (1998).
Proliferation of granule cell precursors in the dentate gyrus of adult monkeys is diminished by stress .
Proc. Natl Acad. Sci. USA 95, 3168–3171. - ^ ( EN ) Eriksson PS, Perfilieva E, Björk-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH (1998).
Neurogenesis in the adult human hippocampus Archiviato il 4 giugno 2016 in Internet Archive . .
Nature Med. 4, 1313–1317. - ^ ( EN ) Lie DC, Song H, Colamarino SA, Ming GL & Gage FH (2004).
Neurogenesis in the adult brain: new strategies for central nervous system diseases .
Annu. Rev. Pharmacol. Toxicol. 44, 399–421. - ^ a b ( EN ) Vescovi AL, Galli R and Reynolds BA (2006).
Brain tumour stem cells .
Nature Reviews Cancer 6, 425-436 (June 2006). - ^ ( EN ) Ignatova TN, Kukekov VG, Laywell ED, Suslov ON, Vrionis FD, Steindler DA (2002).
Human cortical glial tumors contain neural stem-like cells expressing astroglial and neuronal markers in vitro .
Glia 39, 193–206. - ^ ( EN ) Singh SK, Clarke ID, Terasaki M, Bonn VE, Hawkins C, Squire J, Dirks PB (2003).
Identification of a cancer stem cell in human brain tumors Archiviato il 12 dicembre 2008 in Internet Archive . .
Cancer Res. 63, 5821–5828. - ^ ( EN ) Galli R, Binda E, Orfanelli U, Cipelletti B, Gritti A, De Vitis S, Fiocco R, Foroni C, Dimeco F, Vescovi A (2004).
Isolation and characterization of tumorigenic, stem-like neural precursors from human glioblastoma Archiviato il 7 ottobre 2008 in Internet Archive . .
Cancer Res. 64, 7011–7021. - ^ ( EN ) Bao S, Wu Q, McLendon RE, Hao Y, Shi Q, Hjelmeland AB, Dewhirst MW, Bigner DD and Rich JN (2006).
Glioma stem cells promote radioresistance by preferential activation of the DNA damage response Archiviato il 19 ottobre 2016 in Internet Archive . .
Nature advance online publication 18 October 2006. - ^ ( EN ) Rich JN (2007).
Cancer Stem Cells in Radiation Resistance Archiviato il 1º dicembre 2008 in Internet Archive . .
Cancer Research 67, 8980-8984, October 1, 2007. - ^ ( EN ) Liu G, Yuan X, Zeng Z, Tunici P, Ng H, Abdulkadir IR, Lu L, Irvin D, Black KL and Yu JS (2006).
Analysis of gene expression and chemoresistance of CD133+ cancer stem cells in glioblastoma .
Molecular Cancer 2006, 5:67. Published: 2 December 2006. - ^ ( EN ) Salmaggi A, Boiardi A, Gelati M, Russo A, Calatozzolo C, Ciusani E, Sciacca FL, Ottolina A, Parati EA, La Porta C, Alessandri G, Marras C, Croci D, De Rossi M (2006).
Glioblastoma-derived tumorospheres identify a population of tumor stem-like cells with angiogenic potential and enhanced multidrug resistance phenotype .
Glia. 2006 Dec;54(8):850-60. Epub 2006 Sep 15. - ^ ( EN ) Murat A, Migliavacca E, Gorlia T, Lambiv WL, Shay T, Hamou MF, de Tribolet N, Regli L, Wick W, Kouwenhoven MC, Hainfellner JA, Heppner FL, Dietrich PY, Zimmer Y, Cairncross JG, Janzer RC, Domany E, Delorenzi M, Stupp R, Hegi ME (2008).
Stem cell-related "self-renewal" signature and high epidermal growth factor receptor expression associated with resistance to concomitant chemoradiotherapy in glioblastoma Archiviato il 30 settembre 2008 in Internet Archive . .
J Clin Oncol. 2008 Jun 20;26(18):3015-24. - ^ ( EN ) Hill RP (2006).
Identifying Cancer Stem Cells in Solid Tumors: Case Not Proven Archiviato l'11 maggio 2008 in Internet Archive . .
Cancer Research 66, 1891-1896, February 15, 2006. - ^ ( EN ) Kelly PN, Dakic A, Adams JM, Nutt SL, Strasser A (2007).
Tumor growth need not be driven by rare cancer stem cells Archiviato il 10 maggio 2008 in Internet Archive . .
Science. 2007 Jul 20;317(5836):337. - ^ ( EN ) Jin F, Zhao L, Zhao HY, Guo SG, Feng J, Jiang XB, Zhang SL, Wei YJ, Fu R, Zhao JS (2008).
Paradoxical expression of anti-apoptotic and MRP genes on cancer stem-like cell isolated from TJ905 glioblastoma multiforme cell line Archiviato il 29 giugno 2021 in Internet Archive . .
Cancer Invest. 2008 May;26(4):338-43. - ^ ( EN ) Yoo MH, Hatfield DL (2008).
The Cancer Stem Cell Theory: Is It Correct? [ collegamento interrotto ] .
Mol Cells. 2008 Aug 14;26(5). - ^ ( EN ) Prestegarden L, Enger PØ (2010).
Cancer stem cells in the central nervous system--a critical review Archiviato il 21 febbraio 2011 in Internet Archive . .
Cancer Res. 2010 Nov 1;70(21):8255-8. Epub 2010 Oct 19. - ^ a b c d e f ( EN ) Kleihues P, Burger PC, Aldape KD, Brat DJ, Biernat W, Bigner DD, Nakazato Y, Plate KH, Giangaspero F, von Deimling A, Ohgaki H, Cavenee WK (2007). Glioblastoma . In ( EN ) Louis DN, Ohgaki H, Wiestler OD, Cavenee WK (eds) (2007). World Health Organization Classification of Tumours of the Central Nervous System . IARC, Lyon.
- ^ ( EN ) Wilkening S, Bermejo JL, Burwinkel B, Klaes R, Bartram CR, Meindl A, Bugert P, Schmutzler RK, Wappenschmidt B, Untch M, Hemminki K, Försti A (2006). The Single Nucleotide Polymorphism IVS1+309 in 'Mouse Double Minute 2' Does Not Affect Risk of Familial Breast Cancer Archiviato il 14 maggio 2007 in Internet Archive . .
Cancer Research 66, 646-648, January 15, 2006 - ^ ( EN ) Wang X, Trotman LC, Koppie T, Alimonti A, Chen Z, Gao Z, Wang J, Erdjument-Bromage H, Tempst P, Cordon-Cardo C, Pandolfi PP, Jiang X (2007).
NEDD4-1 Is a Proto-Oncogenic Ubiquitin Ligase for PTEN .
Cell 128: 129-139. - ^ ( EN ) Trotman LC, Wang X, Alimonti A, Chen Z, Teruya-Feldstein J, Yang H, Pavletich NP, Carver BS, Cordon-Cardo C, Erdjument-Bromage H, Tempst P, Chi SG, Kim HJ, Misteli T, Jiang X, Pandolfi PP (2007).
Ubiquitination Regulates PTEN Nuclear Import and Tumor Suppression Archiviato il 29 giugno 2021 in Internet Archive . .
Cell 128: 141-156. - ^ ( EN ) Shen WH, Balajee AS, Wang J, Wu H, Eng C, Pandolfi PP, Yin Y (2007).
Essential Role for Nuclear PTEN in Maintaining Chromosomal Integrity .
Cell 128: 157-170 - ^ ( EN ) Kleihues P and Ohgaki H (1999).
Primary and secondary glioblastomas: From concept to clinical diagnosis .
Neuro-oncol 1999 January; 1(1): 44-51 - ^ ( EN ) Ohgaki H, Dessen P, Jourde B, Horstmann S, Nishikawa T, Di Patre PL, Burkhard C, Schüler D, Probst-Hensch NM, Maiorka PC, Baeza N, Pisani P, Yonekawa Y, Yasargil MG, Lütolf UM, Kleihues P (2004).
Genetic pathways to glioblastoma: a population-based study Archiviato il 9 marzo 2007 in Internet Archive . .
Cancer Res. 2004 Oct 1;64(19):6892-9 - ^ a b Ohgaki H, Kleihues P (2007).
Genetic pathways to primary and secondary glioblastoma .
Am J Pathol. 2007 May;170(5):1445-53 - ^ ( EN ) Per una trattazione aggiornata, comprensiva di descrizione e terapia, si può esaminare su Internet (in Inglese)
Copia archiviata , su brainlife.org . URL consultato il 6 agosto 2008 (archiviato dall' url originale il 23 giugno 2008) . . URL consultato il 24 agosto 2008. - ^ Colorazione intensa dei nuclei con cromatina nucleare addensata
- ^ Diversità di forma cellulare in relazione al mutare delle condizioni ambientali
- ^ Formazione di nuovi vasi sanguigni per fornire ossigeno e fattori nutritivi alle cellule tumorali
- ^ Burger PC, Kleihues P (1989).
Cytologic composition of the untreated glioblastoma with implications for evaluation of needle biopsies .
Cancer 63: 2014-2023 - ^ Fujisawa H, Kurrer M, Reis RM, Yonekawa Y, Kleihues P, Ohgaki H (1999).
Acquisition of the Glioblastoma Phenotype during Astrocytoma Progression Is Associated with Loss of Heterozygosity on 10q25-qter . American Journal of Pathology. 1999;155:387-394. - ^ Di aspetto e consistenza vetrosa, semitrasparente
- ^ I sintomi e segni elencati non sono dunque specifici del glioblastoma, ma, in generale, fanno la loro comparsa per altre e diverse cause
- ^ a b c Bruzzone MG, Farina L.
Imaging dei gliomi cerebrali. Archiviato l'8 maggio 2008 in Internet Archive .
URL consultato il 22-09-2008. - ^ a b c d Biagini C, Gavelli G (1999). Radiobiologia e radioprotezione. PICCIN Editore. ISBN 88-299-1463-0 .
- ^ a b c d e f g h i j k l m n ( EN ) DeAngelis LM, Loeffler JS, Adam N. Mamelak AN (2007).
Primary and Metastatic Brain Tumors Archiviato il 7 settembre 2008 in Internet Archive . .
In Pazdur R, Coia LR, Hoskins WJ, and Wagman LD (2007). Cancer Management: A Multidisciplinary Approach, 10th Edition .
URL consultato il 24-09-2008. - ^ a b ( EN ) Chang SM, Parney IF, Huang W, Anderson FA Jr, Asher AL, Bernstein M, Lillehei KO, Brem H, Berger MS, Laws ER; Glioma Outcomes Project Investigators (2005).
Patterns of care for adults with newly diagnosed malignant glioma Archiviato il 5 settembre 2008 in Internet Archive .
JAMA 2005 Feb 2;293(5):557-64. - ^ ( EN ) Williams BA (2008).
Treatment Options for Glioblastoma and other Gliomas [ collegamento interrotto ]
BrainLife Newsletter Volume 7, Number 19 - 1 October 2008. - ^ ( EN ) Barnholtz-Sloan JS, Williams VL, Maldonado JL, Shahani D, Stockwell HG, Chamberlain M, Sloan AE (2008).
Patterns of care and outcomes among elderly individuals with primary malignant astrocytoma Archiviato il 29 giugno 2021 in Internet Archive .
J Neurosurg. 2008 Apr;108(4):642-648. - ^ ( EN ) Forsyth PA, Weaver S, Fulton D, Brasher PMA, Sutherland G, Stewart D, Hagen NA (2003).
Prophylactic Anticonvulsants in Patients with Brain Tumour Archiviato il 22 novembre 2018 in Internet Archive . .
The Canadian Journal of Neurological Sciences, Volume 30, Number 2 / May 2003. - ^ a b ( EN ) Laws ER, Parney IF, Huang W, Anderson F, Morris AM, Asher A, Lillehei KO, Bernstein M, Brem H, Sloan A, Berger MS, Chang S; Glioma Outcomes Investigators (2003).
Survival following surgery and prognostic factors for recently diagnosed malignant glioma: data from the Glioma Outcomes Project [ collegamento interrotto ] .
J Neurosurg. 2003 Sep;99(3):467-73. - ^ ( EN ) Liau LM, Prins RM, Kiertscher SM, Odesa SK, Kremen TJ, Giovannone AJ, Lin JW, Chute DJ, Mischel PS, Cloughesy TF, Roth MD (2005).
Dendritic cell vaccination in glioblastoma patients induces systemic and intracranial T-cell responses modulated by the local central nervous system tumor microenvironment Archiviato il 24 luglio 2008 in Internet Archive . .
Clin Cancer Res. 2005 Aug 1;11(15):5515-25. - ^ ( EN ) Tatter SB, Shaw EG, Rosenblum ML, Karvelis KC, Kleinberg L, Weingart J, Olson JJ, Crocker IR, Brem S, Pearlman JL, Fisher JD, Carson K, Grossman SA; New Approaches to Brain Tumor Therapy Central Nervous System Consortium (2003).
An inflatable balloon catheter and liquid 125I radiation source (GliaSite Radiation Therapy System) for treatment of recurrent malignant glioma: multicenter safety and feasibility trial [ collegamento interrotto ] .
J Neurosurg. 2003 Aug;99(2):297-303. - ^ ( EN ) Chiocca EA, Broaddus WC, Gillies GT, Visted T, Lamfers ML (2004).
Neurosurgical delivery of chemotherapeutics, targeted toxins, genetic and viral therapies in neuro-oncology.
J Neurooncol. 2004 Aug-Sep;69(1-3):101-17. - ^ ( EN ) Perry J, Chambers A, Spithoff K, Laperriere N (2007).
Gliadel wafers in the treatment of malignant glioma: a systematic review .
Curr Oncol. 2007 Oct;14(5):189-94. - ^ ( EN ) Attenello FJ, Mukherjee D, Datoo G, McGirt MJ, Bohan E, Weingart JD, Olivi A, Quinones-Hinojosa A, Brem H (2008).
Use of Gliadel (BCNU) Wafer in the Surgical Treatment of Malignant Glioma: A 10-Year Institutional Experience .
Ann Surg Oncol. 2008 Jul 18. - ^ ( EN ) Kenneth M. Little, Allan H. Friedman, Awake craniotomy for malignant glioma resection , Volume 1259, February 2004, Pages 409–414 Archiviato il 29 giugno 2021 in Internet Archive .
- ^ ( EN ) Rachel Grossman, Zvi Ram, Awake Craniotomy in Glioma Surgery , Eur Assoc NeuroOncol, Mag 2014; 4 (1): pp. 27–33 Archiviato l'8 agosto 2017 in Internet Archive .
- ^ ( EN ) Walker MD, Strike TA, Sheline GE (1979).
An analysis of dose-effect relationship in the radiotherapy of malignant gliomas Archiviato il 22 novembre 2018 in Internet Archive . .
Int J Radiat Oncol Biol Phys. 1979 Oct;5(10):1725-31. [Median OS: no RT 18 weeks vs. 50 Gy 28 weeks vs. 55 Gy 36 weeks vs. 60 Gy 42 weeks] - ^ a b c ( EN ) Cook B, Dvorak T et al . Radiation Oncology Archiviato il 26 maggio 2019 in Internet Archive . . Wikibook.
Section High Grade Gliomas Adjuvant Therapy Archiviato il 9 luglio 2020 in Internet Archive . .
URL consultato il 30-09-2008 - ^ ( EN ) Buatti J, Ryken TC, Smith MC, Sneed P, Suh JH, Mehta M, Olson JJ (2008).
Radiation therapy of pathologically confirmed newly diagnosed glioblastoma in adults .
J Neurooncol. 2008 Sep;89(3):313-37. Epub 2008 Aug 20. - ^ ( EN ) Roa W, Brasher PM, Bauman G, Anthes M, Bruera E, Chan A, Fisher B, Fulton D, Gulavita S, Hao C, Husain S, Murtha A, Petruk K, Stewart D, Tai P, Urtasun R, Cairncross JG, Forsyth P (2004).
Abbreviated course of radiation therapy in older patients with glioblastoma multiforme: a prospective randomized clinical trial Archiviato l'11 luglio 2007 in Internet Archive . .
J Clin Oncol. 2004 May 1;22(9):1583-8. Epub 2004 Mar 29. - ^ ( EN ) Stupp R, Mason WP, van den Bent MJ, Weller M, Fisher B, Taphoorn MJ, Belanger K, Brandes AA, Marosi C, Bogdahn U, Curschmann J, Janzer RC, Ludwin SK, Gorlia T, Allgeier A, Lacombe D, Cairncross JG, Eisenhauer E, Mirimanoff RO; European Organisation for Research and Treatment of Cancer Brain Tumor and Radiotherapy Groups; National Cancer Institute of Canada Clinical Trials Group. (2005).
Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma Archiviato il 13 maggio 2008 in Internet Archive . .
NEJM Volume=352, Issue=10, pages=987-996. - ^ ( EN ) Hegi ME, Diserens AC, Gorlia T, Hamou MF, de Tribolet N, Weller M, Kros JM, Hainfellner JA, Mason W, Mariani L, Bromberg JE, Hau P, Mirimanoff RO, Cairncross JG, Janzer RC, Stupp R (2005).
MGMT gene silencing and benefit from temozolomide in glioblastoma Archiviato il 4 settembre 2008 in Internet Archive . .
N Engl J Med. 2005 Mar 10;352(10):997-1003. - ^ ( EN ) Hegi ME, Liu L, Herman JG, Stupp R, Wick W, Weller M, Mehta MP, Gilbert MR (2008).
Correlation of O6-methylguanine methyltransferase (MGMT) promoter methylation with clinical outcomes in glioblastoma and clinical strategies to modulate MGMT activity Archiviato il 3 ottobre 2008 in Internet Archive . .
J Clin Oncol. 2008 Sep 1;26(25):4189-99. - ^ ( EN ) Brandes AA, Franceschi E, Tosoni A, Blatt V, Pession A, Tallini G, Bertorelle R, Bartolini S, Calbucci F, Andreoli A, Frezza G, Leonardi M, Spagnolli F, Ermani M (2008).
MGMT promoter methylation status can predict the incidence and outcome of pseudoprogression after concomitant radiochemotherapy in newly diagnosed glioblastoma patients Archiviato il 7 settembre 2008 in Internet Archive . .
J Clin Oncol. 2008 May 1;26(13):2192-7. - ^ ( EN ) Hall W, Christie M, Currow D (2005).
Cannabinoids and cancer: causation, remediation, and palliation Archiviato il 22 maggio 2009 in Internet Archive . .
Lancet Oncol 6: 35–42 (January 2005). - ^ ( EN ) Guzmán M (2003).
Cannabinoids: potential anticancer agents Archiviato il 24 giugno 2017 in Internet Archive . .
Nat Rev Cancer 3: 745–755 (October 2003). - ^ ( EN ) Massi P, Vaccani A, Ceruti S, Colombo A, Abbracchio MP, Parolaro D (2004).
Antitumor Effects of Cannabidiol, a Nonpsychoactive Cannabinoid, on Human Glioma Cell Lines Archiviato il 21 agosto 2008 in Internet Archive . .
J Pharmacol Exp Ther. 2004 Mar;308(3):838-45. Epub 2003 Nov 14. - ^ ( EN ) Blázquez C, Casanova ML, Planas A, Gómez Del Pulgar T, Villanueva C, Fernández-Aceñero MJ, Aragonés J, Huffman JW, Jorcano JL, Guzmán M (2003).
Inhibition of tumor angiogenesis by cannabinoids Archiviato il 20 agosto 2020 in Internet Archive . .
FASEB J. 2003 Mar;17(3):529-31. Epub 2003 Jan 2. - ^ ( EN ) Guzmán M, Duarte MJ, Blázquez C, Ravina J, Rosa MC, Galve-Roperh I, Sánchez C, Velasco G, González-Feria L (2006).
A pilot clinical study of Delta9-tetrahydrocannabinol in patients with recurrent glioblastoma multiforme Archiviato l'11 novembre 2020 in Internet Archive . .
Br J Cancer. 2006 Jul 17;95(2):197-203. Epub 2006 Jun 27. - ^ ( EN ) Aguado T, Carracedo A, Julien B, Velasco G, Milman G, Mechoulam R, Alvarez L, Guzmán M, Galve-Roperh I (2007).
Cannabinoids Induce Glioma Stem-like Cell Differentiation and Inhibit Gliomagenesis Archiviato il 18 giugno 2008 in Internet Archive . .
J Biol Chem. 2007 Mar 2;282(9):6854-62. Epub 2007 Jan 2. - ^ ( EN ) Boiardi A, Silvani A, Eoli M, Lamperti E, Salmaggi A, Gaviani P, Fiumani A, Botturi A, Falcone C, Solari A, Filippini G, Di Meco F, Broggi G (2008).
Treatment of recurrent glioblastoma: can local delivery of mitoxantrone improve survival? .
J Neurooncol. 2008 Feb 19. - ^ ( EN ) Reardon DA, Egorin MJ, Quinn JA, Rich JN, Gururangan S, Vredenburgh JJ, Desjardins A, Sathornsumetee S, Provenzale JM, Herndon JE 2nd, Dowell JM, Badruddoja MA, McLendon RE, Lagattuta TF, Kicielinski KP, Dresemann G, Sampson JH, Friedman AH, Salvado AJ, Friedman HS (2005).
Phase II study of imatinib mesylate plus hydroxyurea in adults with recurrent glioblastoma multiforme Archiviato il 24 settembre 2008 in Internet Archive . .
J Clin Oncol. 2005 Dec 20;23(36):9359-68. - ^ ( EN ) Combs SE, Heeger S, Haselmann R, Edler L, Debus J and Schulz-Ertner D (2006).
Treatment of primary glioblastoma multiforme with cetuximab, radiotherapy and temozolomide (GERT) - phase I/II trial: study protocol Archiviato l'11 maggio 2008 in Internet Archive . .
BMC Cancer 2006, 6:133; Published: 18 May 2006. - ^ ( EN ) Reardon DA, Desjardins A, Rich JN, Vredenburgh JJ (2008).
The emerging role of anti-angiogenic therapy for malignant glioma .
Curr Treat Options Oncol. 2008 Feb;9(1):1-22. Epub 2008 Feb 7. - ^ ( EN ) Marx GM, Pavlakis N, McCowatt S, Boyle FM, Levi JA, Bell DR, Cook R, Biggs M, Little N, Wheeler HR (2001).
Phase II study of thalidomide in the treatment of recurrent glioblastoma multiforme .
J Neurooncol 2001 Aug;54(1):31-8. - ^ ( EN ) Baumann F, Bjeljac M, Kollias SS, Baumert BG, Brandner S, Rousson V, Yonekawa Y, Bernays RL (2004).
Combined Thalidomide and Temozolomide Treatment in Patients with Glioblastoma Multiforme .
Journal of Neuro-Oncology, 67 (1-2): 191-200, March, 2004 - April, 2004. - ^ ( EN ) Boiardi A, Bartolomei M, Silvani A, Eoli M, Salmaggi A, Lamperti E, Milanesi I, Botturi A, Rocca P, Bodei L, Broggi G and Paganelli G (2005).
Intratumoral delivery of mitoxantrone in association with 90-Y radioimmunotherapy (RIT) in recurrent glioblastoma .
Journal of Neuro-Oncology, Vol 72, Number 2, April, 2005, Pages 125-131, Online Date May 31, 2005. - ^ MD. Walker, E. Alexander; WE. Hunt; CS. MacCarty; MS. Mahaley; J. Mealey; HA. Norrell; G. Owens; J. Ransohoff; CB. Wilson; EA. Gehan, Evaluation of BCNU and/or radiotherapy in the treatment of anaplastic gliomas. A cooperative clinical trial. , in J Neurosurg , vol. 49, n. 3, settembre 1978, pp. 333-43, DOI : 10.3171/jns.1978.49.3.0333 , PMID 355604 .
- ^ VA. Venur, DM. Peereboom; MS. Ahluwalia, Current medical treatment of glioblastoma. , in Cancer Treat Res , vol. 163, 2015, pp. 103-15, DOI : 10.1007/978-3-319-12048-5_7 , PMID 25468228 .
- ^ G. Filippini, C. Falcone; A. Boiardi; G. Broggi; MG. Bruzzone; D. Caldiroli; R. Farina; M. Farinotti; L. Fariselli; G. Finocchiaro; S. Giombini, Prognostic factors for survival in 676 consecutive patients with newly diagnosed primary glioblastoma. , in Neuro Oncol , vol. 10, n. 1, febbraio 2008, pp. 79-87, DOI : 10.1215/15228517-2007-038 , PMID 17993634 . URL consultato il 28 settembre 2008 (archiviato dall' url originale il 18 gennaio 2008) .
- ^ JP. Thakkar, TA. Dolecek; C. Horbinski; QT. Ostrom; DD. Lightner; JS. Barnholtz-Sloan; JL. Villano, Epidemiologic and molecular prognostic review of glioblastoma. , in Cancer Epidemiol Biomarkers Prev , vol. 23, n. 10, Oct 2014, pp. 1985-96, DOI : 10.1158/1055-9965.EPI-14-0275 , PMID 25053711 .
- ^ H. Cholewa, K. Duda; K. Łabuzek; B. Okopień, [The newest perspectives on the treatment of glioblastoma multiforme]. , in Pol Merkur Lekarski , vol. 37, n. 218, agosto 2014, pp. 119-23, PMID 25252449 .
- ^ Scott JN, Rewcastle NB, Brasher PM, Fulton D, Hagen NA, MacKinnon JA, Sutherland G, Cairncross JG, Forsyth P (1998). Long-term glioblastoma multiforme survivors: a population-based study. , Can J Neurol Sci. 1998 Aug;25(3):197-201. , su ncbi.nlm.nih.gov . URL consultato il 26 marzo 2020 ( archiviato l'8 maggio 2017) .
- ^ Notizia della morte da France2 , su info.france2.fr ( archiviato il 29 giugno 2021) .
- ^ David Servan-Schreiber est mort , su leparisien.fr . URL consultato il 26 marzo 2020 ( archiviato il 26 marzo 2020) .
- ^ In memory of David Servan-Schreiber 1961-2011 Archiviato il 25 dicembre 2014 in Internet Archive .
- ^ David Servan-Schreiber's approach to living and dying Archiviato il 27 settembre 2014 in Internet Archive .
- ^ Le combat contre la mort de David Servan-Schreiber , su tempsreel.nouvelobs.com . URL consultato il 26 marzo 2020 ( archiviato il 2 novembre 2017) .
- ^ CL. Lin, AS. Lieu; KS. Lee; YH. Yang; TH. Kuo; MH. Hung; JK. Loh; CP. Yen; CZ. Chang; SL. Howng; SL. Hwang, The conditional probabilities of survival in patients with anaplastic astrocytoma or glioblastoma multiforme. , in Surg Neurol , vol. 60, n. 5, Nov 2003, pp. 402-6; discussion 406, PMID 14572960 .
Voci correlate
- Classificazione dei tumori del sistema nervoso centrale
- Gradazione dei tumori del sistema nervoso centrale
- Neurooncologia
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su glioblastoma
Wikimedia Commons contiene immagini o altri file su glioblastoma
Collegamenti esterni
| Classificazione e risorse esterne ( EN ) | ICD-10 : C71 ; OMIM : 137800 ; MeSH : D005909 ; DiseasesDB : 29448 ;eMedicine : 1156220 e 283252 ; |
| Controllo di autorità | LCCN ( EN ) sh91003964 · GND ( DE ) 4157617-2 |
|---|