Hidrocarburi
Hidrocarburile sunt compuși organici care conțin numai atomi de carbon și hidrogen . [1] [2]
Utilizate pe scară largă ca combustibili , sursa lor principală în natură este sursa fosilă .
Caracteristici
Atomii de carbon (C) sunt legați împreună pentru a forma scheletul moleculei, în timp ce atomii de hidrogen (H) ies din acest schelet. Hidrocarburile sunt singura clasă de compuși organici lipsiți de grupări funcționale , sunt compuși de fapt numai de atomi de hidrogen și carbon.
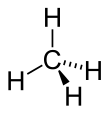
Pe măsură ce crește numărul atomilor de carbon din lanțul de hidrocarburi, crește numărul de posibili compuși de hidrocarburi. Cel mai scurt lanțul posibil este compus din doar un atom de carbon, care corespunde cu metan , având formula empirică CH 4.
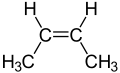
Există trei hidrocarburi cu doi atomi de carbon:
Aceste trei hidrocarburi diferă prin numărul de legături care țin împreună cei doi atomi de carbon adiacenți: o legătură (deci vorbim de „legătură simplă”) în cazul etanului, două legături („dublă legătură”) în cazul etilenei și trei legături („triplă legătură”) în cazul acetilenei.
În structura unei hidrocarburi generic fiecare carbon atom utilizări de la unu la trei electroni de valență pentru a forma legături cu carbonul adiacent, în timp ce electronii de valență de carbon rămase sunt utilizate pentru a forma legături cu atomii de hidrogen. In interiorul moleculei de hidrocarburi poate fi vorba de atomii de carbon la care ei nu sunt atomi de hidrogen legați, dar numai alți atomi de carbon (de exemplu , este atomul de carbon central al moleculei neopentan ).
Clasificarea hidrocarburilor
O primă distincție între diferitele hidrocarburi se referă la lor starea fizică în condițiile de presiune și de temperatură a mediului și anume:
- Hidrocarburile solide sau semisolide: constituenți ai " asfalt , cu bitum și , ceară de parafină, etc ..
- Hidrocarbura lichide : constituenți de petrol (țiței), benzen , hexan , octan , etc.
- Hidrocarbonate gazelor : metan , etan , propan , butan , etc ..
Din punct de vedere al proprietăților chimice, hidrocarburile sunt împărțite în două clase principale:
- hidrocarburi aromatice : echipat cu „aromaticitate“, un proprietăți chimice conferită de un inel benzenic , ceea ce le face deosebit de stabil; [1]
- hidrocarburi alifatice : nu sunt echipate cu aromaticitate.
Diferitele tipuri de hidrocarburi (alcani, alcheni etc.) descrise mai jos sunt denumite „serii omoloage”.
Clasificarea descrisă aici nu este intenționată să fie exhaustivă, de fapt există multe tipuri de hidrocarburi care nu sunt bine clasificate, cum ar fi, de exemplu, catenanii , care sunt alcătuite din mai multe inele inserate unul în celălalt, astfel încât fiecare să se poată deplasa independent de cealaltă, dar fără „topire” (într-un mod similar cu inelele unui lanț de oțel, de unde și numele). [3]
Hidrocarburi alifatice
În funcție de CC tipuri de obligațiuni prezintă în moleculă (single, duble sau triple) și geometria lor (liniar, ramificat, ciclic), hidrocarburi alifatice se împart în: [1]
- Hidrocarburi saturate cu numai CC obligațiuni unică [4]
- Alcani (sau parafine): hidrocarburi saturate non-ciclice, adică având un lanț nu reînchisă pe ea însăși; Ei au formula generală CnH2n + 2. La rândul lor, ele pot fi liniare sau ramificate, în funcție de faptul dacă atomii de carbon se succed continuu sau cu bifurcații
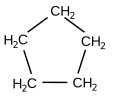
- cicloalcani : hidrocarburi saturate ciclice, având formula generală CnH2n [5]
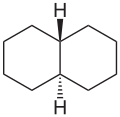
- bicicloalcani : hidrocarburi saturate constau din două catene ciclice învecinate [5]
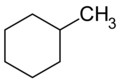
- alchilcicloalcani : hidrocarburi saturate constau dintr - un lanț de hidrocarbură ciclică legată de un lanț non-ciclic) [6]
Formula structura ciclopentan (a cicloalcani )
Formula structura decalină (a bicicloalcano )
Formula structura metilciclohexan (a alchilcicloalcano )
- hidrocarburi nesaturate conțin cel puțin o legătură multiplă CC (adică, dublu sau triplu) [4] . Legăturile formate din doi sau mai mulți atomi prezent în catena de carbon care constituie scheletul moleculei trigonal geometrie , deoarece Have ei sunt hibridizate sp 2 sau au o geometrie liniară , deoarece acestea sunt sp hibridizar; în scheletul moleculei există cel puțin o legătură dublă, σ + π;
- Alchene (sau olefine): non-ciclice și cu o legătură C = C dublă, având formula generală CnH2n
- diene (sau alcadienelor), trienes (sau alcatrieni), poliene : non-ciclice și având respectiv două, trei sau mai multe legături duble C = C
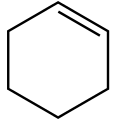
- cicloalchene : ciclic, cu o dublă C = C legătură, având formula generală CnH2n-2
- alchinele : non-ciclice și cu o triplă legătură C = C, având formula generală CnH2n-2
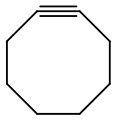
- cicloalchine : ciclic, cu o triplă legătură, având formula generală CnH2n-4.
Formula structura ciclohexenă (a cicloalchenă )
Formula structura cicloottino (a cicloalchino )
Hidrocarburile alifatice ciclice sunt numite hidrocarburi aciclice .
Hidrocarburi aromatice
În funcție de tipul de structură, hidrocarburile aromatice pot fi împărțite în:
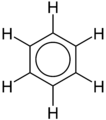
- benzen și derivații
- hidrocarburi aromatice policiclice (sau „policiclic“)
Structura Formula benzen (o hidrocarbură aromatică)
Structura Formula de cumen (un derivat de benzen)
Formula structurală a ' antracen (o polinucleato hidrocarbură aromatică)
Proprietate
În general , pentru alcanii aciclice, cei cu greutate moleculară similară au proprietăți chimice și fizice similare.
Ele există în natură diferite amestecuri de hidrocarburi, cu caratteristhe fizico-chimice intermediare de la o categorie la alta.
Starea de agregare

Starea de agregare hidrocarburilor (la temperatura ambiantă și presiunea) depinde de greutatea lor moleculară: hidrocarburi având o greutate moleculară mai mică ( de exemplu , metan , etan , propan ) pot fi găsite în stare gazoasă, cei cu greutate moleculară mai mare ( de exemplu , benzen , hexan și octan ) sunt lichide și cei având greutate moleculară mai mare sunt solide ceroase.
Adesea , hidrocarburile care temperatura și presiunea sunt sub formă de gaz sunt menținute în interiorul recipientelor sub presiune ( de exemplu buteliile ), astfel încât să le păstreze în volume mai mici. De fapt, la aceeași temperatură și cantitate a substanței , odată cu creșterea presiunii, aceasta scade volumul ocupat de un gaz (după cum se deduce din „ legea ideală a gazului sau din alte ecuații de stare ), până când trece (parțial sau total ) la starea lichidă. De exemplu, comun „a buteliilor de gaz“ , utilizat într - un mediu casnic , care conține un amestec de hidrocarburi lichide (cunoscut sub numele de GPL ) , care sunt gazoase la temperatura și presiunea ambiantă.
Stabilitate / reactivitate
Hidrocarburile ciclice formate din mai puțin de șase atomi de carbon sunt deosebit de instabile datorită micității inelului, care are ca rezultat o tensiune ridicată a inelului (sau „tensiune unghiulară”), care este o energie ridicată stocată în moleculă care tinde să deschidă inelul . [7]
În general, hidrocarburi saturate, cu toate că acestea sunt foarte inflamabile și astfel ușor reacționează cu " oxigenul , au o relativă inerția chimică; Din acest motiv , au fost numite parafine (de la latini affinis parum, „nereactiv“). [8]
Hidrocarburile care conțin nesaturații au alte proprietăți, datorate legăturilor duble sau triple și sunt chimic mai reactive în pozițiile care conțin legătura dublă sau triplă sau imediat adiacente acestora.
Hidrocarburile aromatice formează o clasă proprie în termeni de stabilitate și au o reactivitate chimică foarte diferită de cea a hidrocarburilor alifatice.
Polaritate
Moleculele de alcani și cicloalcani sunt apolar , deoarece, chiar dacă CH legătură covalentă este polarizat, diferența de electronegativitate este destul de scăzut (0,4) și conduce structura tetraedrice la o distribuție a taxa în totalul moleculelor simetrice. Considerațiile în structura lor moleculară sunt confirmate prin teste de solubilitate : alcani sunt practic insolubile în apă , în timp ce se dizolvă în solvenți apolar.
Separarea hidrocarburilor
Multe hidrocarburi derivate din procesul de rafinare a petrolului , care constă dintr - un set de procese fizico-chimice , care au scopul obținerii anumitor produse chimice (amestecuri de combustibili, bitum, lubrifianți etc.) Pornind de la țiței .
Dintre diversele procese utilizate în rafinarea, distilarea țițeiului (sau „topping“) joacă un rol fundamental. În coloana de distilare uleiul brut este separat în mai multe „bucăți“, în funcție de greutatea moleculară (sau doresc să fie mai precisă, volatilitatea ) a hidrocarburilor care constituie tăietura în cauză. Fiecare tăietură este identificată prin numărul de atomi de carbon conținuți în moleculele tăieturii în cauză. De exemplu , tăietura C4 conține hidrocarburi care au patru atomi de carbon (cum ar fi butan , butenă și de izomeri ). Acest lucru se datorează faptului că este mult mai dificilă separarea moleculelor de hidrocarburi care au greutăți moleculare apropiate sau chiar identice numai prin distilare. Aceasta reflectă faptul că hidrocarburile similare ( de exemplu , aparținând aceleiași serii omoloage ) au proprietăți chimice-fizice similare între ele.
Procese chimice care implică hidrocarburi
Hidrocarburile sunt o clasă atât de largă de compuși încât este imposibil să se numească toate reacțiile industriale în care pot fi implicați.
Printre numeroasele reacții care implică hidrocarburi, sunt incluse următoarele:
- cracare : este un proces chimic industrial adresat la formarea parafinelor cu greutate moleculară mică din parafinelor cu greutate moleculară ridicată;
- reformare catalitică este un proces care are ca scop obținerea unui produs cu o cifră octanică mai mare. Pornind de la parafine, se formează olefine, aromate, izomeri ramificați și molecule cu lanț mai scurt;
- polimerizare : este exploatată pentru obținerea de polimeri , sau molecule având greutăți moleculare foarte ridicate; polimeri de natură de hidrocarburi sunt , cum ar fi polietilena și polipropilena .
Aspecte economice și geopolitice
Toate hidrocarburi capătă o importanță enormă în " economie și geopolitică modernă, în primul rând datorită rolului lor esențial ca o sursă de energie și pentru marea aplicațiile industriale .
Notă
Bibliografie
- TW Graham Solomons, Organic Chemistry , editat de G. Ortaggi, D. Misti, ediția a II-a, Bologna, Zanichelli, 1988, ISBN 88-08-09414-6 .
- (EN) William D. Callister, Material Science and Engineering: An Introduction , ediția a 5-a, John Wiley & Sons Inc., 1999, ISBN 0-471-35243-8 .
Elemente conexe
- Petrol
- Combustibili fosili
- Gaz natural
- Compusi organici
- Originea abiotică a uleiului
- Soba cu hidrocarburi
- Polimer
Alte proiecte
-
 Wikționar conține dicționar de intrare „ hidrocarburi “
Wikționar conține dicționar de intrare „ hidrocarburi “ -
 Wikimedia Commons conține imagini sau alte fișiere pe hidrocarburi
Wikimedia Commons conține imagini sau alte fișiere pe hidrocarburi
linkuri externe
- (RO) Hidrocarburi , în Enciclopedia Britannica , Encyclopaedia Britannica, Inc.
- Cazarea și structura hidrocarburilor (PDF) [ link rupt ] , pe treccani.it .
- MSN Encarta - Hidrocarburi , pe it.encarta.msn.com. Accesat 25 octombrie 2009 (depusă de „URL - ul original 23 mai 2009).
- Sapere.it - Hidrocarburi , pe sapere.it.
- (RO) Structurile moleculare ale Compuși organici - Hidrocarburi , pe csi.chemie.tu-darmstadt.de.
| Controlul autorității | Thesaurus BNCF 12924 · LCCN (RO) sh85063372 · GND (DE) 4125165-9 · BNF (FR) cb119369263 (data) · NDL (RO, JA) 00572658 |
|---|