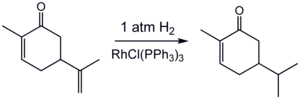Hidrogenare
L 'este o reacție chimică în care hidrogenarea este adăugată hidrogen la un substrat care poate fi un element sau un compus chimic , de regulă în prezența unui catalizator . Reacția inversă se numește deshidrogenare. Hidrogenarea constă adesea în adăugarea a doi atomi de hidrogen la o moleculă care conține o legătură dublă sau triplă de carbon- carboniu, dar hidrogenul poate fi adăugat și altor specii chimice. De exemplu, puteți adăuga hidrogen în azot ( sinteza amoniacului ) sau monoxid de carbon (sinteza metanolului ). În orice caz, vine vorba de reacții de reducere care necesită prezența unui catalizator adecvat, de obicei de nichel , paladiu , platină sau rodiu . În absența catalizatorului, reacțiile de hidrogenare necesită temperaturi prea mari pentru a fi de folos practic. Se obișnuiește să se distingă hidrogenările în faza eterogenă de cele din faza omogenă. În primul caz, catalizatorul este un solid dispersat într-un solvent împreună cu substratul sau pus în contact cu un substrat gazos. În reacții de fază omogene, catalizatorul este dizolvat în același solvent care conține substratul care urmează să fie hidrogenat.
Există diferite tipuri de reacții legate de hidrogenare. Majoritatea hidrogenărilor utilizează „ hidrogen molecular (H 2), dar uneori folosind alte surse de hidrogen; în aceste cazuri vorbim de reacții de transfer de hidrogen . Când reacția are loc cu ruperea legăturii în timpul adăugării de hidrogen, se ajunge la hidrogenoliză ; această reacție poate fi efectuată pe legături carbon-carbon și carbon- heteroatom ( oxigen , azot sau halogen ). Hidrogenarea nu trebuie confundată cu protonația și adăugarea de hidrură ; în cazul hidrogenării, reactivii și produsele au aceeași sarcină.
fundal
Hidrogenarea catalitică în fază eterogenă
Prima hidrogenare eterogenă cunoscută se referă la adăugarea de hidrogen la oxigen. În 1823 Johann Wolfgang Döbereiner a observat că platina a favorizat reacția dintre hidrogen și oxigen și a devenit lampa Döbereiner , un conic care a obținut un succes comercial considerabil și care a rămas în uz până la începutul primului război mondial . [1] [2] În ciuda acestui precedent, de obicei tatăl proceselor eterogene de hidrogenare este considerat chimistul francez Paul Sabatier . În 1897, Sabatier a descoperit că etilena a fost transformată în etan trecând împreună cu hidrogenul în contact cu nichelul , fără ca acesta din urmă să fie modificat. [3] În urma Sabatier a studiat procesele de hidrogenare a diferitelor alte hidrocarburi, iar rezultatele a obținut Premiul Nobel pentru chimie în 1912. Wilhelm Normann a brevetat în Germania (1902) și Marea Britanie (1903) un proces de hidrogenare a uleiurilor lichide, inițierea industria grăsimilor hidrogenate . În 1905 Fritz Haber a reușit să hidrogeneze azotul obținând amoniac în laborator, iar în 1910 Carl Bosch a perfecționat acest proces făcând posibilă sinteza amoniacului la scară industrială. În 1924 Murray Raney a conceput un catalizator de nichel sub formă de pulbere fină, cunoscut sub numele de nichel Raney , încă utilizat pe scară largă în multe reacții de hidrogenare. [4] În 1925, Franz Fischer și Hans Tropsch au obținut combustibili sintetici pornind de la amestecuri de monoxid de carbon și hidrogen ( procesul Fischer-Tropsch ). [5]
Hidrogenare catalitică în fază omogenă
Hidrogenarea în fază omogenă a început să se dezvolte mult mai târziu decât hidrogenarea eterogenă. Primul exemplu în fază omogenă a fost documentat în 1938 de Melvin Calvin , care a descris hidrogenarea benzoquinonei în soluție de chinolină , catalizată cu acetat de cupru (I) . [6] [7] Dezvoltarea reală a catalizei de hidrogenare omogenă a început abia în 1965, când Sir Geoffrey Wilkinson a studiat complexul RhCl (PPh 3 ) 3 (cunoscut sub numele de catalizator Wilkinson ), un compus de fosfină care poate hidrogenează alchenele și alchinele în soluție omogenă. la temperatura și presiunea camerei. [8] În 1968, William Knowles a realizat prima hidrogenare asimetrică folosind ca catalizator un complex de rodiu cu liganzi fosfinici chirali . [9] „ Excesul enantiomeric a fost inițial mic, dar la câțiva ani după ce a ajuns la sinteza industrială a primului medicament chiral, L-DOPA , care este utilizat în tratamentul bolii Parkinson . [10] [11] În 1980 Ryoji Noyori a sintetizat ligandul BINAP , [12] dând loc unei noi generații de catalizatori pe bază de ruteniu, putând efectua hidrogenări asimetrice ale substraturilor polare, cum ar fi cetone și aldehide . Knowles și Noyori au primit Premiul Nobel pentru chimie din 2001 „pentru munca lor asupra reacțiilor de hidrogenare promovate de cataliza chirală”.
Componentele reacției
Reacțiile de hidrogenare sunt în general foarte favorizate din punct de vedere termodinamic. De exemplu, pentru reacția de hidrogenare a ' etilenei (C 2 H 4 + H 2 → C 2 H 6), factorul entropic ușor nefavorabil ( Δ r Sº = -120,9 J · K -1 · mol -1) este compensat prin entalpia factorului foarte favorabil ( Δ r Hº = -136,95 kJ · mol -1). Rezultă că la temperatura camerei energia liberă a reacției este foarte negativă ( Δ r Gº = -100,92 kJ · mol -1) și, prin urmare, procesul este favorizat termodinamic. Cu toate acestea, datorită stabilității ridicate a moleculei de dihidrogen (ΔHº diss (H 2) = 434 kJ · mol -1), reacția necesită o cantitate mare de energie (temperatură ridicată) sau utilizarea unui catalizator. În general, este preferată a doua soluție, prin care reacțiile de hidrogenare sunt efectuate în prezența a trei componente: substratul nesaturat, hidrogenul și catalizatorul. Se utilizează valori diferite de temperatură și presiune în funcție de substrat și de activitatea catalizatorului.
Substraturi
În general, toți compușii chimici care au una sau mai multe legături multiple pot acționa ca substraturi în reacțiile de hidrogenare. În unele cazuri, în special pentru compușii care au o legătură triplă, produsul final depinde și de condițiile de hidrogenare. De exemplu, alchinele hidrogenante în condiții ușoare sunt alchene obținute, în timp ce în condiții mai severe ajunge direct la corespondenți cu alcani . În ceea ce privește hidrogenarea alchenelor și alchinelor, trebuie remarcat faptul că ambii atomi de hidrogen sunt adăugați pe aceeași față a moleculei ( add syn), cu atât mai puțin aglomerată, atât în hidrogenări în fază eterogenă, cât și în cele în fază omogenă. [13] Următorul tabel listează câteva clase de substraturi organice nesaturate și produse care sunt obținute prin hidrogenarea lor.
| alchene , R2C = CR „2 | alcan , R2 CHCHR „2 |
| alchin , RCCR | alchena , cis -RHC = CHR ' sau alcan , R2 CHCHR „2 |
| aldehidă , RCHO | alcool primar , RCH 2 OH |
| cetonă , R2 CO | alcool secundar , R 2 CHOH |
| ester , RCO 2 R ' | doi alcooli , RCH 2 OH, R'OH |
| imine , RR'CNR " | amină , RR'CHNHR " |
| amidă , RC (O) NR '2 | amină, RCH 2 NR '2 |
| nitril , RCN | imină, RHCNH |
| nitroderivativ , RNO 2 | amină, RNH2 |
Surse de hidrogen
Cea mai mare parte a hidrogenului este utilizată ca H2 gazos , produs industrial din hidrocarburi prin reformarea aburului . [14] Gazul este stocat sub presiune în butelii și adesea procesul de hidrogenare se efectuează la presiuni mai mari de 1 atmosferă.
În aplicații specializate în loc folosind H2 gazos este extras de hidrogen din alte substanțe ( reacții de transfer de hidrogen ). Aceste substanțe donatoare de hidrogen acționează adesea ca solvenți; unele exemple sunt hidrazina , 1,2-dihidronaftalina , 9,10-diidroantracena , izopropanolul , acidul formic . [15]
Catalizatori
În general, reacțiile de hidrogenare sunt favorizate din punct de vedere termodinamic, dar sunt favorizate cinetic datorită rezistenței mari a legăturii din molecula H2 . Din acest motiv, în absența unui catalizator, reacția dintre H2 și un compus organic sunt foarte rare , sub 480 ° C Lucrul la temperaturi ridicate este incomod și există compuși organici care nu pot rezista la temperaturi ridicate. Soluția preferată este utilizarea unui catalizator, care se leagă atât la compusul nesaturat, cât și la hidrogen și promovează reacția lor. Metalele din grupul platinei , în special platina , paladiul , rodiul și ruteniul sunt catalizatori deosebit de activi și funcționează la temperatură scăzută și presiune scăzută a hidrogenului. S-au dezvoltat, de asemenea, catalizatori pe bază de metale neprețioase, în special pe bază de nichel (cum ar fi nichelul Raney și nichelul Urushibara [16] ), cobaltul , fierul și cuprul , [17], dar adesea acești catalizatori mai ieftini sunt mai încet sau mai lent. Necesită condiții mai drastice . În general, este necesar să se găsească un compromis între activitatea catalizatorului (și, prin urmare, viteza reacției) și prețul acestuia, luând în considerare și costul echipamentului necesar pentru a funcționa la presiune ridicată. De exemplu, hidrogenarea cu nichel Raney necesită în mod normal presiuni ridicate: [18] [19]
Există două tipuri de catalizatori: catalizatorii eterogeni și catalizatorii omogeni . Catalizatorii heterogeni sunt solide dispersate împreună cu substratul în solvent sau solide în contact cu substratul gazos. Catalizatorii omogeni sunt substanțe dizolvate în solvent împreună cu substratul.
Catalizatori heterogeni
Procesele de hidrogenare cu catalizatori eterogeni sunt cele mai importante din punct de vedere industrial. Cel mai evident avantaj al catalizatorilor eterogeni este că catalizatorul poate fi separat foarte ușor de reactanți și de produse de reacție. Activitatea catalizatorului este optimizată prin schimbarea împrejurimilor metalului. De exemplu, fețele diferite ale unui catalizator cristalin eterogen au activități diferite. Mai mult, activitatea catalizatorilor eterogeni este influențată de suport, adică de materialul utilizat pentru a lega catalizatorul. În chimia organică, paladiu pe carbon la 5 sau 10% (prescurtat ca "Pd / C", procentul este în greutate) sau hidroxid de paladiu pe carbon la 10 sau 20% (catalizator Pearlman) este adesea utilizat. În unele cazuri, o serie de modificări empirice ale catalizatorului sunt încercate să-l „otrăvească” selectiv. Astfel, un catalizator modificat în mod adecvat poate hidrogenează unele grupări funcționale fără a atinge altele, poate tipa hidrogenate alchene fără a modifica inele aromatice, sau hidrogenează selectiv doar un alchin în alchenă. Utilizarea liganzilor chirali pe un metal este de asemenea posibilă efectuarea hidrogenărilor asimetrice eterogene. [20]
Catalizatori omogeni
Activitatea și selectivitatea catalizatorilor omogeni sunt reglate prin schimbarea liganzilor. Folosind un substrat prociral puteți regla selectivitatea catalizatorului în așa fel încât să favorizați formarea unui singur enantiomer. Doi catalizatori omogeni bine cunoscuți sunt catalizatorul Wilkinson pe bază de rodiu și catalizatorul Crabtree pe bază de ' iridiu . Un exemplu practic este hidrogenarea carvonei cu catalizatorul lui Wilkinson: [21]
Otravire cu catalizator
Multe substanțe pot otrăvi catalizatorul, adică îl pot opri complet sau parțial. Exemplele clasice de otrăvuri sunt compuși care conțin sulf sau fosfor . Otravurile pot provoca eșecul hidrogenării catalitice, dar pot servi și la modificarea reactivității și selectivității catalizatorului. De exemplu, catalizatorul Lindlar , un catalizator de paladiu depus pe sulfat de bariu și apoi tratat cu chinolină , reducând alchinele doar la alcheni, și a fost utilizat pentru a converti fenilacetilena în stiren : [22]
Mecanism
Cataliză heterogenă
În cazul catalizei pe suprafața unui solid stabilit, mecanismul este cel propus de Iurô Horiuti și Michael Polanyi . [23] [24] Întregul proces implică trei etape, ilustrate în figură în cazul unei alchene:
- Substratul nesaturat și hidrogenul sunt adsorbiți pe suprafața catalizatorului. Molecula H 2 este disociată și formează hidrogen atomic.
- Unul dintre atomii de hidrogen se adaugă la substrat, legându-se de un atom de carbon. Acest pas este reversibil.
- Un alt atom de carbon adaugă al doilea atom de hidrogen. În condițiile de hidrogenare, această etapă este ireversibilă, iar molecula hidrogenată se desprinde de catalizator.
În a doua etapă, se formează un intermediar saturat care se poate roti înainte de a reacționa înapoi prin disocierea din nou a catalizatorului ca alchenă. În consecință, contactul cu un catalizator de hidrogenare determină în mod necesar o izomerizare cis-trans , favorizată termodinamic. Aceasta poate fi o problemă în cazul hidrogenării parțiale, în timp ce în cazul hidrogenării complete nu există probleme, deoarece chiar și alchena trans este hidrogenată.
În cazul substraturilor aromatice , prima legătură C-H este cea mai dificil de format, din cauza energiei care trebuie cheltuită pentru ruperea sistemului aromatic. În proces, formează o ciclohexadienă, specie extrem de reactivă, care nu poate fi izolată, care este redusă imediat la ciclohexen în condiții suficient de reducătoare, deoarece a provocat ruperea aromaticității. La rândul său, ciclohexena este în mod normal redusă la ciclohexan , complet saturată, dar cu catalizatori modificați corespunzător, reducerea poate fi oprită cel puțin parțial ciclohexenă.
Cataliză omogenă
În majoritatea proceselor de catalizare omogene, centrul metalic leagă atât substratul nesaturat, cât și hidrogenul și se formează un complex alchenă-metal-dihidrid care favorizează hidrogenarea. [25] [26] Figura următoare ilustrează procesul folosind ca exemplu catalizatorul Wilkinson (partea de sus din figură). Inițial, complexul pierde un liant fosfinic ; specia formează RhCl (PPh 3) 2 H, inițiind adevăratul ciclu catalitic și propriu care implică patru etape:
- Complexul adaugă hidrogen și formează un complex dihidrid (reacție adăugare oxidativă ).
- Centrul metalic adaugă alchena în coordonare deci η² .
- Primul atom de hidrogen este transferat din metal în carbon formând un alchil coordonat (reacție inserție migratoare ).
- Al doilea atom de hidrogen este transferat la gruparea alchil, cu disocierea simultană a formatului dell'alcano (reacție de eliminare reductivă ).
Aplicații industriale
Procesele de hidrogenare au diverse aplicații în domeniul industrial. [14] Aceste hidrogenări pe scară largă utilizează în mod normal catalizatori eterogeni.
Amoniac
Azotul gazos de hidrogenare pentru a obține amoniac ( procesul Haber-Bosch ) este unul dintre cele mai importante procese ale chimiei industriale . În 2010 s-a produs aproximativ 133 de milioane de tone de amoniac, care a fost folosit aproximativ 75% pentru obținerea îngrășămintelor . [27]
Hidrocarburi
Procesele de hidrogenare din industria petrochimică Nell sunt utilizate pentru a transforma alchenele în alcani (mai puțin volatili) și compuși aromatici în alcani saturați ( parafine ) și cicloalcani ( naftene ). Hidrogenul este, de asemenea, utilizat pentru a obține fracțiuni mai ușoare prin hidrogenarea fisurilor . [14]
Hidrogenarea cărbunelui
Există diferite procese de hidrogenare a cărbunelui, în funcție de produsul final care urmează să fie obținut. În procesele de hidrogenare, cum ar fi procesul cărbunelui Bergius, acesta este tratat sub presiune de hidrogen, astfel încât să producă hidrocarburi lichide și gazoase. În procesele de hidropiroliză, cărbunele este tratat la temperaturi ridicate (până la 1000 ° C) pentru perioade scurte de timp în prezența hidrogenului pentru a obține hidrocarburi lichide. În procesul de hidrogenare, cărbunele este transformat în metan . [14]
Industria agroalimentară
Aplicarea foarte importantă a proceselor de hidrogenare este prelucrarea uleiurilor vegetale . Uleiuri vegetale derivate din grăsimi polinesaturate grase , care conțin mai mult de o legătură dublă carbon-carbon. În condiții adecvate pot fi parțial hidrogenate aceste duble legături, [28] prin transformarea uleiurilor vegetale în grăsimi solide sau semisolide precum cele prezente în margarină . În comparație cu grăsimile animale, uleiurile vegetale parțial hidrogenate sunt mai puțin costisitoare, pot avea o textură foarte variată și sunt mai rezistente la „ râncezi ”; în consecință, acestea sunt utilizate ca grăsimi alimentare în majoritatea produselor de patiserie.
Producția de anilină
Hidrogenarea catalitică a nitrobenzenului este modul cel mai frecvent utilizat pentru producerea anilinei . Conform diferitelor procese, reacția poate avea loc atât în faza lichidă, cât și în faza gazoasă. Catalizatorii cei mai utilizați industrial sunt compuși din Ni și Cu în combinație cu promotori de bază ai diferitelor metale de tranziție. [29]
Notă
- ^ Collins 1986
- ^ Hoffmann 1998
- ^ Sabatier 1912
- ^ Raney 1925
- ^ Fischer și Tropsch în 1926
- ^ Gold și Carmona 2007
- ^ Calvin și Polanyi 1938
- ^ Osborn și colab. 1966
- ^ Knowles și Sabacky 1968
- ^ Knowles și colab. 1974
- ^ Knowles și colab. 1975
- ^ Miyashita și colab. 1980
- ^ Smith 2012
- ^ A b c d Häussinger 2002
- ^ Van Es și Staskun 1971
- ^ Sarko și Dimare 2001
- ^ Rylander 2002
- ^ Allen și VanAllan 1941
- ^ Mekler și colab. 1961
- ^ Mallat și colab. 2007
- ^ Irlanda și Bey 1973
- ^ Lindlar și Dubuis 1966
- ^ Horiuti și Polanyi 1934
- ^ Gallezot 2002
- ^ Chaloner și colab. 1994
- ^ De Vries și Elsevier 2007
- ^ Smil 2011
- ^ Freeman 2002
- ^ Andreas Jess, Peter Wassercheid, Chemical Technology, Wiley-VCH, 2013.
Bibliografie
- (EN) CFH Allen și J. VanAllan, m-Toylybenzylamine , în Org. Sintetizator. , vol. 21, 1941, p. 108 DOI : 10.15227 / orgsyn.021.0108 .
- (EN) și M. Calvin M. Polanyi, Hidrogenare catalitică omogenă , în Trans. Faraday Soc., Vol. 34, 1938, pp. 1181-1191, DOI : 10.1039 / TF9383401181 .
- (EN) PA Chaloner, MA Esteruelas, F. Joo și L. Gold, Hidrogenare omogenă, Dordrecht, Springer, 1994, ISBN 978-94-017-1791-5 .
- (EN) PMD Collins, Rolul esențial al platinei în descoperirea catalizei. Opera de pionierat a lui Johann Wolfgang Döbereiner în timpul anului 1820 (PDF), în Platinum Metals Rev., vol. 30, n. 3, 1986, pp. 141-146.
- (EN) JG de Vries și CJ Elsevier (eds), Manual de hidrogenare omogenă, Wiley-VCH, 2007, ISBN 978-3-527-31161-3 .
- (DE) F. Fischer și H. Tropsch, Über die direkte Synthese von Erdöl- Kohlenwasserstoffen beautiful gewöhnlichem Druck. (Erste Mitteilung) , în Ber. deutsch. chim. Iisus , vol. 59, nr. 4, 1926, pp. 830-831, DOI : 10.1002 / cber.19260590442 .
- (EN) IP Freeman, Margarine and shortenings, în Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a16_145 .
- (EN) P. Gallezot, Hydrogenation - Heterogeneous, în Encyclopedia of Catalysis, John Wiley & Sons, 2002, DOI : 10.1002 / 0471227617.eoc114 .
- (EN) Häussinger P., R. Lohmüller și AM Watson, Hydrogen, în Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a13_297 .
- (EN) R. Hoffmann, Bricheta lui Döbereiner , în American Scientist, vol. 86, nr. 4, 1998, p. 326, DOI : 10.1511 / 1998.4.326 .
- (EN) Horiuti I. și M. Polanyi, Reacții de schimb de hidrogen pe catalizatori metalici , în Trans. Faraday Soc., Vol. 30, 1934, pp. 1164-1172, DOI : 10.1039 / TF9343001164 .
- (EN) RE Ireland și P. Bey, Hidrogenare catalitică omogenă: Dihidrocarvonă , în Org. Sintetizator. , vol. 53, 1973, p. 63 DOI : 10.15227 / orgsyn.053.0063 .
- (EN) WS Knowles și MJ Sabacky, hidrogenare catalitică asimetrică Utilizarea unui complex de rodiu solubil, activ optic , în Chem. Comun. (Londra), 1968, pp. 1445-1446, DOI : 10.1039 / C19680001445 .
- (EN) WS Knowles, MJ Sabacky și BD Vineyard, α-aminoacizi prin hidrogenare asimetrică , în Adv. Chem. Ser., Vol. 132, 1974, pp. 274-282, DOI : 10.1021 / ba-1974-0132.ch018 .
- WS Knowles, MJ Sabacky și BD Vineyard, proces L-Dopa și intermediari , din brevetul SUA 4005127 A, 1975. Accesat la 5 octombrie 2015.
- (EN) H. Lindlar și R. Dubuis, catalizator de paladiu pentru reducerea parțială a acetilenelor , în organ. Sintetizator. , vol. 46, 1966, p. 89 DOI : 10.15227 / orgsyn.046.0089 .
- (EN) T. Mallat, Orglmeister E. și A. Baiker, Asimetric Catalysis Chiral at Metal Surfaces, în Chem. Rev. , vol. 107, nr. 11, 2007, pp. 4863-4890, DOI : 10.1021 / cr0683663 .
- (EN) AB Mekler, S. Ramachandran, S. Swaminathan și MS Newman, 2-metil-1,3-ciclohexanedionă , în Org. Sintetizator. , vol. 41, 1961, p. 56, DOI : 10.15227 / orgsyn.041.0056 .
- (EN) A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R. Noyori, Sinteza 2,2'-bis (difenilfosfino) -1,1'-binaftil ( BINAP), o bis (triaril) fosfină chirală atropizomerică și utilizarea sa în hidrogenarea asimetrică catalizată de rodiu (I) a acizilor α- (acilamino) acrilici , în J. Am. Chem. Soc. , Vol. 102, nr. 27, 1980, pp. 7932-7934, DOI : 10.1021 / ja00547a020 .
- (EN) THE Gold și D. Carmona, Rhodium (PDF), în JG de Vries și CJ Elsevier (eds), The Handbook of Homogeneous Hydrogenation, Weinheim, Wiley-VCH, 2007, ISBN 978-3-527-31161 -3 .
- (EN) JA Osborn, FH Jardine, JF Young și G. Wilkinson, Prepararea și proprietățile tris (trifenilfosfinei) halogenorodiu (I) și unele reacții ale acestora, inclusiv hidrogenarea catalitică omogenă a olefinelor și acetilenelor și a derivaților acestora , în J. Chem. Soc. A, 1966, pp. 1711-1732, DOI : 10.1039 / J19660001711 .
- M. Raney, Metodă de producere a nichelului fin divizat în brevetul SUA 1628190, 1925. Accesat la 30 septembrie 2015.
- (EN) PN Rylander, Hydrogenation and Dehydrogenation, în Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a13_487 .
- P. Sabatier, Nobel Lecture: The Method of Direct Hydrogenation by Catalysis pe nobelprize.org, Nobel Media AB 2014, 1912. Accesat la 30 septembrie 2015.
- (EN) CR Sarko și M. Dimare, Urushibara Nickel, în e-EROS Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001, DOI : 10.1002 / 047084289X.ru003 .
- (EN) V. Smil, Ciclul azotului și producția mondială de alimente (PDF), în World Agriculture, vol. 2, nr. 1, 2011, pp. 9-13.
- (EN) Smith MB, March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, ediția a VII-a, John Wiley & Sons, 2012, ISBN 978-0-470-46259-1 .
- (EN) B. T. van Es și Staskun, Aldehidele din nitrilii aromatici: 4-Formilbenzensulfonamida , în Org. Sintetizator. , vol. 51, 1971, p. 20, DOI : 10.15227 / orgsyn.051.0020 .
Alte proiecte
-
 Wikționarul conține intrarea în dicționar „ hidrogenare ”
Wikționarul conține intrarea în dicționar „ hidrogenare ” -
 Wikimedia Commons conține imagini sau alte fișiere pentru hidrogenare
Wikimedia Commons conține imagini sau alte fișiere pentru hidrogenare
linkuri externe
- (EN) Hidrogenare pe Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | Tezaur BNCF 30617 · LCCN (EN) sh85063436 · BNF (FR) cb11958221b (data) · NDL (EN, JA) 00.571.633 |
|---|