Sistem imunitar

Sistemul imunitar este o rețea complexă integrată de mediatori chimici și celulari, structuri și procese biologice , dezvoltată pe parcursul evoluției , pentru a apăra organismul de orice formă de insultă chimică, traumatică sau infecțioasă a integrității sale. Pentru a funcționa corect, un sistem imunitar trebuie să fie capabil să detecteze o mare varietate de agenți cunoscuți sub numele de agenți patogeni , de la viruși la viermi și să le distingă de țesutul sănătos al corpului lor .
La multe specii , sistemul imunitar poate fi clasificat în subsisteme, cum ar fi sistemul imunitar înnăscut versus sistemul imunitar adaptativ sau imunitatea umorală versus imunitatea mediată de celule . La om, bariera sânge-creier , bariera sânge-lichid cefalorahidian și alte bariere similare fluido-creier separă sistemul imunitar periferic de sistemul neuroimun care protejează creierul .
Agenții patogeni pot evolua și adapta rapid, reușind astfel să evite detectarea și neutralizarea sistemului imunitar; cu toate acestea, au evoluat mai multe mecanisme de apărare pentru a depăși acest lucru. Chiar și organismele unicelulare simple, cum ar fi bacteriile , posedă un sistem imunitar rudimentar, format din enzime care protejează împotriva infecțiilor cu bacteriofagi . Alte mecanisme imune de bază au evoluat în eucariotele antice și rămân în descendenții lor moderni, cum ar fi plantele și nevertebratele . Acestea includ fagocitoza , peptidele antimicrobiene numite defensine și sistemul complementului .
Gnatostomii , inclusiv oamenii, se mândresc cu mecanisme de apărare și mai sofisticate, [1] inclusiv capacitatea de a se adapta în timp pentru a recunoaște agenții patogeni specifici mai eficient. Imunitatea adaptivă creează o memorie imunologică în urma unui prim răspuns la un agent patogen specific, ducând astfel la o reacție mai bună la orice întâlnire ulterioară cu același agent patogen. Acest proces de imunitate dobândită stă la baza vaccinării .
Tulburările sistemului imunitar pot provoca boli autoimune , boli inflamatorii și cancere . [2] Imunodeficiența apare atunci când sistemul imunitar este mai puțin activ decât în mod normal, ducând la infecții recurente și care pun viața în pericol. La om, imunodeficiența poate fi rezultatul unei boli genetice cum ar fi imunodeficiența combinată severă sau dobândită din boli precum HIV / SIDA sau din utilizarea medicamentelor imunosupresoare . În schimb, autoimunitatea față de un sistem imunitar hiperactiv implică atacarea țesuturilor normale, ca și cum ar fi organisme străine. Cele mai frecvente boli autoimune sunt tiroidita Hashimoto , artrita reumatoidă , diabetul zaharat de tip 1 și lupusul eritematos sistemic . Imunologia se referă la studiul tuturor aspectelor sistemului imunitar.
Istoria imunologiei
Imunologia este disciplina care studiază structura și funcția sistemului imunitar. Acesta provine din medicină și din studiile timpurii asupra cauzelor imunității bolii. Cea mai veche referință cunoscută la imunitate datează de la ciuma Atenei din 430 î.Hr. Tucidide a observat că cei care au fost vindecați au putut îngriji bolnavii fără a contracta boala pentru a doua oară. [3] În secolul al XVIII-lea, Pierre Louis Moreau de Maupertuis a experimentat veninul de scorpion , observând că unii câini și șoareci erau imuni la acesta. [4] Aceasta și alte observații cu privire la imunitatea dobândită au fost ulterior exploatate de Louis Pasteur în dezvoltarea vaccinării și a propunerii sale privind teoria germenilor bolii . [5] Teoria lui Pasteur era în opoziție directă cu teoriile contemporane ale bolii, cum ar fi doctrina miasmatic-umorală . A fost necesar să se aștepte până în 1891 cu lucrarea lui Robert Koch , pentru care a primit Premiul Nobel în 1905, pentru ca microorganismele să fie confirmate ca fiind cauza bolilor infecțioase. [6] Virusii au fost identificați pentru prima dată ca agenți patogeni umani în 1901, odată cu descoperirea lui Walter Reed a virusului febrei galbene . [7]
Spre sfârșitul secolului al XIX-lea, imunologia a făcut progrese mari datorită dezvoltărilor rapide în studiul imunității umorale și a imunității celulare . [8] Deosebit de importantă a fost lucrarea lui Paul Ehrlich , care a propus teoria lanțului lateral pentru a explica specificitatea reacției antigen-anticorp; contribuția sa la înțelegerea imunității umorale a fost recunoscută prin acordarea unui premiu Nobel în 1908, acordat în comun fondatorului imunologiei celulare, Ilya Il'ič Mečnikov . [9]
Descriere generala
O caracteristică fundamentală a sistemului imunitar este, prin urmare, capacitatea de a distinge între structurile endogene sau exogene care nu constituie un pericol și care, prin urmare, pot sau trebuie conservate ( auto ) și structurile endogene sau exogene care se dovedesc în schimb dăunătoare organismului și care trebuie deci eliminat ( non-sinele ).
Conform celor mai recente teorii, sistemul imunitar distinge prin urmare un sine neinfecțios ( sinele neinfecțios ) de un eu infecțios (sinele infecțios). Discriminarea dintre sine și non-sine are loc la nivel molecular și este mediată de anumite structuri celulare ( receptor Toll-like , receptori ai limfocitelor T , complexe MHC , anticorpi ), care permit prezentarea și recunoașterea componentelor agentului dăunător definit ca antigeni (inductori literalmente de anticorpi).
În funcție de modul în care sunt recunoscuți antigenii, se pot distinge două zone ale sistemului imunitar:
- Imunitate nespecifică sau înnăscută: include mediatori chimici (responsabili de inflamație ) și mediatori celulari responsabili de o primă linie de apărare împotriva agresiunii. Este evolutiv mai vechi și permite recunoașterea unui repertoriu limitat de antigeni. Recunoaște o stare generică de pericol și plasează sistemul imunitar într-o stare de „alarmă”, ceea ce favorizează dezvoltarea imunității specifice
- imunitate specifică sau dobândită sau adaptativă: include mediatori chimici și celulari responsabili de un răspuns defensiv mai puternic și mai direcționat (practic capabil să recunoască orice formă de antigen), dar mai lent. Este evolutiv mai recent și se bazează pe răspunsul nespecific pentru numeroase funcții de prezentare și distrugere a antigenului. Este împărțit la rândul său în:
- imunitate specifică umorală (adică mediată de anticorpi).
- imunitate specifică mediată de celule
Apărare pe mai multe niveluri
Sistemul imunitar protejează organismele de infecții datorită apărării pe mai multe niveluri a specificității crescânde. În termeni simpli, barierele fizice împiedică agenții patogeni, precum bacteriile și virușii, să pătrundă în organism. Dacă un agent patogen depășește aceste bariere, sistemul imunitar înnăscut oferă un răspuns imediat, dar nespecific. Sistemul imunitar înnăscut se găsește la toate plantele și animalele. [10] Dacă agenții patogeni evită cu succes răspunsul înnăscut, vertebratele posedă un al doilea nivel de protecție, sistemul imunitar adaptativ, care este activat de răspunsul înnăscut. Aici, sistemul imunitar își adaptează răspunsul în timpul infecției prin îmbunătățirea recunoașterii agentului patogen. Acest răspuns îmbunătățit este apoi menținut după ce agentul patogen a fost eliminat, sub forma unei memorii imunologice, permițând astfel sistemului imunitar adaptiv să răspundă mai rapid și mai eficient de fiecare dată când întâlnește din nou acest agent patogen. [11] [12]
| Sistem imunitar înnăscut | Sistemul imunitar adaptativ |
|---|---|
| Răspunsul este nespecific | Răspuns specific la agenți patogeni și antigeni |
| Expunerea duce la un răspuns maxim imediat | Intervalul de timp dintre expunere și răspunsul maxim |
| Imunitatea umorală și mediată celular | Imunitatea umorală și mediată celular |
| Fără memorie imunologică | Expunerea duce la memoria imunologică |
| Găsit în aproape toate formele de viață | Se găsește numai în gnatostomi |
Atât imunitatea înnăscută, cât și adaptarea depind de capacitatea sistemului imunitar de a distinge între moleculele de sine și cele care nu sunt de sine . În imunologie, moleculele proprii sunt cele care alcătuiesc corpul și care pot fi distinse de substanțele străine de sistemul imunitar. [13] În schimb, moleculele non-auto sunt cele recunoscute ca molecule străine. O clasă de molecule care nu se auto- numesc sunt numite „ antigene ” (prescurtarea pentru generatorii de anticorpi ) și sunt definite ca substanțe care se leagă de receptori imuni specifici și care generează un răspuns imun. [14]
Sistem imunitar înnăscut
Microorganismele sau toxinele care intră cu succes în organism întâlnesc celulele și procesele sistemului imunitar înnăscut . De obicei, răspunsul înnăscut este activat atunci când microbii sunt identificați de receptorii de recunoaștere a modelelor (PRR) , capabili să recunoască componentele grupurilor mari de microorganisme, [15] orice celule deteriorate sau stresate, trimitând semnale de alarmă. [16] Apărările imune înnăscute sunt, prin urmare, „nespecifice”, ceea ce înseamnă că aceste sisteme răspund la agenți patogeni într-un mod generic. [14] Acest sistem nu conferă imunitate durabilă împotriva unui agent patogen. În majoritatea organismelor vii, sistemul imunitar înnăscut este sistemul de apărare dominant. [10]
Bariere de suprafață
Mai multe bariere, fie că sunt mecanice, chimice sau biologice, protejează organismele de infecții. Cuticula cerată a multor frunze , exoscheletul insectelor , cojile, membranele exterioare ale ouălor depuse și pielea sunt exemple de bariere mecanice care funcționează ca prima linie de apărare împotriva infecției. [14] Cu toate acestea, organismele nu pot fi complet izolate de mediul lor, astfel încât alte sisteme acționează pentru a proteja diferitele deschideri din corp, cum ar fi plămânii , intestinele și tractul urogenital . În plămâni, tusea și strănutul sunt sisteme mecanice capabile să elimine agenții patogeni și alți iritanți din căile respiratorii . Lacrimile au o acțiune de spălare și odată cu urina sunt expulzați agenții patogeni, în timp ce mucusul secretat de tractul respirator și gastro-intestinal servește la captarea microorganismelor. [17]
Există, de asemenea, bariere chimice care protejează împotriva infecțiilor. Pielea și căile respiratorii secretă peptide antimicrobiene precum β defensinele . [18] Enzimele precum lizozima și fosfolipaza A2 găsite în salivă, lacrimi și laptele matern sunt, de asemenea, antibacteriene. [19] [20] Secrețiile vaginale dobândesc o funcție de barieră chimică după menarhie când devin ușor acide , în timp ce lichidul seminal conține defensină și zinc pentru a ucide agenții patogeni. [21] [22] În stomac, acidul gastric și proteaza sunt puternice mijloace de apărare chimică împotriva agenților patogeni ingerați.
În tractul genito-urinar și gastro-intestinal, flora comensală servește ca o barieră biologică, concurând cu bacteriile patogene pentru hrană și spațiu și, în unele cazuri, modificarea condițiilor mediului lor, cum ar fi pH-ul sau disponibilitatea fierului , [23] reducând probabilitatea ca agenții patogeni pot ajunge la o cantitate suficientă pentru a provoca boli. Cu toate acestea, deoarece antibioticele vizează eliminarea bacteriilor și nu afectează ciupercile , dacă sunt administrate pe cale orală, acestea pot duce la o prezență „excesivă” a ciupercilor și pot provoca afecțiuni precum candidoză vaginală. [24] Există dovezi bune că reintroducerea florei probiotice , cum ar fi culturile pure de lactobacili găsite în mod normal în iaurtul nepasteurizat , ajută la restabilirea unui echilibru sănătos al populațiilor microbiene în timpul infecțiilor intestinale la copii, în timp ce datele preliminare obținute în mai multe studii, încurajează această practică în cazuri de gastroenterită bacteriană, boli inflamatorii cronice intestinale , infecții ale tractului urinar și infecții post- chirurgicale . [25] [26] [27]
Inflamaţie
Inflamația este unul dintre primele răspunsuri ale sistemului imunitar la infecție. [28] Simptomele inflamației sunt roșeața, umflarea, căldura și durerea, toate acestea fiind cauzate de creșterea fluxului sanguin către țesut . Inflamația este produsă de eicosanoide și citokine , care sunt eliberate din celulele deteriorate sau infectate. Eicosanoidele includ prostaglandinele care induc febra și dilatarea vaselor de sânge asociate cu inflamația și leucotrienele care atrag anumite celule albe din sânge (leucocite). [29] [30] Citokinele obișnuite includ interleukinele , care sunt responsabile pentru comunicarea dintre celulele albe din sânge, chemokinele care promovează chemotaxia și interferonii care prezintă efecte antivirale, cum ar fi oprirea sintezei proteinelor în celula afectată. [31] În timpul evenimentului inflamator, pot fi eliberați și factori de creștere și factori citotoxici. Aceste citokine și alte substanțe chimice pot recruta alte celule imune la locul infecției și, după îndepărtarea agenților patogeni, pot promova vindecarea oricărui țesut deteriorat. [32]
Sistemul complement
Sistemul complementului este o cascadă biochimică care atacă suprafețele celulelor străine. Conține peste 20 de proteine diferite și este numit astfel pentru capacitatea sa de a „completa” uciderea agenților patogeni de către anticorpi . Complementul este componenta umorală majoră a răspunsului imun înnăscut. [33] [34] Multe specii au sisteme complementare, inclusiv non- mamifere precum plante, pești și unele nevertebrate. [35]
La om, acest răspuns este declanșat prin legarea la anticorpii care sunt legați de acești microbi sau prin legarea proteinelor complementului la carbohidrații prezenți pe suprafețele microbilor. Acest semnal de recunoaștere declanșează un răspuns care are ca rezultat o ucidere rapidă. [36] Viteza de răspuns este rezultatul amplificării semnalului care are loc după activarea proteolitică secvențială a moleculelor complementului, care sunt și proteaze . După ce proteinele complementului se leagă inițial de microb, acestea declanșează activitatea de protează, care la rândul său activează alte proteaze ale complementului și așa mai departe. Aceasta produce o cascadă catalitică care amplifică semnalul inițial, prin feedback pozitiv. [37] Rezultatele cascadei constau în producerea de peptide care atrag celulele imune, cresc permeabilitatea vasculară și acoperă suprafața unui agent patogen cu opsonine , marcând-o pentru distrugere. Această depunere a complementului poate distruge celulele direct prin întreruperea membranei lor plasmatice . [33]
Bariere celulare

Leucocitele (globulele albe din sânge) se comportă ca organisme unicelulare independente și sunt al doilea nivel al sistemului imunitar înnăscut. [14] Leucocitele înnăscute includ fagocite ( macrofage , neutrofile și celule dendritice ), limfocite , mastocite , eozinofile , bazofile și limfocite naturale ucigașe . Aceste celule identifică și elimină agenții patogeni, fie atacând pe cei mai mari prin contact, fie prin înghițire și apoi uciderea microorganismelor mai mici. [35] Celulele înnăscute sunt, de asemenea, mediatori importanți în dezvoltarea organelor limfoide și pentru activarea sistemului imunitar adaptativ. [38]
Fagocitoza este o caracteristică importantă a celulelor imunității înnăscute și este realizată de celule numite „ fagocite ” care sunt capabile să fagociteze sau să mănânce agenți patogeni sau particule. Fagocitele patrulează în general organismul pentru agenți patogeni, dar pot fi chemate în anumite locuri de către citokine. [14] Odată ce un agent patogen este străbătut de un fagocit, acesta este prins într-o veziculă intracelulară numită fagozom , care apoi fuzionează cu o altă veziculă, numită lizozom , pentru a forma un fagolizozom . Agentul patogen este ucis de activitatea enzimelor digestive sau după o explozie respiratorie care eliberează radicali liberi în fagolizozom. [39] [40] Fagocitoza a evoluat ca un mijloc de a obține substanțe nutritive, dar acest rol a fost extins în fagocite pentru a include ingestia de agenți patogeni ca mecanism de apărare. [41] Fagocitoza reprezintă probabil cea mai veche formă de apărare; fagocitele au fost identificate atât la animale vertebrate, cât și la nevertebrate. [42]
Neutrofilele și macrofagele sunt fagocite care se deplasează pe tot corpul în căutarea agenților patogeni. [43] Neutrofilele sunt prezente în mod normal în sânge și sunt cel mai abundent tip de fagocite, reprezentând în mod normal 50% - 60% din totalul leucocitelor circulante. [44] În timpul fazei acute a inflamației, în special după o infecție bacteriană, neutrofilele migrează la locul inflamației într-un proces numit chemotaxis și sunt de obicei primele celule care ajung la locul infecției. Macrofagele sunt celule versatile care locuiesc în țesuturi și produc o gamă largă de substanțe chimice, inclusiv enzime, proteine complementare și citokine, în timp ce pot acționa și ca „scuturi” pentru a scăpa corpul de celule uzate și alte resturi și cacelulele care prezintă antigen. , activează sistemul imunitar adaptiv. Macrofagele îndeplinesc funcții de fagocitoză și digestie oxidativă a agenților patogeni, dar intervin, în general, în etapele tardive ale inflamației acute sau ale inflamației cronice. Au legături foarte strânse cu celulele imunității specifice, deoarece depind de acestea din urmă pentru a realiza activarea completă și a influența diferențierea lor în etapele timpurii ale răspunsului imunitar specific; pot contribui și la prezentarea antigenică. [45]
Mastocitele locuiesc în țesuturile conjunctive și membranele mucoase și reglează răspunsul inflamator. [46] Acestea sunt cel mai adesea asociate cu alergie și anafilaxie . [44] Bazofilele și eozinofilele sunt legate de neutrofile. Aceștia secretă mediatori chimici implicați în apărarea împotriva paraziților și joacă un rol în reacțiile alergice, cum ar fi în cazul astmului . [47] Limfocitele NK ( natural killer ) sunt leucocite care atacă și distrug celulele canceroase sau celulele care au fost infectate cu viruși. [48]
Celulele dendritice sunt fagocite care se găsesc în țesuturi, sunt specializate morfologic și funcțional în captarea și prezentarea antigenului și au caracteristica de a fi în contact cu mediul extern; în consecință, acestea se găsesc în principal în piele, nas, plămâni, stomac și intestine. [49] Acestea sunt numite astfel pentru asemănarea lor cu dendritele neuronale , dar celulele dendritice nu sunt în niciun fel legate de sistemul nervos . Celulele dendritice acționează ca o legătură între țesuturile corpului și sistemul imunitar înnăscut și adaptativ, deoarece sunt capabile să prezinte antigeni la celulele T , unul dintre principalele tipuri de celule ale sistemului imunitar adaptativ. [49]
Limfocite naturale ucigașe
Limfocitele ucigașe naturale sau celulele NK sunt o componentă a sistemului imunitar înnăscut care nu atacă direct microbii invadatori. Specializarea lor, de fapt, este de a distruge celulele compromise ale organismului, cum ar fi celulele canceroase sau celulele infectate cu viruși, recunoscându-le datorită unei afecțiuni cunoscute sub numele de „ sin lipsă ”. Acest termen descrie celule cu niveluri scăzute ale unui marker de suprafață celulară numit MHC I ( complex major de histocompatibilitate ), o situație care poate apărea în infecțiile virale. [35] Au fost numiți „ ucigași naturali ” datorită noțiunii inițiale că nu necesită activare pentru a ucide celulele. Timp de mulți ani nu a fost clar cum celulele NK au recunoscut celulele canceroase și celulele infectate. Acum se știe că markerul MHC de pe suprafața acestor celule este modificat și celulele NK sunt activate prin recunoașterea „ sinelui lipsă ”. Celulele normale ale corpului nu sunt recunoscute și atacate de celulele NK, deoarece exprimă auto-antigene MHC intacte. [50]
Sistemul imunitar adaptativ
Sistemul imunitar adaptiv (cunoscut și ca „imunitate specifică” sau „imunitate dobândită”) a evoluat la vertebratele timpurii și permite un răspuns imun mai puternic, precum și memoria imunologică, în care fiecare agent patogen este „amintit”. [51] Răspunsul imun adaptiv este specific antigenului și necesită recunoașterea unor antigeni specifici „ non-self ” în timpul unui proces numit prezentare a antigenului . Specificitatea antigenică permite generarea de răspunsuri adaptate la agenții patogeni specifici sau la celulele organismului infectat cu agentul patogen. Capacitatea de a întreprinde aceste răspunsuri adecvate este menținută în organism de „celulele de memorie”. Dacă un agent patogen infectează organismul de mai multe ori, aceste celule de memorie specifice sunt utilizate pentru a-l elimina rapid.
Sistemul imunitar adaptiv este alcătuit în principal din celule din linia limfoidă (din seria T și B) și celule accesorii. Limfocitele T se împart în limfocite T auxiliare CD4 + și limfocite T citotoxice CD8 + (CTL). Funcția efectoră a primului este de a coordona complexul de răspuns imun prin activarea limfocitelor și macrofagelor CD8 + (T-helper 1) sau limfocitelor B (T-helper 2) și de a susține procesul inflamator. Această activitate se desfășoară prin interacțiuni celulă-celulă sau prin eliberarea unor factori solubili anumiți numiți citokine .
Funcția efectoare a limfocitelor CD8 + este de a liza celulele infectate datorită producției de limfokine. Limfocitele B activate, pe de altă parte, sunt specializate în celulele secretoare de anticorpi (plasmocite). Celulele accesorii sunt celulele recrutate din compartimentul înnăscut al sistemului imunitar. Spre deosebire de imunitatea nespecifică sau înnăscută, imunitatea specifică sau dobândită a fost selectată de evoluție pentru capacitatea sa de a se adapta dinamic la variabilitatea agenților de mediu recunoscută ca un pericol pentru organism. Această variabilitate este evident o caracteristică particulară a multor microorganisme infecțioase aflate în continuă co-evoluție cu sistemul imunitar care încearcă să le distrugă.
Prin urmare, imunitatea specifică trebuie să poată răspunde la toate combinațiile moleculare posibile prezente în natură și să poată interacționa cu organismul. Deoarece numărul acestor combinații este estimat la aproximativ 10 10 , imunitatea adaptivă trebuie să aibă un număr la fel de mare de structuri celulare capabile să se lege specific de fiecare antigen individual. Cu toate acestea, întrucât genomul uman cuprinde doar 30.000 de gene în total, este imposibil ca fiecare structură de prezentare și recunoaștere antigenică să fie codificată de o singură genă. Acest paradox poate fi rezolvat prin analiza compoziției moleculare a anticorpilor, a receptorilor limfocitelor T (TCR) și a complexelor MHC: de fapt, în toate cazurile, acestea sunt complexe proteice constând din combinația de structuri modulare multiple codificate de multiple (dar în orice caz limitată numeric) variante de gene de același tip. Fiecare celulă a sistemului imunitar adaptiv în cursul maturizării sale efectuează o rearanjare aleatorie a repertoriului genetic moștenit de la subiect în linia germinativă generând o combinație unică de MHC, TCR sau anticorpi.
Un alt mecanism rafinat pentru generarea diversității patrimoniului anticorpului (înțeles într-un sens larg ca complexul de structuri responsabile de recunoașterea antigenului) este dat de inserarea de mutații punctiforme mici în genele care codifică modulele structurilor antigenului. recunoașterea antigenică. Ultimul fenomen este accentuat în special în limfocitele B în faza de maturare târzie ( hipermutație somatică ).
Reorganizarea somatică a structurilor anticorpilor este în mod evident un proces extrem de costisitor, deoarece conduce la producerea de numeroase variante nefuncționale. Cu alte cuvinte, fiecare individ dezvoltă autonom din momentul nașterii un sistem imunitar bazat pe determinanți genetici moșteniți în linia germinativă, dar cu caracteristici unice și irepetabile datorită aleatoriei evenimentelor de recombinare și a presiunii selective a mediului extern. L'adozione di una forma di riconoscimento antigenico non precostituita e in grado di evolversi con la storia biologica dell'individuo pone il sistema immunitario nella necessità di dotarsi di alcune funzioni particolarmente evolute normalmente proprie di sistemi superiori come il sistema nervoso centrale .
Linfociti

Le cellule del sistema immunitario adattativo sono speciali tipi di leucociti, chiamati linfociti . I linfocita B ei linfociti T sono i principali tipi e derivano dalle cellule staminali ematopoietiche del midollo osseo . [35] I linfociti B sono coinvolte nella risposta immunitaria umorale , mentre i linfociti T sono coinvolti nella risposta immunitaria cellulo-mediata .
Sia i linfociti B che T possiedono molecole recettoriali che riconoscono obiettivi specifici. I linfociti T riconoscono un bersaglio " non-self ", come un agente patogeno, solo dopo che gli antigeni (piccoli frammenti del patogeno) sono stati elaborati e presentati in combinazione con un recettore " self " chiamato complesso maggiore di istocompatibilità (MHC). Esistono due principali sottotipi di linfociti T: i T killer ei T helper . In aggiunta vi sono le cellule T regolatorie che hanno un ruolo nella modulazione della risposta immunitaria. I linfociti T killer riconoscono solo gli antigeni accoppiati alle molecole MHC di classe I, mentre le cellule T helper ei linfociti T regolatori riconoscono solo gli antigeni accoppiati a molecole MHC di classe II. Questi due meccanismi di presentazione dell'antigene riflettono i diversi ruoli dei due tipi di linfociti T. Un terzo, sottotipo minore sono le linfociti T γδ che riconoscono gli antigeni intatti che non siano vincolati ai recettori MHC. [52]
Al contrario, il recettore antigene-specifico dei linfociti B è una molecola anticorpale presente sulla loro superficie in grado di riconoscere patogeni interi, senza che vi sia la necessità della processazione dell'antigene . Ogni stirpe di linfociti B esprime un anticorpo diverso, in modo che il set completo dei recettori per l'antigene dei linfociti B rappresentino tutti gli anticorpi che il corpo può produrre. [35]
Linfociti T killer
I linfociti T Killer sono un sottogruppo di linfociti T in grado di uccidere le cellule infettate da virus (e altri agenti patogeni) o altrimenti che risultino danneggiate o disfunzionali. [53] Come con i linfociti B, ciascun tipo di T riconosce un antigene diverso. I linfociti T killer vengono attivati quando il loro recettore (TCR) si lega a questo antigene specifico in un complesso con il recettore per l' MHC di classe I di un'altra cellula. Il riconoscimento del complesso MHC-antigene viene aiutato da un co-recettore posto sul linfocita T e chiamato CD8 . Il linfocita T viaggia attraverso il corpo alla ricerca di cellule dove i recettori MHC I portano questo antigene. Quando il linfocita viene attivato dal contatto con tali cellule, rilascia citochine , come la perforina che ha come bersagli i pori della membrana plasmatica della cellula bersaglio, permettendo così agli ioni , all' acqua e alle tossine di entrare. L'ingresso di un'altra tossina, chiamata granulisina (una proteasi ). induce la cellula bersaglio a ricorrere all' apoptosi (una sorta di "suicidio cellulare"). [54] L'uccisione delle cellule infettate da parte dei linfociti T risulta particolarmente importante per prevenire la replicazione del virus . L'attivazione dei linfociti T è strettamente controllata e in genere richiede un forte segnale di attivazione MHC/antigene, o segnali di attivazione aggiuntivi forniti dai linfociti T " helper " (vedi in seguito). [54]
Linfociti T helper

I linfociti T helper regolano sia la risposta immunitaria innata che quella adattativa, oltre a promuovere la risposta stessa ad un particolare agente patogeno. [55] [56] Queste cellule non hanno alcuna attività citotossica e non uccidono le cellule infette o gli agenti patogeni direttamente; agiscono invece controllando l'azione immunitaria dirigendo gli altri linfociti ad eseguire queste attività.
IT helper esprimono i recettori delle cellule T ( T cell receptors - TCR) che riconoscono l'antigene legato alle molecole MHC di classe II . L'antigene viene riconosciuto anche dal corecettore CD4 presente sui linfociti helper, che recluta le molecole all'interno del linfocita responsabili per l'attivazione dei linfociti T. [57] In generale si può dire che lo scopo dei linfociti T helper è quello di secernere citochine in seguito a stimolazione antigenica fungendo da "aiutanti" sia nella risposta immunitaria adattativa che innata, in aperta contrapposizione ai CD8 citotossici che svolgono un'azione diretta nell'uccisione delle cellule. A partire dai linfociti T helper si sviluppano diverse sottopopolazioni in risposta alle citochine prodotte durante le fasi precoci della risposta. I linfociti T differenziati poi producono citochine che li caratterizzano, favorendo la propria popolazione e inibendo le altre. Questo differenziamento fa parte della specializzazione dell'immunità adattativa dal momento che, sottotipi diversi possiedono funzioni effetrici ben diverse. I segnali delle citochine migliorano la funzione microbicida dei macrofagi e l'attività delle cellule T killer. [14] Inoltre, l'attivazione dei linfociti T helper provoca una sovraregolazione di molecole espresse sulla superficie del linfocita T, come il CD40 ligando , che forniscono dei segnali stimolatori supplementari necessari per attivare i linfociti B produttori di anticorpi. [58]
Linfociti T γδ
I linfociti T γδ costituiscono un'esigua minoranza dei linfociti T ed esprimono un recettore alternativo TCR di tipo γδ rispetto ai linfociti T (αβ) CD4+ e CD8+, ma condividono le caratteristiche dei T helper, dei T citotossici e dei linfociti NK. A differenza degli altri linfociti possono attivarsi e rispondere direttamente, senza ulteriori segnali costimolatori. Questi linfociti non riconoscono i complessi peptide-MHC, ma i fosfantigeni, delle molecole a 5 atomi di carbonio contenenti residui di fosfato, fondamentali perché consentono il riconoscimento, da parte del recettore, del fosfantigene. La produzione dei fosfantigeni avviene nella via del mevalonato; essi sono degli intermedi, come il colesterolo e l'IPP (isopentenil pirofosfato). I linfociti T γδ sono relativamente più frequenti a livello del tratto gastroenterico, dove si suppone che svolgano un'attività di regolazione della risposta immunitaria (tale funzione sembra essere persa in corrispondenza di malattie come la celiachia [59] ).
IT γδ si trovano a cavallo del confine tra immunità innata e adattativa. [60] Da un lato, le cellule T γδ sono una componente dell'immunità adattativa essendo in grado di modificarsi per produrre una diversità del recettore e possono anche sviluppare una memoria fenoripica ; d'altra parte, i vari sottogruppi fanno anche parte del sistema immunitario innato. [52]

Linfociti B e anticorpi
Un linfocita B è in grado di identificare gli agenti patogeni, quando gli anticorpi si legano alla superficie di un antigene specifico ed estraneo al corpo. [62] Questo complesso antigene/anticorpo viene attaccato dal linfocita B che viene degadato in peptidi da parte della proteolisi . I linfociti B, quindi, mostrano questi peptidi antigenici sulla superficie delle proprie molecole MHC di classe II. Questa combinazione tra MHC e antigene attira il linfocita T helper corrispondente, che rilascia linfochine e attiva il linfocita B. [63] Quando il linfocita B viene attivato, esso inizia a dividersi e la sua prole ( plasmacellule ) secerne milioni di copie dell'anticorpo che riconosce questo antigene. Questi anticorpi circolano nel plasma sanguigno e nel sistema linfatico , si legano agli agenti patogeni che esprimono l'antigene e li segnano per la distruzione grazie all' attivazione del complemento o per l'assorbimento e la distruzione da parte dei fagociti. Gli anticorpi possono neutralizzare gli antagonisti direttamente, legandosi alle tossine batteriche o interferendo con i recettori che i virus ei batteri utilizzano per infettare le cellule. [64]
Memoria immunologica
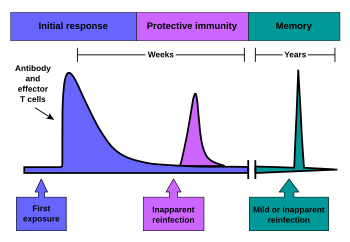
Quando i linfociti B e T vengono attivati e cominciano a replicarsi, alcuni dei loro discendenti diventano cellule di memoria a lunga durata. Durante tutto il corso della vita di un animale, esse sono in grado ricordare ogni agente patogeno specifico incontrato e, se l'agente viene rilevato nuovamente, può stimolare una forte, risposta. Questo è un sistema "adattativo" in quanto consiste in un adattamento alle infezioni causate da quel dato patogeno e prepara il sistema immunitario ad incontrarlo in futuro. La memoria immunologica può essere sotto forma di una memoria passiva a breve termine o di una memoria attiva a lungo termine.
Memoria passiva
I neonati non hanno alcuna precedente esposizione ai microbi e sono pertanto particolarmente vulnerabili alle infezioni. Diversi livelli di protezione passiva sono forniti dalla madre. Durante la gravidanza , un particolare tipo di anticorpi, chiamati IgG , si trasferisce dalla madre al bambino direttamente attraverso la placenta , in modo che i neonati abbiano alti livelli di anticorpi, anche alla nascita, con la stessa gamma di specificità dell'antigene della propria madre. [65] Anche il latte materno contiene anticorpi che vengono trasferiti all' intestino del neonato fornendogli protezione contro le infezioni batteriche fino a quando il neonato non sia in grado di sintetizzare i propri anticorpi. [66] Questa è l' immunità passiva poiché il feto in realtà non produce alcuna cellula di memoria o anticorpi, prendendoli solamente in prestito. Questa immunità passiva è di solito a breve termine, che va da pochi giorni fino a diversi mesi. In medicina, la protezione da immunità passiva può anche essere trasferita artificialmente da un individuo ad un altro, tramite un siero ricco di anticorpi. [67]
Memoria attiva e immunizzazione
La memoria attiva a lungo termine viene acquisita a seguito di un'infezione e da un'attivazione dei linfociti B e T. L'immunità attiva può anche essere generata artificialmente, attraverso la vaccinazione . Il principio alla base della vaccinazione (chiamato anche immunizzazione) è quello di introdurre un antigene di un agente patogeno al fine di stimolare il sistema immunitario e sviluppare l'immunità specifica contro quel particolare patogeno, senza però causare la malattia correlata a tale organismo. [14] Questa induzione deliberata di una risposta immunitaria ha successo poiché sfrutta la specificità naturale del sistema immunitario, così come la sua inducibilità. Dato che la malattia infettiva è una delle principali cause di morte nella popolazione umana, la vaccinazione rappresenta la manipolazione più efficace del sistema immunitario che l'uomo ha sviluppato. [35] [68]
La maggior parte dei vaccini virali sono basati su virus vivi attenuati, mentre molti vaccini batterici sono basati su componenti acellulari di microrganismi, comprese delle tossine rese innocue. [14] Poiché molti antigeni derivati da vaccini acellulari non inducono una forte risposta adattativa, i vaccini batterici sono forniti con coadiuvanti aggiuntivi che attivano le cellule che presentano l'antigene del sistema immunitario innato e massimizzano l'immunogenicità. [69]
Immunità specifica umorale
Nella difesa specifica umorale il ruolo fondamentale spetta agli anticorpi che sono prodotti dalle plasmacellule delle cellule derivate dalle cellule clone che a loro volta sono cellule derivate dai linfociti B.
Il processo di difesa umorale inizia quando un linfocita rileva un agente esterno grazie al suo recettore specifico, ossia rileva uno ed un solo corpo esterno, (ci sono vari gruppi di linfociti B che hanno diversi recettori) e inizia la produzione di cellule clone che in parte saranno destinate alla memoria immunologica e in parte andranno a formare le plasmacellule. Le plasmacellule poi produrranno gli anticorpi che si legheranno al corpo esterno bloccando i suoi siti attivi facilitando la fagocitosi da parte dei macrofagi.
Immunità specifica cellulare
È svolta dai linfociti T citotossici , che sono capaci di indurre apoptosi nelle cellule che presentano in superficie il complesso maggiore di istocompatibilità (MHC) di classe I associato allo stesso peptide che li ha attivati. Questo significa che riconoscono tutte le cellule che "mostrano" un'espressione di MHC + peptide diversa da quella delle cellule in salute ed uguale a quella che ne ha attivato l'attività citotossica. La cellula T citotossica si attacca alla cellula bersaglio con vari recettori, rilasciando vescicole contenenti Perforina, Granulisina e Granzimi. La Perforina ha un ruolo nell'indurre la morte cellulare, contrariamente a quanto si pensava fino a pochi anni fa e cioè che servisse a generare un poro di membrana nella cellula da uccidere. La Granulisina ha un'attività pro-apoptotica e microbicida. I Granzimi sono Serin/Treonin-Proteasi apoptotiche capaci di attivare la Caspasi 3 e di indurre la formazione del poro sulla membrana mitocondriale che determina la fuoriuscita del citocromo c con conseguente attivazione definitiva dell'apoptosi.
Disturbi dell'immunità umana
Il sistema immunitario è un insieme di processi notevolmente efficace che specificità, inducibilità e adattamento. Tuttavia possono verificarsi dei malfunzionamenti ed essi si possono dividere in tre grandi categorie: immunodeficienze , malattie autoimmuni e ipersensibilità .
Immunodeficienze
L'immunodeficienza si verifica quando uno o più componenti del sistema immunitario risultano inattivi. Sia nella popolazione pediatrica che in quella geriatrica, la capacità di rispondere agli agenti patogeni è minore rispetto al normale. [70] [71] Nei paesi sviluppati, l' obesità , l' alcolismo e l'uso di droga sono le cause più comuni di una scarsa funzione immunitaria, [71] tuttavia, nei paesi in via di sviluppo la malnutrizione è la causa più comune di immunodeficienza. [71] Le diete prive di un sufficiente apporto di proteine , sono correlate con un'alterata immunità cellulo-mediata, con una diminuzione dell'attività del complemento, della funzione dei fagociti, delle concentrazioni di anticorpi IgA e della produzione di citochine. Inoltre, la perdita del timo , in giovane età, per via di mutazioni genetiche o come risultato di una resezione chirurgica , comporta una grave immunodeficienza e un'elevata suscettibilità alle infezioni. [72]
Le immunodeficienze possono essere ereditate o "acquisite". [14] La malattia granulomatosa cronica , dove i fagociti hanno una ridotta capacità di distruggere i patogeni, è un esempio di un malattia ereditaria o congenita . L' AIDS e alcuni tipi di tumore sono causa dell'immunodeficienza acquisita. [73] [74]
Autoimmunità
Nella risposta autoimmune, una cellula normale può presentare un complesso proteico , prodotto dai geni MHC , e contenere una piccola sequenza aminoacidica , (8-11 aminoacidi) di natura estranea al genoma originario ereditato dai propri genitori . La sequenza aminoacidica estranea può derivare dalla sintesi proteica trascritta da geni virali integrati nel genoma stesso, o da plasmidi o da oncogeni . Questa sequenza estranea, non self , viene rilevata e segnalata alle cellule Natural Killer . I linfociti NK si attivano per la distruzione dell'intera cellula che contenendo dei geni estranei è diventata essa stessa alterata e non più self . Le cellule normali del corpo sono riconosciute e non vengono mai attaccate da macrofagi o da cellule LNK, poiché esse esprimono frammenti proteici, col MHC, sani e intatti. Ossia esprimono solo frammenti di proteine "figlie" del DNA trasmesso dai genitori. Il sistema immunitario distingue correttamente tra self e non self . In caso di presenza di proteine anomale il sistema di difesa distrugge qualunque cellula "alterata", in qualunque organo . Distrugge le cellule "infette" cercando di ottenere un così detto male minore per l'intero organismo.
Nessun anticorpo può penetrare all'interno di una cellula intatta. Solo dopo la rottura della membrana cellulare , operata dai LNK, gli anticorpi ( autoanticorpi ) legano ogni componente cellulare per una mera operazione di pulizia. Per esempio, il sistema immunitario può eliminare parzialmente o totalmente la tiroide dando luogo a noduli degenerativi solidi o colliquativi, può distruggere le articolazioni ( artrite reumatoide ), può distruggere la cute ( psoriasi ), può distruggere le pareti arteriose con formazione di placche aterosclerotiche (che potranno evolvere in infarti cardiaci , ictus cerebrale ...), può distruggere gli epiteli intestinali (come nella malattia di Crohn , la malattia celiaca , la colite ulcerosa )...
Sono note circa 70 malattie autoimmuni. Se l'organismo non riuscisse a distruggere le proprie cellule “non più self” potrebbe dover accettare un male maggiore : il rischio di sviluppare un cancro. Infatti i geni estranei, oltre alla capacità di trascrivere per sintetizzare proteine, hanno la possibilità di usare il loro macchinario replicativo attivando la topoisomerasi ea seguire l' elicasi ei propri primer per duplicare l'intero genoma cellulare e di conseguenza l'intera cellula, questo dopo aver paralizzato gli 'oncosopressori' interni, in primis i geni p53 , BRCA1 e BRCA2 , Rb ,...
Un trattamento solo sintomatico nelle malattie autoimmuni si avvale di farmaci immunosoppressivi e cortisonici , mentre alcuni farmaci antivirali potrebbero costituire una terapia causale.
Ipersensibilità
Le reazioni di ipersensibilità sono una risposta immunitaria che danneggia i tessuti del corpo. Esse sono suddivise in quattro classi (dal tipo I al tipo IV) basate sui meccanismi coinvolti e dal loro decorso. L'ipersensibilità di tipo I è una reazione immediata o anafilattica , spesso associata con l' allergia . I sintomi possono variare da un leggero fastidio fino al decesso. L'ipersensibilità di tipo I è mediata dagli IgE , che innescano la degranulazione dei mastociti e dei basofili , quando sono legate ad un antigene. [75] L'ipersensibilità di tipo II si verifica quando gli anticorpi si legano agli antigeni sulle cellule del paziente, contrassegnandoli per la distruzione. Questa viene chiamata anche ipersensibilità anticorpo-dipendente (o citotossica), ed è mediata dagli anticorpi IgG e IgM . [75] I complessi immuni (aggregazioni di antigeni, proteine del complemento e anticorpi IgG e IgM) depositati nei vari tessuti innescano reazioni di ipersensibilità di tipo III. [75] L'ipersensibilità di tipo IV (nota anche come cellulo-mediata o ipersensibilità di tipo ritardato) di solito impiega tra due e tre giorni di tempo per svilupparsi. Le reazioni di tipo IV sono coinvolte in molte malattie autoimmuni e infettive, ma può anche comportare una dermatite da contatto. Queste reazioni sono mediate dai linfociti T, dai monociti e dai macrofagi . [75]
Altri meccanismi e l'evoluzione
È probabile che un sistema immunitario adattativo multicomponente, sia nato con i primi vertebrati , in quanto gli invertebrati non sono in grado di produrre linfociti o una risposta umorale basata sugli anticorpi. [1] Molte specie, tuttavia, utilizzano alcuni meccanismi che sembrano essere precursori di alcuni aspetti dell'immunità dei vertebrati. Un sistema immunitario appare anche nelle strutturalmente più semplici forme di vita; i batteri possiedono un unico meccanismo di difesa, chiamato " sistema di resitrizione-modificazione " per proteggersi dagli agenti patogeni virali, chiamati batteriofagi . [76] I procarioti possiedono anche un'immunità acquisita, attraverso un sistema che utilizza sequenze CRISPR per conservare frammenti del genoma del batteriofago di cui è venuto precedentemente in contatto, che consente a loro di bloccare la replicazione del virus attraverso una forma di interferenza dell'RNA . [77] [78] Elementi offensivi del sistema immunitario sono presenti anche negli eucarioti unicellulari , ma vi sono pochi studi che analizzano il loro ruolo. [79]
I recettori di riconoscimento di pattern sono proteine utilizzate da quasi tutti gli organismi per identificare le molecole associate ai patogeni. I peptidi antimicrobici, chiamati defensine, sono una componente evolutivamente conservata della risposta immunitaria innata che si trova in tutti gli animali e in tutte le piante, costituendo la principale forma di immunità sistemica degli invertebrati. [1] Il sistema del complemento ei fagociti , sono utilizzati anche dalla maggior parte delle forme di vita invertebrata. La ribonucleasi e il percorso dell'interferenza dell'RNA si sono conservati in tutti gli eucarioti e si ritiene che possano svolgere un ruolo nella risposta immunitaria ai virus. [80]
A differenza degli animali, le piante sono prive di fagociti, ma le risposte immunitarie di molti vegetali coinvolgono segnali chimici sistemici che vengono inviati attraverso una struttura. [81] Le cellule vegetali individuali rispondono alle molecole associate a patogeni noti come modelli grazie ai profili molecolari associati ai patogeni (o PAMP, da Pathogen Associated Molecular Patterns ). [82] Quando una parte di una pianta si infetta, essa produce una risposta ipersensibile localizzata, per cui le cellule nel sito di infezione subiscono una rapida apoptosi al fine di prevenire la diffusione della malattia in altre parti di essa. La resistenza sistemica acquisita (SAR) è un tipo di risposta difensiva utilizzata dalle piante e che la rende resistente a un particolare agente infettivo. [81] I meccanismi di silenziamento dell'RNA sono particolarmente importanti in questa risposta sistemica in quanto possono bloccare la replicazione del virus. [83]
Immunologia dei tumori

Un altro ruolo importante del sistema immunitario è quello di identificare ed eliminare i tumori . Questo compito è chiamato sorveglianza immunitaria . Le mutate cellule tumorali esprimono antigeni che non si trovano sulle cellule normali. Per il sistema immunitario, questi antigeni appaiono estranei e la loro presenza induce i linfociti ad attaccarle. Gli antigeni espressi dai tumori hanno diverse fonti; [85] alcuni sono derivati dai virus oncogeni , come il papillomavirus umano causa del tumore cervicale , [86] mentre altri sono proteine proprie dell'organismo che vengono prodotte a bassi livelli nelle cellule normali ma raggiungono alti livelli in quelle tumorali. Un esempio, è l' enzima tirosinasi che quando viene espresso ad alti livelli, trasforma alcune cellule della pelle (ad esempio i melanociti ) in neoplasie chiamate melanomi . [87] [88] Una terza possibile fonte di antigeni tumorali sono le proteine che normalmente sono importanti per la regolazione della crescita cellulare e per la sopravvivenza, che frequentano mutano in molecole che inducono i tumori, chiamate oncogeni . [85] [89] [90]
La principale risposta del sistema immunitario ai tumori consiste nella distruzione delle cellule anormali, utilizzando i linfociti T killer, talvolta con l'assistenza dei linfociti T helper. [88] [91] Gli antigeni tumorali sono presentati sulle molecole MHC di classe I in un modo simile agli antigeni virali. Questo permette ai linfociti T killer di riconoscere la cellula tumorale come anormale. [92] Anche i linfociti NK sono in grado di uccidere le cellule tumorali in modo simile, soprattutto se queste presentano meno molecole MHC di classe I sulla loro superficie del normale; questo è un fenomeno comune nei tumori. [93] A volte gli anticorpi vengono generati contro le cellule tumorali per consentire la loro distruzione da parte del sistema del complemento . [89]
Chiaramente, alcune cellule mutate eludono il sistema immunitario e progrediscono dando luogo alle neoplasie. [94] Le cellule tumorali spesso hanno un ridotto numero di molecole MHC di classe I sulla loro superficie, evitando in tal modo il rilevamento da parte dei linfociti T killer. [92] Alcune cellule tumorali rilasciano anche prodotti che inibiscono la risposta immunitaria; per esempio secernendo la citochinaTGF-β , che sopprime l'attività dei macrofagi e dei linfociti. [95] Inoltre, può svilupparsi una tolleranza immunologica contro gli antigeni tumorali, così che il sistema immunitario non riesca ad attaccare le cellule neoplastiche. [94]
Paradossalmente, i macrofagi possono promuovere la crescita neoplastica; [96] questo avviene quando le cellule tumorali inviano citochine che attirano i macrofagi, che poi essi stessi generano citochine e fattori di crescita che alimentano lo sviluppo del tumore. Inoltre, una combinazione dell' ipossia nel tumore e una citochina prodotta dai macrofagi, induce le cellule tumorali a diminuire la produzione di una proteina che blocca la metastasi e quindi aumenta la diffusione delle cellule tumorali.
Regolazione fisiologica
Gli ormoni possono agire come immunomodulatori, alterando la sensibilità del sistema immunitario. Ad esempio, gli ormoni sessuali femminili sono noti per essere immunostimolanti sia della risposta adattiva che della risposta innata. [97] . [98] Alcune malattie autoimmuni, come il lupus eritematoso colpiscono preferenzialmente le donne e il loro esordio coincide spesso con la pubertà . Per contro, gli ormoni sessuali maschili, come il testosterone , sembrano essere immunosoppressivi. [99] Si pensa che anche altri ormoni siano in grado di regolare il sistema immunitario, in particolare la prolattina , l' ormone della crescita e la vitamina D . [100] [101]
Quando un linfocita T incontra un agente patogeno esterno, estende un recettore della vitamina D . Questo è essenzialmente un dispositivo di segnalazione che permette ai linfociti T di legarsi alla forma attiva della vitamina D, lo steroide dell'ormone calcitriolo . I linfociti T hanno un rapporto simbiotico con la vitamina D, infatti non solo estendono il recettore per essa, ma esprimono anche il gene CYP27B1 , che è il gene responsabile per la conversione della versione pre-ormone della vitamina D, il calcidiolo, nella versione ormone steroideo , il calcitriolo . Solo dopo che si forma il legame con calcitriolo, i linfociti T possono svolgere la loro funzione prevista. Altre cellule del sistema immunitario note per esprimere il gene CYP27B1 e quindi attivare la vitamina D calcidiolo, sono le cellule dendritiche , i cheratinociti ei macrofagi . [102] [103]
Si ritiene che un progressivo declino dei livelli ormonali con l'avanzare dell'età, sia parzialmente responsabile per l'indebolimento della risposta immunitaria che si riscontra negli individui anziani. [104] Al contrario, alcuni ormoni sono regolati dal sistema immunitario, in particolare l'attività dell' ormone tiroideo . [105] Il declino relativo all'età nella funzione immunitaria è anche legato alla diminuzione dei livelli di vitamina D negli anziani. Con l'invecchiamento accadono due eventi che possono influenzare negativamente i propri livelli di vitamina D. In primo luogo, essi tendenzialmente rimangono maggiormente in casa per via di un'attività motoria ridotta e questo significa che prendono meno sole, producendo quindi meno colecalciferolo tramite le radiazioni ultraviolette . In secondo luogo, la cute di una persona anziana diventa meno abile nel produrre vitamina D. [106]
Sonno e riposo
Il sistema immunitario viene influenzato dal sonno e dal riposo, [107] infatti si è dimostrato che la privazione del sonno è dannosa per la funzione immunitaria. [108] Un complesso sistema di feedback e loop che coinvolge citochine , come l' interleuchina 1 e il fattore di necrosi tumorale-α , prodotte in risposta alle infezioni, sembra svolgere un ruolo nella regolazione della fase non-rapid eye movement ( REM ) del sonno. [109] Così la risposta immunitaria alle infezioni può comportare modifiche al ciclo del sonno, tra cui un aumento del sonno a onde lente rispetto al sonno REM. [110]
Quando si soffre di privazione del sonno, le vaccinazioni attive possono avere una diminuzione dell'effetto provocando una ridotta produzione di anticorpi e una risposta immunitaria meno efficiente, rispetto a quella che si osserverebbe in un individuo ben riposato. Inoltre, proteine come NFIL3 , che hanno dimostrato di essere strettamente correlate sia con la differenziazione dei linfociti T che con i ritmi circadiani , possono essere influenzate attraverso il disturbo dei cicli di luce naturale per via della privazione del sonno, dei lavori a turni, ecc. Come di conseguenza, ciò può portare all'aumento delle patologie croniche, come le malattie cardiache, il dolore cronico e l' asma . [111]
Oltre alle conseguenze negative della privazione del sonno, lo stravolgimento del sistema circadiano ha dimostrato di avere forti effetti regolatori sulle funzioni immunologiche che interessano sia l'immunità innata che quella adattativa. In primo luogo, durante la fase iniziale del sonno ad onde lente, un calo improvviso dei livelli ematici di cortisolo , adrenalina e noradrenalina inducono un aumento dei livelli ematici degli ormoni leptina , dell' ormone ipofisario della crescita e della prolattina . Questi segnali inducono uno stato pro-infiammatorio, per via della produzione di citochine interleuchina 1, interleuchina-12, TNF-alfa e interferone gamma . Queste citochine poi stimolano le funzioni immunitarie come l'attivazione delle cellule immunitarie, la loro proliferazione e la differenziazione. [112]
Durante i periodi di veglia, le cellule effettrici differenziate, come i linfociti citotossici natural killer ei linfociti T citotossici, presentano un picco di attività in modo da ottenere una risposta efficace contro eventuali agenti patogeni intrusi. Vi sono due teorie che cercano di spiegare perché lo stato pro-infiammatorio è riservato al tempo di sonno. La prima considera che se l'infiammazione si verificasse durante i periodi di veglia, causerebbe gravi menomazioni cognitive e fisiche, mentre la seconda considera la presenza della melatonina nei periodi di sonno. L'infiammazione provoca una grande quantità di stress ossidativo e la presenza di melatonina durante i periodi di sonno potrebbe contrastare attivamente la produzione di radicali liberi durante questo periodo. [112] [113]
Nutrizione e dieta
Apporti nutritivi troppo elevati, sono correlati con malattie come il diabete e l' obesità che sono note per influenzare la funzione immunitaria. Anche una cattiva dieta , così come alcune carenze di minerali ed elementi nutrizionali specifici, può essere causa di una compromissione della risposta immunitaria. [114]
Gli alimenti ricchi di alcuni acidi grassi possono essere promotori di un sistema immunitario sano. [115] Analogamente, una denutrizione fetale può causare un danno permanente al sistema. [116]
Manipolazione in medicina

La risposta immunitaria può essere manipolata per sopprimere le risposte indesiderate derivanti dalle malattie autoimmuni, dalle allergie e dal rigetto di trapianto e per stimolare le risposte di protezione contro gli agenti patogeni che in gran parte sfuggono al sistema immunitario o ai tumori .
Immunosoppressione
Farmaci immunosoppressori vengono usati per controllare i disordini autoimmuni o l'infiammazione quando si verifica un eccessivo danno tissutale, oltre che per prevenire il rigetto del trapianto dopo aver subito un trapianto d'organo . [35] [117]
Farmaci antinfiammatori sono spesso utilizzati per controllare gli effetti dell'infiammazione, tra questi, i glucocorticoidi sono i più potenti; tuttavia questi farmaci possono avere molti effetti collaterali indesiderati, come obesità addominale, iperglicemia , osteoporosi , dunque il loro uso deve essere controllato scrupolosamente. [118] Basse dosi di farmaci anti-infiammatori sono spesso usati in combinazione con farmaci citotossici o immunosoppressivi, come il metotrexato o l' azatioprina . I farmaci citotossici inibiscono la risposta immunitaria uccidendo le cellule in divisione, come i linfociti T attivati. Tuttavia, vengono uccise indiscriminatamente le cellule che si dividono e altri organi vengono colpiti, provocando effetti collaterali tossici. [117] I farmaci immunosoppressori, come la ciclosporina , evitano che i linfociti T rispondano ai segnali correttamente inibendo le vie di trasduzione del segnale . [119]
Immunostimolazione
La terapia con anticorpi monoclonali stimola il sistema immunitario ad attaccare le cellule del tumore .
Note
- ^ a b c Gregory Beck e Gail S. Habitat, Immunity and the Invertebrates ( PDF ), in Scientific American , vol. 275, n. 5, novembre 1996, pp. 60–66, DOI : 10.1038/scientificamerican1196-60 . URL consultato il 1º gennaio 2007 ( archiviato il 27 marzo 2009) .
- ^ O'Byrne KJ, Dalgleish AG,Chronic immune activation and inflammation as the cause of malignancy , in British Journal of Cancer , vol. 85, n. 4, Aug 2001, pp. 473–83, DOI : 10.1054/bjoc.2001.1943 , PMC 2364095 , PMID 11506482 .
- ^ Retief FP, Cilliers L, The epidemic of Athens, 430-426 BC , in South African Medical Journal = Suid-Afrikaanse Tydskrif Vir Geneeskunde , vol. 88, n. 1, Jan 1998, pp. 50–3, PMID 9539938 .
- ^ Ostoya P, Maupertuis et la biologie , in Revue d'histoire des sciences et de leurs applications , vol. 7, n. 1, 1954, pp. 60–78, DOI : 10.3406/rhs.1954.3379 . URL consultato il 15 settembre 2016 ( archiviato il 24 settembre 2015) .
- ^ Plotkin SA, Vaccines: past, present and future , in Nature Medicine , vol. 11, 4 Suppl, Apr 2005, pp. S5–11, DOI : 10.1038/nm1209 , PMID 15812490 .
- ^ The Nobel Prize in Physiology or Medicine 1905 Archiviato il 22 giugno 2018 in Internet Archive . Nobelprize.org Accessed 8 January 2009.
- ^ Major Walter Reed, Medical Corps, US Army Walter Reed Army Medical Center. Accessed 8 January 2007.
- ^ Elie Metchnikoff e Translated by FG Binnie., Immunity in Infective Diseases , Cambridge University Press, 1905, LCCN 68025143 .
- ^ The Nobel Prize in Physiology or Medicine 1908 Archiviato l'8 luglio 2018 in Internet Archive . Nobelprize.org Accessed 8 January 2007
- ^ a b Litman GW, Cannon JP, Dishaw LJ,Reconstructing immune phylogeny: new perspectives , in Nature Reviews. Immunology , vol. 5, n. 11, Nov 2005, pp. 866–79, DOI : 10.1038/nri1712 , PMC 3683834 , PMID 16261174 .
- ^ Restifo NP, Gattinoni L, Lineage relationship of effector and memory T cells , in Current Opinion in Immunology , vol. 25, n. 5, ottobre 2013, pp. 556–63, DOI : 10.1016/j.coi.2013.09.003 , PMID 24148236 .
- ^ Kurosaki T, Kometani K, Ise W, Memory B cells , in Nature Reviews. Immunology , vol. 15, n. 3, marzo 2015, pp. 149–59, DOI : 10.1038/nri3802 , PMID 25677494 .
- ^ Smith AD (Ed) Oxford dictionary of biochemistry and molecular biology. (1997) Oxford University Press. ISBN 0-19-854768-4
- ^ a b c d e f g h i Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts e Peter Walters, Molecular Biology of the Cell , Fourth, New York and London, Garland Science, 2002, ISBN 978-0-8153-3218-3 . URL consultato il 4 maggio 2019 ( archiviato il 17 agosto 2006) .
- ^ Medzhitov R, Recognition of microorganisms and activation of the immune response , in Nature , vol. 449, n. 7164, Oct 2007, pp. 819–26, Bibcode : 2007Natur.449..819M , DOI : 10.1038/nature06246 , PMID 17943118 .
- ^ Matzinger P, The danger model: a renewed sense of self , in Science , vol. 296, n. 5566, Apr 2002, pp. 301–5, Bibcode : 2002Sci...296..301M , DOI : 10.1126/science.1071059 , PMID 11951032 .
- ^ Boyton RJ, Openshaw PJ, Pulmonary defences to acute respiratory infection , in British Medical Bulletin , vol. 61, n. 1, 2002, pp. 1–12, DOI : 10.1093/bmb/61.1.1 , PMID 11997295 .
- ^ Agerberth B, Gudmundsson GH, Host antimicrobial defence peptides in human disease , in Current Topics in Microbiology and Immunology , Current Topics in Microbiology and Immunology, vol. 306, 2006, pp. 67–90, DOI : 10.1007/3-540-29916-5_3 , ISBN 978-3-540-29915-8 , PMID 16909918 .
- ^ Moreau JM, Girgis DO, Hume EB, Dajcs JJ, Austin MS, O'Callaghan RJ, Phospholipase A(2) in rabbit tears: a host defense against Staphylococcus aureus , in Investigative Ophthalmology & Visual Science , vol. 42, n. 10, Sep 2001, pp. 2347–54, PMID 11527949 (archiviato dall' url originale il 9 settembre 2012) .
- ^ Hankiewicz J, Swierczek E, Lysozyme in human body fluids , in Clinica Chimica Acta; International Journal of Clinical Chemistry , vol. 57, n. 3, Dec 1974, pp. 205–9, DOI : 10.1016/0009-8981(74)90398-2 , PMID 4434640 .
- ^ Fair WR, Couch J, Wehner N, Prostatic antibacterial factor. Identity and significance , in Urology , vol. 7, n. 2, Feb 1976, pp. 169–77, DOI : 10.1016/0090-4295(76)90305-8 , PMID 54972 .
- ^ Yenugu S, Hamil KG, Birse CE, Ruben SM, French FS, Hall SH,Antibacterial properties of the sperm-binding proteins and peptides of human epididymis 2 (HE2) family; salt sensitivity, structural dependence and their interaction with outer and cytoplasmic membranes of Escherichia coli , in The Biochemical Journal , vol. 372, Pt 2, Jun 2003, pp. 473–83, DOI : 10.1042/BJ20030225 , PMC 1223422 , PMID 12628001 .
- ^ Gorbach SL, Lactic acid bacteria and human health , in Annals of Medicine , vol. 22, n. 1, Feb 1990, pp. 37–41, DOI : 10.3109/07853899009147239 , PMID 2109988 .
- ^ Hill LV, Embil JA,Vaginitis: current microbiologic and clinical concepts , in Cmaj , vol. 134, n. 4, Feb 1986, pp. 321–31, PMC 1490817 , PMID 3510698 .
- ^ Reid G, Bruce AW,Urogenital infections in women: can probiotics help? , in Postgraduate Medical Journal , vol. 79, n. 934, Aug 2003, pp. 428–32, DOI : 10.1136/pmj.79.934.428 , PMC 1742800 , PMID 12954951 .
- ^ Salminen SJ, Gueimonde M, Isolauri E, Probiotics that modify disease risk , in The Journal of Nutrition , vol. 135, n. 5, maggio 2005, pp. 1294–8, PMID 15867327 . URL consultato il 6 ottobre 2016 ( archiviato il 17 gennaio 2021) .
- ^ Reid G, Jass J, Sebulsky MT, McCormick JK, Potential uses of probiotics in clinical practice , in Clinical Microbiology Reviews , vol. 16, n. 4, Oct 2003, pp. 658–72, DOI : 10.1128/CMR.16.4.658-672.2003 , PMC 207122 , PMID 14557292 .
- ^ Kawai T, Akira S, Innate immune recognition of viral infection , in Nature Immunology , vol. 7, n. 2, Feb 2006, pp. 131–7, DOI : 10.1038/ni1303 , PMID 16424890 .
- ^ Miller SB, Prostaglandins in health and disease: an overview , in Seminars in Arthritis and Rheumatism , vol. 36, n. 1, Aug 2006, pp. 37–49, DOI : 10.1016/j.semarthrit.2006.03.005 , PMID 16887467 .
- ^ Ogawa Y, Calhoun WJ, The role of leukotrienes in airway inflammation , in The Journal of Allergy and Clinical Immunology , vol. 118, n. 4, Oct 2006, pp. 789–98; quiz 799–800, DOI : 10.1016/j.jaci.2006.08.009 , PMID 17030228 .
- ^ Le Y, Zhou Y, Iribarren P, Wang J, Chemokines and chemokine receptors: their manifold roles in homeostasis and disease ( PDF ), in Cellular & Molecular Immunology , vol. 1, n. 2, Apr 2004, pp. 95–104, PMID 16212895 . URL consultato il 6 ottobre 2016 ( archiviato il 5 marzo 2019) .
- ^ Martin P, Leibovich SJ, Inflammatory cells during wound repair: the good, the bad and the ugly , in Trends in Cell Biology , vol. 15, n. 11, Nov 2005, pp. 599–607, DOI : 10.1016/j.tcb.2005.09.002 , PMID 16202600 .
- ^ a b Rus H, Cudrici C, Niculescu F, The role of the complement system in innate immunity , in Immunologic Research , vol. 33, n. 2, 2005, pp. 103–12, DOI : 10.1385/IR:33:2:103 , PMID 16234578 .
- ^ Degn SE, Thiel S, Humoral pattern recognition and the complement system , in Scandinavian Journal of Immunology , vol. 78, n. 2, agosto 2013, pp. 181–93, DOI : 10.1111/sji.12070 , PMID 23672641 .
- ^ a b c d e f g Janeway CA, Jr. , Immunobiology , 6th, Garland Science, 2005, ISBN 0-443-07310-4 .
- ^ Liszewski MK, Farries TC, Lublin DM, Rooney IA, Atkinson JP, Control of the complement system , in Advances in Immunology , Advances in Immunology, vol. 61, 1996, pp. 201–83, DOI : 10.1016/S0065-2776(08)60868-8 , ISBN 978-0-12-022461-6 , PMID 8834497 .
- ^ Sim RB, Tsiftsoglou SA, Proteases of the complement system ( PDF ), in Biochemical Society Transactions , vol. 32, Pt 1, Feb 2004, pp. 21–7, DOI : 10.1042/BST0320021 , PMID 14748705 .
- ^ Withers DR, Innate lymphoid cell regulation of adaptive immunity , in Immunology , giugno 2016, DOI : 10.1111/imm.12639 , PMID 27341319 .
- ^ Ryter A, Relationship between ultrastructure and specific functions of macrophages , in Comparative Immunology, Microbiology and Infectious Diseases , vol. 8, n. 2, 1985, pp. 119–33, DOI : 10.1016/0147-9571(85)90039-6 , PMID 3910340 .
- ^ Langermans JA, Hazenbos WL, van Furth R, Antimicrobial functions of mononuclear phagocytes , in Journal of Immunological Methods , vol. 174, 1–2, Sep 1994, pp. 185–94, DOI : 10.1016/0022-1759(94)90021-3 , PMID 8083520 .
- ^ May RC, Machesky LM, Phagocytosis and the actin cytoskeleton , in Journal of Cell Science , vol. 114, Pt 6, Mar 2001, pp. 1061–77, PMID 11228151 . URL consultato il 6 ottobre 2016 ( archiviato il 31 marzo 2020) .
- ^ Salzet M, Tasiemski A, Cooper E, Innate immunity in lophotrochozoans: the annelids , in Current Pharmaceutical Design , vol. 12, n. 24, 2006, pp. 3043–50, DOI : 10.2174/138161206777947551 , PMID 16918433 .
- ^ Zen K, Parkos CA, Leukocyte-epithelial interactions , in Current Opinion in Cell Biology , vol. 15, n. 5, Oct 2003, pp. 557–64, DOI : 10.1016/S0955-0674(03)00103-0 , PMID 14519390 .
- ^ a b Viera Stvrtinová, Ján Jakubovský e Ivan Hulín, Inflammation and Fever from Pathophysiology: Principles of Disease , Computing Centre, Slovak Academy of Sciences, Academic Electronic Press, 1995, ISBN 80-967366-1-2 . URL consultato il 1º gennaio 2007 (archiviato dall' url originale l'11 luglio 2001) .
- ^ Rua R, McGavern DB, Elucidation of monocyte/macrophage dynamics and function by intravital imaging , in Journal of Leukocyte Biology , vol. 98, n. 3, settembre 2015, pp. 319–32, DOI : 10.1189/jlb.4RI0115-006RR , PMID 26162402 .
- ^ Krishnaswamy G, Ajitawi O, Chi DS, The human mast cell: an overview , in Methods in Molecular Biology , vol. 315, 2006, pp. 13–34, PMID 16110146 .
- ^ Kariyawasam HH, Robinson DS, The eosinophil: the cell and its weapons, the cytokines, its locations , in Seminars in Respiratory and Critical Care Medicine , vol. 27, n. 2, Apr 2006, pp. 117–27, DOI : 10.1055/s-2006-939514 , PMID 16612762 .
- ^ Middleton D, Curran M, Maxwell L, Natural killer cells and their receptors , in Transplant Immunology , vol. 10, 2–3, Aug 2002, pp. 147–64, DOI : 10.1016/S0966-3274(02)00062-X , PMID 12216946 .
- ^ a b Guermonprez P, Valladeau J, Zitvogel L, Théry C, Amigorena S, Antigen presentation and T cell stimulation by dendritic cells , in Annual Review of Immunology , vol. 20, n. 1, 2002, pp. 621–67, DOI : 10.1146/annurev.immunol.20.100301.064828 , PMID 11861614 .
- ^ Rajalingam R, Overview of the killer cell immunoglobulin-like receptor system , in Methods in Molecular Biology , Methods in Molecular Biology™, vol. 882, 2012, pp. 391–414, DOI : 10.1007/978-1-61779-842-9_23 , ISBN 978-1-61779-841-2 , PMID 22665247 .
- ^ Pancer Z, Cooper MD, The evolution of adaptive immunity , in Annual Review of Immunology , vol. 24, n. 1, 2006, pp. 497–518, DOI : 10.1146/annurev.immunol.24.021605.090542 , PMID 16551257 .
- ^ a b Holtmeier W, Kabelitz D, gammadelta T cells link innate and adaptive immune responses , in Chemical Immunology and Allergy , Chemical Immunology and Allergy, vol. 86, 2005, pp. 151–83, DOI : 10.1159/000086659 , ISBN 3-8055-7862-8 , PMID 15976493 .
- ^ Harty JT, Tvinnereim AR, White DW, CD8+ T cell effector mechanisms in resistance to infection , in Annual Review of Immunology , vol. 18, n. 1, 2000, pp. 275–308, DOI : 10.1146/annurev.immunol.18.1.275 , PMID 10837060 .
- ^ a b Radoja S, Frey AB, Vukmanovic S, T-cell receptor signaling events triggering granule exocytosis , in Critical Reviews in Immunology , vol. 26, n. 3, 2006, pp. 265–90, DOI : 10.1615/CritRevImmunol.v26.i3.40 , PMID 16928189 . URL consultato il 6 ottobre 2016 ( archiviato il 9 settembre 2012) .
- ^ Abbas AK, Murphy KM, Sher A, Functional diversity of helper T lymphocytes , in Nature , vol. 383, n. 6603, Oct 1996, pp. 787–93, Bibcode : 1996Natur.383..787A , DOI : 10.1038/383787a0 , PMID 8893001 .
- ^ McHeyzer-Williams LJ, Malherbe LP, McHeyzer-Williams MG, Helper T cell-regulated B cell immunity , in Current Topics in Microbiology and Immunology , Current Topics in Microbiology and Immunology, vol. 311, 2006, pp. 59–83, DOI : 10.1007/3-540-32636-7_3 , ISBN 978-3-540-32635-9 , PMID 17048705 .
- ^ Kovacs B, Maus MV, Riley JL, Derimanov GS, Koretzky GA, June CH, Finkel TH, Human CD8+ T cells do not require the polarization of lipid rafts for activation and proliferation , in Proceedings of the National Academy of Sciences of the United States of America , vol. 99, n. 23, Nov 2002, pp. 15006–11, Bibcode : 2002PNAS...9915006K , DOI : 10.1073/pnas.232058599 , PMC 137535 , PMID 12419850 .
- ^ Grewal IS, Flavell RA, CD40 and CD154 in cell-mediated immunity , in Annual Review of Immunology , vol. 16, n. 1, 1998, pp. 111–35, DOI : 10.1146/annurev.immunol.16.1.111 , PMID 9597126 .
- ^ B Meresse, Celiac disease: from oral tolerance to intestinal inflammation, autoimmunity and lymphomagenesis , in Mucosal Immunology , vol. 2, n. 1, 2008, pp. 8-23.
- ^ Girardi M, Immunosurveillance and immunoregulation by gammadelta T cells , in The Journal of Investigative Dermatology , vol. 126, n. 1, Jan 2006, pp. 25–31, DOI : 10.1038/sj.jid.5700003 , PMID 16417214 .
- ^ Understanding the Immune System: How it Works ( PDF ), su niaid.nih.gov , National Institute of Allergy and Infectious Diseases (NIAID). URL consultato il 1º gennaio 2007 (archiviato dall' url originale il 3 gennaio 2007) .
- ^ Sproul TW, Cheng PC, Dykstra ML, Pierce SK, A role for MHC class II antigen processing in B cell development , in International Reviews of Immunology , vol. 19, 2–3, 2000, pp. 139–55, DOI : 10.3109/08830180009088502 , PMID 10763706 .
- ^ Kehry MR, Hodgkin PD,B-cell activation by helper T-cell membranes , in Critical Reviews in Immunology , vol. 14, 3–4, 1994, pp. 221–38, DOI : 10.1615/CritRevImmunol.v14.i3-4.20 , PMID 7538767 .
- ^ Kenneth Murphy e Casey Weaver, 10: The Humoral Immune Response , in Immunobiology , 9ª ed., Garland Science, 2016, ISBN 978-0-8153-4505-3 .
- ^ Saji F, Samejima Y, Kamiura S, Koyama M, Dynamics of immunoglobulins at the feto-maternal interface , in Reviews of Reproduction , vol. 4, n. 2, maggio 1999, pp. 81–9, DOI : 10.1530/ror.0.0040081 , PMID 10357095 .
- ^ Van de Perre P, Transfer of antibody via mother's milk , in Vaccine , vol. 21, n. 24, Jul 2003, pp. 3374–6, DOI : 10.1016/S0264-410X(03)00336-0 , PMID 12850343 .
- ^ Keller MA, Stiehm ER, Passive immunity in prevention and treatment of infectious diseases , in Clinical Microbiology Reviews , vol. 13, n. 4, Oct 2000, pp. 602–14, DOI : 10.1128/CMR.13.4.602-614.2000 , PMC 88952 , PMID 11023960 .
- ^ Death and DALY estimates for 2002 by cause for WHO Member States. Archiviato il 2 maggio 2008 in Internet Archive . World Health Organization . Retrieved on 1 January 2007.
- ^ Singh M, O'Hagan D, Advances in vaccine adjuvants , in Nature Biotechnology , vol. 17, n. 11, Nov 1999, pp. 1075–81, DOI : 10.1038/15058 , PMID 10545912 .
- ^ Aw D, Silva AB, Palmer DB,Immunosenescence: emerging challenges for an ageing population , in Immunology , vol. 120, n. 4, Apr 2007, pp. 435–46, DOI : 10.1111/j.1365-2567.2007.02555.x , PMC 2265901 , PMID 17313487 .
- ^ a b c Chandra RK, Nutrition and the immune system: an introduction , in The American Journal of Clinical Nutrition , vol. 66, n. 2, Aug 1997, pp. 460S–463S, PMID 9250133 . URL consultato il 6 ottobre 2016 ( archiviato il 17 gennaio 2021) .
- ^ Miller JF, The discovery of thymus function and of thymus-derived lymphocytes , in Immunological Reviews , vol. 185, n. 1, Jul 2002, pp. 7–14, DOI : 10.1034/j.1600-065X.2002.18502.x , PMID 12190917 .
- ^ Joos L, Tamm M, Breakdown of pulmonary host defense in the immunocompromised host: cancer chemotherapy , in Proceedings of the American Thoracic Society , vol. 2, n. 5, 2005, pp. 445–8, DOI : 10.1513/pats.200508-097JS , PMID 16322598 .
- ^ Copeland KF, Heeney JL, T helper cell activation and human retroviral pathogenesis , in Microbiological Reviews , vol. 60, n. 4, Dec 1996, pp. 722–42, PMC 239461 , PMID 8987361 . URL consultato il 6 ottobre 2016 ( archiviato il 17 gennaio 2021) .
- ^ a b c d Abdul Ghaffar,Immunology — Chapter Seventeen: Hypersensitivity States , su Microbiology and Immunology On-line , University of South Carolina School of Medicine, 2006. URL consultato il 29 maggio 2016 ( archiviato il 18 maggio 2016) .
- ^ Bickle TA, Krüger DH, Biology of DNA restriction , in Microbiological Reviews , vol. 57, n. 2, Jun 1993, pp. 434–50, PMC 372918 , PMID 8336674 . URL consultato il 6 ottobre 2016 ( archiviato il 18 febbraio 2020) .
- ^ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P, CRISPR provides acquired resistance against viruses in prokaryotes , in Science , vol. 315, n. 5819, Mar 2007, pp. 1709–12, Bibcode : 2007Sci...315.1709B , DOI : 10.1126/science.1138140 , PMID 17379808 .
- ^ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J, Small CRISPR RNAs guide antiviral defense in prokaryotes , in Science , vol. 321, n. 5891, Aug 2008, pp. 960–4, Bibcode : 2008Sci...321..960B , DOI : 10.1126/science.1159689 , PMID 18703739 .
- ^ Bayne CJ, Origins and evolutionary relationships between the innate and adaptive arms of immune systems , in Integr. Comp. Biol. , vol. 43, n. 2, 2003, pp. 293–299, DOI : 10.1093/icb/43.2.293 , PMID 21680436 .
- ^ Stram Y, Kuzntzova L, Inhibition of viruses by RNA interference , in Virus Genes , vol. 32, n. 3, Jun 2006, pp. 299–306, DOI : 10.1007/s11262-005-6914-0 , PMID 16732482 .
- ^ a b David Schneider, Innate Immunity — Lecture 4: Plant immune responses ( PDF ), su web.stanford.edu , Stanford University Department of Microbiology and Immunology. URL consultato il 1º gennaio 2007 ( archiviato il 6 gennaio 2017) .
- ^ Jones JD, Dangl JL, The plant immune system , in Nature , vol. 444, n. 7117, Nov 2006, pp. 323–9, Bibcode : 2006Natur.444..323J , DOI : 10.1038/nature05286 , PMID 17108957 .
- ^ Baulcombe D, RNA silencing in plants , in Nature , vol. 431, n. 7006, Sep 2004, pp. 356–63, Bibcode : 2004Natur.431..356B , DOI : 10.1038/nature02874 , PMID 15372043 .
- ^ Morgan RA, Dudley ME, Wunderlich JR, etal,Cancer Regression in Patients After Transfer of Genetically Engineered Lymphocytes , in Science , vol. 314, n. 5796, ottobre 2006, pp. 126–9, Bibcode : 2006Sci...314..126M , DOI : 10.1126/science.1129003 , PMC 2267026 , PMID 16946036 .
- ^ a b Andersen MH, Schrama D, Thor Straten P, Becker JC, Cytotoxic T cells , in The Journal of Investigative Dermatology , vol. 126, n. 1, Jan 2006, pp. 32–41, DOI : 10.1038/sj.jid.5700001 , PMID 16417215 .
- ^ Boon T, van der Bruggen P,Human tumor antigens recognized by T lymphocytes , in The Journal of Experimental Medicine , vol. 183, n. 3, Mar 1996, pp. 725–9, DOI : 10.1084/jem.183.3.725 , PMC 2192342 , PMID 8642276 .
- ^ Castelli C, Rivoltini L, Andreola G, Carrabba M, Renkvist N, Parmiani G, <323::AID-JCP2>3.0.CO;2-# T-cell recognition of melanoma-associated antigens , in Journal of Cellular Physiology , vol. 182, n. 3, Mar 2000, pp. 323–31, DOI : 10.1002/(SICI)1097-4652(200003)182:3<323::AID-JCP2>3.0.CO;2-# , PMID 10653598 .
- ^ a b Romero P, Cerottini JC, Speiser DE, The human T cell response to melanoma antigens , in Advances in Immunology , Advances in Immunology, vol. 92, 2006, pp. 187–224, DOI : 10.1016/S0065-2776(06)92005-7 , ISBN 978-0-12-373636-9 , PMID 17145305 .
- ^ a b Guevara-Patiño JA, Turk MJ, Wolchok JD, Houghton AN, Immunity to cancer through immune recognition of altered self: studies with melanoma , in Advances in Cancer Research , Advances in Cancer Research, vol. 90, 2003, pp. 157–77, DOI : 10.1016/S0065-230X(03)90005-4 , ISBN 978-0-12-006690-2 , PMID 14710950 .
- ^ Renkvist N, Castelli C, Robbins PF, Parmiani G, A listing of human tumor antigens recognized by T cells , in Cancer Immunology, Immunotherapy , vol. 50, n. 1, Mar 2001, pp. 3–15, DOI : 10.1007/s002620000169 , PMID 11315507 .
- ^ Gerloni M, Zanetti M, CD4 T cells in tumor immunity , in Springer Seminars in Immunopathology , vol. 27, n. 1, Jun 2005, pp. 37–48, DOI : 10.1007/s00281-004-0193-z , PMID 15965712 .
- ^ a b Seliger B, Ritz U, Ferrone S, Molecular mechanisms of HLA class I antigen abnormalities following viral infection and transformation , in International Journal of Cancer. Journal International Du Cancer , vol. 118, n. 1, Jan 2006, pp. 129–38, DOI : 10.1002/ijc.21312 , PMID 16003759 .
- ^ Hayakawa Y, Smyth MJ, Innate immune recognition and suppression of tumors , in Advances in Cancer Research , Advances in Cancer Research, vol. 95, 2006, pp. 293–322, DOI : 10.1016/S0065-230X(06)95008-8 , ISBN 978-0-12-006695-7 , PMID 16860661 .
- ^ a b Seliger B, Strategies of tumor immune evasion , in BioDrugs , vol. 19, n. 6, 2005, pp. 347–54, DOI : 10.2165/00063030-200519060-00002 , PMID 16392887 .
- ^ Frumento G, Piazza T, Di Carlo E, Ferrini S, Targeting tumor-related immunosuppression for cancer immunotherapy , in Endocrine, Metabolic & Immune Disorders Drug Targets , vol. 6, n. 3, Sep 2006, pp. 233–7, DOI : 10.2174/187153006778250019 , PMID 17017974 .
- ^ Stix G, A malignant flame. Understanding chronic inflammation, which contributes to heart disease, Alzheimer's and a variety of other ailments, may be a key to unlocking the mysteries of cancer ( PDF ), in Scientific American , vol. 297, n. 1, Jul 2007, pp. 60–7, DOI : 10.1038/scientificamerican0707-60 , PMID 17695843 (archiviato dall' url originale il 16 luglio 2011) .
- ^ CR Wira, Crane-Godreau M e Grant K, Endocrine regulation of the mucosal immune system in the female reproductive tract , in Mucosal Immunology , San Francisco, Elsevier, 2004, ISBN 0-12-491543-4 .
- ^ Lang TJ, Estrogen as an immunomodulator , in Clinical Immunology , vol. 113, n. 3, Dec 2004, pp. 224–30, DOI : 10.1016/j.clim.2004.05.011 , PMID 15507385 .
Moriyama A, Shimoya K, Ogata I, Kimura T, Nakamura T, Wada H, Ohashi K, Azuma C, Saji F, Murata Y, Secretory leukocyte protease inhibitor (SLPI) concentrations in cervical mucus of women with normal menstrual cycle , in Molecular Human Reproduction , vol. 5, n. 7, Jul 1999, pp. 656–61, DOI : 10.1093/molehr/5.7.656 , PMID 10381821 .
Cutolo M, Sulli A, Capellino S, Villaggio B, Montagna P, Seriolo B, Straub RH, Sex hormones influence on the immune system: basic and clinical aspects in autoimmunity , in Lupus , vol. 13, n. 9, 2004, pp. 635–8, DOI : 10.1191/0961203304lu1094oa , PMID 15485092 .
King AE, Critchley HO, Kelly RW, Presence of secretory leukocyte protease inhibitor in human endometrium and first trimester decidua suggests an antibacterial protective role , in Molecular Human Reproduction , vol. 6, n. 2, Feb 2000, pp. 191–6, DOI : 10.1093/molehr/6.2.191 , PMID 10655462 . - ^ Fimmel S, Zouboulis CC, Influence of physiological androgen levels on wound healing and immune status in men , in The Aging Male , vol. 8, n. 3-4, 2005, pp. 166–74, DOI : 10.1080/13685530500233847 , PMID 16390741 .
- ^ Dorshkind K, Horseman ND, The roles of prolactin, growth hormone, insulin-like growth factor-I, and thyroid hormones in lymphocyte development and function: insights from genetic models of hormone and hormone receptor deficiency , in Endocrine Reviews , vol. 21, n. 3, Jun 2000, pp. 292–312, DOI : 10.1210/er.21.3.292 , PMID 10857555 .
- ^ Nagpal S, Na S, Rathnachalam R, Noncalcemic actions of vitamin D receptor ligands , in Endocrine Reviews , vol. 26, n. 5, Aug 2005, pp. 662–87, DOI : 10.1210/er.2004-0002 , PMID 15798098 .
- ^ von Essen MR, Kongsbak M, Schjerling P, Olgaard K, Odum N, Geisler C, Vitamin D controls T cell antigen receptor signaling and activation of human T cells , in Nature Immunology , vol. 11, n. 4, Apr 2010, pp. 344–9, DOI : 10.1038/ni.1851 , PMID 20208539 . URL consultato il 4 maggio 2019 ( archiviato il 21 giugno 2017) .
- ^ Sigmundsdottir H, Pan J, Debes GF, Alt C, Habtezion A, Soler D, Butcher EC, DCs metabolize sunlight-induced vitamin D3 to 'program' T cell attraction to the epidermal chemokine CCL27 , in Nature Immunology , vol. 8, n. 3, Mar 2007, pp. 285–93, DOI : 10.1038/ni1433 , PMID 17259988 .
- ^ Hertoghe T, The "multiple hormone deficiency" theory of aging: is human senescence caused mainly by multiple hormone deficiencies? , in Annals of the New York Academy of Sciences , vol. 1057, n. 1, Dec 2005, pp. 448–65, Bibcode : 2005NYASA1057..448H , DOI : 10.1196/annals.1322.035 , PMID 16399912 .
- ^ Klein JR, The immune system as a regulator of thyroid hormone activity , in Experimental Biology and Medicine , vol. 231, n. 3, Mar 2006, pp. 229–36, PMC 2768616 , PMID 16514168 .
- ^ Mosekilde L, Vitamin D and the elderly , in Clinical Endocrinology , vol. 62, n. 3, Mar 2005, pp. 265–81, DOI : 10.1111/j.1365-2265.2005.02226.x , PMID 15730407 .
- ^ Lange T, Perras B, Fehm HL, Born J,Sleep enhances the human antibody response to hepatitis A vaccination , in Psychosomatic Medicine , vol. 65, n. 5, 2003, pp. 831–5, DOI : 10.1097/01.PSY.0000091382.61178.F1 , PMID 14508028 .
- ^ Bryant PA, Trinder J, Curtis N, Sick and tired: Does sleep have a vital role in the immune system? , in Nature Reviews. Immunology , vol. 4, n. 6, Jun 2004, pp. 457–67, DOI : 10.1038/nri1369 , PMID 15173834 .
- ^ Krueger JM, Majde JA,Humoral links between sleep and the immune system: research issues , in Annals of the New York Academy of Sciences , vol. 992, n. 1, maggio 2003, pp. 9–20, Bibcode : 2003NYASA.992....9K , DOI : 10.1111/j.1749-6632.2003.tb03133.x , PMID 12794042 .
- ^ Majde JA, Krueger JM, Links between the innate immune system and sleep , in The Journal of Allergy and Clinical Immunology , vol. 116, n. 6, Dec 2005, pp. 1188–98, DOI : 10.1016/j.jaci.2005.08.005 , PMID 16337444 .
- ^ Sleep's Effects On Your Immune System Revealed In New Body Clock Study , su huffingtonpost.com . URL consultato il 28 aprile 2014 ( archiviato il 17 novembre 2013) .
- ^ a b Besedovsky L, Lange T, Born J, Sleep and immune function , in Pflügers Archiv , vol. 463, n. 1, Jan 2012, pp. 121–37, DOI : 10.1007/s00424-011-1044-0 , PMID 22071480 .
- ^ Can Better Sleep Mean Catching fewer Colds? , su webmd.com . URL consultato il 28 aprile 2014 (archiviato dall' url originale il 9 maggio 2014) .
- ^ RM Suskind, CL Lachney, JN Udall, Jr., " Malnutrition and the Immune Response Archiviato il 2 agosto 2016 in Internet Archive .", in: Dairy products in human health and nutrition , M. Serrano-Ríos, ed., CRC Press, 1994, pp. 285–300
- ^ Pond CM, Adipose tissue and the immune system , in Prostaglandins, Leukotrienes, and Essential Fatty Acids , vol. 73, n. 1, Jul 2005, pp. 17–30, DOI : 10.1016/j.plefa.2005.04.005 , PMID 15946832 .
- ^ Langley-Evans SC, Carrington LJ, Diet and the developing immune system , in Lupus , vol. 15, n. 11, 2006, pp. 746–52, DOI : 10.1177/0961203306070001 , PMID 17153845 .
- ^ a b Taylor AL, Watson CJ, Bradley JA, Immunosuppressive agents in solid organ transplantation: Mechanisms of action and therapeutic efficacy , in Critical Reviews in Oncology/Hematology , vol. 56, n. 1, Oct 2005, pp. 23–46, DOI : 10.1016/j.critrevonc.2005.03.012 , PMID 16039869 .
- ^ Barnes PJ, Corticosteroids: the drugs to beat , in European Journal of Pharmacology , vol. 533, n. 1-3, Mar 2006, pp. 2–14, DOI : 10.1016/j.ejphar.2005.12.052 , PMID 16436275 .
- ^ Masri MA, The mosaic of immunosuppressive drugs , in Molecular Immunology , vol. 39, n. 17-18, Jul 2003, pp. 1073–7, DOI : 10.1016/S0161-5890(03)00075-0 , PMID 12835079 .
Bibliografia
- Charles A. Janeway, Paul Travers, Mark Walport, Mark J. Shlomchik, Immunobiologia (3ª edizione italiana sulla 6ª inglese) , Padova, Piccin, 2007, ISBN 88-299-1814-8 .
- ( EN ) Charles Janeway, Immunobiology , 6th, Garland Science, 2005, ISBN 0-443-07310-4 .
- ( EN ) Viera Stvrtinová, Ján Jakubovský e Ivan Hulín, Inflammation and Fever from Pathophysiology: Principles of Disease , Computing Centre, Slovak Academy of Sciences, Academic Electronic Press, 1995, ISBN 80-967366-1-2 . URL consultato il 1º gennaio 2007 (archiviato dall' url originale l'11 luglio 2001) .
- ( EN ) Kenneth Murphy e Casey Weaver, 10: The Humoral Immune Response , in Immunobiology , 9ª ed., Garland Science, 2016, ISBN 978-0-8153-4505-3 .
- ( EN ) CR Wira, Crane-Godreau M e Grant K, Endocrine regulation of the mucosal immune system in the female reproductive tract , in Mucosal Immunology , San Francisco, Elsevier, 2004, ISBN 0-12-491543-4 .
- ( EN ) Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts e Peter Walters, Molecular Biology of the Cell , Fourth, New York and London, Garland Science, 2002, ISBN 978-0-8153-3218-3 .
Voci correlate
- Malattie del sistema immunitario
- Antigene
- Anticorpo
- Infezione
- Immunosenescenza
- Teoria della selezione clonale
- HLA-B
- Sistema immunitario artificiale
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file sul sistema immunitario
Wikimedia Commons contiene immagini o altri file sul sistema immunitario
Collegamenti esterni
- Sistema immunitario , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- ( EN ) Sistema immunitario , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Sistema immunitario , in Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 5131 · LCCN ( EN ) sh86006453 · GND ( DE ) 4026643-6 · BNF ( FR ) cb12098530j (data) |
|---|