Malarie
| Malarie | |
|---|---|
| Forme inelare de Plasmodium falciparum și gametocite în sângele uman. | |
| Specialitate | boală infecțioasă |
| Etiologie | Plasmodium falciparum , Plasmodium vivax , Plasmodium malariae , Plasmodium ovale , Plasmodium și Plasmodium knowlesi |
| Clasificare și resurse externe (EN) | |
| OMIM | 248310 |
| Plasă | D008288 |
| MedlinePlus | 000621 |
| eMedicină | 221134 și 784065 |
| Sinonime | |
| paludism | |
| Eponime | |
| doctrină miasmatic-umorală zona umedă | |
Malaria ( de asemenea , numit malarie) este un parazit boală cauzată de parazitare protozoare din genul Plasmodium (United Protiste , încrengătura Apicomplexa , clasa Sporozoea , Ordinul Eucoccidiida ). Dintre diferitele specii de paraziți Plasmodium , patru sunt cele mai răspândite, dar cel mai periculos este Plasmodium falciparum , cu cea mai mare rată a mortalității în rândul subiecților infestați. Rezervorul de paraziți este format din indivizi infectați cronic. Vectorii sunt țânțari din genul Anopheles .
Malaria este cel mai răspândit dintre toți paraziții, cu tabloul său clinic al bolii febrile acute care se manifestă cu semne de severitate variabilă în funcție de specia infectantă. [1] Răspândirea sa actuală nu se limitează la zonele tropicale din America de Sud , Africa și Asia , ci afectează sporadic SUA și alte țări industrializate, unde pot apărea cazuri clinice ale bolii în urma deplasărilor persoanelor care contractă boala în zone unde este endemic. [2] [3]
Se crede că malaria a fost una dintre cauzele afirmării talasemiei minore (și a consecințelor majore ), deoarece, în Evul Mediu, malaria a fost răspândită în Europa și, ca răspuns la aceasta, gena corespunzătoare talasemiei s-a schimbat spontan, făcând mai complexă reproducerea agentului patogen în corpul uman. [4]
Etimologia numelui
Etimologia „malariei” derivă dintr-un termen medieval italian „mal aria” sau aer rău [5] în timp ce termenul „paludismo” derivă din credința că boala a fost cauzată de miasma din zonele mlăștinoase . Acest termen a fost folosit și în secolul al XVIII-lea în afara Italiei pentru a descrie o febră care a apărut doar vara și a fost adesea fatală. [6]
Istorie
Malaria, conform studiilor care au verificat prezența bolii și la cimpanzei , [7] infectează omenirea de peste 50.000 de ani. [8] Primele mărturii verificate se găsesc în 2700 î.Hr. în China, [9] în timp ce prima descriere a tabloului clinic al malariei datează de la Hipocrate care în Epidemii și Aforisme descrie febra intermitentă tipică. [10]
Dezvoltarea malariei s-a mutat ulterior în Italia, unde răspândirea sa a fost împiedicată de capacitatea romanilor de a se ocupa de câmpurile agricole și de lucrările de refacere a acestora. [6] Primele dovezi istorico-arheologice ale sosirii în Europa a Plasmodium falciparum , identificate în urma săpăturilor necropolei copiilor , datează din secolul al V-lea d.Hr. , aproximativ coincizând cu data convențională acăderii Imperiului Roman de Vest. din Lugnano în Teverina , lângă o vilă romană din mijlocul văii Tibru . Când Imperiul Roman și-a pierdut splendoarea antică, focarele și-au făcut din nou apariția, circumstanță care a implicat o lungă lucrare de recuperare până în Evul Mediu . [6] Conform unui studiu din 2016 [11], există și dovezi anterioare. Cercetătorii (Canada, Italia și Australia) au analizat 58 de dinți de indivizi adulți din trei cimitire (Isola Sacra - Portus Romae, secolul I-III, secolul Velia I-II și secolul Vagnari I-IV [12] . s-a constatat prezența Plasmodium spp. [13] în timp ce în două s-a constatat prezența Plasmodium falciparum .
Primul medic care a simțit implicarea țânțarilor în răspândirea bolii a fost Giovanni Maria Lancisi . La sfârșitul secolului al XIX-lea, în Italia au existat 15.000 de decese pe an de malarie, cu febră de vară-toamnă, în special în sud și în insule. Malaria din Italia a fost eradicată în jurul anilor 1950 , cu campanii de eradicare finanțate de Fundația Rockefeller . În 1880, Alphonse Laveran [14] , la Constantin în Algeria , a observat pentru prima dată parazitul în celulele sanguine periferice umane ale persoanelor care suferă de această boală. El a propus ca boala să fie cauzată de acel protozoar , o intuiție care i-a adus premiul Nobel pentru medicină în 1907 . Ettore Marchiafava și Angelo Celli [15] , un an mai târziu la Roma , au studiat protozoarul și l-au numit Plasmodium .
În 1885 , la Pavia , Camillo Golgi , distins cu Premiul Nobel în 1906 , a demonstrat asocierea dintre periodicitatea febrei malarice și ciclul plasmodium. El a reușit să demonstreze cum cele două tipuri diferite de febră malarică, terțianul și quartanul, au fost cauzate de două specii distincte de plasmodiu: Plasmodium vivax , responsabil pentru terțianul benign, și Plasmodium malariae , responsabil pentru quartan. În 1889 a arătat că atacurile febrile au avut loc atunci când sporozoizii (etapa ciclului plasmodium) au rupt globulele roșii și au fost eliberate în fluxul sanguin . Ettore Marchiafava , Angelo Celli , Amico Bignami și Giuseppe Bastianelli , la Roma , au demonstrat existența Plasmodium falciparum , responsabil pentru terțianul malign. În 1894, Patrick Manson , în China , a fost primul care a emis ipoteza că Plasmodium a fost transmis oamenilor de către un țânțar . Această teză a fost dovedită în 1897 de Ronald Ross ( Nobel 1902 ), în India . [16]
În 1898 Giovanni Battista Grassi [17] , la Roma , a identificat vectorul malariei, Anopheles , și a obținut prima transmisie experimentală. În 1899 a descris ciclul complet al diferitelor specii de Plasmodium . În 1905 , Carlos Chagas , care observase și studiase mai întâi transmisia intradomicilară a plasmodiumului, organizat la vârsta de 26 de ani, și desfășurat în Itatinga , în interiorul statului São Paulo ( Brazilia ), prima campanie eficientă de combatere a malariei. profilaxia în istorie. „Stația experimentală pentru lupta antimalarică” a fost construită la Roma în 1925 , în regia italianului Alberto Missiroli și a americanului Lewis Hackett .
Tot în 1925, în contextul Primului Congres Internațional al Malariei desfășurat la Roma, a apărut necesitatea unui institut internațional de malariologie, așa cum sugerează Liga Națiunilor ; guvernul italian nu a acceptat sugestia, dar a transformat propunerea prin înființarea în 1927 a unui nou organism de cercetare împotriva malariei; Școala de Malariologie din Roma, înființată și dirijată de clinician prof. Vittorio Ascoli, care de ani de zile studia și publicase literatură medicală despre malarie. La moartea sa în 1931 , Școala a fost apoi regizată de Giuseppe Bastianelli . În 1933 , Școala a devenit Institutul de Malariologie, având ca scop formarea medicilor malarieni.
Studii recente au arătat că paraziții pot provoca recidive ale bolii. [18] [19]
Epidemiologie
Malaria este cea mai importantă parazitoză și a doua boală infecțioasă din lume pentru morbiditate și mortalitate după tuberculoză , cu peste 200 de milioane de cazuri clinice noi pe an și 438.000 de decese pe an (date din 2015) [20] . 40% din populația lumii trăiește în zone în care malaria este endemică, situate în zone tropicale și subtropicale și la o altitudine sub 1 800 m slm . [21] Aproximativ 10.000 până la 30.000 de călători europeni și americani se îmbolnăvesc de malarie în fiecare an. Femeile aflate în sarcină sunt deosebit de susceptibile la această boală și, în ciuda eforturilor de reducere a transmiterii prin creșterea tratamentului, efectul obținut nu corespunde cu cel intenționat. [22] Frecvența sa se datorează unei serii de factori, inclusiv condițiile climatice favorabile bolii și numărul de subiecți care poartă gametocite în sângele periferic uman în zona de contagiune, chiar dacă un studiu exact este foarte complex dat fiind amploarea a zonelor implicate. [23]
În 1882, numai în două provincii italiene - Imperia și Macerata - nu au existat infecții. Harta zonelor de malarie publicată în același an - prin voința senatorului Luigi Torelli - a arătat că zonele în care boala era prezentă reprezentau o treime din suprafața totală a țării, în timp ce 3.075 din 8.362 de municipalități erau în mod regulat afectat [24] .
În 1887, decesele cauzate de boală au fost de 21.033, dintre care 18.730 în regiunile sudice și numai în Lazio [25] .
De vreme ce malaria a fost eradicată în Italia astăzi, există doar cazuri autohtone sporadice. Majoritatea episoadelor care apar sunt de import: afectează turiștii , călătorii sau imigranții din zone endemice. [26] În ceea ce privește cazurile înregistrate intern în țară, în 1970 Organizația Mondială a Sănătății (OMS) a declarat Italia ca zonă liberă de pericolul focarelor de malarie. Cu toate acestea, evenimentele erau deja foarte limitate. Un focar autohton de malarie P. vivax a fost raportat în Sicilia în 1962 , [27] la aproape 40 de ani de la ultimul focar înregistrat. Până acum, în Italia, cazurile autohtone unice apar doar sporadic, în special în regiunile central-sudice și insulare. [28] Ultima deces din cauza malariei din Italia a fost înregistrată la Brescia în 2017 [29] .
Deoarece simptomele malariei sunt nespecifice, iar diagnosticul și tratamentul trebuie să fie prompte, malaria trebuie suspectată la toți pacienții cu semne febrile care se întorc de la tropice .

Risc foarte limitat
Risc de malarie P. vivax sau P. falciparum sensibil la clorochină
Risc de malarie cu prezența posibilă a tulpinilor de clorochină rezistente
Risc ridicat de malarie P. falciparum chimio-rezistent sau risc moderat / scăzut de malarie P. falciparum cu prevalență ridicată a tulpinilor chimio-rezistente.
Au fost stabiliți indici de prevalență pentru a evalua zonele cu cea mai mare prevalență a malariei; sunt nenumărate, dar cele mai importante sunt: [30]
- Indicele splenic: numărul de copii care prezintă anumite simptome
- Indicele parazit: raportul dintre cantitatea de specii ale parazitului unic comparativ cu numărul total de cazuri de malarie
- Densitatea parazitară: numărul mediu al prezenței în sânge a protozoarelor infectate
- Indicele sporozoitic: numărul de țânțari prezenți care sunt potențial periculoși pentru oameni
- Rata de inoculare entomologică: legată de indicele sporozoitic, măsoară și cantitatea de înțepături pe care oamenii le suferă în mod normal
- Indicele de sânge uman (HBI): măsoară câte țânțari dintr-o anumită regiune au sânge uman (este un indice studiat, de asemenea, pentru a înțelege efectele anumitor alimente sau minerale [31] )
Etiologie
Majoritatea infecțiilor malariale se datorează a patru specii de Plasmodium : P. falciparum [32] , P. vivax [33] , P. ovale [34] și P. malariae . [35] Diagnosticul speciilor este important deoarece malaria P. falciparum este potențial fatală.
Inițial, s-a crezut că numai aceste patru specii de protozoare ar putea afecta oamenii și pot transporta infecția , dar recent au fost studiate și alte specii, de asemenea cauzatoare de malarie, precum Plasmodium simiovale și Plasmodium knowlesi , care sunt greu de diagnosticat, a căror epidemiologie. este limitat la Asia de Sud [36] și în special la Malaezia . [37] Vectorii infecției sunt Anopheles latens și Anopheles hackeri . [38]
Există și alte forme derivate din prima care apar la animale precum Plasmodium brasilianum , multe maimuțe din America de Sud sunt infectate cu acest parazit care pare a fi un derivat al formei malariae . S-a adaptat pentru a se dezvolta la maimuțe, probabil după descoperirea continentului. [39]
Distribuție geografică
- Distribuția speciilor [40]
- Malaria nu este foarte prezentă în nordul Africii și predomină P. vivax .
- P. falciparum predomină în Africa Centrală și de Est , dar sunt prezente și P. vivax și P. malariae .
- În Africa de Vest predomină P. falciparum , dar P. ovale este de asemenea răspândit; P. vivax este de asemenea prezent, dar rar.
- În insulele Oceanului Indian și în Asia de Sud-Est predomină P. falciparum , dar sunt prezente și P. vivax și P. malariae .
- În subcontinentul indian predomină P. vivax , dar este prezent și P. falciparum .
- În insulele Oceanului Pacific și în America Centrală există atât P. vivax, cât și P. falciparum , mult mai răspândite în Amazon .
- După caracteristicile teritoriului
„Modelul” geografic influențează caracteristicile epidemiologice:
- În zonele savanei africane transmisia este perenă, cu variații sezoniere, mai sensibilă pe măsură ce se îndepărtează de ecuator ; P. falciparum domină, iar morbiditatea și mortalitatea sunt predominante la copii și femei însărcinate ; rezistența la medicamente este larg răspândită.
- În câmpiile și văile din America Centrală, China și India, transmisia este variabilă și moderată, cu variații sezoniere puternice și risc de epidemii. P. vivax predomină și rezistența la medicamente este destul de stabilă.
- Pe zonele muntoase , în zonele și insulele semi-deșertice ( Sahel , Asia de Sud-Est, Africa de Sud , Insulele Pacificului, Caraibe ), riscul de epidemii se datorează aberațiilor climatice, fenomenelor migratoare din zonele de malarie extrem de endemice și modificărilor obiceiurilor agricole.
- În zonele de dezvoltare agricolă recentă ( Africa , Asia , America de Sud ) irigarea în agricultură poate crește transmiterea plasmodiumului, cu riscul consecvent al malariei sezoniere cu epidemii în rândul lucrătorilor imigranți neimuni.
- În zonele urbane și periurbane ale orașelor africane, transmisia și populația imună sunt foarte variabile chiar și la distanțe mici.
Patogenie
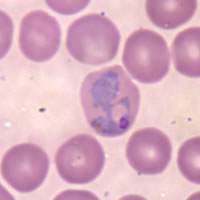
În majoritatea cazurilor, se menține un echilibru între infecție și răspunsul imun . În infecțiile cu P. falciparum echilibrul este precar: boala poate precipita în orice moment și parazitemia crește necontrolat, provocând o disfuncție multiorganică (MOF, „insuficiență multi-organică”) sau o hemoliză intravasculară progresivă subacută. În ambele cazuri, poate apărea moartea. Mortalitatea la un pacient neimun și netratat poate fi de până la 20%.
Formele malariei P. falciparum sunt mai grave, deoarece plasmodiumul infectează toate eritrocitele și provoacă parazitemii mai mari, spre deosebire de P. vivax și P. ovale care infectează reticulocitele (eritrocitele tinere) și P. malariae care îi infectează pe cei vechi.
În malaria cerebrală , eritrocitele parazitate sunt sechestrate în microcirculația cerebrală, devin mai rigide și nedeformabile, aderă la eritrocite sănătoase, formând clustere în formă de rozetă și la endotelele capilarelor și venulelor cerebrale și se împachetează, obstrucționându-le lumen. Citoaderența este determinată de proteinele care sunt exprimate pe membrana eritrocitelor parazite formând tuberculi care pot fi observați doar la microscopul electronic. În consecință, apar congestii cerebrale și, în stadii avansate, hemoragii intraparenchimale. Alterarea permeabilității vaselor cerebrale este cauzată de producția endogenă de substanțe vasoactive ( NO , TNF , IFNγ ).
Anemia este de tip hemolitic, normocrom și normocitic. Scăderile dramatice ale hemoglobinemiei pot apărea în timpul atacurilor acute datorate hemolizei din ruperea globulelor roșii de către schizonti. Eritrocitele parazite aderă la cele sănătoase, iar grupurile sunt fagocitate și distruse împreună. Anemia nu este neapărat proporțională cu parazitemia. În cele din urmă, eritrocitele transfuzate sunt distruse mai rapid. Diseritropoieza (distrugerea eritrocitelor înainte de eliberarea lor din măduva osoasă ) și sechestrarea fierului , deoarece TNF stimulează fagocitoza și deprimă eritropoieza . [41]
Modul de transmitere și ciclul de viață al Plasmodium
Forma infectantă a plasmodiumului este sporozoitul care este prezent în interiorul glandelor salivare ale țânțarilor femele aparținând genului Anopheles din care sunt inoculați în gazdă în timpul mesei de sânge.
Anopheles labranchiae , A. superpictus , A. maculipennis , A. atroparvus au fost țânțarii vectori în Europa înainte de eradicare. În prezent, speciile implicate în transmisie sunt: Anopheles gambiae și A. funestus în Africa ecuatorială; Anopheles culicifacies , A. minimus și A. maculatus în Asia; Anopheles darlingi și A. acquasalis în America de Sud. Numărul de sporozoizi eliberați de țânțar este destul de variabil, dar se crede că poate ajunge la maximum 100 pentru Plasmodium falciparum .
După o scurtă ședere în fluxul sanguin, sporozoizii invadează hepatocitele ( celulele hepatice ) în 45 de minute de la masa de sânge, pentru care au un tropism ridicat.
În acest moment, prima fază a multiplicării asexuale începe în interiorul hepatocitului (faza exoeritrocitară sau externă a celulelor roșii din sânge ) numită și schizogonică. Această fază are o durată variabilă în funcție de specie, deoarece variază de la 5-7 zile pentru P. falciparum la aproximativ 15 pentru P. malariae și determină formarea unui schizont, care se descompune și care, după liza hepatocitului, se revarsă în circulație mii de merozoiți mononucleari, care infectează eritrocitele (de cele mai multe ori câte un merozoit pe celulă sanguină, dar în unele infecții cu P. falciparum poate ajunge până la 4).
În cadrul globulelor roșii (faza intra eritrocitară) începe un nou ciclu de reproducere asexuată [42] [43] [44] [45] . De fapt, merozoitul se transformă în trofozoit (formă vegetativă) care se distinge morfologic în imatur (cu formă de inel) și matur (cu citoplasmă mai mărită și acumularea de hemozoină ). Ulterior trofozoitul se transformă într-un schizont de dimensiuni mai mici decât cele intrahepatocitice și care conține în general până la maximum 24 de merozoiți. Merozoiții, după ruperea schizontului, determină liza membranei celulelor roșii infectate și se toarnă în circulație gata să infecteze noi specii și să înceapă un nou ciclu reproductiv. Acest ciclu este regulat și, în special, durează 48 de ore pentru P. falciparum , P. vivax și P. ovale și 72 de ore pentru P. malariae .
În timpul ruperii celulelor roșii din sânge, sunt eliberate substanțe pirogene (vezi secțiunea privind patogeneza) care determină apariția vârfurilor clasice de febră dacă infecțiile cu eritrocite au devenit sincrone.
În infecțiile cu P. vivax și P. ovale, unii dintre sporozoizi pot persista latenți în celulele hepatice (hipnozoite, forme „latente”) și pot rămâne în această stare luni sau ani și apoi pot fi reactivați ciclic, provocând recăderi. Un fenomen similar poate apărea și în cazul P. falciparum și P. malariae numai că în astfel de cazuri cauza constă în persistența, în fluxul sanguin, a unei parazitemii prea scăzută pentru a fi detectată.
După mai multe cicluri, unii trofozoizi se diferențiază în forme eritrocitare sexate (gametocite). Acestea sunt formele care permit menținerea ciclului plasmodium în mediu: omul este rezervorul de gametocite din care pescuiesc țânțarii și rămâne așa timp de aproximativ un an după contagiune. Microgametocitul (masculin) și macrogametocitul (femela) sunt ingerate de anofeli la mușcătura unui individ infectat, în timpul unei noi mese de sânge. Ciclul sexual al țânțarului se numește sporogonic.
În stomacul insectei, gametocitele părăsesc celula roșie din sânge care le găzduiește: nucleul microgametocitului suferă diverse diviziuni mitotice și formează opt microgamete masculine, flagelate . Macrogametocitele, pe de altă parte, nu suferă procese de divizare și, în orice caz, populația lor este mai mare decât cea a microgametocitelor.
Un microgametocit flagelat pătrunde în macrogametocit și ulterior, după o fază de meioză , se formează zigotul care apoi devine mai lung și mai mobil (oocinete), invadează peretele intestinului mijlociu al țânțarului, unde incizează devenind oocist.
Aceasta suferă o reproducere asexuată care determină formarea a mii de sporozoizi atunci când oochistul este acum matur. Ulterior, oocistul se descompune și eliberează sporozoii care ajung la glandele salivare ale țânțarului și sunt inoculați la om la următoarea puncție cu repetarea întregului ciclu.
Faza de dezvoltare în interiorul țânțarului durează de la 8 zile la o lună, în funcție de diferiți factori, inclusiv speciile de plasmodiu infectante și, de asemenea, factorii climatici.
Alte modalități de transmitere
Pe lângă modul clasic de transmitere, există și alte posibilități de a contracta această boală:
- Administrarea de sânge infectat: tipic este cazul transfuziilor de sânge, pentru accidente sau boli, dar și pentru schimbul de seringi infectate obișnuite pentru dependenții de droguri; această metodologie de difuzare apare adesea în țările africane unde malaria și SIDA sunt ambele manifestate la individ [ neclar ] [46] În ultima vreme se studiază o metodă pentru a preveni această răspândire. [47]
- Transmiterea transplacentară: mama transmite plasmodium copilului în timpul sarcinii
- Așa-numita „malarie aeroportuară”: țânțarii infectați care provin din țări cu epidemie pot infecta persoane care provin din alte țări care nu sunt supuse în mod normal epidemiei (primul caz a avut loc în 1977 [48] [49] și de atunci au înregistrat aproape o sută de cazuri în Numai Europa [50] )
Complicații
- Forme severe
Formele severe sunt toate cauzate de P. falciparum . Mortalitatea prin malarie severă este mai mare la copiii cu vârsta cuprinsă între 6 luni și 3 ani în zonele endemice. Călătorii neimuni au o mortalitate ridicată, indiferent de vârstă.
Semnele prognostice nefavorabile sunt starea comatoasă ne-trezită, anemie normocitară severă (hematocrit <15%, hemoglobinemie <5g / dL), insuficiență renală (creatininemie> 3 mg / dL, diureză 24 h <400 cc la adulți sau <12 cc / kg la copii), edem pulmonar, hipoglicemie (<40 mg / dl), colaps cardiovascular, șoc, coagulopatie de consum, sângerări spontane, convulsii generalizate repetate (> 2/24 h, în ciuda răcirii cu comprese umede), acidoză, hemoglobinurie, hiperparazitemie ( > 5% RBC infectat,> 250.000 paraziți / cc), icter mucocutanat (bilirubinemie totală> 3 mg / dL), leucocitoză (nu neapărat din cauza complicațiilor bacteriene).
- Splenomegalie hiperreactivă a malariei (HMS)
Cunoscut anterior ca „ Sindromul Splenomegalic Tropical ”, este o afecțiune patologică rezultată dintr-un răspuns imunologic aberant la atacurile repetate de malarie și este răspândită în Sudan. [51] HMS prezintă splenomegalie severă la copii sau adulți, niveluri ridicate de anticorpi anti-plasmodium, niveluri serice ridicate de IgM , de tip policlonal și răspuns clinic și imunologic la terapia antimalarică adecvată pe termen lung. Hipersplenismul este responsabil pentru anemia hemolitică cronică, leucopenia și trombocitopenia . Există pierderea în greutate, astenie, tahicardie , dispnee după efort, un sentiment de greutate și durere în hipocondrul stâng. De obicei, examinarea directă a picăturii groase de sânge periferic nu relevă prezența plasmodiei, iar testele biohumorale indică o stare inflamatorie marcată (creștereaESR și a proteinelor plasmatice în fază acută).
- Malaria cerebrală
Malaria cerebrală este o encefalopatie acută difuză. Pacientul este comatos (variind ca severitate și durând de la 6 la 96 de ore); parazitemia este de obicei mare și pot apărea convulsii. Hemoragiile retiniene sunt asociate cu un prognostic mai prost. Pot apărea tulburări temporare (strabism divergent, reflexe patologice, ușoară rigoare nucală). Cel mai frecvent tablou neurologic la adulți este cel al unei leziuni simetrice a neuronului motor superior. Poate apărea rigiditate din decerebrare (brațele și picioarele întinse), decorticarea (brațele flectate și picioarele întinse), opisthotonus . Presiunea LCR este de obicei normală la rahicenteza. Lichidul cefalorahidian este limpede (<10 celule / µL), protorehia și acidul lactic pot fi crescute. Scanarea electronică a creierului prezintă constatări anormale, dar nespecifice. Constatarea CT este complet normală. Reflexele cutanate abdominale sunt întotdeauna absente. Poate exista o hepatosplenomegalie modestă.
La copii debutul este cu febră (37,5 - 41 ° C), anorexie , vărsături, tuse, rareori diaree. Simptomele preced de obicei coma cu 1 sau 2 zile (dacă coma durează mai mult de o jumătate de oră după o criză febrilă, ar trebui suspectată malaria cerebrală). Respirația profundă poate fi un semn al acidozei metabolice. Opisthotonus poate fi proeminent și imită tetanosul sau meningita . Presiunea LCR poate crește mult spre deosebire de adulți. 10% dintre copiii care supraviețuiesc malariei cerebrale au sechele neurologice persistente (hemipareză, ataxie cerebeloasă, orbire corticală, hipotonie severă, retard mental, afazie, spasticitate generalizată).
- Anemie
Foarte frecvent în cazul malariei severe, în special la copiii africani și femeile însărcinate, în care este adesea semnul prezentator. Parazitemia este adesea scăzută, dar există un pigment malaric abundent în monocite - macrofage . Anemia este adesea asociată cu suprainfecții bacteriene. În deficiențele congenitale de glucoză-6-fosfat dehidrogenază și alte defecte enzimatice (deficit de piruvat kinază), unele medicamente antimalarice, cu efect oxidant (de exemplu, primachină), pot provoca hemoliză intravasculară și anemie semnificativă, chiar și în absența malariei. Si riscontrano esempi di ittero , febbricola o apiressia, con minima o nulla parassitemia (a differenza dell'emolisi massiva, che è abbastanza rara, in corso di iperparassitemia). È probabilmente scatenata dalla terapia con chinino e sono stati segnalati recentemente casi associati a meflochina e alofantrina. Tuttavia il test di Coombs diretto è negativo, a differenza delle comuni emolisi indotte dai farmaci.
- Iperparassitemia
Nei soggetti non immuni, parassitemie >5% con schizontemia periferica sono segno prognostico sfavorevole. Nelle aree altamente endemiche, i bimbi semi-immuni possono sopportare parassitemie anche >20%, senza segni clinici evidenti.
- Insufficienza renale
Complicanza quasi esclusiva dell'adulto. Aumentano la creatininemia , l' azotemia . Compaiono oliguria o anuria per necrosi tubulare acuta: si verifica un danno al microcircolo renale per un meccanismo simile a quello del danno cerebrale (ischemia corticale e congestione midollare). A volte può esserci poliuria. L'insufficienza renale è reversibile.
- Ipoglicemia
L' ipoglicemia si verifica principalmente in tre gruppi di pazienti: nei bambini, nelle donne gravide, in pazienti trattati con chinino o chinidina (iperinsulinemia iatrogena). Nei pazienti coscienti si presenta classicamente con ansietà e disturbi del sensorio, sudorazione e senso di freddo, midriasi, dispnea, tachicardia, oliguria. Può precipitare rapidamente in coma ipoglicemico e convulsioni generalizzate e spesso può sfuggire perché nascosta o confusa dai segni della malaria cerebrale.
- Alterazioni idro-elettrolitiche e dell'equilibrio acido-base
L'ipovolemia da disidratazione si manifesta con bassa pressione venosa giugulare, ipotensione posturale , oliguria con urine concentrate e ridotto turgore cutaneo. La cosiddetta “malaria algida” consiste in un collasso cardiocircolatorio, con ipotensione sistolica (<80 mmHg), cute fredda e cianotica, vasocostrizione periferica, polso flebile e rapido. Spesso è dovuta a una complicanza settica (setticemia da batteri Gram negativi).
- Acidosi lattica
L' acidosi lattica , ovvero l'accumulazione di acido lattico nel corpo, è una complicanza pericolosa per la prognosi della persona. Si manifesta per via della glicosi anaerobia nei tessuti infetti. si rende evidente con comparsa di respiro profondo ( di Kussmaul ) e iperventilazione. Si verifica nei pazienti con shock, ipoglicemia, iperparassitemia, insufficienza renale.
- Edema polmonare
È una complicanza grave (mortalità >50%) e tipica della malaria da P. falciparum (3-10%). Ricorda la sindrome da “distress” respiratorio acuto dell'adulto ( Adult Respiratory Distress Syndrome , ARDS ). Ha un'insorgenza relativamente tardiva e improvvisa durante la malaria da P. falciparum, anche alcuni giorni dopo che si sia instaurata un'adeguata terapia antiparassitaria, quando le condizioni cliniche migliorano e la parassitemia periferica sta diminuendo. Tuttavia spesso è associata alle altre forme di malaria severa. Si manifesta con tachipnea e dispnea . Può precipitare rapidamente con deterioramento del sensorio, convulsioni e morte in poche ore. Sono stati proposti diversi meccanismi patogenetici: l'aumento della permeabilità capillare da microemboli in corso di CID, lo scompenso dei capillari alveolari, lo scompenso del microcircolo polmonare, per aumento delle resistenze vascolari, conseguenza di fenomeni immunomediati, il sovraccarico iatrogeno di fluidi, l'ipoalbuminemia. Gli alveoli polmonari vengono inondati da liquido trasudatizio rendendo impossibili gli scambi gassosi. La radiografia del torace [52] nei casi più gravi, mostra diffusi bilaterali infiltrati alveolari e interstiziali, periferici e confluenti.
- Coagulopatia da consumo
È detta coagulazione intravascolare disseminata (CID), in senso improprio, perché si hanno manifestazioni trombotiche alternate a manifestazioni emorragiche, sanguinamenti spontanei: gengivorragie, epistassi, petecchie , emorragie sottocongiuntivali, ematemesi , melena (<10% dei casi, soprattutto nei non immuni). [53] La trombocitopenia può essere presente (sequestro splenico, consumo), ma non è la causa dei sanguinamenti (la conta piastrinica torna normale con il trattamento della malaria), i quali invece sono provocati dal consumo dei fattori della coagulazione attivati in modo incontrollato.
- Ipertermia
Il notevole aumento della temperatura corporea , molto comune nei bimbi, è associato a convulsioni, delirio, coma. Entra in diagnosi differenziale con il colpo di calore. Temperature corporee >42 °C possono dare danni neurologici permanenti.
Clinica
Segni e sintomi
Il decorso classico dei sintomi nella malaria è un ciclo che prevede oscillazioni termiche e quindi brividi improvvisi (per una-due ore), che avvengono quando la temperatura corporea sale, cui fanno seguito irrigidimento e febbre; anche se la persona non avverte la sensazione di calore, ma anzi prova benessere, la febbre può superare i 40 gradi (due-sette ore). L'ultima fase è una sudorazione eccessiva (due-tre ore), quando la temperatura scende. Il ciclo, che non osserva quasi mai intervalli regolari, dura dalle quattro alle sei ore e si ripete ogni due giorni nella P. vivax e P. ovale , mentre ogni tre per P. malariae . [54]
La P. falciparum può mostrarsi con febbre ricorrente ed alta ogni 36-48 ore o una febbre meno pronunciata e quasi continua. Per ragioni ancora sconosciute, ma che possono essere collegate con l'alta pressione intracranica , bambini affetti da malaria mostrano una postura anormale, un segno che indica danni molto gravi al cervello. [55] La malaria severa può progredire in modo estremamente veloce e causare la morte in poche ore o in qualche giorno, ed è causata da P. falciparum da 6 a 14 giorni dopo l'infezione. [56]
- Febbre , sintomo principale della malattia è dovuta alla libera circolazione del pigmento malarico (emozoina) nel sangue. Se nessuna terapia viene adottata e non si sviluppa in forme gravi, la malaria dapprima sembra guarire spontaneamente e poi sviluppa di nuovo episodi di febbre che rimangono intermittenti nella forma P. falciparum e si protraggono per 3-4 mesi.
- Epatosplenomegalia , una conseguenza dell'esasperazione del lavoro del sistema macrofagico di eritrocateresi , che è stato riscontrato con degli studi specifici nel 25% dei casi. [57]
- Epatomegalia l'aumento del volume del fegato , presente in quasi la totalità delle persone coinvolte. [57]
- Tachicardia e delirio , spesso compaiono in concomitanza con eventi febbrili acuti e ne sono, soprattutto nel caso del delirio, conseguenza specifica.
Organi coinvolti
- Milza , in alcune forme si presenta tumefatta e iperemica, diventando ospite di molti parassiti può apparire talmente sensibile che si riscontrano casi di rottura della stessa.
- Reni , durante la manifestazione della malaria per colpa della deposizione di immunocomplessi, si può assistere ad una loro insufficienza. Attraverso una terapia adeguata si può ristabilire la loro funzionalità. L'indebolimento renale può causare la febbre emoglobinurica , dove si presenta una grave emolisi e l'emoglobina fuoriesce nell'urina colorandola di nero, [58] episodio con cui viene diagnosticato, anche se i casi studiati sono molto pochi. [59] Questa manifestazione si riscontra soprattutto in casi di assunzione esagerata di chinino per profilassi o terapia, ma la sua patogenesi ancora non è chiara. [60]
Stadi della malattia
- Incubazione
Il tempo che va dall' infezione con la puntura di zanzara e la comparsa dei trofozoiti negli eritrociti circolanti è detto "tempo prepatente", che è fisso e costante per ogni specie:
- P. falciparum 9-10 giorni
- P. vivax 11-13 giorni
- P. ovale 10-14 giorni
- P. malariae 15-16 giorni [61]
Il tempo che va dall'infezione con la puntura di zanzara alla comparsa dei segni e dei sintomi della malaria è detto "tempo d'incubazione". Questo è variabile e più lungo o al massimo uguale al periodo prepatente e dipende dalla carica infettante iniziale di sporozoiti iniettati dalla zanzara:
- P. falciparum 9-14 giorni
- P. vivax 12-17 giorni (raramente il periodo è ancora più lungo)
- P. ovale 16-18 giorni
- P. malariae 18-40 giorni (raramente il periodo è ancora più lungo) [61]
L'infezione da P. falciparum è detta "febbre terzana maligna", quella da P. vivax e da P. ovale è detta "febbre terzana benigna" e quella da P. malariae è detta "febbre quartana" in base alla frequenza di febbre intermittente. Quelle di febbre "terzana" e "quartana" sono definizioni fuorvianti, perché solo una minima parte dei casi di malaria si presenta con febbre intermittente, ogni 48 ore (terzana, ogni terzo giorno) od ogni 72 ore (quartana, ogni quarto giorno). La febbre terzana si vedeva in Europa nelle zone endemiche per il P. vivax (terzana benigna) e negli immigrati: le navi infatti facevano viaggi di 1-2 settimane, e quando arrivavano in Europa, seguendo la storia naturale dell'infezione da P. falciparum , da intermittente irregolare la febbre si faceva terzana, se il malato non era morto nel frattempo o se non era stato trattato. La febbre terzana si vede anche nei casi in cui si sia stati infettati da un unico ceppo di P. falciparum , evento non comune nelle aree endemiche, dove si è infettati più volte in sequenza ei cicli dei vari ceppi si sovrappongono con attacchi febbrili ad andamento irregolare.
- Fase invasiva
Corrisponde alla rottura dello schizonte e alla liberazione dei merozoiti che vanno a invadere altri eritrociti . Si manifesta con febbre intermittente, brivido scuotente, sudorazione, cefalea , artralgia , mialgia , talvolta riattivazioni di herpes labiale , prostrazione, dolore negli ipocondri, sindromi gastroenteriche ( diarrea , vomito , dolore addominale). Nei bimbi si possono avere convulsioni febbrili.
- Fase tardiva
Quando i cicli vitali dei vari ceppi presenti si sono sincronizzati, compare la febbre terzana (tipico attacco malarico): brivido scuotente seguito da rialzo termico che si risolve dopo qualche ora con sudorazione profusa e uno stato di vaga euforia, e si ripete ogni 48 ore. La splenomegalia di solito compare dopo giorni o settimane; all'inizio è più comune l' epatomegalia . Pallore muco-cutaneo, ittero , urine ipercromiche (fortemente colorate) sono segni prognostici sfavorevoli. Nella maggioranza dei casi non trattati la malaria si risolve spontaneamente dopo 2 settimane; raramente dura più di un anno (mai più di 2 anni).
- Recrudescenza
È la ricaduta causata dalla persistenza in circolo di forme intra-eritrocitarie (nei globuli rossi). È tipica delle infezioni da P.falciparum trattate in modo inadeguato (per qualità e/o durata del trattamento e per posologia) e può avere una latenza da qualche giorno a qualche settimana. Si può avere anche nelle infezioni da P. malariae con una latenza anche di molti anni.
- Recidiva
Per recidiva si intende una ricaduta causata dalla persistenza di merozoiti nel fegato (ipnozoiti) che ricominciano un nuovo ciclo eso-eritrocitario, 5-6 mesi dopo l'infezione. È tipica delle infezioni da P. vivax e P. ovale nelle quali non sono state trattate le forme intraepatiche (con primachina ).
Differenze tra le specie
La malaria da P. vivax ha un tempo di incubazione più lungo. Si presenta come quella da P. falciparum con attacchi febbrili irregolari, seguiti da sudorazioni profuse e defervescenza. Si può avere splenomegalia (raramente rottura splenica). Dopo qualche attacco si esaurisce, ma può avere ricadute per la persistenza degli ipnozoiti. Allora compare la febbre terzana benigna. Se i ceppi sono due e hanno un ritmo sfasato si può avere una doppia terzana, che è quotidiana. La terapia con clorochina cura l'attacco malarico ma non previene le ricadute. Nelle regioni africane ( Golfo di Guinea ) dove mancano individui portatori dell'antigene eritrocitario Duffy, P. vivax è assente ed è rimpiazzato da P. ovale . Il quadro clinico è sostanzialmente sovrapponibile a quello di P. vivax .
La malaria da P. malariae è la forma meno grave di malaria. Il plasmodio può persistere per anni negli eritrociti, a parassitemia bassissima, e nelle recrudescenze la febbre è quartana. Tuttavia, nei bimbi tra i 4 e gli 8 anni, come conseguenza di infezioni ripetute o continue, si possono avere gravi patologie renali , come glomerulonefriti membrano-proliferative, con proliferazione dell'endotelio glomerulare e del mesangio. Il danno è causato da deposizione di immunocomplessi a livello delle aree mesangiali e subendoteliali del glomerulo renale . Clinicamente, in fase acuta, la malattia si presenta con proteinuria importante, edema generalizzato e versamento ascitico ( sindrome nefrosica ): nella maggior parte dei casi la nefropatia non è reversibile dopo il trattamento dell'infezione malarica. La prognosi è sfavorevole ei pazienti progrediscono verso l' insufficienza renale cronica nel giro di 5 anni dall'esordio.
Malaria in gravidanza
La malaria durante la gravidanza è molto pericolosa, con una mortalità fino a 10 volte più alta che nella popolazione generale, caratterizzata da alta parassitemia, con pericoli per madre e feto (stress fetale, aborto, parto prematuro, basso peso alla nascita). Le gravide sono particolarmente suscettibili all'ipoglicemia e all'edema polmonare. Nelle semi-immuni (soprattutto primigravide) è più comune l'anemia. Complicanze settiche comuni sono le polmoniti e le infezioni urinarie. [62]
Diagnosi
Esami di laboratorio e strumentali
Esami bioumorali
Anemia normocromica e normocitica progressiva, aumento dei reticolociti, bassa aptoglobina , alte bilirubinemia indiretta e LDH. Trombocitopenia (100,000/mm3). Leucocitosi o leucopenia. L'aumento della transaminasemia e bilirubinemia diretta, se importanti, sono segno prognostico sfavorevole di insufficienza epatica. Fibrinogenemia elevata (se bassa è segno sfavorevole per consumo o insufficiente produzione), PCR elevata, γ-globuline elevate, albuminemia ridotta.
Esami microbiologici
La diagnosi microbiologica d'infezione da plasmodi trova tuttora il suo punto di riferimento nell' emoscopia tramite striscio sottile e goccia spessa ed opportuna colorazione (soprattutto tramite colorazione di Giemsa , Wright o Field ) [63] .
Il campione da sottoporre ad indagine emoscopica dovrebbe essere prelevato dai capillari periferici (ad esempio tramite puntura su polpastrello o su lobo auricolare) ove i plasmodi tendono a concentrarsi maggiormente. Il prelievo di sangue venoso periferico raccolto in provette contenenti anticoagulanti (tipo EDTA ed eparina ) potrebbe creare qualche problema in caso di bassa parassitemia, e quindi dare un risultato falsamente negativo, e dovrebbe, comunque, essere sottoposto ad indagine in breve tempo, massimo un'ora, onde evitare alterazioni nella morfologia dei globuli bianchi e dei plasmodi. È da ricordare, inoltre, che l'anticoagulante non permette una defibrinizzazione ottimale durante la preparazione d'una goccia spessa che risulterà così, maggiormente ricca di detriti e di più difficile interpretazione.
Oltre a queste metodiche se ne sono aggiunte successivamente altre le quali, comunque, possono presentare alcuni inconvenienti quali una sensibilità ridotta rispetto all'emoscopia oppure essere al di fuori della portata dei laboratori comuni soprattutto nei paesi a risorse limitate. Tra le metodologie diagnostiche alternative ritroviamo:
- la fluorescenza ,
- il Buffy Coat quantitativo ( Quantitative Buff Coat )
- l' immunocromatografia (test rapidi), reperibili anche in Italia, che servono per rintracciare nel sangue la glicoproteina di tipo 2 (un antigene) o altri di recente studio. [64]
- metodiche immunologiche su siero
- metodiche di biologia molecolare , dove si effettuano studi sul dna del parassita e si somministrano enzimi a carattere restrittivo, anche se praticamente tali pratiche vengono applicate di rado nella diagnostica attuale per via dell'elevatissima tecnologia non sempre presente. [64] La diagnosi molecolare risulta utile per comprendere quali siano le resistenze ai farmaci e utilizzare quelli più appropriati. [65]
Lo striscio sottile
L'emoscopia tramite striscio sottile, è una metodica di facile preparazione ed alla portata di pressoché tutti i laboratori. È un esame indispensabile per la diagnosi di specie in quanto consente l'identificazione morfologica dei parassiti ematici (è da ricordare, inoltre, che tale esame viene utilizzato anche per la diagnosi delle altre emoparassitosi come la tripanosomiasi , la leishmaniosi e la babesiosi ) [66] .
Per preparare uno striscio sottile basta pungere, con un aghetto sterile, un polpastrello od un lobo auricolare, dopo averli sgrassati e disinfettati, e porre una goccia di sangue ad un'estremità d'un vetrino accuratamente pulito e sgrassato.
Si utilizza, poi, un secondo vetrino il cui bordo più piccolo viene messo a contatto della goccia formando un angolo acuto col vetrino precedente in maniera tale che la goccia si disponga lungo tutta la linea del bordo stesso. Successivamente il secondo vetrino viene strisciato sul primo in maniera tale che tutti i globuli rossi si dispongano a formare un singolo strato. A questo punto il vetrino viene asciugato all'aria, fissato in metanolo e colorato in maniera opportuna [67] .
La lettura d'uno striscio sottile richiede una buona dose d'esperienza in quanto bisogna osservare un elevato numero di campi microscopici, muovendosi a serpentina su tutto il vetrino, prima di stilare un referto di negatività e prestare molta attenzione in quanto talvolta i globuli rossi infetti possono assumere una morfologia altamente atipica e confondersi con altri elementi cellulari. Un altro fattore da considerare è la possibilità d'una carica parassitaria bassa per cui bisogna prestare molta attenzione ad individuare gli eventuali pochi globuli rossi infetti od i possibili elementi extraeritrocitari.
La metodica dello striscio sottile permette anche una quantificazione della carica parassitaria il che rappresenta un elemento utile nella valutazione della risposta terapeutica [68] .
Per effettuare la quantificazione si contano i globuli rossi parassitati in 25 campi microscopici (usando l'oculare ad immersione) e lo si rapporta al numero totali di globuli rossi negli stessi campi e si moltiplica il risultato per 100.
%parassitemia = (Numero di globuli rossi parassitati in 25 campi/Numero di globuli rossi in 25 campi) x 100
In caso di presenza di numerosi plasmodi, referenzialmente in aree endemiche, si può effettuare il conteggio su 10 campi.
La goccia spessa
La metodica della goccia spessa permette d'esaminare una quantità di sangue molto maggiore rispetto allo striscio sottile (circa 20 volte) determinando, così, un aumento della sensibilità soprattutto in caso di parassitemia bassa. L'identificazione morfologica, invece, risulta essere molto più difficoltosa in quanto, con la rottura dei globuli rossi che si determina, vari elementi utili per la diagnosi di specie, come ad esempio le granulazioni intraeritrocitarie, vengono persi. È proprio per ovviare a tale problema che nella prassi quotidiana vengono effettuate entrambe le metodiche.
Per preparare una goccia spessa si depongono su un vetrino 2 o 3 gocce di sangue, prelevate con le stesse modalità dello striscio sottile. Con un oggetto appuntito come un aghetto o l'angolo d'un altro vetrino si eseguono movimenti circolari che miscelano le gocce e le spianano su un'area di circa 2 cm di diametro. Tale operazione risulta necessaria al fine d'eliminare i frustoletti di fibrina .
Successivamente il vetrino viene lasciato all'aria per circa 12 ore e dopo di ciò si procede direttamente alla colorazione. Il vetrino non va asciugato al calore né fissato. Ciò è dovuto al fatto che i globuli rossi durante la fase di colorazione si lisano ed un precedente fissaggio impedisce che tale fenomeno si verifichi [69] .
La fase di lettura di una goccia spessa richiede un'elevata accuratezza ed esperienza in quanto i plasmodi possono confondersi con detriti cellulari e piastrine
Anche tramite la goccia spessa è possibile valutare la parassitemia. Ciò viene fatto contando via via il numero di parassiti ed il numero di globuli bianchi presenti (si devono conteggiare almeno 200 globuli bianchi o 500). Il risultato del rapporto di questi due valori viene poi moltiplicato con il valore dei globuli bianchi per microlitro di sangue. Nel caso in cui la formula leucocitaria non sia disponibile si può usare un valore medio di 8 000 globuli bianchi per microlitro.
Parassiti/μl = (Numero parassiti contati/ Numero globuli bianchi contati (200 oppure 500)) x Numero dei globuli bianchi/μl (in mancanza di esso 8 000 globuli bianchi/μl)
È da notare che i valori di parassitemia espressa in percentuale e in numero di parassiti/μl sono intercambiabili conoscendo il numero totale dei globuli rossi oppure utilizzando un valore medio ( ).
Ad esempio, una parassitemia dell'1% corrisponde ad un valore di 50 000 parassiti per microlitro (infatti, 1/100= 0,01 da cui 0,01 X 5 000 000=50 000 parassiti/μl).
Metodiche basate sulla fluorescenza
L'utilizzo del microscopio a fluorescenza nella diagnostica della malaria si basa sull'uso di coloranti fluorescenti in grado di legarsi preferenzialmente al DNA o all' RNA che andranno a colorare il materiale genetico del plasmodio che spiccherà rispetto al globulo rosso [70] [71] .
I coloranti maggiormente utilizzati a livello internazionale sono l' arancio di acridina , la benzotiocarbossipurina od il DAPI-PI (4,6-diamidino-2-fenilindolo propidio ioduro). [72] [73] [74] [75]
La rodamina-123 , invece, viene utilizzata per la sua capacità di legarsi alla membrana dei plasmodi ancora attivi permettendo, pertanto, una valutazione della loro vitalità. [76] .
Una variante delle metodiche a fluorescenza è stata proposta da Kawamoto nel 1991. Essa prevede non più l'uso della lampada a fluorescenza, costosa e di manutenzione difficile, ma l'uso di una serie di lenti interferenti che convogliano, sul preparato colorato con arancio di acridina, una luce di lunghezza d'onda tale da poter eccitare il colorante. [77] .
Tali metodiche risultano essere assai rapide e facili da eseguire ed presentano una sensibilità maggiore rispetto alla colorazione con Giemsa ma si tratta, comunque, di metodologie che richiedono un'attrezzatura di difficile reperimento in paesi a risorse limitate e che necessitano di operatori esperti che sappiano distinguere i plasmodi da cellule o frammenti cellulari contenenti materiale genetico.
Si consiglia, comunque, sempre un affiancamento con le metodiche dello striscio sottile e della goccia spessa.
Una metodica simile (QBC, “quantitative buffy coat”) si basa sulla valutazione del sangue in un capillare da ematocrito, centrifugato, in modo da separarne le componenti, e studiato al microscopio a fluorescenza: nello strato dei globuli rossi, separato dai globuli bianchi, risalteranno i globuli rossi parassitati.
Altre metodiche
L'esame emoscopico non consente sempre di fare diagnosi o di escludere la malaria. La presenza dei plasmodi nel sangue di turisti o pazienti che non vivono in zona endemica è segno inequivocabile di malaria, ma è possibile che, temporaneamente, non si trovino parassiti in circolo, perché sequestrati nei capillari, o per autotrattamenti empirici e inadeguati. Nelle zone di endemia la diagnosi di malaria può essere controversa. Gli indigeni possono vivere, con parassitemie che raggiungono anche il 20%, in completo benessere, pertanto la positività dell'esame emoscopico non consente con certezza la diagnosi di malaria. Il fatto che i sintomi tipici di malaria eventualmente regrediscano con il trattamento anti-malarico, non consente la diagnosi “ex-juvantibus”, poiché molte virosi guariscono spontaneamente e molti antimalarici hanno anche un'azione antiflogistica.
Recentemente, sfruttando le metodiche immuno-isto-chimiche, sono stati introdotti nuovi test rapidi per la diagnosi di infezione. Una si basa sulla ricerca nel siero del paziente di un antigene del plasmodio (histidine rich protein-2, HRP-2) specialmente di P. falciparum e P. vivax (es. ParaSight, ICT Pf). Un'altra si basa sulla ricerca della lattato-deidrogenasi specifica di Plasmodium (pLDH) sia evidenziando la sua attività enzimatica, sia con “immunoassay” (es. Optimal). [78]
Diagnosi differenziale
Uno stato di malessere generale con febbre, insorto in viaggiatori tornati da almeno un mese da zone endemiche, deve far pensare principalmente alla malaria, ma vanno considerate anche la tripanosomiasi africana (malattia del sonno), la febbre dengue, leptospirosi, la febbre tifoide e altre patologie febbrili d'importazione, influenza e altre virosi, infezione acuta da HIV, batteriemia, polmonite.
Diagnosi precoce
L' anamnesi è la raccolta di tutti gli elementi utili da parte del medico attraverso un interrogatorio al paziente. Il medico deve chiedere se la persona che accusa i sintomi di malaria abbia soggiornato di recente (per i turisti) in paesi ad alto rischio o se abbia soggiornato per molto tempo (per gli immigrati) in regioni endemiche per malaria. Il medico deve poi comprendere quale possa essere stata l'eventuale modalità di trasmissione del microorganismo e chiedere quindi di punture di insetti o trasfusioni eseguite.
Trattamento
Trattamento farmacologico



Il farmaco più efficace nel trattamento dell'infezione da P. falciparum è l' artemisinina , in combinazione con altri antimalarici quali [79] :
- per la malaria causata da Plasmodium falciparum sensibile alla clorochina: clorochina
- per la malaria causata da Plasmodium falciparum resistente alla clorochina e in zone endemiche: chinina per os (o in caso di infezioni gravi chinidina per ev) associata a doxiciclina (o clindamicina nei bambini) per ridurne la durata della terapia
- per la malaria causata da Plasmodium malariae , vivax e ovale : clorochina (associata negli ultimi due casi a primachina per uccidere anche gli ipnozoiti)
I farmaci anti-malarici impiegati nella terapia della malaria non sono necessariamente gli stessi validi per la profilassi anti-malarica e non lo sono certamente le posologie (cioè le dosi) con cui sono impiegati. Alcuni di essi hanno importanti controindicazioni ed effetti collaterali.
- Principi attivi utilizzati
- Alofantrina : combatte lo stadio eritrocitario del P. falciparum
- Artemetere associato a lumefantrina
- Chinino
- Clorochina
- Meflochina : per il trattamento chemioprofilattico del P. vivax
- Pirimetamina associata a sulfadossina : contro il P. falciparum
- Primachina : contro P. vivax e P. ovale
- Proguanil cloridrato : per il trattamento chemioprofilattico contro P. falciparum o P. vivax
- Proguanil cloridrato associato ad Atovaquone : «Malarone»
- Principi attivi secondari o non specifici sperimentati contro la malaria
Esistono anche alcuni principi attivi che sono stati utilizzati in aggiunta sperimentale:
- Doxiciclina : per P. falciparum
- Propranololo : di utilizzo recente
Pattern di resistenza ai farmaci anti-malarici
Distribuzione delle farmaco-resistenze : [40]
- La Zona A è caratterizzata dalla presenza di ceppi di plasmodio sensibili alla clorochina ; è ormai limitata all'America centrale, ai Caraibi e al Medio Oriente .
- La Zona B è caratterizzata dalla prevalenza di P. vivax , con presenza di ceppi di P. falciparum resistenti alla clorochina, e comprende il subcontinente Indiano e l' Iran .
- La Zona C interessa tutte le altre regioni malariche, nelle quali prevalgono ceppi di P. falciparum clorochino-resistenti.
Questa è una classificazione a grandi linee, perché l' epidemiologia della malaria ei "pattern" di farmaco-resistenza variano molto, spesso anche a distanza di pochi chilometri, e sono in continua evoluzione, a causa dell'impiego intensivo e spesso improprio dei farmaci antimalarici , ma anche influenzati da sconvolgimenti ecologici e disastri naturali (per esempio uragani e tifoni ). Inoltre, va considerata la recente comparsa di meflochino-resistenza nelle zone silvestri al confine tra Thailandia e Birmania e Thailandia e Cambogia . [80]
Prevenzione
Comprendendo fin dai tempi antichi le cause che favoriscono il nascere della malaria negli ultimi tempi si è pensato a come prevenire l'insorgere del morbo nei paesi industrializzati come in quelli in via di sviluppo. Fino al 1945 le tecniche furono le continue bonifiche e la distruzione delle larve mediante sali d' arsenico . [81] Negli anni cinquanta e negli anni sessanta, c'è stato un notevole sforzo della sanità pubblica per sradicare la malaria distruggendo le zanzare nelle zone dove la malattia era diffusa, [82] anche se questi sforzi non sono riusciti a sradicare la malaria in molte parti del mondo, soprattutto in molte zone dell'Africa, per via dello sviluppo di zanzare che resistono agli insetticidi. Nel 1998 l' OMS cambiò la sua strategia istituendo la "Roll Back Malaria" dove fra le varie iniziative tuttora si tende all'istruzione della popolazione africana , come ad esempio a far riconoscere ai bambini le larve delle zanzare e convincere le madri a far visitare i loro bambini quando presentano i primi sintomi. [83]
Immunità
Nelle aree endemiche i bimbi sono protetti per i primi 6 mesi dall' immunità passiva materna, data dagli anticorpi ereditati dalla madre, poi si ha una progressiva acquisizione di una "semi-immunità", per successive esposizioni alle infezioni del plasmodio. Si hanno ricorrenti attacchi di malaria, dall'età di pochi mesi fino a 5-10 anni, prima di raggiungere uno stato di semi-immunità. Molti bimbi soffrono di ritardo di crescita e altri muoiono. Se i bimbi sopravvivono, mantengono la semi-immunità per continue reinfezioni, per tutta la vita, finché risiedono in area endemica.
La semi-immunità può calare temporaneamente durante la gravidanza (con conseguenza anche drammatiche, soprattutto nelle primigravide) e si attenua col tempo negli individui che abbandonano le zone endemiche (scompare dopo 2 anni di distanza). Questa viene considerata una semi-immunità perché durante la vita si hanno ugualmente ricorrenti episodi di parassitemia, di breve durata e bassa carica, per lo più asintomatici o paucisintomatici (con pochi sintomi). [84]
Mutazioni dell' emoglobina (S,C, beta e alfa talassemie ), degli enzimi glucosio-6-fosfato deidrogenasi e piruvato chinasi , proteggono dalle forme gravi di malaria provocate da P. falciparum in portatori eterozigoti e nel caso dell'emoglobina C soprattutto in omozigosi . Le particolari proprietà delle catene dell'emoglobina e le condizioni di stress ossidativo provocate dell'infezione stessa, possono provocare l'emolisi degli eritrociti ostacolando la maturazione dei trofozoiti. Nonostante queste mutazioni siano dannose (quasi sempre in omozigosi sono letali), grazie alla protezione conferita nei confronti della malaria si trovano ad alte frequenze in popolazioni che vivono in zone endemiche (o ex endemiche) per malaria (bacino del mediterraneo, Africa sub-sahariana, sud-est asiatico). Tranne per l'emoglobina C, in queste popolazioni la frequenza delle mutazioni di resistenza è comunque destinata ad arrivare ad un valore di equilibrio (intorno al 15-20%) che rispecchia lo svantaggio dovuto alla letalità della mutazione ed il vantaggio rispetto alla malaria. Nelle zone non malariche, queste mutazioni generalmente sono molto rare o assenti poiché la loro letalità non è controbilanciata da effetti positivi.
Un esempio molto interessante è quello dell'evoluzione dell' antigene eritrocitario Duffy , il recettore attraverso il quale i merozoiti di P. vivax penetrano il globulo rosso. Gli eritrociti che non hanno questo antigene ( Duffy negativi) sono refrattari all'infezione da parte di quel plasmodio. In Africa occidentale, una mutazione che elimina l'antigene dalla superficie degli eritrociti ma che non ha altre conseguenze cliniche ha raggiunto (probabilmente in varie migliaia di anni) la frequenza del 100% e quindi la maggior parte degli abitanti dell'Africa centrale e occidentale non viene infettata da questa specie di plasmodio.
Chemio-profilassi
La chemioprofilassi antimalarica si basa sul principio secondo il quale si raggiunge e si mantiene una concentrazione plasmatica di un farmaco anti-malarico a livelli bassi per essere curativi ma sufficienti a impedire che si sviluppi la malattia dopo una puntura della zanzara e l'infezione da parte del plasmodio. Tale concentrazione deve essere mantenuta per tutto il periodo in cui si è potenzialmente esposti alla malattia, cioè per tutto il periodo di permanenza in zona malarica e fino almeno a 4 settimane dopo il ritorno, pertanto solitamente si inizia la profilassi per tempo, 1 o 2 settimane prima di partire.
- Per la profilassi in zone malariche di clorochino-sensibilità, si impiega efficacemente la clorochina 300 mg base (500 mg sale) per via orale, una volta alla settimana (dose pediatrica 5 mg/kg base (8.3 mg/kg sale) per via orale, una volta alla settimana, senza superare la dose massima dell'adulto di 300 mg base. Nell'Africa francofona si usa quotidianamente la nivachina (clorochina) in pasticche da 100 mg in maniera da mantenere costante nel tempo il dosaggio del prodotto nel sangue.
- Per la profilassi in zone malariche di clorochino-resistenza, si impiega la meflochina (Lariam) 228 mg base (250 mg sale, 1 compressa) per via orale, una volta alla settimana. Le dosi pediatriche variano secondo il peso:
- sotto i 9 kg: 4.6 mg/kg base (5 mg/kg sale) per via orale, una volta alla settimana
- tra 10–19 kg: 1/4 di compressa una volta alla settimana
- tra 20–30 kg: 1/2 compressa una volta alla settimana
- tra 31–45 kg: 3/4 di compressa una volta alla settimana
- Per la profilassi in zone malariche di clorochino-resistenza e meflochino-resistenza (per es. in zone della Thailandia) si può impiegare la doxiciclina per via orale 100 mg al giorno. Nei bambini è solitamente sconsigliata;
- in quelli che pesano meno di 25 kg o hanno meno di 8 anni è controindicato;
- da 25 a 35 kg di peso oppure da 8 a 10 anni: 1/2compressa al giorno
- da 36 a 50 kg di peso oppure da 11 a 13 anni: 3/4 di compressa al giorno
- da 50 kg di peso in poi oppure da 14 anni in poi: 1 compressa al giorno
- In alternativa, nelle zone con multiresistenze, si può impiegare il Malarone ( Atovaquone 250 mg + Proguanil 100 mg, 1 compressa). La dose per adulti è 1 compressa al giorno, iniziando 1-2 giorni prima di entrare nella zona a rischio e continuando fino a una settimana dopo l'uscita dalla zona.
- Nei bambini da 11 a 20 kg di peso: 1/4 di compressa degli adulti
- da 21 a 30 kg di peso: 1/2 compressa degli adulti
- da 31 a 40 kg di peso: 3/4 di compressa degli adulti
- oltre 40 kg dose degli adulti.
Vaccini
Ci sono attualmente molti progetti per lo sviluppo di un vaccino efficace, ma nessuno ancora disponibile e impiegabile in larga scala. [85] Molte associazioni sono nate con il preciso scopo di individuare un vaccino che possa ostacolare efficacemente la malaria, [86] o sono state incaricate di farlo, [87] ma secondo la ricerca scientifica lo sviluppo di un vaccino dovrebbe essere accompagnato da un impegno parallelo per migliorare gli strumenti diagnostici e la loro disponibilità nelle zone a rischio. [88]
Molte discussioni di carattere economico nascono attorno allo studio della malaria, fra le tante alcune di esse affermano che con lo stesso importo che si sta utilizzando per la ricerca dell' AIDS si potrebbero avere più benefici per la popolazione africana se tali entrate venissero dirottate verso lo studio del paludismo. [89] Fra i metodi alternativi si sta studiando la possibilità di sterilizzare gli insetti, in tali casi serve un'applicazione continua e rapida. Vi sono stati dei risultati, ma bisogna confrontare i dati rapportandoli ad un progetto di più lunga durata. [90] . Particolarmente promettenti appaiono due filoni di ricerche nell'ambito della tecnica CRISPR Cas: uno che mira alla scomparsa delle specie di zanzara tramite la diffusione di maschi geneticamente modificati per dare una progenie esclusivamente maschile, portandole all'estinzione in circa 6 generazioni, e un altro che induce nei loro sistemi immunitari la produzione di un anticorpo anti plasmodio.
Prevenzione per i viaggiatori
Il sistema migliore per non ammalarsi di malaria è evitare di essere punti dalla zanzara vettore.
La zanzara femmina dell' Anopheles punge preferibilmente di notte, tra il tramonto e l'alba, pertanto i viaggiatori dovrebbero evitare le punture d'insetto soprattutto in queste ore. Si consiglia di vestirsi evitando i colori scuri, coprendosi il più possibile, e di usare sulla pelle esposta (volto e mani) spray e sostanze repellenti per gli insetti, di dormire in stanze trattate precedentemente con insetticida, dormendo coperti dalle apposite reti protettive impregnate con insetticida o con repellente. Il repellente più efficace è il DEET ( N,N-dietilmetatoluamide ). Tra gli insetticidi si può usare la permetrina . Inoltre, l'aria condizionata rende gli insetti meno attivi e quindi meno pericolosi.
Prognosi

nessun dato
<10
0–100
100–500
500–1000
1000–1500
1500–2000
2000–2500
2500–2750
2750–3000
3000–3250
3250–3500
≥3500
Se trattati correttamente, gli individui colpiti da malaria, solitamente possono aspettarsi un completo recupero. [91] Tuttavia, la malaria severa può progredire molto rapidamente e causare la morte entro poche ore o giorni. [92] Nei casi più gravi della malattia, il tasso di mortalità può raggiungere il 20 %, anche con il trattamento e il ricorso alla terapia intensiva . [93] Nel lungo periodo, menomazioni di sviluppo sono state documentate nei bambini che hanno sofferto di episodi di malaria grave. [94] L'infezione cronica può verificarsi, una forma di immunodeficienza acquisita, dove il sistema immunitario è anche meno sensibile alla Salmonella e al virus di Epstein-Barr . [95]
La malaria provoca anemia diffusa durante un periodo di rapido sviluppo del cervello e danni cerebrali, anche diretti. I bambini risultano più vulnerabili a questi attacchi. [94] Alcuni superstiti di malaria cerebrale presentano un aumentato rischio di sviluppare deficit neurologici e cognitivi, disturbi del comportamento ed epilessia . [96] Gli studi clinici hanno dimostrato che la profilassi della malaria è in grado di migliorare la funzione cognitiva e il rendimento scolastico, rispetto al gruppo placebo . [94]
Nella letteratura
La malaria viene spesso citata nella letteratura , spesso correlata ad ambientazioni esotiche, come nei romanzi di Emilio Salgari , ma anche in contesti occidentali, come nelle Novelle rusticane di Giovanni Verga (1883) [97] . La malattia compare anche come morbo endemico nel libro di Carlo Levi , Cristo si è fermato a Eboli : l'autore, in quanto medico, cura i malati del piccolo paese in cui trascorre il confino a causa della sua avversione al fascismo. Celebre, inoltre, è la descrizione dell'arrivo a Matera della sorella dello scrittore, a cui si fanno incontro i bambini della città chiedendo il Chinino , uno dei farmaci più efficaci di allora contro la malaria. [98] La malattia è riportata anche nel libro Ebano del reporter polacco Ryszard Kapuściński, sia per l'esperienza personale sia per la descrizione, in poche righe ma estremamente vivida, di persone in fase terminale in un villaggio africano. Dante Alighieri morì di malaria dopo avere attraversato le zone paludose delle Valli di Comacchio mentre stava andando a Ravenna. Morì di malaria il grande ciclista Fausto Coppi nel 1960, di ritorno da un viaggio in Africa, dove era stato punto da zanzare che gli avevano trasmesso il plasmodium falciparum .
Note
- ^ Gaetano Filice, Malattie infettive, 2ª edizione, pag 518 , Milano, McGraw-Hill, 1998, ISBN 88-386-2362-7 .
- ^ Douglas M. Anderson, A. Elliot Michelle, Mosby's medical, nursing, & Allied Health Dictionary sesta edizione Volume I, pag 900 , New York, Piccin, 2004, ISBN 88-299-1716-8 .
- ^ Lee Goldman e Andrew Schafer, Goldman-Cecil Medicina Interna , Edra, 2017-06-30T00:00:00+02:00, pp. 8240–, ISBN 978-88-214-4185-1 .
- ^ Collegamento tra talassemia e malaria , su fondazioneveronesi.it .
- ^ Crotti D., A history of Malaria from and for a popular point of view , in Infez Med , vol. 4, 2005, pp. 265-270.
- ^ a b c Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione pag 224 , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- ^ Escalante A, Freeland D, Collins W, Lal A, The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome. , in Proc Natl Acad Sci USA , vol. 95, n. 14, 1998, pp. 8124-9, PMID 9653151 .
- ^ Joy D, Feng X, Mu J, et al , Early origin and recent expansion of Plasmodium falciparum. , in Science , vol. 300, n. 5617, 2003, pp. 318-21, PMID 12690197 .
- ^ Cox F, History of human parasitology. , in Clin Microbiol Rev , vol. 15, n. 4, 2002, pp. 595-612, PMID 12364371 .
- ^ ( EN ) Pappas G, Kiriaze IJ, Falagas ME., Insights into infectious disease in the era of Hippocrates. , in Int J Infect Dis. , 2008.
- ^ http://www.cell.com/current-biology/fulltext/S0960-9822(16)31201-5
- ^ http://www.lescienze.it/news/2016/12/06/news/malaria_impero_romano-3341709/
- ^ spp. abbreviazione di specie (plurale).
- ^ Biography of Alphonse Laveran , su nobelprize.org , The Nobel Foundation. URL consultato il 15 giugno 2007 . ] Nobel foundation. Ultimo accesso 25 ottobre 2006
- ^ ( EN ) Ole Daniel Enersen, Ettore Marchiafava , in Who Named It? .
- ^ Biography of Ronald Ross , su nobelprize.org , The Nobel Foundation. URL consultato il 15 giugno 2007 .
- ^ Grassi, Giovanni Battista , su treccani.it . URL consultato il 25-03-2020 (archiviato dall' url originale l'11 ottobre 2019) .
- ^ Krotoski W, Collins W, Bray R, et al , Demonstration of hypnozoites in sporozoite-transmitted Plasmodium vivax infection. , in Am J Trop Med Hyg , vol. 31, n. 6, 1982, pp. 1291-3, PMID 6816080 .
- ^ Meis J, Verhave J, Jap P, Sinden R, Meuwissen J, Malaria parasites--discovery of the early liver form. , in Nature , vol. 302, n. 5907, 1983, pp. 424-6, PMID 6339945 .
- ^ World Health Organization, World Malaria Day 2015 , su who.int , WHO, 25 aprile 2015 (archiviato dall' url originale il 25 aprile 2016) .
- ^ Gaetano Filice, Malattie infettive, 2ª edizione Pag 519 , Milano, McGraw-Hill, 1998, ISBN 88-386-2362-7 .
- ^ Hay S, Guerra C, Tatem A, Noor A, Snow R, The global distribution and population at risk of malaria: past, present, and future. , in Lancet Infect Dis , vol. 4, n. 6, 2004, pp. 327-36, PMID 15172341 .
- ^ Greenwood B, Mutabingwa T, Malaria in 2002 , in Nature , vol. 415, 2002, pp. 670–2, PMID 11832954 .
- ^ ( EN ) Frank M. Snowden, The Conquest of Malaria: Italy, 1900-1962 , New Haven, Yale University Press, 2006, ISBN 9780300108996 .
- ^ On. Francesco Nitti, Inchiesta parlamentare sulle condizioni dei contadini nelle provincie meridionali e nella Sicilia , vol. 5, III, Roma, 1910, p. 357.
- ^ Majori G, Sabatinelli G, Casaglia O, Cavallini C, Monzali C., Imported malaria in Italy from 1986 to 1988 , in JR Soc Health , vol. 110, 1990, pp. 88-89.
- ^ Lazzara A, Morante V, Priolo A, Microfocolaio residuo di infezione malarica in provincia di Palermo , in Ann Sanità Publica , vol. 28, 1967, pp. 725-741.
- ^ Baldari M, Tamburro A, Sabatinelli G, Romi R, "Malaria in maremma, Italy" , in The Lancelot , vol. 351, 1998, pp. 1248-1249.
- ^ Bimba di quattro anni morta di malaria a Brescia , su ansa.it .
- ^ Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione pag 236-238 , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- ^ Muturi EJ, Muriu S, Shililu J, Mwangangi J, Jacob BG, Mbogo C, Githure J, Novak RJ., Effect of Rice Cultivation on Malaria Transmission in Central Kenya , in Am J Trop Med Hyg , vol. 78, 2008, pp. 270-275.
- ^ P. falciparum , su cdfound.to.it (archiviato dall' url originale il 6 settembre 2005) .
- ^ P. vivax , su cdfound.to.it (archiviato dall' url originale il 29 novembre 2005) .
- ^ P. ovale , su cdfound.to.it (archiviato dall' url originale il 14 aprile 2005) .
- ^ P. malariae , su cdfound.to.it (archiviato dall' url originale il 27 novembre 2005) .
- ^ Chin W, Contacos PG, Coatney RG, Kimbal HR., A naturally acquired quotidian-type malaria in man transferable to monkeys , in Science , vol. 149, 1965, p. 865, PMID 14332847 .
- ^ Singh B, Lee KS, Matusop A, Radhakrishnan A, Shamsul SSG, Cox-Singh J, Thomas A, Conway DJ, A large focus of naturally acquired Plasmodium knowlesi infections in human beings , in Lancet , vol. 363, 2004, pp. 1017–24, DOI : 10.1016/S0140-6736(04)15836-4 .
- ^ Wharton RH, Eyles DE., Anopheles hackeri, a vector of Plasmodium knowlesi in Malaya , in Science , vol. 134, 1961, pp. 279–80.
- ^ Collins WE, Jeffery GM.., Plasmodium malariae: parasite and disease. , in Clin Microbiol Rev. , vol. 4, 2007, pp. 579-92.
- ^ a b Distribuzione Malaria
- ^ Pathogenesis of Malaria and Clinically Similar Conditions , su cmr.asm.org .
- ^ Immagini dei diversi stadi di P. falciparum , su dpd.cdc.gov . URL consultato il 17 marzo 2020 (archiviato dall' url originale il 21 marzo 2008) .
- ^ Immagini dei diversi stadi di P. malariae , su dpd.cdc.gov . URL consultato il 17 marzo 2020 (archiviato dall' url originale il 19 marzo 2008) .
- ^ Immagini dei diversi stadi di P. ovale , su dpd.cdc.gov . URL consultato il 17 marzo 2020 (archiviato dall' url originale il 23 marzo 2008) .
- ^ Immagini dei diversi stadi di P. vivax , su dpd.cdc.gov . URL consultato il 17 marzo 2020 (archiviato dall' url originale il 23 marzo 2008) .
- ^ Abu-Raddad L, Patnaik P, Kublin J, Dual infection with HIV and malaria fuels the spread of both diseases in sub-Saharan Africa , in Science , vol. 314, n. 5805, 2006, pp. 1603-6, PMID 17158329 .
- ^ Alkhunaizi AM, Al-Tawfiq JA, Al-Shawaf MH., Transfusion-transmitted malaria in a kidney transplant recipient. How safe is our blood transfusion? , in Saudi Med J. , vol. 2, 2008, pp. 293-295.
- ^ Guillet P, Germain MC, Giacomini T, Chandre F, Akogbeto M, Faye O, Dual Origin and prevention of airport malaria in France. , in Trop Med Int Hlth , vol. 3, 1998, pp. 700-705.
- ^ Giacomini T, Goudal H, Boudon P, Rennes C, Dumouchel P, Petithory JC, A propos de deux cas de paludisme à Plasmodium falciparum. Responsabilité probable d'anophèles importés par voie aérienne , in Bull Soc Path Ex , vol. 70, 1977, pp. 375-379.
- ^ Giacomini T, Paludisme des aéroports et de leurs alentours , in Revue du Praticien , vol. 48, 1998, pp. 264-267.
- ^ Allam MM, Alkadarou TA, Ahmed BG, Elkhair IS, Alansary EH, Ibrahim ME, Elhassan AM, Elhassan IM., Hyper-reactive Malarial Splenomegaly (HMS) in malaria endemic area in Eastern Sudan. , in Acta Trop. , 2007.
- ^ immagine da sito Atlas Archiviato il 3 settembre 2005 in Internet Archive ..
- ^ Immagine bambino infetto Archiviato il 14 settembre 2005 in Internet Archive .
- ^ Malaria life cycle & pathogenesis Archiviato il 18 gennaio 2008 in Internet Archive . Malaria in Armenia. Ultimo accesso 31 ottobre 2006
- ^ R Idro, Otieno G, White S, Kahindi A, Fegan G, Ogutu B, Mithwani S, Maitland K, Neville BG, Newton CR, Decorticate, decerebrate and opisthotonic posturing and seizures in Kenyan children with cerebral malaria , in Malaria Journal , vol. 4, n. 57, PMID 16336645 . URL consultato il 21 gennaio 2007 .
- ^ Trampuz A, Jereb M, Muzlovic I, Prabhu R, Clinical review: Severe malaria. , in Crit Care , vol. 7, n. 4, 2003, pp. 315-23, PMID 12930555 .
- ^ a b Ranque S, Poudiougou B, Traoré A, Keita M, Oumar AA, Safeukui I, Marquet S, Cabantous S, Diakité M, Mintha D, Cissé MB, Keita MM, Dessein AJ, Doumbo OK., Life-Threatening Malaria in African Children: A Prospective Study in a Mesoendemic Urban Setting , in Pediatr Infect Dis J. , vol. 2, 2008, pp. 130-135.
- ^ Da qui il nome inglese Blackwater fever , febbre dell'acqua nera.
- ^ Oumar AA, Poudiougou B, Sylla M, Sall A, Konate S, Togo B, Diakite M, Keita MM., Blackwater Blackwater fever in children during cerebral malaria: 3 case reports in Bamako , in Arch Pediatr. , vol. 8, 2005, pp. 993-5.
- ^ Gobbi F, Audagnotto S, Trentini L, Nkurunziza I, Corachan M, Di Perri G., Blackwater fever in children, Burundi. , in Emerg Infect Dis. , vol. 7, 2005, pp. 1118-20.
- ^ a b Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione pag 233 , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- ^ Impact of Malaria during Pregnancy on Low Birth Weight in Sub-Saharan Africa
- ^ PLASMODIUM FALCIPARUM Archiviato l'8 settembre 2005 in Internet Archive .
- ^ a b Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione pag 249 , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- ^ Laufer MK, Djimdé AA, Plowe CV., Monitoring and deterring drug-resistant malaria in the era of combination therapy. , in Am J Trop Med Hyg. , vol. 77, 2007, pp. 160-169.
- ^ Immagine di Babesia canis Archiviato il 1º febbraio 2008 in Internet Archive .
- ^ immagine PLASMODIUM FALCIPARUM Archiviato il 9 aprile 2005 in Internet Archive .
- ^ Immagine globuli rossi PLASMODIUM FALCIPARUM Archiviato il 4 settembre 2005 in Internet Archive .
- ^ Immagine PLASMODIUM FALCIPARUM Archiviato il 3 settembre 2005 in Internet Archive .
- ^ PLASMODIUM FALCIPARUM Archiviato il 5 settembre 2005 in Internet Archive .
- ^ PLASMODIUM FALCIPARUM Archiviato il 5 settembre 2005 in Internet Archive .
- ^ Rapid diagnosis of malaria by use of fluorescent probes , su ncbi.nlm.nih.gov .
- ^ Acridine orange fluorescent microscopy and the detection of malaria in populations with low-density parasitemia
- ^ Detection of Plasmodium falciparum infection with the fluorescent dye, benzothiocarboxypurine
- ^ Acridine orange stained blood wet mounts for fluorescent detection of malaria , su ncbi.nlm.nih.gov .
- ^ A method for monitoring the viability of malaria parasites (Plasmodium yoelii) freed from the host erythrocytes
- ^ Rapid diagnosis of malaria by fluorescence microscopy with light microscope and interference filter , su ncbi.nlm.nih.gov .
- ^ Rapid Diagnostic Tests for Malaria Parasites , su cmr.asm.org .
- ^ Kokwaro G (2009). "Ongoing challenges in the management of malaria". Malaria Journal. 8 (Suppl 1): S2. PMC 2760237 Freely accessible. PMID 19818169 . doi:10.1186/1475-2875-8-S1-S2. open access publication – free to read
- ^ Malaria - Dipartimento della sanità pubblica e dell'innovazione Direzione generale dei rapporti europei ed internazionali Ufficio III – ex DGRUERI ( PDF ), su salute.gov.it . URL consultato il 25 marzo 2020 (archiviato dall' url originale l'8 marzo 2014) .
- ^ Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione pag 257 , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- ^ Gladwell, Malcolm., The Mosquito Killer , The New Yorker, 2 luglio 2001 (archiviato dall' url originale il 6 febbraio 2009) .
- ^ Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione pag 258 , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- ^ Articolo , su cmr.asm.org .
- ^ Sicuro ed efficace il vaccino anti-malaria , su lescienze.espresso.repubblica.it , Le Scienze, 18 novembre 2007. URL consultato il 25 gennaio 2008 .
- ^ ( EN ) Kilama WL, Chilengi R, Wanga CL., ATowards an African-driven malaria vaccine development program: history and activities of the African Malaria Network Trust (AMANET). , in Am J Trop Med Hyg. , vol. 77, 2007, pp. 282-288..
- ^ ( EN ) Ballou WR, Cahill CP., Two decades of commitment to malaria vaccine development: GlaxoSmithKline Biologicals. , in Am J Trop Med Hyg. , vol. 77, 2007, pp. 289-295.
- ^ ( EN ) Wongsrichanalai C, Barcus MJ, Muth S, Sutamihardja A, Wernsdorfer WH., A review of malaria diagnostic tools: microscopy and rapid diagnostic test (RDT). , in Am J Trop Med Hyg. , vol. 77, 2007, pp. 119-127.
- ^ Hull, Kevin. (2006) "Malaria: Fever Wars". PBS Documentary Archiviato il 18 gennaio 2008 in Internet Archive .
- ^ ( EN ) Fillinger U, Kannady K, William G, Vanek MJ, Dongus S, Nyika D, Geissbuehler Y, Chaki PP, Govella NJ, Mathenge EM, Singer BH, Mshinda H, Lindsay SW, Tanner M, Mtasiwa D, de Castro MC, Killeen GF., A tool box for operational mosquito larval control: preliminary results and early lessons from the Urban Malaria Control Programme in Dar es Salaam, Tanzania. , in Malar J , vol. 7, gennaio 2008, p. 20. .
- ^ Frequently Asked Questions (FAQs): If I get malaria, will I have it for the rest of my life? , su cdc.gov , US Centers for Disease Control and Prevention, 8 febbraio 2010. URL consultato il 14 maggio 2012 .
- ^ Trampuz A, Jereb M, Muzlovic I, Prabhu R, Clinical review: Severe malaria , in Critical Care , vol. 7, n. 4, 2003, pp. 315–23, DOI : 10.1186/cc2183 , PMC 270697 , PMID 12930555 .
- ^ Nadjm B, Behrens RH, Malaria: An update for physicians , in Infectious Disease Clinics of North America , vol. 26, n. 2, 2012, pp. 243–59, DOI : 10.1016/j.idc.2012.03.010 , PMID 22632637 .
- ^ a b c Fernando SD, Rodrigo C, Rajapakse S, The 'hidden' burden of malaria: Cognitive impairment following infection , in Malaria Journal , vol. 9, 2010, p. 366, DOI : 10.1186/1475-2875-9-366 , PMC 3018393 , PMID 21171998 .
- ^ Riley EM, Stewart VA, Immune mechanisms in malaria: New insights in vaccine development , in Nature Medicine , vol. 19, n. 2, 2013, pp. 168–78, DOI : 10.1038/nm.3083 , PMID 23389617 .
- ^ Idro R, Marsh K, John CC, Newton CRJ,Cerebral malaria: Mechanisms of brain injury and strategies for improved neuro-cognitive outcome , in Pediatric Research , vol. 68, n. 4, 2010, pp. 267–74, DOI : 10.1203/PDR.0b013e3181eee738 , PMC 3056312 , PMID 20606600 .
- ^ Testo in rete della "malaria" , su digilander.libero.it . URL consultato il 02-08-2008 .
- ^ Carlo Levi, Cristo si è fermato a Eboli , Einaudi, Torino, 1945.
Bibliografia
- Claudio Genchi, Pozio Edoardo, Parassitologia generale e umana, 13ª edizione , Milano, Ambrosiana, 2004, ISBN 88-408-1269-5 .
- Massimo Scaglia, Simona Gatti, Elio Guido Rondanelli, Parassiti e parassitosi umane. Dalla clinica al laboratorio , Milano, Selecta medica, 2006, ISBN 88-7332-129-1 .
- Gaetano Filice, Malattie infettive, 2ª edizione , Milano, McGraw-Hill, 1998, ISBN 88-386-2362-7 .
- Joseph C. Segen,Concise Dictionary of Modern Medicine , New York, McGraw-Hill, 2006, ISBN 978-88-386-3917-3 .
- Douglas M. Anderson, A. Elliot Michelle, Mosby's medical, nursing, & Allied Health Dictionary sesta edizione , New York, Piccin, 2004, ISBN 88-299-1716-8 .
Storia della malaria
- G. Penso, Parassiti, microbi e contagi nella storia dell'umanità , Ciba-Geigy, Milano 1990
- F. Snowden, The Conquest of Malaria in Italy 1900-1962 , Yale University Press, New Haven 2006
- E. Tognotti, Per una storia della malaria in Italia. Il caso della Sardegna , prefazione di Frank Snowden, Franco Angeli, Milano 2008
- Frank M. Snowden, La conquista della malaria. Una modernizzazione italiana 1900-1962 , Einaudi, 2008, ISBN 978-88-06-18541-1 .
Straniera
- ( BR ) Roberto Focaccia, Ricardo Veronesi, Tratado de Infectologia terza edizione , Sao Paulo, ATHENEU RIO, 2005, ISBN 85-7379-805-X .
- ( EN ) G.Carosi, F.Castelli (editors) Handbook of malaria infection in the Tropics: health co-operation papers, pubblicato dall'"Associazione italiana amici di R.Follerau", 1997
- ( EN ) G.Cook, Manson's P. Tropical Diseases . 12th ed. Saunders, 1998
- ( EN ) Patrick R., Ph. D. Murray, Ellen Jo Baron, James H. Jorgensen, Marie Louise Landry, Michael A. Pfaller: Manual of Clinical Microbiology. American Society for Microbiology. Nona edizione
- ( EN ) Atlas of medical parasitology, Carlo DeNegri Foundation , su cdfound.to.it . URL consultato il 22 ottobre 2005 (archiviato dall' url originale il 13 ottobre 2005) .
- ( EN ) Armengaud A, Legros F, et al. A case of autochthonous Plasmodium vivax malaria, Corsica, August 2006. Euro Surveill. 2006 Nov 16;11(11).
Voci correlate
Progetti di calcolo distribuito
Progetti che si propongono di sconfiggere la Malaria sfruttando la potenza di calcolo dei PC :
Altri progetti
-
 Wikiquote contiene citazioni sulla malaria
Wikiquote contiene citazioni sulla malaria -
 Wikizionario contiene il lemma di dizionario « malaria »
Wikizionario contiene il lemma di dizionario « malaria » -
 Wikimedia Commons contiene immagini o altri file sulla malaria
Wikimedia Commons contiene immagini o altri file sulla malaria
Collegamenti esterni
- ( EN ) Malaria , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- ( EN ) Malaria , in Encyclopædia Iranica , Ehsan Yarshater Center, Columbia University.
- Aiuta l'UNICEF a combattere la malaria , su unicef.it .
- Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute , su epicentro.iss.it .
- Il sito del ministero della salute [ collegamento interrotto ] , su trapianti.ministerosalute.it .
- Società italiana di medicina tropicale , su simetweb.eu . URL consultato il 29 gennaio 2008 (archiviato dall' url originale il 13 febbraio 2009) .
- ( EN ) Brian J. Angus, Malaria on the World Wide Web, Clinical Infectious Diseases 2001;33:651-661 , su journals.uchicago.edu .
- ( EN ) CDC site on malaria , su cdc.gov .
- ( EN ) Doctors Without Frontiers/Medecins Sans Frontieres Malaria information pages , su doctorswithoutborders.org . URL consultato il 17 ottobre 2005 (archiviato dall' url originale il 17 dicembre 2005) .
- ( EN ) Sito internazionale sulla malaria , su malaria.org . URL consultato il 29 gennaio 2008 (archiviato dall' url originale il 3 febbraio 2008) .
- ( EN ) WHO site on malaria , su mosquito.who.int . URL consultato il 17 ottobre 2005 (archiviato dall' url originale il 6 gennaio 2006) .
- ( EN ) Yahoo! - Malaria directory category
- ( EN ) Net Gain: Free Online Book on Insecticide treated nets for the prevention of malaria , su idrc.ca . URL consultato il 17 ottobre 2005 (archiviato dall' url originale il 20 novembre 2005) .
- Malaria parasite interactions with the human host , su jpgmonline.com .
- Developing artemisinin based drug combinations for the treatment of drug resistant falciparum malaria: A review , su jpgmonline.com .
- Management of severe falciparum malaria , su jpgmonline.com .
- Malaria: Le iniziative di Novartis , su novartis.it . URL consultato il 20 agosto 2012 (archiviato dall' url originale il 30 settembre 2012) .
- Malaria: cause, sintomi, ciclo vitale e trattamento , su BioPills.net
| Controllo di autorità | Thesaurus BNCF 12983 · LCCN ( EN ) sh85080038 · GND ( DE ) 4037197-9 · BNF ( FR ) cb11941348r (data) · BNE ( ES ) XX526064 (data) · NDL ( EN , JA ) 00567482 |
|---|