Boală renală cronică
| Boală renală cronică | |
|---|---|
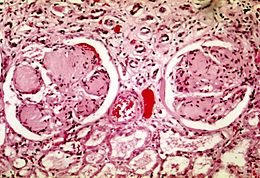
| Glomeruloscleroza la un pacient cu diabet zaharat , o afecțiune frecvent asociată cu boli renale cronice. | |
| Specialitate | Nefrologie |
| Clasificare și resurse externe (EN) | |
| Plasă | D051436 |
| MedlinePlus | 000471 |
| eMedicină | 238798 |
Boala renală cronică ( CKD ) este orice afecțiune patologică care afectează rinichiul și care poate provoca pierderea progresivă și completă a funcției renale sau complicații care rezultă din funcția renală redusă. Boala renală cronică este, de asemenea, definită ca prezența leziunilor renale, evidențiată de anumite rezultate de laborator, instrumentale sau patologice sau funcția renală redusă care durează cel puțin 3 luni, indiferent de boala de bază [1] [2] .
Consecința naturală a CKD este reprezentată de insuficiența renală cronică (IRC), adică pierderea progresivă și ireversibilă a funcției renale. [3] În cele mai avansate etape (începând cu a treia, în funcție de stadializarea K-DOQI), boala renală cronică este identificată cu insuficiență renală cronică, adică cu reducerea funcției de filtrare a rinichilor, cuantificabilă cu clearance-ul creatininei sau cu diverse formule care estimează rata de filtrare glomerulară . Pierderea completă a funcției renale necesită un tratament de substituție, reprezentat de dializă sau transplant .
Fiziologie
Rinichii au patru funcții esențiale, care pot fi rezumate după cum urmează:
- Reglarea cantității de apă și electroliți conținuți în organism ( echilibru hidroelectrolitic )
- Reglarea echilibrului acido-bazic (contribuie la menținerea pH-ului corect al sângelui)
- Eliminarea unor substanțe produse de metabolism (cum ar fi ureea , creatinina , acidul uric ) sau eliberate din exterior (medicamente și toxice)
- Producerea de hormoni . Printre cele mai importante se numără renina , implicată în reglarea tensiunii arteriale, eritropoietina , care stimulează producția de celule roșii din sânge și prostaglandine , care contribuie, printre alte funcții, la reglarea fluxului sanguin în rinichi. Mai mult, în rinichi are loc activarea vitaminei D.
Filtrarea sângelui are loc în glomerulii renali , mici bile de capilare cu un perete cu caracteristici particulare, care funcționează ca un filtru foarte selectiv pentru sângele care trece prin ele. Capacitatea unei molecule de a trece prin filtrul glomerular depinde în primul rând de mărimea acesteia: moleculele mici, cum ar fi sodiul și ureea, trec cu ușurință, spre deosebire de moleculele mai mari, ca majoritatea proteinelor . Încărcarea electrică este, de asemenea, importantă: deoarece bariera glomerulară este bogată în sarcini negative, va fi favorizat trecerea substanțelor cu sarcină neutră sau pozitivă.
Rezultatul procesului de filtrare este formarea de ultrafiltrat sau pre-urină (aproximativ 130-180 litri pe zi). Prin urmare, ultrafiltratul traversează tubul renal , unde compoziția sa este modificată datorită proceselor de reabsorbție și secreție de către celulele tubulare. În special, aproximativ 99% din apa prezentă în ultrafiltrat este reabsorbită: de aceea volumul de urină produs într-o zi este de ordinul a 1-2 litri. Produsul final al acestor procese este urina .
Fiziopatologie
Mecanisme de compensare
Indiferent de boala care o provoacă, CKD de bază este o reducere progresivă a numărului de nefroni funcționali. În primele etape ale acestui proces, nefronii reziduali suferă hipertrofie și tind să filtreze mai mult: de aceea se observă o creștere tranzitorie a ratei de filtrare glomerulară ( hiperfiltrare ). Factorul cel mai responsabil pentru acest mecanism de adaptare este angiotensina II, care exercită o acțiune de vasoconstricție asupra arteriolei eferente a glomerulului; acest lucru duce la o creștere a presiunii hidrostatice în glomerul, favorizând procesul de filtrare. Dezavantajul hiperfiltrării este că tinde să uzeze nefronii care funcționează încă, supraîncărcându-i.
Un alt mecanism de compensare care poate fi stabilit în acest moment este creșterea secreției tubulare, care reprezintă o încercare extremă a rinichilor de a elimina substanțele reziduale precum creatinina, un produs al metabolismului muscular. Aceasta, în condiții normale, este aproape complet eliminată prin filtrare glomerulară. Cu toate acestea, atunci când GFR scade sub 50 ml / min, creatinina începe să fie secretată în cantități semnificative de tubul. Când reducerea numărului de nefroni depășește capacitatea compensatorie a rinichiului, apar primele semne de laborator ale insuficienței renale. Creșterea creatininei serice peste valorile „normale” (1,2-1,3 mg / dl) indică faptul că RFG a scăzut deja cu 40-50%. [3] Din acest motiv, nu se recomandă utilizarea creatininei serice singure ca indice al funcției renale.
În stadiile mai avansate ale IRC, se observă, de asemenea, o creștere a nivelurilor de uree plasmatică; reprezintă produsul terminal al catabolismului proteinelor și, în condiții fiziologice, este filtrat de glomerul și parțial reabsorbit de celulele tubului proximal. Deoarece funcția tubulară (și, prin urmare, procesul de reabsorbție) este păstrată în stadiile incipiente ale bolii, creșterea nivelului de uree va fi foarte târziu.
Echilibrul apei
În stadiile incipiente (stadiile 2 și 3 ale BCR), hiperfuncția nefronelor reziduale descrise mai sus duce la producerea de urină diluată, cu o greutate specifică mică (mai mică de 1020). Un răspuns redus la hormonul antidiuretic (ADH) de către tubul colector este, de asemenea, responsabil pentru acest fenomen. Mulți pacienți, în această fază, raportează poliurie (creșterea cantității de urină produsă în timpul zilei) și nocturie (producția predominantă de urină și, prin urmare, îndeamnă să urineze , pe timp de noapte).
Între etapele 3 și 4, din cauza epuizării treptate a mecanismelor de compensare, începe să apară o retenție moderată de apă , cu apariția edemului înclinat. Această situație devine și mai evidentă în etapa 5.
Schimbări electrolitice
Sodiul este principalul ion extracelular și traversează liber membrana glomerulară. Cea mai mare parte (peste 99%), în condiții normale, este reabsorbită de tubul. Reabsorbția de sodiu este însoțită de reabsorbția unei cantități izotonice de apă, astfel încât o pierdere excesivă de sodiu duce la o pierdere excesivă de apă și invers. În etapele mai avansate ale CRI, excreția redusă de sodiu poate provoca, pe lângă efectele asupra compartimentului extravascular (edem), și efecte asupra sistemului cardiovascular, cum ar fi hipertensiunea dependentă de sodiu și insuficiența cardiacă congestivă . Cea mai înfricoșătoare complicație a retenției de sare și apă în CRF netratat este edemul pulmonar .
Spre deosebire de sodiu, aproape tot potasiul filtrat este reabsorbit în mod normal la nivelul tubului proximal și al buclei Henle; cu toate acestea, orice exces al acestui ion (datorat, de exemplu, unei supraîncărcări de alimente) poate fi eliminat prin secreție din tubul colector. Acest ultim proces este favorizat de aldosteron . Când filtrarea glomerulară este redusă, potasiul tinde să se acumuleze în corp; în stadii avansate, când funcția tubulară este, de asemenea, compromisă, hiperpotasemia este aproape întotdeauna observată. Acest lucru este deosebit de periculos, deoarece poate declanșa chiar aritmii cardiace fatale.
Efecte asupra echilibrului acido-bazic
Rinichiul joacă un rol fundamental în menținerea echilibrului acido-bazic. În fiecare zi în organism are loc o producție endogenă de acizi, derivând mai ales din catabolismul proteinelor, pentru un total de 50-100 mEq / zi. Rinichiul elimină ionii de hidrogen atât prin secretarea lor directă la nivelul tubului colector sub formă de ioni de amoniu (aciditate netitrabilă), cât și prin reducerea reabsorbției fosfaților (aciditate titrabilă) în tubul proximal; în același loc are loc reabsorbția bicarbonatului , responsabil pentru cel mai important sistem tampon al organismului.
Toate aceste procese sunt compromise în cursul IRC; rezultatul este starea patologică numită acidoză metabolică . Este definită ca o modificare a echilibrului acido-bazic, caracterizată printr-o reducere primară a concentrației plasmatice a bicarbonaților, cu reducerea consecventă a pH-ului sanguin la niveluri sub 7,38. [3]
În stadiile incipiente ale insuficienței renale există o creștere compensatorie a secreției de amoniu de către nefronii care funcționează rezidual; cu toate acestea, atunci când GFR scade sub 50 ml / min, excreția de amoniu este, de asemenea, redusă. Scăderea reabsorbției tubulare a bicarbonatelor contribuie, de asemenea, la dezvoltarea acidozei.
Concentrația plasmatică a bicarbonaților tinde să scadă la niveluri sub 15 mEq / L, dar de obicei nu atinge niveluri extrem de scăzute, deoarece acest tip de acidoză se instalează lent, oferind mecanismelor compensatorii timp pentru a interveni. Excesul de ioni de hidrogen poate fi tamponat din matricea osoasă cu mobilizarea calciului și a fosfaților . Acest lucru contribuie, împreună cu alți factori, la apariția treptată a osteodistrofiei uremice .
Datorită compensării, acidoză metabolică a IRC rămâne asimptomatică pentru o lungă perioadă de timp. Singura modalitate de a diagnostica este de a efectua un gaz de sange analize privind sângele arterial, care vor prezenta întotdeauna o reducere a bicarbonați și, în caz de decompensare, de asemenea , o reducere a pH - ului sângelui. În cele mai grave cazuri de decompensare, pot apărea dispnee (datorită unei încercări de compensare a plămânului, care încearcă să elimine acizii sub formă de CO 2 ), slăbiciune musculară, neuropatii periferice, ritm și tulburări de contractilitate cardiacă; în cazuri particulare, în prezența patologiilor concomitente sau a tratamentului cu medicamente precum metformina , poate duce la șoc și comă .
Alterări ale metabolismului calciu-fosfor
Funcțiile rinichiului, așa cum am menționat anterior, includ activarea vitaminei D (colecalciferol) introdusă odată cu dieta. Acesta este mai întâi metabolizat de ficat în hidroxicolecalciferol (25-OH-D 3 ), apoi în rinichi suferă hidroxilare suplimentară care îl transformă în forma sa activă (dihidroxicolecalciferol sau 1,25-OH-D 3 ). Funcțiile vitaminei D active constau în promovarea absorbției calciului în intestinul subțire și a depunerii acestuia în os. În consecință, o reducere a vitaminei va provoca o tendință la hipocalcemie . Vitamina D îmbunătățește, de asemenea, acțiunea în rinichi a hormonului paratiroidian (PTH), un hormon produs de glandele paratiroide , care este, de asemenea, responsabil pentru menținerea calciului. Hormonul paratiroidian acționează asupra tubului proximal favorizând reabsorbția calciului și mărind excreția fosfaților; acționează și asupra osului prin promovarea mobilizării calciului sub formă de hidroxiapatită și stimulează activarea renală a vitaminei D. În condiții normale, vitamina D și hormonul paratiroidian acționează sinergic pentru a menține stabilitatea calciului plasmatic.
În insuficiența renală cronică, producția de vitamina D și, prin urmare, calcemia, tinde să fie redusă. În același timp, reducerea progresivă a GFR duce la o excreție urinară redusă de fosfat, rezultând o creștere a nivelurilor plasmatice ale acestei substanțe. Reducerea calciului plasmatic și creșterea fosfatului stimulează producția de hormon paratiroidian; aceasta reprezintă o încercare de reechilibrare a celor doi ioni prin reglarea excreției lor renale. Se instituie astfel un hiperparatiroidism secundar. În CKD moderată, creșterea PTH reușește în continuare să compenseze modificările metabolice; odată cu reducerea GFR la mai puțin de 30 ml / min (stadiul 4), încep să apară hipocalcemia și hiperfosfatemia.
Osteodistrofia renală
Acesta este modul în care este definit setul de modificări ale metabolismului osos și mineral asociate cu CKD. Cei doi factori principali responsabili sunt hiperparatiroidismul secundar și modificările metabolismului vitaminei D, dar epuizarea fosfaților din os contribuie, de asemenea, la compensarea acidozei metabolice. Mai mult, odată cu progresul bolilor renale, acumularea de toxine uremice și deficitul de vitamina D duc la o rezistență a scheletului la acțiunea hormonului paratiroidian. Aceste alterări agravează hipocalcemia, contribuie la hiperparatiroidism și la apariția și evoluția leziunilor osoase. Principalele manifestări clinice ale osteodistrofiei renale includ [4] :
- Osteita fibroasă : este cea mai frecventă dintre patologiile osoase asociate cu BCR și patogeneza sa este strâns legată de hiperparatiroidism. Se caracterizează printr-un exces de resorbție osoasă de către osteoclaste , care sunt crescute ca număr. Radiologic sunt vizibile eroziuni subperiostali ale falangelor proximale sau distale ale degetelor. Într-un stadiu mai avansat, eroziunile pot afecta și craniul , cu zone alternante de resorbție și altele de îngroșare osoasă, ceea ce le conferă un aspect radiologic de „sare și piper”.
- Osteomalacia : este consecința unei calcificări modificate a osului, care implică o creștere a țesutului osteoid ne-mineralizat pe suprafața trabeculelor și o extindere redusă a frontului de calcificare. Debutul acestei patologii este favorizat de acumularea de aluminiu , conținută în unele lianți de fosfor administrați pacienților cu CRF. Zonele de slăbire (benzi radiolucente în osul cortical) sunt tipice radiologic.
- Boala osoasă adinamică [3] : similară cu osteomalacia, spre deosebire de aceasta din urmă, nu este asociată cu intoxicația cu aluminiu, ci cu utilizarea terapeutică excesivă a derivaților de vitamina D. Se caracterizează printr-o formare redusă de trabecule osoase datorită rezistenței osului la acțiunea PTH în prezența nivelurilor normale sau reduse (prin suprimare farmacologică) a acestui hormon.
- Osteoscleroza : rară, afectează în principal corpurile vertebrale , pelvisul și craniul; caracterizată printr-o creștere a masei osoase datorată unei creșteri a grosimii și a numărului de trabecule ale osului spongios. Cu tehnici radiologice comune, sunt detectate zone cu densitate osoasă crescută.
- Osteoporoza : legată de hipocalcemie, este dificil de distins de osteoporoza senilă obișnuită. Caracterizat prin reducerea volumului osos total.
Calcificări metastatice
Ele apar în general în stadiile avansate ale uremiei, când produsul calciu x fosfor (pentru valori exprimate în mg / dL) este mai mare de 70. Se formează prin precipitarea sărurilor de calciu din țesuturile moi. Uneori sunt microscopice și, prin urmare, demonstrabile numai la examenul histologic, alteori pot fi evidențiate radiologic, dacă nu chiar la examenul fizic. Principalele locuri ale calcificărilor metastatice sunt arterele (în special cele de calibru mediu și mare), țesuturile periarticulare , inima, plămânii și rinichii. În timp ce calcificările viscerale și ale țesuturilor moi, compuse în principal din apatită , tind să regreseze atunci când produsul calciu x fosfor se normalizează, calcificările vasculare (conținând magneziu și pirofosfat) sunt mai puțin solubile și sunt mai greu de regresat. Simptomele legate de calcificări, atunci când sunt localizate pe piele, includ mâncărime ; localizarea la nivelul conjunctivei sau corneei poate provoca în schimb hiperemie conjunctivală, arsură și rupere. La nivelul capsulelor articulare, calcificările metastatice pot genera dureri articulare cu o imagine a „pseudogutei”. Mai grave sunt posibilele consecințe ale calcificărilor vasculare (fenomene ischemice care afectează diferite organe și sisteme) și cardiace (aritmii și insuficiență cardiacă).
Sistem hematopoietic
Printre funcțiile rinichiului se numără producția de eritropoietină , un hormon și factor de creștere care acționează în măduva osoasă prin stimularea producției de eritrocite . Această moleculă este produsă de celule peritubulare, după cum se dovedește de câțiva ani în urma studiilor pe modele animale. [5]
Producția de eritropietină are loc ca răspuns la hipoxie , detectată de un „senzor de oxigen” (probabil o proteină cu grup hem ) în rinichi. O cantitate mică de eritropoietină este, de asemenea, produsă de ficat. [6]
În stadiile avansate ale IRC a existat o anemie normocitică și normocromă, datorată parțial reducerii producției de eritropoietină, parțial scăderii duratei medii de viață a globulelor roșii din circulație pentru hemoliză cronică, datorită acțiunii toxice a metaboliților uremici. Nivelurile de hematocrit, în absența tratamentului, pot fi mai mici de 20%, cu o reducere caracteristică a numărului de reticulocite (precursori ai eritrocitelor).
În plus față de anemie, în CRI se observă de obicei o capacitate chemotactică și fagocitară redusă a celulelor imune, în special macrofage și celule polimorfonucleare ; acest lucru duce la o stare de imunosupresie cu o tendință crescută la infecții. Funcția trombocitelor poate fi, de asemenea, afectată, rezultând o tendință de sângerare. Aceste modificări tind să regreseze cu tratamentul de dializă.
Sistem nervos
La pacienții cu CRF, este posibilă apariția alterărilor sistemului nervos central și periferic. Dintre primele, care apar atunci când GFR scade sub 60 ml / min / m², tulburările cognitive (legate de memorie, atenție și concentrare) și somn sunt frecvente; sunt posibile și tulburări senzoriale, în special ale mirosului și gustului.
Periferice neuropatii sunt mai frecvente, în special , o senzitivomotor polinevrite care se manifestă în sine , cu parestezie , senzație de arsură dureri, reducerea sau dispariția reflexelor tendinoase profunde. Sindromul picioarelor neliniștite este de asemenea frecvent, caracterizat prin mișcări continue ale membrelor inferioare în timpul somnului și cauzate de o viteză redusă de conducere neuromusculară. De asemenea, sistemul nervos autonom poate fi compromis, rezultând modificări ale controlului tensiunii arteriale și disfuncții erectile .
La baza neuropatiei există probabil un bloc de transmitere nervoasă mediat de așa-numitele „toxine uremice” (uree, creatinină, hormon paratiroidian, mioinozitol și β2-microglobulină) [7] . În special, se suspectează că unele molecule cu o greutate moleculară cuprinsă între 300 și 12.000 Da sunt responsabile de neuropatie. Studiile au arătat o încetinire a conducerii nervoase chiar și în segmente neafectate clinic. Atât semnele clinice, cât și modificările instrumentale se corelează cu severitatea IRC și tind să regreseze după transplantul de rinichi.
Modificări metabolice
La pacienții cu boli renale cronice, se observă adesea anomalii ale metabolismului glucidelor , lipidelor și proteinelor . În special, este comun să se găsească o toleranță redusă la carbohidrații cu hiperinsulinemie și hiperglucagonemie ; poate fi răspunsul la rezistența periferică la insulină, adică la o acțiune redusă a acesteia asupra țesuturilor, probabil datorită acțiunii toxinelor uremice. Printre modificările metabolismului lipidic, creșterea trigliceridelor și a VLDL cu reducerea HDL este frecventă . O sinteză crescută a VLDL în ficat, reducerea catabolismului acestora și hiperinsulinemia în sine contribuie la această imagine. Din toate aceste motive și pentru starea de inflamație care însoțește CKD, pacientul uremic este predispus în special la ateroscleroză și, prin urmare, la patologia ischemică, în special la artera coronară . Un alt aspect important de luat în considerare, printre modificările metabolismului, este echilibrul negativ de azot (la care contribuie utilizarea proastă a carbohidraților), care duce frecvent la pierderea masei musculare.
Sistem digestiv
În insuficiența renală severă există adesea simptome legate de acțiunea toxică a metaboliților azotați, cum ar fi anorexia , greața și vărsăturile , gastrita cronică (atrofică sau hipertrofică) cu tendință la ulcer peptic . De asemenea, caracteristica pacienților avansați este halitoza uremică .
Metode de evaluare a funcției renale
Funcția renală este măsurată prin evaluarea ratei de filtrare glomerulară (GFR) exprimată în mililitri pe minut (în engleză GFR, din „Glomerular Filtration Rate”). GFR poate fi estimat prin evaluarea clearance- ului creatininei. Clearance-ul renal al unei substanțe este reprezentat de cantitatea de plasmă care este „curățată” de acea substanță în unitatea de timp de către rinichi. Creatinina este eliminată de rinichi în principal prin filtrare, prin urmare clearance-ul său este în mod normal foarte similar cu cel al GFR. Pentru a măsura direct clearance-ul creatininei, acesta trebuie măsurat în ser și urină colectate pe parcursul a 24 de ore, apoi se aplică formula (unde U = concentrația creatininei în urină, V = volumul urinei și P = creatinina plasmatică). Într - un subiect de sex masculin sănătoși, clearance - ul creatininei poate lua valori între 80 și 120 ml / min , [3] Acesta a fost recent clarificat faptul că , chiar măsura creatininei în sânge numai ne permite de a estima GFR cu aproximație bună și , prin urmare , să spuneți dacă o persoană are insuficiență renală [8] . Clearance-ul creatininei poate fi, de asemenea, estimat cu o formulă (formula Cockroft și Gault) care permite estimarea acestuia, cunoscând doar concentrația de creatinină din sânge, pe lângă greutatea și vârsta pacientului:
- Clearance-ul creatininei (ml / min) = (140 de ani) × Greutatea corporală ideală (Kg) / (72 × creatinina (mg / dL))
această valoare trebuie înmulțită × 0,85 pentru femei. Un calculator online este accesibil pe site-ul Colegiului Medical din Wisconsin [9] .
Formula MDRD [10] permite estimarea GFR mai direct.
unde GFR este exprimat în ml / min / 1,73 . [3]
La copii (cu vârsta sub 18 ani), formula Schwartz este utilizată pentru a estima GFG [11] . Calculul online se poate face pe acest site [12] .
Definiția și etapizarea CKD
Definiția bolii renale cronice utilizate în prezent la nivel mondial este cea propusă în 2002 de Fundația Națională a Rinichilor și exprimată în ghidurile K / DOQI . Arhivat 1 noiembrie 2008 în Internet Archive . (Inițiativa calității rezultatului bolii renale) [13] [14] Stadializarea relativă ia în considerare doi factori: „afectarea rinichilor” și reducerea funcției renale, înțeleasă ca rata de filtrare glomerulară (GFR sau GFR). Primul este diagnosticat pornind de la constatările de laborator (prezența albuminei, proteinelor sau urmelor de sânge de origine renală în urină), instrumentale (modificări patologice identificabile cu ultrasunete renale) sau histologice ( biopsie renală ), persistente timp de cel puțin trei luni. Prezența acestor semne face posibilă diagnosticarea bolii renale cronice chiar și atunci când rata filtrării glomerulare este încă normală sau crescută (stadiul 1) sau doar ușor redusă (stadiul 2).
- Etapa 1 : Semne de afectare a rinichilor cu GFR normal sau crescut (GFR> 90 mL / min)
- etapa 2 : Semne de afectare a rinichilor cu o ușoară reducere a GFR (GFR între 60 și 89 ml / min)
- etapa 3 : Reducere moderată a GFR (GFR între 59 și 30 ml / min)
- etapa 4 : Reducere severă a GFR (GFR între 29 și 15 ml / min)
- Etapa 5 : Insuficiență renală sau uremie în stadiul final (RFG <15 ml / min sau pacient în tratament de substituție)
Această clasificare a fost modificată în 2004 de KDIGO (Boala renală: Îmbunătățirea rezultatelor globale), adăugând o referință la orice terapie de înlocuire în curs, cu adăugarea unei litere T pentru transplant, D pentru dializă.
Clasa 5 se mai numește faza uremică sau terminală, deoarece rinichii și-au pierdut aproape complet funcția. Aceasta implică reținerea apei [15] și a altor substanțe care se acumulează și dau naștere așa-numitului sindrom uremic . Urmează manifestări hematologice, cardiovasculare, nervoase, endocrine, osoase etc. În această fază, pacientul trebuie trimis absolut la nefrolog, care va decide, pe baza tabloului clinic, cea mai bună strategie terapeutică, în special în ceea ce privește pregătirea pentru terapia de substituție a funcției renale ( dializă sau transplant de rinichi ).
Dacă este necesar să se măsoare separat excreția celor doi rinichi (de exemplu în rezultatele bolilor care pot afecta un singur rinichi, cum ar fi pielonefrita cronică), se utilizează scintigrafia renală funcțională. Acest test se bazează pe injecția unui trasor radioactiv format din DTPA etichetat cu Tc 99. Radioactivitatea emisă este măsurată prin intermediul unor detectoare speciale la nivelul rinichilor individuali, permițând calcularea contribuției procentuale la funcția renală.
Având în vedere debutul său lent și gradat și stabilirea mecanismelor de adaptare, insuficiența renală cronică (CRF) poate să nu prezinte niciun simptom până la cele mai avansate etape. Diagnosticul se face apoi pe baza modificărilor testelor de laborator.
Frecvența CKD și principalele sale cauze
Bolile renale cronice și insuficiența renală care reprezintă evoluția acesteia sunt patologii extrem de frecvente. În Statele Unite, studiile NHANES au arătat, în perioada 1999 - 2004 , o prevalență a bolilor renale cronice de 13% din populație, cu o creștere semnificativă comparativ cu perioada 1988 - 1994 . În Europa, frecvența bolii pare să fie ușor mai mică. Anumite boli precum diabetul zaharat și hipertensiunea arterială predispun la insuficiență renală. Prin urmare, subiecții afectați trebuie să își verifice frecvent funcția renală [16] . Cele mai frecvente cauze ale bolilor cronice de rinichi sunt raportate în această secțiune.
Diabetul zaharat
Boala diabetică poate provoca leziuni ale rinichilor acționând direct și deteriorând vasele mici de sânge ale rinichilor ( nefropatie diabetică ) sau poate fi un cofactor (împreună cu hipertensiunea și creșterea grăsimii din sânge) în geneza afectării vasculare arteriosclerotice. Il segno precoce di nefropatia diabetica è la presenza di piccoli quantitativi di albumina nelle urine ( microalbuminuria ). La valutazione della microalbuminuria richiede un test specifico da eseguirsi sulle urine fresche (spot) o, in alternativa, sulla raccolta urinaria delle 24 ore. Controllare frequentemente la microalbuminuria, per le persone diabetiche, è molto importante perché in questa fase una buona correzione dei valori di glicemia può rallentare la progressione del danno renale. È da notare che la microalbuminuria non è conseguente solo al diabete, ma può essere presente anche nei pazienti con danno renale da ipertensione. In una fase successiva può comparire proteinuria evidente anche all'esame urine; in alcuni casi, quando la proteinuria è maggiore di 3-3,5 grammi nelle 24 ore, può insorgere una sindrome nefrosica caratterizzata da edemi , modificazioni delle proteine plasmatiche e alterazioni dei lipidi nel sangue.
Ipertensione Arteriosa
L' ipertensione è una delle più importanti cause di danno vascolare, insieme al diabete e alla dislipidemia (aumento dei grassi nel sangue). Considerato che tutti i vasi sono contemporaneamente esposti al danno esso è di norma generalizzato e si concretizza nel danno arteriosclerotico . Ogni organo risponde con manifestazioni diverse, ad esempio il danno vascolare al cuore causa angina o infarto, al cervello attacchi ischemici o ictus ecc. Quando è colpito il rene si parla di nefro-angio-sclerosi (nefro= rene, angio= vaso, sclerosi= indurimento) e il danno vascolare a carico del rene si manifesta con insufficienza renale cronica e progressiva. La sua gravità e velocità di progressione è direttamente proporzionale ai valori pressori, cioè quanto più è alta la pressione tanto più è grave e rapidamente progressivo il danno vascolare [17] . Per rallentare la progressione della malattia (o insufficienza) renale si consigliano valori pressori di 130/85 mmHg nel soggetto non diabetico e di 120/80 mmHg nel soggetto diabetico. Per il raggiungimento di questi valori nel paziente con insufficienza renale sono particolarmente consigliati i farmaci della famiglia degli ACE inibitori [18] .
Pielonefrite
La pielonefrite è una infezione del tratto urinario che raggiunge la pelvi renale (in greco pyelum ) e che si palesa con febbre, dolori lombari (mono o bilaterali) e disuria (minzione dolorosa). Essa può essere causata da una noxa presente nella pelvi (ad esempio calcoli che impediscono il normale deflusso dell'urina e/o creano lesioni che si infettano) o può raggiungere il rene per via ascendente. In quest'ultimo caso si tratta di una infezione vescicale che, risalendo attraverso l'uretere, si trasmette alla pelvi renale [19] . Un fattore a ciò predisponente è il reflusso vescico-ureterale : di norma l'urina contenuta in vescica viene eliminata durante la minzione attraverso l' uretra e non risale verso la pelvi grazie a delle valvole situate nel punto di unione fra uretere e vescica. In rari casi queste valvole sono incontinenti per un difetto congenito e pertanto consentono a piccoli quantitativi di urina di risalire verso il rene durante la minzione. Questa patologia si chiama reflusso vescico-ureterale ed è la più frequente causa delle pielonefriti croniche che determinano un danno progressivo del rene [20] . Il danno pielonefritico è evidenziabile con ecografia, urografia o UroTac dell'apparato urinario (che rilevano anche la eventuale presenza di calcoli). Il reflusso vescico-ureterale si diagnostica con la cistografia . Raramente una pielonefrite può essere causata anche da infezioni che raggiungono il rene attraverso il sangue (tipico è il caso dell'infezione tubercolare ). Devono invece allertare sulla presenza di reflusso vescico-ureterale le infezioni ricorrenti (più di 5-7 per anno) soprattutto nei bambini [21] .
Malattia policistica renale
Il rene policistico [22] è una malattia ereditaria, cronica e progressiva, caratterizzata dalla formazione di cisti all'interno del rene. Le cisti scompaginano la struttura dell'organo e ne alterano la funzione conducendo a un danno progressivo che evolve lentamente verso l'insufficienza renale terminale. Esistono due forme di rene policistico: il rene policistico dell'adulto (ereditato con tratto mendeliano dominante) e il rene policistico infantile (ereditato come tratto mendeliano recessivo). Il primo è di gran lunga il più frequente ed è generalmente meno grave. Nella famiglia della persona malata si trovano di norma altri familiari con la stessa malattia. L'età in cui essa si manifesta e quella in cui compare l'insufficienza renale terminale variano notevolmente; infatti esistono forme che conducono all'insufficienza renale in età giovanile e forme più lente che vi conducono in età molto avanzata, o addirittura evolvono così lentamente che la persona che ne è affetta non sviluppa mai una insufficienza renale terminale [23] [24] . Spesso la malattia è asintomatica, tuttavia qualche volta le cisti si rompono provocando dolore e macroematuria (presenza di sangue visibile nelle urine). Altre volte si infettano, provocando dolore e febbre. La diagnosi si pone con l'ecografia renale e con l'analisi della storia clinica familiare.
Altre nefropatie congenite ed ereditarie
Oltre al rene policisitico esistono molte altre nefropatie congenite ed ereditarie. Fra le meno rare vi è la sindrome di Alport , in cui si associano microematuria, insufficienza renale cronica e progressiva e sordità neurosensoriale per i toni alti. Un danno renale inoltre può essere presente anche in numerose malattie congenite che colpiscono principalmente altri organi, ad esempio la Sindrome di Lesch-Nyhan o altre malattie che comportano accumulo di sostanze per difetti enzimatici congeniti ( tesaurismosi ).
Glomerulonefriti
Le glomerulonefriti sono malattie del rene accomunate dalla presenza di un danno di tipo infiammatorio dei glomeruli. La cause ei sintomi di tali malattie sono tuttavia sono molto eterogenei. Fra i segni clinico-laboratoristici più comuni si ricordano:
- Presenza di sangue nelle urine, visibile a occhio nudo (macroematuria) o rilevabile soltanto all'esame chimico-enzimatico delle urine (microematuria).
- Presenza di proteine nelle urine ( proteinuria ) in quantità variabile, fino a diversi grammi nelle 24 ore.
- Ipertensione arteriosa.
- Edemi.
- Insufficienza renale acuta, subacuta o cronica.
Spesso questi segni sono associati nei quadri della sindrome nefritica e della sindrome nefrosica. Nessuno fra questi è specifico per un particolare tipo di glomerulonefrite; per la diagnosi di certezza è necessario eseguire una biopsia renale . Le glomerulonefriti possono avere andamento acuto (la più comune in tal senso è quella post-infettiva da streptococco) o cronico (come ad esempio la nefropatia a depositi di IgA o nefropatia di Berger). Esse si dicono primitive quando interessano unicamente o principalmente il rene, come la nefropatia di Berger. Si definiscono invece secondarie le glomerulonefriti conseguenti a patologie che interessano altri organi o l'intero organismo (malattie sistemiche); un esempio è costituito da malattie autoimmuni come il lupus eritematoso sistemico ).
Ostruzione cronica delle vie escretrici
L'ostruzione delle vie escretrici può essere causata da alterazioni anatomiche congenite od acquisite (per lo più calcolotiche o neoplastiche). Fra le cause di ostruzione congenita vanno ricordate:
- La sindrome del giunto pielo ureterale ( stenosi (restringimento) della zona di passaggio fra pelvi renale e uretere, per lo più congenita)
- Stenosi od ostruzione dell'uretere (il più spesso da valvole utererali congenite)
Queste due alterazioni possono essere mono o bilaterali. Nel primo caso il rene che non ne è affetto compensa la funzione del rene con l'ostruzione e non si ha compromissione delle funzione renale, ma il rene affetto subisce un danno progressivo che ne compromette la funzionalità. Ovviamente si ha una compromissione della funzionalità renale solo nel caso di stenosi od ostruzioni bilaterali.
Le ostruzioni acquisite possono essere dovute a calcoli . Questi possono ostruire totalmente o parzialmente il giunto pielo ureterale o l'uretere. La condizione può essere asintomatica o causare una colica renale . Ostruzioni simili possono essere causate da tumori delle vie urinarie o, molto più frequentemente degli organi vicini che comprimono o inglobano gli ureteri. Una causa non rara di stenosi dell'uretere, spesso bilaterale e che comporta insufficienza renale cronica, è la fibrosi retroperitoneale .
- Ostruzione dovuta ad aumento di volume della prostata spesso causata da iperplasia prostatica benigna.
- Ostruzione dovuta a compressione meccanica da parte di prolasso degli organi pelvici, di norma conseguente a prolasso dell'utero .
In tali casi la difficoltà a svuotare la vescica condiziona un danno meccanico e/o infettivo cronico dei due reni che ne compromette progressivamente la funzionalità.
- ostruzione dell' uretra (da valvole uretrali congenite, stenosi acquisite, o più raramente altre cause).
La diagnosi di tali patologie ostruttive si pone con ecografia od urografia (più raramente Uro-TAC) e la terapia è chirurgica (frequentemente chirurgia laparoscopica o endoscopica ).
Cause più rare di malattia renale cronica
Sebbene la gran maggioranza dei casi di malattia renale cronica riconosca una della cause su menzionate esistono altre cause di danno renale. Fra queste citiamo alcune infezioni (ad esempio quella da Mycobacterium tuberculosis (nefropatia tubercolare) e ancora il danno tossico da farmaci e in particolare da FANS , farmaci citotossici , ma anche litio , antibiotici, ciclosporina , ecc.
Terapia
Il primo passo nel trattamento della IRC è identificare la causa che l'ha determinata e, se possibile, rimuoverla. Infatti esistono numerose patologie la cui causa è identificabile e rimovibile anche con facilità. Basti pensare alle nefropatie ostruttive in cui la semplice, ma tempestiva, identificazione di un calcolo e la sua frantumazione con onde d'urto, consente di evitare il danno renale che, lasciato a sé, diventa irreversibile. In altri casi la rimozione della causa, pur non determinando un miglioramento della insufficienza renale, ne rallenta l'evoluzione. È questo, ad esempio, il caso delle nefropatie da analgesici e da farmaci nefrotossici in generale, ma soprattutto della malattia diabetica in cui la progressione del danno renale è notevolmente accelerata da un cattivo controllo glicemico.
Tuttavia l'insufficienza renale cronica è una malattia progressiva e il danno frequentemente procede indipendentemente dalla causa che lo ha determinato. Per tale motivo il medico e il paziente devono agire concordemente per mettere in atto tutte le misure necessarie a rallentarne l'evoluzione ea prevenirne (o curarne) le complicanze. Questo approccio consente frequentemente di ridurre il ritmo di progressione dell'IRC (a volte fin quasi arrestarlo) prolungando notevolmente la sopravvivenza renale e consentendo una qualità di vita molto buona.
È stato dimostrato che i pazienti che si rivolgono al nefrologo hanno una minore frequenza di complicanze e la loro funzione renale si riduce più lentamente pertanto frequenti controlli nefrologici sono altamente consigliati. Le linee guida della Società Italiana di nefrologia per la terapia della insufficienza renale cronica [25] prevedono controlli ogni 4 mesi nella IRC moderata, ogni 3 mesi nella IRC severa e ogni 45 giorni quando il filtrato glomerulare si riduce sotto i 15 ml/min ( IRC terminale )
Il trattamento della IRC prevede:
- misure generali per ridurre il ritmo di progressione della insufficienza renale, come le misure dietetiche (vedi avanti)
- trattamento delle complicanze (sovraccarico idrico, alterazioni ossee, anemia, acidosi metabolica etc..)
- preparazione per la terapia sostitutiva ( dialisi o trapianto di rene )
È frequente che le terapie finalizzate a ottenere i primi due elementi coincidano, pertanto gli elementi cardine sono i seguenti: [25] [26]
Mantenimento di una buona pressione arteriosa
La pressione ottimale nel soggetto nefropatico è 130/85 mmHg, ma più bassa 120/75 mmHg in caso di diabete o proteinuria. Oltre i 60 anni i valori salgono a 140/90 mmHg, ma anche in tal caso a una riduzione della pressione sotto tali valori corrisponde una riduzione del rischio cardiovascolare e della velocità di progressione della malattia renale. Per il controllo dell' ipertensione si consiglia, come farmaci di prima scelta, l'utilizzo di ACE inibitori o sartani in quanto questi farmaci, più di altri, si sono dimostrati utili nel rallentamento della evoluzione della insufficienza renale indipendentemente dal loro effetto antipertensivo. Per ottenere un controllo pressorio ottimale a essi possono essere associati altri farmaci antipertensivi e, fra questi, calcio antagonisti , Betabloccanti e, soprattutto, diuretici dell'ansa utili a evitare sovraccarico idrico, specie nelle fasi più avanzate e della IRC, ea mantenere i valori pressori nei limiti richiesti.
Correzione dell'anemia
Questo si ottiene con l'uso di ferro e di fattori eritropoietici con l'obiettivo di mantenere l' emoglobina fra 11 e 12 g/dL: una emoglobinemia in tale range migliora la qualità di vita e riduce il ritmo di peggioramento della malattia.
Misure dietetiche
Esse sono finalizzate a ridurre l'apporto proteico, non necessariamente con l'ausilio di prodotti aproteici, ma con una dieta equilibrata che contenga:
- Proteine 0.6 - 0.7 g/kg/peso ideale [27] , (75% ad alto valore biologico)
- Glucidi 60% delle calorie (zuccheri complessi)
- Lipidi 30% delle calorie
- Calorie > 30-35 Kcal/kg peso ideale /die
Non è noto se la dieta ipoproteica rallenti la progressione della malattia renale, in quanto gli studi in merito sono discordanti anche se una metanalisi di studi randomizzati e controllati ha dimostrato una utilità per questo scopo. [28] In ogni caso la dieta è sicuramente utile nel migliorare il controllo dell'acidosi, dell'anemia, del metabolismo Calcio - Fosforo, nel ridurre i valori di azotemia, fosforemia e PTH. [29]
Con l'ausilio di un nutrizionista o dietista , possono venir alternate 2 tipi di misure dietetiche in modo da garantire maggior variabilità e maggiore disponibilità del paziente a seguire la dieta.
Una dieta a base di cibi glucidici (pasta, pane etc) aproteici e proteine nobili animali contenute nella carne (che può contenere fino al 20% di pr) senza superare la dose giornaliera consigliata.
Un'altra a base di cibi glucidici normali (che possono contenere fino all'11% di proteine) e proteine vegetali (contenute nei legumi). In entrambe non bisogna far mancare verdura e frutta, evitando possibilmente i tipi particolarmente ricchi di potassio come banane, kiwi, albicocche.
L'apporto calorico è di estrema importanza in quanto lo stato tossico conseguente all'insufficienza renale tende a ridurre l'appetito e molti pazienti tendono alla denutrizione. Per tale motivo e per assicurare una riduzione quanto più possibile dell'introito fosforico è utile ricorrere all'uso di prodotti ipoproteici (biscotti, fette biscottate, pane, pasta, farina [30] ). È inoltre necessario moderare l'introito di potassio e quello di sale (non più di 2 grammi al giorno di sale aggiunto agli alimenti).
Correzione delle alterazioni elettrolitiche
Le alterazioni elettrolitiche tipiche della IRC sono:
- iperpotassiemia (si corregge limitando l'apporto dietetico e, ove necessario, con farmaci ( resine a scambio ionico ) che si assumono per bocca e consentono di eliminare il potassio eccesso)
- acidosi (si corregge con la dieta ed eventualmente con l'assunzione di bicarbonato di sodio )
- Iperfosforemia e ipocalcemia si correggono con la dieta e l'uso di supplementi di calcio per lo più come calcio carbonato che oltre ad aumentare la calcemia contribuisce a correggere l'iperfosforemia. Frequentemente è utile anche l'uso di Vitamina D normalmente prodotta dal rene (tramite la seconda idrossilazione), che in caso di IRC è carente, nella sua forma attiva. La correzione di questi disturbi elettrolitici consente di evitare danni ossei tipici della osteodistrofia renale correggendo la sua principale causa, cioè un aumento patologico del paratormone
Correzione della iperlipidemia
La colesterolemie e la trigliceridemia sono frequentemente elevate nei pazienti con IRC. Ciò è causa ed effetto della malattia renale. Inoltre l'iperlipemia aumenta il rischio cardiovascolare . Pertanto è importante mantenere la colesterolemia sotto 195 mg/dL e la trigliceridemia sotto 150 mg/dL con opportuna dieta o con l'utilizzo di farmaci appositi.
Norme igieniche
Cessazione del fumo, attività fisica.
Altri problemi connessi alla IRC
Fra gli altri problemi connessi alla IRC vi sono le alterazioni sessuali. Oltre il 50% degli uomini con IRC hanno disfunzione erettile e le donne frequenti alterazioni mestruali o amenorrea e infertilità. Tali alterazioni possono trovare opportune soluzioni ed è necessario discuterle con il nefrologo.
Un altro importante problema è la gravidanza in pazienti con IRC. In una donna con IRC una gravidanza può peggiorare la funzione renale, il peggioramento può essere transitorio o definitivo, lieve o grave e dipende da numerosi fattori che vanno studiati caso per caso. L'opportunità di affrontare una gravidanza da parte di una paziente con IRC, va pertanto discussa con il nefrologo. L'IRC avanzata (uremia) inoltre aumenta il rischio di interruzione spontanea di gravidanza, parto prematuro, peggioramento definitivo della funzione renale e preeclampsia .
Note
- ^ Linee guida NKF/KDOQI , su kidney.org . URL consultato il 20 ottobre 2011 (archiviato dall' url originale il 13 novembre 2011) .
- ^ LINEA GUIDA: Identificazione, prevenzione e gestione della Malattia Renale Cronica nell'adulto. Gennaio 2012
- ^ a b c d e f FP Schena, FP Selvaggi, L. Gesualdo, M. Battaglia, Malattie del rene e delle vie urinarie , 4ª ed., McGraw-Hill, 2008, ISBN 978-88-386-2397-4 .
- ^ V. Bonomini, A. Vangelista, S. Stefoni, Nefrologia clinica , Esculapio, 1993, ISBN 88-85040-09-8 .
- ^ Lacombe C, Da Silva JL, Bruneval P, Fournier JG, Wendling F, Casadevall N, Camilleri JP, Bariety J, Varet B, Tambourin P. Peritubular cells are the site of erythropoietin synthesis in the murine hypoxic kidney. J Clin Invest. 1988 Feb;81(2):620-3. PubMed PMID 3339134 ; PubMed Central PMCID: PMC329613.
- ^ Lacombe C, Da Silva JL, Bruneval P, Casadevall N, Camilleri JP, Bariety J, Tambourin P, Varet B. Erythropoietin: sites of synthesis and regulation of secretion. Am J Kidney Dis. 1991 Oct;18(4 Suppl 1):14-9. Review. PubMed PMID 1928074 .
- ^ Krishnan AV, Kiernan MC; Medscape. Neurological complications of chronic kidney disease. Nat Rev Neurol. 2009 Oct;5(10):542-51. Epub 2009 Sep 1. Review. PubMed PMID 19724248 .
- ^ Expressing the Modification of Diet in Renal Disease Study equation for estimating glomerular filtration rate with standardized serum creatinine values. Levey AS, Coresh J, Greene T, Marsh J, Stevens LA, Kusek JW, Van Lente F; Chronic Kidney Disease Epidemiology Collaboration.
- ^ Medical College of Wisconsin Archiviato il 17 agosto 2008 in Internet Archive .
- ^ Neprhon Information centre
- ^ Schwartz GJ, Haycock GB Edelmann CM Jr, Spitzer A. A simple estimate of glomerular filtration rate in children derived from body length and plasma creatinine. Pediatrics 1976;58:259-263
- ^ GFR calculator for Children
- ^ NKF guidelines , su kidney.org . URL consultato il 30 giugno 2008 (archiviato dall' url originale il 20 dicembre 2008) .
- ^ K/DOQI Clinical Practice Guidelines for Chronic Kidney Disease: Am.J. Kidney Dis. 39:S1-266, 2002 (suppl 1)
- ^ Edoardo La Porta, Luca Lanino e Marta Calatroni, Volume Balance in Chronic Kidney Disease: Evaluation Methodologies and Innovation Opportunities , in Kidney & Blood Pressure Research , 7 luglio 2021, pp. 1–15, DOI : 10.1159/000515172 . URL consultato il 14 luglio 2021 .
- ^ National Library of Medicine: Medical Encyclopedia
- ^ Linee guida per il trattamento dell'ipertensione , su siia.it . URL consultato il 29 giugno 2008 (archiviato dall' url originale il 14 settembre 2008) .
- ^ ( PDF ) Metanalisi ACE inibitori
- ^ La pielonefrite acuta nella popolazione adulta - C. Rollino
- ^ Medical Encyclopedia:Urinary tract infection - chronic
- ^ Serie Educativa della Società Italiana di Nefrologia Infezioni Urinarie e Reflusso Vescicoureterale nel Bambino
- ^ Medical Encyclopedia Polycystic kidney disease
- ^ Serie Educativa della Società Italiana di Nefrologia - La Nefropatia Policistica - Parte 1
- ^ Serie Educativa della Società Italiana di Nefrologia - La Nefropatia Policistica - Parte 2
- ^ a b Linee Guida per la terapia conservativa dell'insufficienza renale cronica Giornale Italiano di Nefrologia / Anno 20, S-24 2003/pp. S48-S60
- ^ Linee Guida per il trattamento dell'anemia Giornale Italiano di Nefrologia / Anno 20, S-24 2003/pp. S61-S82
- ^ http://www.renalgate.it/antropometria.xls
- ^ Fouque D, Laville M, Boissel JP. Low protein diets for chronic kidney disease in non diabetic adults. Cochrane Database Syst Rev. 2006 Apr 19;(2):. Review.
- ^ Ikizler TA.Dietary protein restriction in CKD: the debate continues. Am J Kidney Dis. 2009 Feb;53(2):189-91
- ^ Foto di piatti confezionati con prodotti ipoproteici
Bibliografia
- V. Bonomini, A. Vangelista, S. Stefoni, Nefrologia clinica , Esculapio, 1993, ISBN 88-85040-09-8 .
- Brenner e Rector, Il rene , vol. 4, Verduci, 1992 [1991] , ISBN 88-7620-238-2 .
- Harrison, Principi di Medicina Interna - Il manuale , 16ª ed., New York-Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3 .
- Pontieri, Russo, Frati, Patologia generale , 3ª ed., Padova, Piccin, 2005, ISBN 88-299-1734-6 .
- Claudio Rugarli, Medicina interna sistematica , 5ª ed., Masson, 2005, ISBN 978-88-214-2792-3 .
- FP Schena, FP Selvaggi, L. Gesualdo, M. Battaglia, Malattie del rene e delle vie urinarie , 4ª ed., McGraw-Hill, 2008, ISBN 978-88-386-2397-4 .
Voci correlate
- Insufficienza renale acuta
- Dialisi peritoneale
- Emodialisi
- Osteodistrofia renale
- Trapianto renale
- Uremia
Altri progetti
-
 Wikimedia Commons contiene immagini o altri file su malattia renale cronica
Wikimedia Commons contiene immagini o altri file su malattia renale cronica
Collegamenti esterni
- Società Italiana di Nefrologia , su sin-italy.org .
- un portale di nefrologia e dialisi con filmati e presentazioni on line , su renalgate.it .
- Calcolatore online del Modification of Diet in Renal Disease , su mdrd.com .
| Controllo di autorità | LCCN ( EN ) sh85112814 · GND ( DE ) 4127098-8 |
|---|