Mezoteliom
| Mezoteliom | |
|---|---|
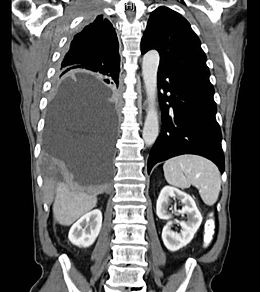 CT scanare a mezoteliomului pleural (masă mare care zdrobește plămânul drept) | |
| Tip | malign |
| Factori de risc | expunerea la azbest |
| Vârsta medie la diagnostic | 40-60 de ani |
| Clasificare și resurse externe | |
| ICD - 9 -CM | ( EN ) 163 |
 Membrane seroase: mezenteliom pleural difuz | |
Mezoteliomul este un neoplasm care provine din mezoteliu , stratul de celule care acoperă cavitățile seroase ale corpului: pleură , peritoneu , pericard , cavitatea vaginală a testiculelor . Aproape toate cazurile de cancer detectate în prezent se referă la mezoteliom pleural și sunt legate de expunerea la fibre de azbest în aer (azbest), cu o latență temporală deosebit de ridicată - cincisprezece până la patruzeci și cinci de ani - și un curs de unu până la doi ani.
Mezoteliomul pleural este deosebit de răspândit în zona Casale Monferrato [1] , în provincia Alessandria , unde, din 1907 până în 1987 [2] , s-a stabilit una dintre principalele plante Eternit din Italia.
La spitalul Alessandria există biorepozitorul „Banca biologică a mezoteliomului malign” care conține treizeci de ani de probe de material biologic [3] și care la începutul anului 2021 a intrat în Nodul Național al Infrastructurii Europene de Cercetare a Biobăncilor și Resurselor BioMoleculare (BBMRI- ERIC).
Epidemiologie și factori de risc
Expunerea poate fi legată de muncă, pentru operatorii angajați în producția și utilizarea industrială a azbestului și a derivaților sau para-ocupațională, pentru utilizarea produselor conexe. Expunerea poate fi, de asemenea, neprofesională, care este legată de utilizarea artefactelor în scopuri nelucrătoare și naturale, în cazurile rare de expunere în locații geologice la prafuri de origine naturală, care nu sunt extrase . Incidența acestui neoplasm pare să crească în întreaga lume, cu aproximativ 2,2 cazuri pe milion de locuitori.
Fiind puternic corelat cu utilizarea industrială a azbestului, interzis în Italia din 1992 [4] și eliminat în unele țări, fiind patologia cu latență temporală ridicată ( perioada de incubație este de aproximativ treizeci de ani), se prevede un nivel constant de incidența bolii în Italia până în 2022 (adică la aproximativ 30 de ani după 1992) și o scădere ulterioară din momentul eliminării factorilor de risc, adică recuperarea siturilor poluate. [5]
Patogenie
S-a descoperit că, în realitate, azbestul în sine nu este un mutagen, ci este capabil să promoveze autofosforilarea EGFR prin activarea căii proliferative RAS - MAP kinază . Apoi, formele cristaline care conțin și fier ( crocidolit ) sunt capabile să catalizeze sinteza speciilor reactive de oxigen care sunt cancerigene.
Alte studii arată, de asemenea, un rol al virusului SV40 care pare să posede doi antigeni implicați în tumorigeneză: un antigen nuclear ( antigen t mic ) capabil să promoveze progresia ciclului celular prin stimularea unor kinaze și a unui antigen mai mare; ( antigenul mare ) capabil să favorizeze crearea mutațiilor și exprimarea factorului de creștere IGF1 . In plus, ambele aceste proteine par a fi capabile de a reprima mai multe tumorale gene supresoare.
Studii recente atribuie genei CDKN2A (inhibitorul de ciclină dependentă de ciclină 2A, o genă găsită pe cromozomul 9 la om), un rol important în patogeneza mezoteliomului pleural malign [6] .
Anatomie patologică
Mezoteliomul apare macroscopic ca o îngroșare a pleurei, în general difuză, mai rar nodulară. Creșterea sa poate duce la obliterarea spațiului pleural și blocajul pulmonar consecutiv; dacă necesită demolare. Apare în trei forme histologice:
- epitelioid,
- sarcomatoid
- bifazic
Clinica
Principalele simptome se suprapun adesea cu alte boli și pot întârzia diagnosticul și constau din: tuse , dureri toracice sau de spate, febră și agravare a dispneei (mai rar anorexie , în cazul mezoteliomului peritoneal și dureri abdominale ). Simptomele sistemice pot include: astenie și stare generală de rău. Cel mai frecvent semn detectabil este revărsatul pleural ; în cazuri mai limitate pot exista și febră și pierderea în greutate .
Diagnostic
Diagnosticul este histologic / radiologic (prin CT ). Mai mult, mezoteliomul este pozitiv pentru calretinină, o proteină de legare a calciului, dependentă de vitamina D, legată de transducția semnalizării celulare dependentă de calciu și în microscopia electronică prezintă microviliți mari și abundenți (spre deosebire de carcinoamele care au puține și mici) . PET nu este recomandat în prezent în efectuarea procesului normal de stadializare, deoarece este mai puțin sensibil decât CT (în afară de pacienții cu tumoare potențial rezecabilă la care trebuie combinat); dar pare a fi util în urmărirea pacienților, deoarece pozitivitatea leziunilor pare să fie corelată cu eficacitatea terapiilor efectuate.
Punerea în scenă
Există mai multe clasificări pentru mezoteliom dezvoltate de diferiți autori de-a lungul timpului:
Butchart (1979)
- limitat la pleura parietală
- invadează peretele mediastinal, organele toracice și / sau ganglionii limfatici toracici
- invadează diafragma , pericardul ajungând la inimă , pleura contralaterală, peritoneul sau organele extratoracale
- prezența metastazelor hematogene la distanță
Brigham (1993)
- limitat în pleura parietală ipsilaterală la zona afectată, pericard, plămân și diafragmă ipsilaterală
- sunt afectate ganglionii limfatici intratoracici și tumora ca etapă 1
- afectarea tumorii extratoracale fără metastaze îndepărtate sau ganglioni limfatici pozitivi în afara pieptului
- prezente metastaze îndepărtate
Sugarbaker (1999)
- tumoră limitată la pleura parietală complet rezecabilă
- la fel ca stadiul 1, dar cu margini de rezecție pozitive sau cu ganglioni limfatici intratoracici implicați
- extinderea locală a oricărui organ mediastinal sau afectarea peritoneală
- metastaze îndepărtate
IMIG (1995, cel mai precis după majoritatea)
T.
1:
- a: limitat la pleura parietală fără implicarea celei viscerale
- b: focare izolate în pleura viscerală
2: este implicată pleura parietală și este prezentă una dintre condițiile de mai jos:
- a implicat diafragma
- a implicat pleura viscerală și extinderea la parenchimul pulmonar
3: tumoare rezecabilă local avansată: întotdeauna implicare ipsilaterală plus condițiile de mai jos:
- a implicat fascia endotoracică
- tumoare complet rezecabilă care implică țesuturile moi și peretele toracic
- implicarea netransmurală a pericardului
4: tumoare avansată nerezecabilă
Nu.
X: ganglioni limfatici metastatici neidentificabili
0: absența metastazelor ganglionare
1: Ganglioni limfatici bronhopulmonari și pulmonari ipsilaterali implicați
2: metastaze la ganglionii limfatici subcarinali sau toracici ipsilaterali (inclusiv mammari interne)
3: implicarea ganglionilor limfatici extinsă dincolo de siturile menționate anterior
M X / 0/1: metastaze la distanță nedetectabile / absente / prezente.
Ultimul sistem are avantajul de a oferi comparații bune între studii și rezultatele clinice, dar:
- între T2 și T3 distincția este minimă în ceea ce privește supraviețuirea
- N este același cu cel al cancerului pulmonar; deoarece nu se știe cum se clasifică această formă, având în vedere prevalența scăzută a bolii; deci toate cazurile cu N pozitiv sunt îmbinate în etapa 3.
Prognoză
Prognosticul este slab [7] .
Prezentând agresivitate și rezistență la terapiile comune, permite o supraviețuire medie de 7,7 luni (deviație standard 1-72) de la momentul diagnosticului . Vârsta cea mai afectată este cuprinsă între 40 și 60 de ani, sexul masculin fiind afectat în 60% din cazuri, în principal din cauza expunerii ocupaționale mai mari a populației relative la cancerigen.
Terapie
Nu există linii directoare precise pentru tratamentul mezoteliomului. În mod frecvent în stadiul 1 și în cazuri limitate de stadiile 2 și 3, se asigură pleurectomie cu decorticare a acesteia sau pleuropneumectomie (pleura și o parte a plămânului implicat sunt îndepărtate) [8] [9] sau, în cazul localizărilor peritoneale , peritonectomie (îndepărtarea peritoneului afectat). La sfârșitul operației, chimioterapie hyperthermic intracavitar ( chemohyperthermia ) [10] [11] [12] poate fi asociată, care constă în spălarea continuă a câmpului de operare cu medicamente chimioterapie la temperaturi ridicate, în scopul de „sterilizare“ zona și reducerea riscului de recidivă. Acest tip de tratament a arătat o creștere a supraviețuirii și a calității vieții și poate fi efectuat atât pentru cavitatea pleurală, cât și pentru cea peritoneală. În etapele mai avansate, terapia chirurgicală nu este indicată, dar radioterapia integrată și chimioterapia sunt utile. În etapa 4 este prevăzută doar paliație [13] ; printre aceste tehnici ne amintim de pleurodeză . Făcând acest lucru, cele 2 foi pleurale sunt aderate prin mijloace chimice, biologice sau mecanice pentru a preveni revărsările și scurgerile de aer. Primele două mijloace acționează provocând eliberarea de IL-8 de către mezoteliul pleural care, prin amintirea granulocitelor neutrofile pentru chemotaxie, determină declanșarea inflamației și eliberarea fibrinei , de aici și amintirea în locul fibroblastelor și reacția de fibroză. cele două foi împreună. Mijlocul cel mai frecvent utilizate pentru a induce acest fenomen este talc (talcage). Această procedură este cea mai bună atât pentru rezultate, cât și pentru costuri reduse. Contraindicațiile procedurii sunt pacientul pe moarte, cu tulburări respiratorii severe, cu aderențe, limfangită carcinomatoasă sau tulburări de coagulare. Eficacitatea este apoi mai mare dacă se face în stadii incipiente, deoarece pleura sănătoasă și plămânul răspund mai bine. Tratamentele care pot fi propuse împotriva durerii constau în analgezice , radioterapie [14] și în special chimioterapie paliativă [15] . Combinația pemetrexed + cisplatină [16] pare a fi cea mai bună, dar ar trebui suplimentată cu vitamina B 12 și folat pentru a preveni mielosupresia . Această terapie este contraindicată la subiecții cu clearance-ul creatininei mai mic de 45 ml / min și, în orice caz, planificarea trebuie făcută de către medicii oncologi cu experiență în această tumoră.
Având în vedere rata ridicată a mortalității acestei forme tumorale, sunt studiate diferite tehnici de terapie țintită [17] [18] [19] , inclusiv una promițătoare cu lurbinectedina, de asemenea, au fost obținute șase rezultate dintr-o cohortă relativ mică [20] .
Notă
- ^ Michela Bonafede, Antonella Granieri și Alessandra Binazzi, Suferință psihologică după un diagnostic de mezoteliom malign într-un grup de pacienți și îngrijitori de la locul prioritar național contaminat din Casale Monferrato , în Revista Internațională de Cercetare a Mediului și Sănătate Publică , vol. 17, n. 12, 17 iunie 2020, DOI : 10.3390 / ijerph17124353 . Adus la 31 iulie 2020 .
- ^ Cazul „ETERNIT” al lui Casale Monferrato , pe meso.ospedale.al.it . Adus 05-12-2019 (arhivat din original la 5 decembrie 2019) .
- ^ bliccathemes, ALESSANDRIA BIOBANK: ÎN REȚEAUA NAȚIONALĂ CA BANCĂ BIOLOGICĂ A MESOTELIOMULUI , pe SS. Antonio e Biagio și Cesare Arrigo Alessandria , 28 ianuarie 2021. Adus pe 2 februarie 2021 .
- ^ Legea nr. 257 din 27 martie 1992 , pe normattiva.it . Adus la 20 septembrie 2015 .
- ^ (EN) Daniela Ferrante, Dario Mirabelli și Stefano Silvestri, Incidența mortalității și mezoteliomului printre minerii de azbest crizotil din Balangero, Italia: Un studiu de cohortă , în Jurnalul American de Medicină Industrială, vol. 63, nr. 2, 2020-02, pp. 135-145, DOI : 10.1002 / ajim.23071 . Adus la 15 ianuarie 2020 .
- ^ Federica Pezzuto, Francesca Lunardi și Luca Vedovelli, P14 / ARF- Mesoteliom pleural malign pozitiv: un fenotip cu micromediul imunitar distinct , în Frontiers in Oncology , vol. 11, 2021, p. 653497, DOI : 10.3389 / fonc.2021.653497 . Adus la 31 mai 2021 .
- ^ (EN) A Bille, Okiror L, L Harling, Pernazza F, Muzio A, Roveta A, Analiza supraviețuirii pacienților cu mezoteliom pleural malign metastatic , de cancer, 27 mai 2020. Accesat 3 iunie 2020.
- ^ Trevor Williams, Hadi Duraid și Sydeaka Watson, Pleurectomie extinsă și decorticare pentru mezoteliom pleural malign este o chirurgie citoreductivă eficientă și sigură la vârstnici , în Analele chirurgiei toracice , vol. 100, nr. 5, 2015-11, pp. 1868-1874, DOI : 10.1016 / j.athoracsur.2015.04.151 . Adus la 31 mai 2021 .
- ^ (EN) Loïc Lang-Lazdunski, Andrea Bille și Rohit Lal, Pleurectomia / decorticarea este superioară Pneumonectomiei extrapleurale în managementul multimodal al pacienților cu mezoteliom pleural malign , în Journal of Thoracic Oncology, vol. 7, nr. 4, 2012-04, pp. 737-743, DOI : 10.1097 / JTO.0b013e31824ab6c5 . Adus la 15 ianuarie 2020 .
- ^ ncbi.nlm.nih.gov , https://www.ncbi.nlm.nih.gov/pubmed/23434448 .
- ^ (EN) Giuseppe Marullo, Cristiano Breda și Paul Fontana, Pleurectomie-decorticare pentru mezoteliom pleural malign: sunt diferite tehnici chirurgicale asociate cu rezultate diferite? Rezultatele unui studiu multicentric † , în European Journal of Cardio-Thoracic Surgery , vol. 52, nr. 1, 2017-07, pp. 63-69, DOI : 10.1093 / ejcts / ezx079 . Adus la 15 ianuarie 2020 .
- ^ (EN) Marcello Carlo Ambrogi, Bertoglio Pietro și Vittorio April, Diafragmă și chirurgie de conservare a plămânilor cu chimioterapie hipertermică pentru mezoteliom pleural malign: o experiență de 10 ani , în The Journal of Thoracic and Cardiovascular Surgery, vol. 155, nr. 4, 2018-04, pp. 1857–1866.e2, DOI : 10.1016 / j.jtcvs.2017.10.070 . Adus la 15 ianuarie 2020 .
- ^ (EN) Metaxas Y, M Früh, Eboulet Ei, Grosso F, M Pless, Zucali Pa, Lurbinectedin ca a doua sau paliativă a treia linie de terapie în mezoteliomul pleural malign: un internațional, multi-centru, cu un singur braț, faza II Trial (SAKK 17/16) , în Annals of oncology: jurnal oficial al Societății Europene pentru Oncologie Medicală , aprilie 2020. Accesat la 3 iunie 2020 .
- ^ (EN) E. Parisi, A. Romeo și A. Sarnelli, Iradiere cu doză mare după pleurectomie / decorticare sau biopsie pentru tratamentul mezoteliomului pleural , în Cancer / Radiotherapie, vol. 21, n. 8, 2017-12, pp. 766-773, DOI : 10.1016 / j.canrad.2017.05.007 . Adus la 15 ianuarie 2020 .
- ^ Y. Metaxas, M. Früh și EI Eboulet, Lurbinectedin ca terapie paliativă a doua sau a treia linie în mezoteliomul pleural malign: un studiu internațional, multi-centru, cu un singur braț, faza II (SAKK 17/16) , în Annals of Oncology: Jurnalul Oficial al Societății Europene pentru Oncologie Medicală , vol. 31, n. 4, 04 2020, pp. 495-500, DOI : 10.1016 / j.annonc.2019.12.009 . Adus la 31 iulie 2020 .
- ^ (EN) Ceresoli Gl, Aerts Jg, Dziadziuszko R, Ramlau R, Cedres S, van Meerbeeck Jp, Tumor Treating Fields combinate cu Pemetrexed și Cisplatin sau Carboplatin ca tratament de primă linie pentru mezoteliom pleural malign nerezecabil (STELLAR): Un multicentru , Proces de fază 2 cu un singur braț , pe Lancet. Oncologie , 2019 decembrie. Accesat la 3 iunie 2020 .
- ^ Giorgio V. Scagliotti, Rabab Gaafar și Anna K. Nowak, Nintedanib în combinație cu pemetrexed și cisplatină pentru pacienții naivi cu chimioterapie cu mezoteliom pleural malign avansat (LUME-Meso): un studiu de fază 3 dublu-orb, randomizat, controlat cu placebo , în The Lancet. Medicina respiratorie , vol. 7, nr. 7, 07 2019, pp. 569-580, DOI : 10.1016 / S2213-2600 (19) 30139-0 . Adus la 31 iulie 2020 .
- ^ Federica Grosso, Annalisa Roveta și Giulia Gallizzi, Managementul mezoteliomului pleural recurent: rechallenge de succes cu nintedanib în combinație cu chimioterapie , în Clinical Case Reports , vol. 6, nr. 10, 2018-10, pp. 2000-2004, DOI : 10.1002 / ccr3.1775 . Adus la 31 iulie 2020 .
- ^ Giovanni L. Ceresoli, Joachim G. Aerts și Rafal Dziadziuszko, Tumor Treating Fields în combinație cu pemetrexed și cisplatină sau carboplatină ca tratament de primă linie pentru mezoteliomul pleural malezant nerezecabil (STELLAR): un studiu de fază 2 multicentric, cu un singur braț , în Lanceta. Oncologie , vol. 20, nr. 12, 12 2019, pp. 1702-1709, DOI : 10.1016 / S1470-2045 (19) 30532-7 . Adus la 31 iulie 2020 .
- ^ (EN) Dario P. Anobile, Paolo și Francesca Bironzo Picca, Evaluarea eficacității preclinice a mezoteliomului pleural malign în Lurbinectedin în cancer, vol. 13, n. 10, 2021/1, p. 2332, DOI : 10.3390 / cancer 13102332 . Adus la 12 mai 2021 .
Elemente conexe
Alte proiecte
-
 Wikționarul conține dicționarul lema « mezoteliom »
Wikționarul conține dicționarul lema « mezoteliom » -
 Wikimedia Commons conține imagini sau alte fișiere despre mezoteliom
Wikimedia Commons conține imagini sau alte fișiere despre mezoteliom
linkuri externe
- ( EN ) Mesoteliom / Mezoteliom (altă versiune) , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Registrul național al mezoteliomului , pe ispesl.it . Adus la 2 ianuarie 2008 (arhivat din original la 22 ianuarie 2008) .
- Grupul italian de mezoteliom , pe gime.it.
- Asociația Italiană a Cercetării Cancerului - Mezoteliom , pe airc.it.
- ( EN ) Lista ghidurilor [ link întrerupt ] Centrul de informare pentru mezoteliom.
- NEVER ALONE Arhivat 5 decembrie 2019 în Arhiva Internet . Proiect LILT Alessandria realizat de Spitalul Național SS. Antonio și Biagio și C. Arrigo în colaborare cu ASL AL datorită contribuției Fundației Buzzi Unicem Onlus.
- Asociația familiei victimelor azbestului
| Clasificare și resurse externe (EN) | ICD-10-CM : C45 ; OMIM : 156240 și 156240 ; MeSH : D008654 ; Boli DB : 8074 ; MedlinePlus : 000115 ; Ceasurile : 280367 ; |
| Controlul autorității | Tesauro BNCF 53993 · LCCN (EN) sh85083965 · BNF (FR) cb12520796h (data) · NDL (EN, JA) 01.166.679 |
|---|
