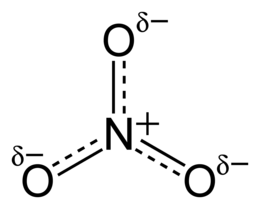
Nitrat
| Ion nitrat | |||
|---|---|---|---|
| Numele IUPAC | |||
| nitrat | |||
| Caracteristici generale | |||
| Formula moleculară sau brută | NU 3 ⁻ | ||
| numar CAS | |||
| PubChem | 943 | ||
| DrugBank | DB14049 | ||
| ZÂMBETE | [N+](=O)([O-])[O-] | ||
| Informații de siguranță | |||
Ionul nitrat este un anion poliatomic important. Are formula NO - 3 și numere de oxidare +5 pentru azot și -2 pentru fiecare atom de oxigen . Este redus la amoniac prin aliajul Devarda , format dintr-un amestec de pulberi metalice.
Prezenţă
NO - 3 ion vine de ionizare completă a acidului azotic HNO3 sau nitrați , atunci când se dizolvă în apă . Acest lucru se face conform următoarei formule:
Deoarece acidul azotic este un acid puternic , ionul nitrat, care constituie baza sa conjugată , are numai proprietăți bazice foarte scăzute. Din acest motiv, sărurile sale cu alcaline pământoase și metale de tranziție, care sunt toate solubile în apă și care se numesc nitrați , au adesea un pH acid în soluție apoasă . O excepție este cazul în care partea cationică este acidul conjugat al unei baze puternice.
Săruri
Nitrații, compuși în care este prezent ionul nitrat, sunt sărurile acidului azotic .
Toate sunt foarte solubile în apă și din acest motiv pot fi găsite doar pe scoarța terestră în teritorii extrem de aride. Cele mai frecvente în natură sunt azotatul de sodiu și azotatul de potasiu .
Săruri principale
Cele mai renumite și mai importante săruri ale acidului azotic sunt următoarele:
- Azotat de aluminiu (Al (NO 3 ) 3 ).
- Azotat de amoniu (NH 4 NO 3 ).
- Azotat de argint (AgNO 3 ).
- Azotat de potasiu (KNO 3 ).
- Azotat de plumb (Pb (NO 3 ) 2 ).
- Azotat de stronțiu (Sr (NO 3 ) 2 ).
- Thaliu nitrat (TlNO 3).
- Azotat de zinc (Zn (NO 3 ) 2 ).
Analiza umedă
În analiza umedă procedăm prin reducerea nitraților la nitriți și reacția ulterioară a acestora cu reactivul Griess .
O soluție alcalină a probei este tratată cu acid acetic până când pH - ul său este de 4-5 și apoi se adaugă zinc metalic, ceea ce reduce nitrații la nitriți. Prin adăugarea reactivului Griess, se produce o culoare roz tipică în prezența nitriților.
O alternativă la testarea prezenței nitraților este analiza inelului maro .
Aplicații și importanță
Ionul NO - 3 și unele dintre sărurile sale au o importanță fundamentală atât pentru natură, cât și pentru om; este de fapt esențial pentru metabolismul plantelor și, prin urmare, pentru menținerea tuturor ecosistemelor . Este, de asemenea, un îngrășământ excelent, mai ales atunci când este inclus în azotatul de amoniu NH 4 NO 3 , una dintre sărurile sale, datorită conținutului ridicat de azot .
În secolul trecut, sarea AgNO 3 , sau azotatul de argint , a fost folosită pentru studiul și crearea primelor echipamente fotografice și este încă folosită pentru a testa potabilitatea apei de la robinet. Azotatul de argint este, de asemenea, utilizat ca catalizator în reacția care stă la baza funcționării testului de alcool. În cele din urmă, acest ion este , de asemenea , hrănirea așa-numitele bacterii denitrificatoare care au rolul biologic de producere a azotului molecular N2 din ea.
Mai multe categorii de nitrați sunt utilizate de industria alimentară ca conservanți , coloranți și antioxidanți din categoria E. Acestea sunt indicate pe etichete cu inițialele E251 și E252. Utilizarea lor este practic obligatorie pentru carnea crudă și se datorează în principal faptului că nitrații sunt în prezent singura alternativă cunoscută pentru a contracara germinarea sporilor de Clostridium botulino , una dintre cele mai grave forme de infecție transmisă de alimente cu infecție mortală. poate fi prevenit doar.
Cercetarea de bază pentru alte forme este interzisă în laboratoarele nespecializate de contact cu studenții, cum ar fi universitățile, limitând în continuare centrele disponibile.
Un al doilea scop este de a forma și stabiliza culoarea roșie a cărnii, în special a șuncăi fierte. Acest scop este secundar, deoarece poate fi obținut și cu utilizarea vitaminei C sau a unor contoare gastronomice speciale cu tipuri de sticlă care reflectă în mod adecvat lumina. În unele cazuri, stabilizarea culorii necesită cantități chiar mai mari decât cele strict necesare pentru conservarea sau prevenirea botulismului.
Carnea, cum ar fi apa potabilă și multe legume, conține în mod natural nitrați și nitriți. Nitrații sunt o componentă a salpetrului utilizat la prepararea cârnaților și sunt folosiți în cantități mai mici pentru a spori culoarea și aroma cărnii.
Nitrații sunt prezenți și în alimentele de origine vegetală, în special datorită îngrășămintelor.
Nitrații pot fi transformați în nitriți în timpul preparării și depozitării alimentelor sau în timpul digestiei prin acțiunea anumitor bacterii nitrificante într-un mediu umed, slab luminat și acid. Aminele sunt prezente în produsele alimentare care conțin proteine ( carne , mezeluri , brânzeturi ). La fel ca nitriții, în urma anumitor reacții într-un mediu acid la pH 3,2, pH-ul stomacului cu acid clorhidric între sucurile gastrice este cuprins între 1 și 2, pot forma nitrozamine, clasificate ca fiind cancerigene.
Nitrații se transformă în acid azotat și apoi în nitriți în microbiota și saliva umane . Printr-o serie de reacții într-un mediu acid devin nitrozamine , dovedite cancerigene . Transformarea nitraților în nitriți este catalizată de nitrat reductaza, o enzimă prezentă în microbiota umană a cavității bucale și a lumenului intestinal.
Cu toate acestea, vitamina C (acid ascorbic) și vitamina E (alfa-tocoferol) sunt capabile să inhibe conversia nitriților în nitrozamine, transformându-le [ care este obiectul? ] în monoxidul de azot , important pentru vasodilatație și controlul agregării plachetare, deci cu efect antitrombotic; în alte cazuri, reacția chimică produce acid azotic, o substanță mutagenică cunoscută.
Limitele sunt stabilite prin Directiva 2006/52 / CE , implementată în Italia prin Decretul ministerial de sănătate din 27 februarie 2008, care depășește Decretul ministerial 209 din 27 februarie 1996 și nu a fost modificat prin Regulamentul 1129/2011. În ciuda pericolului documentat, utilizarea acestuia nu se limitează în principiu la funcția de antibotulină sau conservantă, ci este extinsă și la proprietățile antioxidante și colorante ale nitraților, crescând doza posibilă pentru fiecare produs cu aceleași limite maxime. Cu toate acestea, limitele maxime legale, cel puțin pentru nitritul de sodiu stabilit la 50-100 mg / kg, coincid deja de fapt cu cantitatea minimă necesară pentru siguranța alimentelor [1] . Utilizarea este permisă de lege și în produsele DOC și IGP, cu excepția adoptării diferitelor alegeri și reglementări de către producătorii individuali.
Notă
- ^ Grupul științific privind pericolele biologice la EFSA, Jurnalul EFSA (2003), 14, 1-13
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe nitrat
Wikimedia Commons conține imagini sau alte fișiere pe nitrat
linkuri externe
- Nitrato , pe Treccani.it - Enciclopedii online , Institutul Enciclopediei Italiene .
- Nitrat , pe Vocabolario Treccani , Institutul Enciclopediei Italiene .
- ( EN ) Nitrat , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Efectele secundare ale nitraților , pe Cibo360.it .
| Controlul autorității | Thesaurus BNCF 37237 · GND (DE) 4115398-4 |
|---|