Nitrobenzen
| Nitrobenzen | |
|---|---|
| Numele IUPAC | |
| nitrobenzen | |
| Abrevieri | |
| Ph-NO 2 | |
| Denumiri alternative | |
| nitrobenzol | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 6 H 5 NO 2 |
| Masa moleculară ( u ) | 123.11 |
| Aspect | lichid galben |
| numar CAS | |
| Numărul EINECS | 202-716-0 |
| PubChem | 7416 |
| ZÂMBETE | C1=CC=C(C=C1)[N+](=O)[O-] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1.20 |
| Constanta de disociere a acidului (pKa) la 273 K. | 4.0 |
| Solubilitate în apă | 1,90 g / l la 293 K |
| Temperatură de topire | 6 ° C (279 K) |
| Temperatura de fierbere | 211 ° C (484 K) |
| Presiunea de vapori ( Pa ) la 293 K. | 30 |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | 12.5 |
| C 0 p, m (J K −1 mol −1 ) | 185,8 |
| Informații de siguranță | |
| Punct de flacără | 88 ° C (361 K) |
| Temperatură de autoaprindere | 480 ° C (753 K) |
| Simboluri de pericol chimic | |
   | |
| Pericol | |
| Fraze H | 351 - 361 - 301 - 311 - 331 - 372 - 411 |
| Sfaturi P | 273 - 281 - 314 [1] |
Nitrobenzenul este un compus nitro aromatic ; la temperatura camerei este un lichid galben uleios cu miros caracteristic, care amintește de migdale .
Structura sa este aceea de benzen , în care un hidrogen atom a fost înlocuit cu o grupare nitro -NO2 grup .
fundal
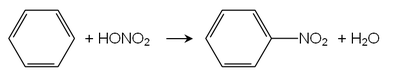
Nitrobenzenul a fost produs în 1847 de chimistul britanic Charles Mansfield , prin reacția benzenului cu acidul azotic . [2]
Producție
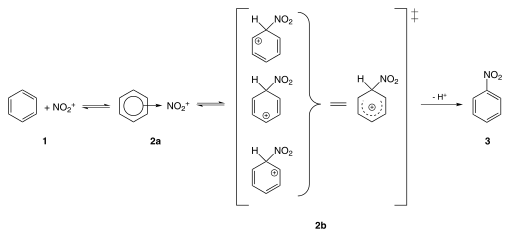
Nitrobenzenul este produs prin nitrarea benzenului, urmând mecanismul de reacție descris în figura următoare.
Ionul NO 2 + necesar pentru sinteza nitrobenzenului poate fi obținut pornind de la acidul azotic , căruia îi corespunde următoarea reacție:
- Pentru a se obține ionul NO 2 + , reacția trebuie catalizată prin intermediul unui acid care are o anumită valoare specifică pKa diferită de cea a acidului azotic în sine.
Reactivitate
Acesta suferă reacții de substituție electrofilă în principal în poziția meta și în condiții mai drastice decât cele adoptate în mod normal pentru a face reacția benzenului, deoarece grupul nitro dezactivează inelul benzenic pentru substituția electrofilă.
Utilizări
Este utilizat în principal ca intermediar în producția de anilină și derivații săi, dar poate fi utilizat atât ca solvent , cât și ca agent de oxidare ușor. Este, de asemenea, utilizat în producția de substanțe izolante, vopsele, lustruire pentru pantofi sau suprafețe, adesea pentru a masca mirosurile neplăcute.
Nitrobenzenul nu are uz terapeutic, dar cu numele de esență Mirbano este utilizat, în locul esenței migdalelor amare (aldehida benzoică), în ambalajul lichiorurilor, săpunurilor, produselor cosmetice, cerurilor pentru lustruirea podelelor etc. și deci poate provoca intoxicație.
În chimia fină este utilizat în sinteza acetaminofenului , un analgezic .
Notă
- ^ foaie informativă nitrobenzen pe IFA-GESTIS Arhivat 16 octombrie 2019 la Arhiva Internet .
- ^ Dicționar complet de biografie științifică .
Bibliografie
- ( EN ) Dicționar complet de biografie științifică - "Mansfield, Charles Blachford" , 2008.
- ( EN ) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chimie , ediția a IV-a, Wiley-VCH, 2003, pp. 375-376, ISBN 3-527-30578-5 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe nitrobenzen
Wikimedia Commons conține imagini sau alte fișiere pe nitrobenzen
linkuri externe
- ( EN ) Nitrobenzen , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | Tesauro BNCF 37371 · LCCN (EN) sh97009279 · GND (DE) 4171938-4 · BNF (FR) cb14619564r (dată) · NDL (EN, JA) 00.576.025 |
|---|