Nitron
Această intrare sau secțiune despre sistematica organică și ionică nu citează sursele necesare sau cei prezenți sunt insuficienți . |
| Ion nitroniu | |||
|---|---|---|---|
| Numele IUPAC | |||
| Dioxid de azot (1+) [1] | |||
| Caracteristici generale | |||
| Formula moleculară sau brută | NU 2 + | ||
| Masa moleculară ( u ) | 46,01 g mol -1 | ||
| numar CAS | |||
| PubChem | 3609161 | ||
| ZÂMBETE | [N+](=O)=O | ||
| Proprietăți termochimice | |||
| S 0 m (J K −1 mol −1 ) | 233,86 JK −1 mol −1 | ||
| Informații de siguranță | |||
| Simboluri de pericol chimic | |||
| | |||
| Atenţie | |||
Ionul nitroniu este un cation cu formula chimică N O 2 + este în general foarte instabil și produs prin îndepărtarea unui electron din dioxidul de azot paramagnetic sau prin protonarea acidului azotic urmată de eliminarea unei molecule de apă.
Nu este suficient de stabil pentru a exista în condiții normale, dar este utilizat pe scară largă ca electrofil în nitrarea substraturilor aromatice, precum și a altor substanțe. Ionul este generat, atunci când este util, prin amestecarea acidului sulfuric ( acid mai puternic) și a acidului azotic (care va acționa ca bază) conform acestei reacții:
- H 2 SO 4 + HNO 3 → HSO 4 - + H 2 O + –NO 2 → HSO 4 - + NO 2 + + H 2 O
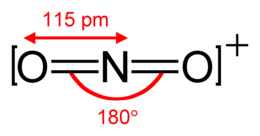
Ionul nitroniu este conținut în pentoxidul de dinitrogen ( N 2 O 5 ) în stare solidă, care este un compus ionic format din ioni nitroniu și ioni nitrați , în timp ce în stare lichidă sau în soluție de solvenți non-protici (CCl 4 , CHCl 3 , POCl 3 și altele asemenea) și în stare gazoasă sau are formă moleculară (O 2 NO-NO 2 ). Ionul nitroniu este izoelectronic cu dioxid de carbon CO 2 , cu oxid azotat N 2 O și cu ionul metaborat BO 2 - și, ca și în acestea, atomul central este hibridizat sp și structura O - N Sau este liniar cu unghiuri de 180 °.
Ionul care conține aceiași atomi, dar încărcat negativ, NO - 2 , este ionul nitrit .
Compuși ionici și moleculari
Există săruri stabile (compuși ionici) de nitroniu cu foarte slab bazicitate și nucleofili anioni, anioni de acizi de obicei foarte puternice. Acești compuși sunt remarcabil higroscopici . [2] Printre acestea se numără:
- Perclorat de nitron (NO + 2 ClO - 4 )
- Tetrafluoroborat de azotiu (NO + 2 BF - 4 )
- Hexafluorofosfat de azot (NO + 2 PF - 6 )
- Hexafluoroarsenat de azotiu (NO + 2 AsF - 6 )
- Hexafluoroantimoniate de azot (NO + 2 SbF - 6 )
Cu anioni de acizi mai puțin puternici există compuși moleculari, non-salini, care includ:
Fiind compuși moleculari, aceștia au puncte de fierbere scăzute (−72 ° C și respectiv −6 ° C) și lungimi scurte ale legăturii N - X (N - F 135 pm, N - Cl 184 pm). [3] Acești compuși moleculari sunt obținuți din reacția cu dioxidul de azot stabil, în care atomul central N are numărul de oxidare +4 și formează 3 legături cu respectivii doi oxigenați laterali lăsând 1 electron liber, considerându-l ca un radical liber nitril (formula -NO2) atunci când reacționează cu F sau CI.
Notă
- ^ dioxidonitrogen (1+) (CHEBI: 29424) , în entități chimice de interes biologic (ChEBI) , Marea Britanie, Institutul European de Bioinformatică.
- ^ Kenneth Schofield, Nitrarea aromatică , Arhiva CUP, 1980, p. 88, ISBN 0-521-23362-3 .
- ^ FA Cotton și G. Wilkinson, Advanced Inorganic Chemistry, ediția a V-a (1988), Wiley, p.333