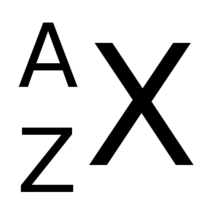Numar atomic
Numărul atomic (de obicei indicat cu Z , din termenul german Zahl , care înseamnă număr și numit și număr de protoni ) corespunde numărului de protoni conținut într-un nucleu atomic [1] : într-un atom neutru, numărul atomic este, de asemenea, egal la numărul de electroni ; altfel este în prezența unui ion ; folosim pentru a scrie acest număr ca indicele din stânga al simbolului elementului chimic în cauză: de exemplu 6 C , deoarece carbonul are șase protoni.
Fiecare număr atomic corespunde unui element chimic diferit, care este plasat în tabelul periodic în funcție de valoarea relativă a lui Z. Legea lui Moseley face posibilă derivarea numărului atomic al unui element dat prin măsurarea frecvenței liniei caracteristice corespunzătoare emisiei de raze X. Atomii care au același număr atomic, dar un număr diferit de neutroni sunt numiți izotopi și diferă între ei pentru numărul de masă diferit, indicat cu A și dat de suma numărului de protoni și a neutronilor totali ( nucleoni ).
Istorie
Tabelul periodic al elementelor
Construcția unui tabel periodic al elementelor permite o ordonare a elementelor, care sunt astfel numerotate și clasificate într-o anumită ordine.
Dmitri Mendeleev și-a organizat primele tabele periodice în ordinea greutății atomice ( Atomgewicht ). Cu toate acestea, având în vedere proprietățile chimice observate ale elementelor, el a schimbat ușor ordinea și a plasat telurul (greutatea atomică 127,6) înaintea iodului (greutatea atomică 126,9) [2] . Această intuiție a sa va fi în concordanță cu practica modernă de ordonare a elementelor în funcție de numărul de protoni, Z , chiar dacă conceptul de număr atomic nu era încă cunoscut în acel moment.
Cu toate acestea, numerotarea simplă bazată pe poziția din tabelul periodic nu a fost niciodată pe deplin satisfăcătoare. În plus față de cazul iodului și telurului, ulterior câteva alte perechi de elemente (cum ar fi argonul și potasiul , cobaltul și nichelul ) au prezentat aceeași problemă, necesitând, pe baza proprietăților chimice observate, să își inverseze poziția în perioada periodică. tabel bazat pe greutăți.atomic [3] .
Modelul atomic al lui Rutherford și ipoteza lui van den Broek
În 1911, Ernest Rutherford , după efectuarea binecunoscutului său experiment de folie de aur , a formulat un nou model atomic în care masa era concentrată într-un nucleu încărcat pozitiv și având o valoare de încărcare aproximativ egală cu jumătate din masa atomică a atomului. La o lună după ce Rutherford a publicat rezultatele experimentelor sale, fizicianul olandez Antonius van den Broek a devenit primul care a înțeles existența unei relații între numărul asociat cu un element din tabelul periodic și sarcina nucleului său atomic [4] .
Experimentul lui Moseley
În 1913 Henry Moseley și-a propus să verifice experimental ceea ce a afirmat van den Broek pe baza modelului atomic al lui Bohr . El a bombardat cu un flux de electroni o serie de elemente dispuse consecutiv în tabelul periodic, măsurând frecvența razelor X pe care le emit. El a constatat că rădăcina pătrată a frecvenței a crescut, progresând în ordinea stabilită de tabelul periodic, pe măsură ce sarcina nucleului atomic a crescut, ceea ce corespundea exact numărului atomic. Ordonând atunci elementele în ordine crescătoare a numărului atomic, mai degrabă decât pe baza greutății atomice, a fost, de asemenea, posibil să depășim inconsecvențele observate de Mendeleev cu clasificarea sa periodică.
Cu toate acestea, a fost necesar să așteptăm descoperirea neutronului, care a avut loc în 1932 grație lui James Chadwick , pentru a clarifica definitiv structura atomică corect.
Notă
- ^ (RO) IUPAC Gold Book, „număr atomic, Z” , pe goldbook.iupac.org.
- ^ (EN) Istoria tabelului periodic , a rsc.org. Adus pe 9 ianuarie 2015 .
- ^ Tabelul periodic al elementelor ( PDF ), pe treccani.it . Adus pe 9 ianuarie 2015 .
- ^ Salvatore Califano, Căi către fizica chimică modernă , Springer Science & Business Media, 2012, p. 152, ISBN 364228180X .
Elemente conexe
- Tabel periodic al elementelor
- Elemente după numărul atomic
- Greutate atomica
- Numar de masa
- Numărul de neutroni
Alte proiecte
-
 Wikționarul conține lema dicționarului „ număr atomic ”
Wikționarul conține lema dicționarului „ număr atomic ”
linkuri externe
- ( EN ) Număr atomic , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
| Controlul autorității | GND ( DE ) 4306456-5 |
|---|