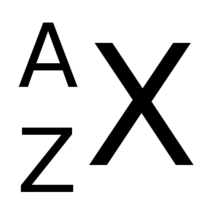Numar de masa
Numărul de masă (notat cu A, din cuvântul german Atomgewicht [greutate atomică] [1] ) este egal cu numărul de neutroni și protoni prezenți într-un atom . [2] [3]
Când doriți să specificați numărul de masă al unui element, îl scrieți în partea de sus (în poziția supercript), în stânga simbolului chimic . [3] De exemplu, pentru atomul de carbon, cu numărul de masă 12 reprezentăm suma celor 6 protoni ai acestuia și a celor 6 neutroni ai acestora: 12 C. Diferenți nuclei cu același număr de masă sunt numiți izobar : un exemplu de nuclizi izobarici constă din 12 C și 12 B.
Numărul masei și masa nucleonilor
Deoarece masele de neutroni și protoni nelegați sunt aproximativ egale cu 1 uma , ca primă aproximare, valoarea numărului de masă poate fi considerată egală în termeni numerici cu valoarea sumei maselor în uma a neutronilor și a protonilor. Deși aceste valori sunt aproape identice numeric, nu este corect să exprimăm numărul de masă în termeni de masă în uma de neutroni + protoni, deoarece numărul de masă este un număr adimensional , în timp ce masa de neutroni și protoni nu este număr.adimensional (de fapt are dimensiunile unei mase).
Mai mult, numărul masei este întotdeauna identificat printr-un număr natural (adică un număr întreg pozitiv), în timp ce masa nucleonilor din uma, pe care o putem aproxima la masa atomică (fiind masa electronilor neglijabilă în comparație cu masa nucleoni), este reprezentat de un număr real . De exemplu, masa atomică de 24 Mg este egală cu aproximativ 23.985 uma, în timp ce numărul său de masă este egal cu 24. [3]
Notă
- ^ Jensen și William B., Originile simbolurilor A și Z pentru greutatea și numărul atomic ( PDF ), în J. Chem. Educ , vol. 82, nr. 1764. Adus pe 7 mai 2021 (arhivat din original la 2 decembrie 2020) .
- ^ Definiția IUPAC a "numărului de masă"
- ^ a b c Silvestroni , p. 584 .
Bibliografie
- Paolo Silvestroni, Fundamentals of chemistry , ed. A X-a, CEA, 1996, ISBN 88-408-0998-8 .
Elemente conexe
linkuri externe
- ( EN ) Număr de masă , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.