Pentacen
| Pentacen | |
|---|---|
| Numele IUPAC | |
| pentacen | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 22 H 14 |
| Masa moleculară ( u ) | 278,35 |
| Aspect | albastru închis solid [1] |
| numar CAS | |
| Numărul EINECS | 205-193-7 |
| PubChem | 18671 |
| ZÂMBETE | C1=CC=C2C=C3C=C4C=C5C=CC=CC5=CC4=CC3=CC2=C1 |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 1,30 [2] |
| Solubilitate în apă | insolubil [1] |
| Temperatură de topire | 271 ° C (544 K) [1] |
| Informații de siguranță | |
Pentacenul este un compus organic cu formula C 22 H 14 . Aparține clasei de aceni și constă din cinci inele de benzen condensate în linie. În condiții normale formează cristale de culoare albastru închis, care sunt foarte sensibile la oxidare. Similar cu omologii superiori hexacen și heptacen , pentacenul este insolubil în apă și slab solubil în solvenți organici. [1]
Sinteză
Pentacenul a fost sintetizat pentru prima dată în 1912 de William Hobson Mills și Mildred May Gostling . [3] O metodă clasică pentru sinteza pentacenei este reacția Elbs : [4] [5]
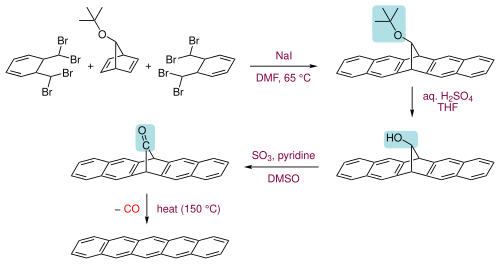
Pentacenul poate fi obținut și de la un precursor adecvat prin îndepărtarea unui mic component volatil, cum ar fi monoxidul de carbon, prin încălzire la 150 ° C (a se vedea ultima etapă din figura următoare). [6] Cetona precursoră poate fi obținută în trei etape. Primul compus cu cinci inele este format din α, α, α ', α'-tetrabromo- sau -xilen și 7- terț- butoxibiciclo [2.2.1] hepta-2,5-dienă tratat cu iodură de sodiu și dimetilformamidă . Gruparea terț- butoxi este apoi hidrolizată în alcool și apoi oxidată în cetonă. [6] Pentacenul este solubil la cald în benzenii clorurați, cum ar fi 1,2,4-triclorobenzen , din care poate fi recristalizat.
Structura

În stare solidă compusul cristalizează în sistemul triclino , grup spațial P 1 , cu constante de rețea a = 793 pm , b = 614 pm , c = 1 603 pm , α = 101,9 °, β = 112,6 °, γ = 85,8 °, cu două molecule pe unitate de celulă . În cristal, moleculele pentacene sunt perfect plane. [2]
În august 2009, o echipă de cercetători IBM a publicat o imagine a unei singure molecule de pentacen, obținută cu un microscop de forță atomică . [8] [9] În 2011, forma orbitalilor frontalieri HOMO și LUMO a fost observată printr-un microscop cu efect de tunel . [10] [11]
Aplicații
Pentacenul este utilizat ca semiconductor în electronica organică [12] și este de exemplu utilizat în tranzistoarele OTFT . În acest scop, este evaporat termic sau împrăștiat prin acoperire cu centrifugare . Pentacenul este aproape insolubil în mulți solvenți obișnuiți și, prin urmare, sunt utilizați în general derivați pentacenici cu solubilitate mai mare. [13] [14] [15]
Informații privind toxicitatea / siguranța
Compusul este disponibil comercial. Nu este clasificat ca periculos conform regulamentului (CE) 1272/2008 . Nu există riscuri cancerigene. [16]
Notă
- ^ a b c d Jahn 2018
- ^ a b Campbell și colab. 1961
- ^ Mills and Mills 1912
- ^ Elbs 1886
- ^ Breitmaier și Jung 2005
- ^ a b Chen și colab. 2007
- ^ Dinca și colab. 2015
- ^ Palmer 2009
- ^ Gross și colab. 2009
- ^ Krieger 2011
- ^ Gross și colab. 2011
- ^ Klauk 2006
- ^ Anthony 2006
- ^ Anthony 2008
- ^ Allard și colab. 2008
- ^ Sigma-Aldrich 2017
Bibliografie
- ( EN ) S. Allard, M. Forster, B. Souharce, H. Thiem și U. Scherf, Semiconductori organici pentru tranzistoare cu efect de câmp (OFET) procesabile în soluție , în Angew. Chem. Ed. Int. , Vol. 47, nr. 22, 2008, pp. 4070-4098, DOI : 10.1002 / an.200701920 .
- ( EN ) JE Anthony, Aceni și heteroaceni funcționalizați pentru electronică organică. , în Chem. Rev. , vol. 106, nr. 12, 2006, pp. 5028-5048, DOI : 10.1021 / cr050966z .
- ( RO ) JE Anthony, The Larger Acenes: Versatile Organic Semiconductors , în Angew. Chem. Ed. Int. , Vol. 47, nr. 3, 2008, pp. 452-483, DOI : 10.1002 / an.200604045 .
- ( DE ) E. Breitmaier și G. Jung, 12.5.3 Elbs-Reaktion , în Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte , Molekülstrukturen , Stuttgart, Georg Thieme Verlag, 2005, ISBN 9783135415055 .
- ( EN ) RB Campbell, JM Robertson și J. Trotter, Structura cristalină și moleculară a pentacenului , în Acta Cryst. , vol. 14, 1961, pp. 705-711, DOI : 10.1107 / S0365110X61002163 .
- ( RO ) K.-Y. Chen, H.-H. Hsieh, C.-C. Wu, J.-J. Hwang și TJ Chow, un nou tip de precursor pentacen solubil pentru tranzistoarele organice cu film subțire , în Chem. Comun. , vol. 2007, nr. 10, 2007, pp. 1065-1067, DOI : 10.1039 / B616511G .
- ( EN ) LE Dinca, F. De Marchi, JM MacLeod, J. Lipton-Duffin și alții, Pentacene on Ni (111): Ambalare moleculară la temperatura camerei și conversie activată la temperatură în grafen , în nanoscală , vol. 7, 2015, pp. 3263-3269, DOI : 10.1039 / C4NR07057G .
- ( DE ) K. Elbs, Beiträge zur Kenntniss aromatischer Ketone, în J. Prakt. Chem. , vol. 33, nr. 1, 1886, pp. 180-188, DOI : 10.1002 / prac.18860330119 .
- ( EN ) L. Gross, F. Mohn, N. Moll, P. Liljeroth și G. Meyer, Structura chimică a unei molecule rezolvate prin microscopie de forță atomică , în Știință , vol. 325, nr. 5944, 2009, pp. 1110-1114, DOI : 10.1126 / science.1176210 .
- ( EN ) L. Gross, N. Moll, F. Mohn, A. Curioni și colab., Imagistica orbitală moleculară de înaltă rezoluție folosind un vârf ST- p- Wave , în Phys. Rev. Lett., Vol. 107, nr. 8, 2011, p. 086101, DOI : 10.1103 / PhysRevLett.107.086101 .
- U. Jahn, Pentacen , pe Römpp online , Georg Thieme, 2018. Accesat la 17 mai 2018 .
- ( EN ) H. Klauk (eds), Organic Electronics: Materials, Manufacturing and Applications , Weinheim, Wiley-VCH, 2006, ISBN 3-527-31264-1 .
- K. Krieger, Molecules Imaged Most Intimately , în Science News , American Association for the Advancement of Science, 2011. Accesat la 18 mai 2018 .
- ( EN ) WH Mills și M. Mills, CCXXX - Producția sintetică a derivaților dinaftantracenului , în J. Chem. Soc., Trans. , vol. 101, 1912, pp. 2194-2208, DOI : 10.1039 / CT9120102194 .
- J. Palmer, Imaginea uimitoare a unei molecule , pe BBC News , 2009. Accesat la 18 mai 2018 .
- Sigma-Aldrich, Fișa tehnică de securitate Pentacene , de pe sigmaaldrich.com , 2017.
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe pentacen
Wikimedia Commons conține imagini sau alte fișiere pe pentacen