Pile of Volta

Grămada de Volta a fost primul generator de electricitate statică niciodată realizat.
Inventat de Alessandro Volta în 1799 , în reședința sa din Lazzate , constituie prototipul bateriei electrice moderne.
Descriere
Invenția bateriei este rezultatul experimentelor efectuate de Volta spre sfârșitul secolului al XVIII-lea, care au reluat studiile anterioare ale lui Luigi Galvani despre electricitate .
Pe prima grămadă, construită în decembrie 1799 , nu există informații precise: în scrierile lui Volta nu este expusă realizarea unui model concret; mai degrabă există instrucțiuni pentru construirea unui dispozitiv generic care utilizează mai multe moduri în mai multe moduri. Volta ar fi observat trecerea fluidului electric inducând contracția mușchilor într-o broască moartă la care fuseseră aplicați doi electrozi conectați la capetele bateriei, fenomen căruia i-a dat numele de galvanism .
Invenția a fost anunțată într-o scrisoare adresată lui Joseph Banks , președintele Societății Regale din Londra , din 20 martie 1800, în care Volta însuși face și prima descriere.
Denumit inițial organ electric artificial sau aparat electromotor , ulterior a fost botezat baterie datorită structurii sale caracteristice. Acest nume a rămas în limba italiană pentru a desemna generic toate bateriile pentru aparatele electrice, indiferent de forma lor.
Grămada a câștigat faimă și onoruri internaționale la Volta: la 7 noiembrie 1801 a ilustrat funcționarea sa la Institutul Franței din Paris în fața lui Napoleon Bonaparte , care cu acea ocazie i-a acordat o medalie de aur și i-a propus un premiu vizibil în numerar.
Descriere
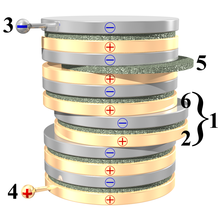
Grămada Volta constă practic dintr-o coloană de mai multe elemente similare suprapuse, așa-numitele elemente voltaice , constând din discuri de zinc alternate cu discuri de cupru și separate printr-un strat intermediar de pâslă sau carton îmbibat în apă sărată (bun conductor). În loc de cupru, este posibil și utilizarea argintului ; staniu poate fi folosit în locul zincului.
Prin conectarea capetelor superioare și inferioare ale bateriei prin intermediul unui conductor electric , se creează un circuit în care trece curent continuu .
Pentru a avea un flux de sarcini electrice, trebuie menținută o diferență de potențial între cei doi poli: în acest scop se utilizează generatoare de curent electric. Primul generator de electricitate din istorie este tocmai bateria.
Operațiune
Grămada lui Alessandro Volta poate fi considerată o coloană de celule galvanice conectate în serie. O diferență de potențial este stabilită între cei doi electrozi metalici ai fiecărei celule care este menținută constantă de forțe de natură chimică. De fapt, fiecare electrod tinde să elibereze ioni metalici pozitivi în soluția cu care este în contact, presupunând un potențial negativ față de acesta. Diferența de potențial între un electrod și soluție depinde de tipul de metal din care este compus electrodul. De exemplu, folosind un disc de zinc și un disc de cupru, așa cum a făcut Volta, un potențial negativ mai mare în valoare absolută decât cel al cuprului este măsurat în zinc. Prin conectarea celor doi electrozi prin intermediul unui conductor, se generează o mișcare de electroni de la polul sarcinii negative la cel de sarcină pozitivă (de la zinc la cupru în cazul anterior) și, prin urmare, un curent electric în direcția opusă.
Mișcarea electronilor în circuitul extern al bateriei tinde să compenseze și să anuleze diferența de potențial dintre electrozi și soluție; pentru ca curentul să rămână constant, polul negativ trebuie alimentat constant cu electroni scăpați din polul pozitiv. Această sarcină este încredințată soluției de electroliți . Având în vedere, de exemplu, o soluție de acid sulfuric în apă în contact cu electrozi de zinc și cupru , se observă că ionii negativi care decurg din disocierea acidului sulfuric sunt direcționați în interiorul soluției către electrodul de zinc. În schimb, ionii H 3 O + ai acidului se îndreaptă spre electrodul de cupru din care elimină fiecare un electron.
Energia chimică care se dezvoltă în timpul reacțiilor dintre metale și soluție este cea necesară pentru a permite fluxul de curent.
Fiecare element conectat în serie contribuie la creșterea tensiunii electrice între capetele celulei și, prin urmare, forța sa electromotivă .
În special, următoarea semi - reacție de oxidare are loc la anodul fiecărui element (în zinc):
care are un potențial de electrod egal cu -0,76 V.
Pe de altă parte, la catod, cuprul rămâne intact (se poate oxida în cele din urmă). Acest lucru se datorează faptului că zincul produce doi electroni și trece de la Zn metalic la Zn 2+ , acești electroni, spre deosebire de ceea ce s-ar putea crede, nu trec la cupru, ceea ce servește doar pentru a crea diferența de potențial, dar trec la ionul oxonium H 3 O + format din disocierea ionică a acidului sulfuric în apă, care se transformă în hidrogen molecular gazos H 2 . Un potențial de electrod de 0 V este asociat cu jumătatea de reacție a evoluției hidrogenului.
Prin urmare, fiecare element are un potențial celular de 0 - (- 0,76) = 0,76 V.
Deoarece bateria este alcătuită din mai multe celule galvanice conectate în serie, diferența de potențial care se stabilește la terminale este egală cu suma tuturor potențialelor celulei, adică este egală cu produsul numărului de elemente conectate în serie pentru 0,76 V.
Importanţă
Înainte de invenția bateriei, erau cunoscute dispozitive precum borcanul Leyden , care furnizau doar o descărcare electrică de foarte scurtă durată și trebuia încărcată înainte de fiecare utilizare. Bateria, pe de altă parte, era în sine un generator de tensiune : cu ea lumea științifică avea la dispoziție pentru prima dată un instrument capabil să producă curent intens într-un mod neîntrerupt (perpetuu, conform Volta), deschizând ușile la descoperirile revoluționare privind energia electrică care au marcat secolul al XIX-lea .
În 1800, la câteva luni de la anunțarea invenției, William Nicholson și Anthony Carlisle , care au fost printre primii care au aflat despre acest lucru prin intermediul băncilor însuși și chiar înainte ca Societatea Regală să fie conștientizată de aceasta, au reprodus bateria și au făcut să fie utilizate pentru efectuarea electrolizei apei, obținând gaze de hidrogen și oxigen .
Humphry Davy a efectuat o cercetare atentă folosind bateria și a ajuns la concluzia că efectele sale electrice, contrar a ceea ce credea Volta, nu au fost cauzate de contactul simplu al diferitelor metale, ci de modificările chimice. Experimentând cu electroliza, a reușit între 1807 și 1808 să izoleze metalele alcaline și alcalino-pământoase precum sodiul , potasiul , bariul , stronțiul , calciul și magneziul din sărurile lor.
Datorită bateriei, au fost posibile și primele încercări de a transmite semnale prin intermediul telegrafului electric.
Bibliografie
- Paolo Rossi (regia). Istoria științei moderne și contemporane . Torino , UTET , 1989. ISBN 88-02-04152-0
- Antonio Caforio, Aldo Ferilli. Physica 3 . Florența , Le Monnier , 1994. ISBN 88-00-49368-8
- Giuliano Pancaldi, Volta : Știința și cultura în epoca iluminismului , Princeton, Princeton University Press, 2003. ISBN 0-691-09685-6 [1]
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe teancul Voltaic
Wikimedia Commons conține imagini sau alte fișiere pe teancul Voltaic
linkuri externe
- ( EN ) Pila di Volta , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Pila Volta: un succes al științei italiene care a durat două sute de ani ( PDF ) [ link rupt ] , pe ulisse.sissa.it .
- Textul scrisorii lui Volta către Sir Banks, tradus în italiană din originalul în franceză, cu ilustrație , pe ppp.unipv.it .
- ( FR ) Original în limba franceză a textului scrisorii lui Volta către Sir Banks, cu ilustrație originală ( PDF ), pe electrochem.cwru.edu . Accesat la 11 octombrie 2012 (arhivat din original la 27 iunie 2013) .
- Descrierea Universității Sapienza din Roma din Pila di Volta , pe phys.uniroma1.it .
- Stiva explicată în proiectul openfisica , pe openfisica.com . Adus la 20 august 2010 (arhivat din original la 14 august 2010) .
- Cum să construiești un teanc în formă de cupă , pe electroyou.it .
- Construcția unei coloane Volta pile și alte pile ( PDF ), pe atuttoportale.it . Adus la 11 octombrie 2012 (arhivat din original la 21 octombrie 2012) .
- Bateria Volta și alte dispozitive electrochimice , pe funsci.com . Adus la 20 august 2010 (arhivat din original la 20 octombrie 2010) .
| Controlul autorității | Thesaurus BNCF 55536 · GND (DE) 4708157-0 |
|---|