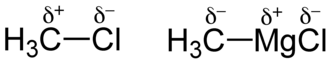Polaritate
În chimie , polaritatea este o proprietate a moleculelor prin care o moleculă (numită polar ) are o sarcină parțială pozitivă pe o parte a moleculei și o sarcină negativă parțială pe partea opusă a acesteia. Moleculele care nu prezintă fenomenul de polaritate se numesc apolare sau nepolare.
În general, în moleculele cu mai mult de doi atomi, atunci când atomii sunt toți la fel și legați de un atom central de un tip diferit (de exemplu CH 4 ), molecula nu prezintă un comportament polar, deoarece simetria moleculei înseamnă că sarcinile sunt distribuite destul de uniform pe limita moleculei.
Un exemplu de moleculă polară este molecula de apă ( H 2 O ), în care o sarcină negativă parțială este prezentă în vecinătatea atomului de oxigen (O) și o sarcină parțială pozitivă este prezentă în vecinătatea celor doi atomi de hidrogen ( H).
Gradul de polaritate al unei legături covalente depinde de capacitatea relativă a atomilor legați de a atrage electroni. Diferența vectorială a electronegativității atomilor unici permite estimarea gradului de polaritate al unei legături. Prin urmare, gradul de polaritate variază pe măsură ce diferența de electronegativitate dintre atomii implicați în legătură crește.
Polaritatea determină, de asemenea, miscibilitatea dintre două substanțe : în general, două substanțe, ambele polare sau ambele nepolare, sunt miscibile între ele.
Momentul dipolului
Polaritatea este exprimată cantitativ prinmomentul săudipolar , care se obține prin înmulțirea sarcinii parțiale prezente la cele două extreme cu distanța dintre sarcini.
Polaritatea într-o moleculă apare dacă electronii care leagă între doi atomi diferiți A și B nu sunt împărțiți în mod egal datorită electronegativității diferite a celor doi atomi .
Prin urmare, se creează un moment electric dipol :
unde d este distanța dintre cele două sarcini + q și -q care alcătuiesc dipolul electric
dacă B este mai electronegativ decât A.
Deoarecemomentul legăturii și distanța legăturii pot fi măsurate experimental, este posibil să se determine sarcina dipolară q și, astfel, procentul caracterului ionic al unei legături covalente .
Momentul electric al moleculelor poliatomice va fi dat de suma vectorială a momentelor dipolare ale legăturilor simple și ale oricăror dublete solitare ; prin urmare, momentul rezultat, care va indica dacă molecula va fi polară sau nu, va depinde și de geometria moleculei.
De exemplu, moleculele de dioxid de carbon (CO 2 ), trifluorură de bor (BF 3 ), tetrafluorură de carbon (CF 4 ) nu sunt polare în ciuda momentelor dipolare ridicate ale legăturilor unice implicate. Pe de altă parte, moleculele de amoniac (NH 3 ), trifluorură de azot (NF 3 ), apă (H 2 O) și trifluormetan (CHF 3 ) sunt polare.
Bibliografie
- TW Graham Solomons, Organic Chemistry, ed. A 2, Bologna, Zanichelli, 2001, pp. 18-20, ISBN 88-08-09414-6 .
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre polaritate
Wikimedia Commons conține imagini sau alte fișiere despre polaritate
linkuri externe
- ( RO ) IUPAC Gold Book, „polaritate” , pe goldbook.iupac.org .