Proteine

În chimie , proteinele (sau protidele ) sunt macromolecule biologice formate din lanțuri de aminoacizi legați între ei printr-o legătură peptidică (adică o legătură între grupul amino al unui aminoacid și grupul carboxil al celuilalt aminoacid, creat prin o condensare de reacție cu pierderea unei molecule de apă ). Proteinele îndeplinesc o gamă largă de funcții în cadrul organismelor vii , inclusiv cataliza reacțiilor metabolice , funcția de sinteză, cum ar fi replicarea ADN , răspunsul la stimuli și transportul moleculelor dintr-un loc în altul. Proteinele diferă unele de altele în principal prin secvența lor de aminoacizi, care este dictată de secvența nucleotidică stocată în gene și care are ca rezultat de obicei plierea proteinelor și o structură specifică tridimensională care determină activitatea acesteia.
În analogie cu alte macromolecule biologice, cum ar fi polizaharidele și acizii nucleici , proteinele formează o parte esențială a organismelor vii și participă practic la fiecare proces care are loc în interiorul celulelor. Multe aparțin categoriei enzimelor , a căror funcție este de a cataliza reacțiile biochimice vitale pentru metabolismul organismelor. Proteinele au, de asemenea, funcții structurale sau mecanice, cum ar fi actina și miozina din mușchii și proteinele care alcătuiesc citoscheletul , care formează o structură care permite celulei să își mențină forma. Altele sunt esențiale pentru transmiterea semnalelor inter și intracelulare , în răspunsul imun , pentru aderența celulelor și pentru ciclul celular. Proteinele sunt, de asemenea, elemente necesare în hrana animalelor, deoarece nu pot sintetiza toți aminoacizii de care au nevoie și trebuie să le obțină pe cele esențiale prin alimente. Datorită procesului de digestie, animalele descompun proteinele ingerate în aminoacizi individuali, care sunt apoi folosiți în metabolism.
Odată sintetizate în organism, proteinele există doar pentru o anumită perioadă de timp și sunt apoi degradate și reciclate prin mecanisme celulare pentru procesul de rotație a proteinelor. Durata de viață a unei proteine este măsurată în funcție de timpul său de înjumătățire și poate fi foarte variată. Unele pot exista doar câteva minute, altele până la câțiva ani, cu toate acestea durata medie de viață în celulele mamiferelor este între 1 și 2 zile. Proteinele anormale, pliate greșit pot provoca instabilitate dacă nu sunt degradate mai repede.
Proteinele pot fi purificate din alte componente celulare utilizând o varietate de tehnici precum ultracentrifugare , precipitare , electroforeză și cromatografie ; apariția ingineriei genetice a făcut posibilă o serie de metode pentru a facilita această purificare. Metodele utilizate în mod obișnuit pentru a studia structura și funcția proteinelor includ imunohistochimie , mutageneză specifică locului , cristalografie cu raze X , rezonanță magnetică nucleară . Proteinele diferă în principal în secvența de aminoacizi care le compune, care la rândul său depinde de secvența nucleotidică a genelor care își exprimă sinteza în interiorul celulei.
Un lanț drept de reziduuri de aminoacizi se numește „ polipeptidă ” (adică un lanț de aminoacizi multipli legați prin legături peptidice). O proteină constă în general din una sau mai multe polipeptide lungi, eventual coordonate cu grupări non-peptidice, numite grupe protetice sau cofactori. Polipeptidele scurte, care conțin mai puțin de aproximativ 20-30 de aminoacizi, sunt rareori considerate proteine și sunt denumite în mod obișnuit peptide sau uneori oligopeptide . Secvența de aminoacizi dintr-o proteină este definită de secvența prezentă într-o genă , care este codificată în codul genetic . În general, codul genetic specifică 20 de aminoacizi standard; cu toate acestea, în unele organisme codul poate include selenocisteină (SEC), iar în unele arhee , pirolizină și în cele din urmă un al 23-lea aminoacid, N-formilmetionina , un derivat al metioninei , care inițiază sinteza proteinelor a unor bacterii.
La scurt timp sau chiar în timpul sintezei proteinelor , reziduurile unei proteine sunt adesea modificate chimic prin modificare post-translațională , care, dacă este prezentă, modifică proprietățile fizice și chimice, plierea, stabilitatea, activitatea și, în cele din urmă, funcția proteinei. Proteinele pot de asemenea să colaboreze pentru a realiza o anumită funcție și adesea se pot asocia în complexe multiproteice stabile.
Proteinele care conțin același tip și număr de aminoacizi pot diferi de ordinea în care sunt situate în structura moleculei . Acest aspect este foarte important deoarece o variație minimă în secvența de aminoacizi a unei proteine (adică în ordinea în care diferitele tipuri de aminoacizi se succed) poate duce la variații în structura tridimensională a macromoleculei care poate face proteina nefuncțională. Un exemplu bine cunoscut este cazul lanțului beta al hemoglobinei umane, care în secvența sa normală poartă o trăsătură formată din: valină - histidină - leucină - treonină - prolină - acid glutamic - lizină .
Clasificare
Formarea copiilor duplicate ale genelor și modificarea funcției unei proteine în timpul evoluției a dus la formarea a aproximativ 500 de familii de proteine identificate. În cadrul unei familii, deși fiecare proteină îndeplinește o funcție ușor diferită de cealaltă, secvența aminoacizilor, în special la siturile catalitice și în regiunile conservate, este aproape identică. Cu toate acestea, nu este o lege care se aplică tuturor proteinelor dintr-o familie; de fapt, există unele proteine cu o secvență de aminoacizi foarte diferită și, cu toate acestea, cu o conformație tridimensională foarte similară.
Prin urmare, se poate spune că în cursul evoluției într-o familie de proteine, conformația tridimensională a fost conservată mai mult decât secvența aminoacizilor. În general, atunci când cel puțin un sfert din secvența de aminoacizi a două proteine se potrivește, acestea au aceeași structură generală. Două proteine diferite aparținând aceleiași familii și având o funcție similară sunt numite „paralogi”, în timp ce aceeași proteină din două organisme diferite (de exemplu, oameni și șoareci) este numită „ortologi”. Relația dintre două proteine este în general acceptată atunci când cel puțin 30% din aminoacizii se potrivesc, dar pentru a o verifica este posibil să se recurgă la așa-numitele amprente digitale , adică secvențe scurte de aminoacizi comune în aproape toate proteinele unui familie dată.

Unele proteine s-au format prin amestecarea domeniilor proteice sau prin duplicarea lor în cadrul aceleiași proteine datorită uniunilor accidentale ale ADN-ului codificator; anumite domenii sunt deosebit de răspândite și, prin urmare, se numesc module proteice. Aceste domenii au caracteristica de a avea terminale N și terminale C la polii opuși ai proteinei, astfel încât agregarea la alte domenii și proteine pentru a forma structuri mai mari este favorizată în comparație cu ceea ce s-ar întâmpla dacă ar fi amândoi spre același pol. ; un exemplu este modulul 1 de fibronectină . În acest caz, domeniile sunt inserate în buclele de proteine ale unor proteine, de exemplu modulul kringle din urokinază sau domeniul SH2. Unele dintre aceste domenii se găsesc nu numai printre proteinele paralogice, dar și ortologele, de exemplu, domeniul SH2 prezintă o difuzie foarte similară atât în vierme, cât și în zbor, dar este foarte rar la plante . Există domenii comune numai anumitor categorii de organizații, cum ar fi MHC, complexul major de histocompatibilitate (complexul major de histocompatibilitate), prezent la om, dar absent la insecte și plante, dar acestea reprezintă doar 7% din total. De asemenea, s-a observat că, deși unele organisme vii aparent simple, cum ar fi planta Arabidopsis thaliana , posedă mai multe gene decât o ființă umană, proteinele umane tind să fie formate dintr-un număr mai mare de domenii și, prin urmare, sunt mai complexe decât ortologii din alte organisme.
Prin urmare, clasificarea se poate face pe baza compoziției chimice, a configurației moleculare sau a solubilității . Astfel, se disting proteinele simple (constând doar din aminoacizi) și proteinele conjugate (constând dintr-o proteină simplă și un grup protetic neproteic).
Proteinele simple includ proteine fibroase , în general insolubile în solvenți apoși și uneori inatacabile de către enzimele proteolitice, cum ar fi: colagen (constituent esențial al țesutului conjunctiv ), elastină (componenta principală a fibrelor elastice și a pereților vaselor), cheratină (componenta esențială a epidermei ) . În plus, întotdeauna printre cele simple există proteine globulare , albumine (foarte răspândite în lumea animală), globuline (insolubile în apă, care se găsesc în sânge, mușchi, țesuturi în general și semințe) și prolamine (caracteristici ale lumii plantelor).
Dintre proteinele conjugate (formate cel puțin din apoproteină + grupa protetică ): hemoglobină , clorofile și opsine .
O altă clasificare a proteinelor este aceea care le distinge pe baza funcției lor, în care putem distinge proteinele structurale care sunt componente ale structurilor permanente ale organismului și care au în principal o funcție mecanică, proteinele de transport care se leagă de apă slab- substanțe solubile și permit transportul acestuia în fluidele și enzimele corpului care sunt proteine catalitice . Alte funcții ale proteinelor includ reglarea expresiei genelor , duplicarea , transcrierea și traducerea ADN-ului , reglarea reacțiilor metabolice, generarea și recepția impulsurilor nervoase. Multe toxine și alergeni sunt, de asemenea, proteine.
Biochimie


Majoritatea proteinelor sunt formate din polimeri liniari construiți din seria a 20 de L-α-aminoacizi diferiți. Toți aminoacizii proteinogeni posedă caracteristici structurale comune, inclusiv un α-carbon cu o grupare amino , o grupare carboxil și un lanț lateral variabil. Numai prolina diferă de această structură de bază prin faptul că conține un inel neobișnuit de grupa amino. [1] Lanțurile laterale ale aminoacizilor standard, detaliate în lista aminoacizilor standard , au o mare varietate de structuri și proprietăți chimice; este efectul combinat al tuturor lanțurilor laterale de aminoacizi dintr-o proteină care determină în cele din urmă structura sa tridimensională și reactivitatea chimică. [2] Aminoacizii unui lanț polipeptidic sunt legați prin legături peptidice. Odată legat în lanțul proteic, un aminoacid individual este numit reziduu și seria legată de atomi de carbon , azot și oxigen sunt cunoscute ca „lanț principal” sau „proteine coloanei vertebrale ”. [3]
Legătura peptidică are două forme de rezonanță care contribuie la legătura dublă și inhibă rotația în jurul axei sale, astfel încât α-carbonii sunt aproximativ coplanari. Celelalte două unghiuri diedre din legătura peptidică determină forma locală asumată de „proteina coloanei vertebrale . [4] Capătul proteinei cu o grupare carboxil liberă este cunoscut sub numele de domeniu C-terminal , în timp ce capătul cu o grupă liberă de amino este cunoscut sub numele de domeniul N-terminal . Termenii proteină, polipeptidă și peptidă sunt oarecum ambigui și se pot suprapune în unele semnificații. "este, în general, recunoscut ca fiind un oligomer de aminoacizi scurt, lipsit deseori de o structură tridimensională stabilă. Cu toate acestea, granița dintre cei doi compuși nu este bine definită și, de obicei, numărul de reziduuri care îi diferențiază este aproape de 20-30. [5 ] Cu „polipeptidă” se poate face referire la orice lanț liniar unic de aminoacizi, de obicei indiferent de lungime, dar adesea termenul implică absența unei conformații definite ta.
Compoziţie
Proteinele au o structură tridimensională foarte complexă, care este întotdeauna asociată cu o funcție biologică. Din această considerație derivă una dintre dogmele fundamentale ale biologiei : „ Structura <--> Funcția ”, în sensul că o funcție biochimică specifică este asociată cu fiecare organizare structurală diferită posedată de o proteină (numită proteină nativă). Din acest punct de vedere, proteinele pot fi clasificate în două mari familii: proteine globulare și proteine cu o structură extinsă sau fibroasă. Aceste două organizații reflectă cele două mari separări funcționale care le disting:
- Proteinele extinse sau fibroase îndeplinesc, în general, funcții biomecanice , fac parte din constituirea oaselor, unghiilor , părului, a stratului cornos al epidermei , a mușchilor (actină și miozină), oferind suport structural și opunându-se unei apărări valabile împotriva lumea inconjuratoare.
- Dimpotrivă, proteinele globulare sunt implicate în funcții biologice specifice și multiple, adesea de o importanță fundamentală pentru economia celulară, sunt proteinele, enzimele , pigmenții respiratori , mulți hormoni , toxine și anticorpi , responsabili de apărarea imună .
Compoziția lor în aminoacizi este variabilă și sub control genetic, astfel încât greutatea lor moleculară poate fi foarte variabilă și depinde de numărul și tipul de aminoacizi (monomeri) din care este fabricată molecula. Dacă molecula este alcătuită din câteva unități de aminoacizi (de obicei nu mai mult de 10), aceasta este definită ca o "oligopeptidă". Moleculele cu mai mult de 10 unități sunt numite „polipeptide” [6] . O proteină este formată din una sau mai multe polipeptide, eventual însoțite de una sau mai multe grupări protetice, iar greutatea sa moleculară nu este în general mai mică de 10.000 [7] .
O proteină în organizația sa nativă și, prin urmare, activă funcțional, poate exista numai în soluții saline diluate (foarte asemănătoare în compoziție cu cele existente în sistemele celulare apoase). Structura sa depinde exclusiv de caracteristicile chimico-fizice ale soluției apoase în care se găsește ( pH , prezența ionilor salini, temperatura, presiunea, prezența compușilor organici precum ureea , alcoolii etc.). Variația acestor parametri poate determina modificări structurale care pot modifica proprietățile funcționale, până la a le anula (proteine denaturate).
Molecula proteică este alcătuită din atomi de carbon , oxigen , hidrogen și azot ; conține adesea sulf (prezent în aminoacizii metionină, cisteină și cistină) și, uneori, fosfor și / sau metale precum fierul , cuprul , zincul și altele.
Proprietăți fizico-chimice
Proprietățile proteinelor sunt legate de cele ale constituenților lor, aminoacizii: sunt electroliți amfoteri , pot fi supuși electroforezei , sunt optic activi (stângaci) și au fenomenul Tyndall .
Punctul izoelectric (sau PI) al unei proteine este reprezentat de acea concentrație de ioni de hidrogen a mediului, care se comportă în așa fel încât să facă protida să-și asume o formă de amfion .
Pentru a obține greutatea moleculară (sau MW) a proteinelor, este necesar să se recurgă la tehnici și metodologii care nu sunt întotdeauna ușor de implementat. Dintre multe, cel care oferă cele mai precise rezultate este, fără îndoială, spectrometria de masă .
Din punct de vedere mecanic, lanțul de aminoacizi se comportă ca un polimer semi-flexibil a cărui extensie este descrisă de modelul lanțului Worm-like , cu o lungime de persistență de 0,4 nm.
Structura
Pliere
O proteină, fiind o macromoleculă formată din zeci de mii de atomi, ar putea prelua un număr incredibil de mare de falduri posibile. Cu toate acestea, considerațiile fizice limitează foarte mult posibilele pliuri și, prin urmare, conformația finală a unei proteine. Între timp, atomii nu se pot suprapune și se pot comporta în linii mari ca sferele cu o rază definită numită rază van der Waals , acest lucru limitează foarte mult numărul de unghiuri permise într-un lanț polipeptidic. Fiecare aminoacid contribuie la formarea lanțului polipeptidic cu trei legături:
- Legătura peptidică (CN) între carbonul unei grupări cetonice a unuia dintre aminoacizii și azotul grupării amino adiacente.
- Legătura denumită în mod convențional Cα- C care este prezentă între carbonul central de care este atașat grupul lateral R și carbonul grupării carboxil.
- Legătura Cα- N între carbonul central și azotul grupului amino al aceluiași aminoacid.
Legătura peptidică este plană și previne o rotație reală, în timp ce celelalte două legături o permit.
Unghiul de rotație al legăturii C α -C se numește ψ, cel al legăturii C α -N se numește φ. Conformația atomilor principali ai lanțului unei proteine este determinată de perechea acestor unghiuri de rotație pentru fiecare aminoacid. Deoarece coliziunile sterice dintre aminoacizi nu sunt posibile, unghiurile posibile sunt limitate. Ramachandran, în funcție de posibilele perechi de unghiuri de rotație, a compilat un grafic care astăzi își ia numele, unde este clar vizibil faptul că majoritatea proteinelor își asumă doar două tipuri majore de conformație: α-helix și β-sheet .
Interacțiunile numite legături sunt stabilite între atomii unei proteine, care pot fi covalente sau necovalente. Legăturile non-covalente, luate individual, sunt întotdeauna mai slabe decât covalenții în ordinea de zeci sau sute de ori, totuși numărul lor dintr-o proteină le face esențiale pentru înțelegerea plierii sale. Legăturile necovalente găsite în proteine sunt legături de hidrogen , atracții electrostatice și atracții van der Waals .
- Legătura de hidrogen se face, de exemplu, între un atom de oxigen și unul vecin de hidrogen .
- Atracțiile electrostatice apar între grupurile laterale cu sarcină periferică opusă.
- Atracțiile Van der Waals apar între dipoli moleculari instantanei induși ( forța londoneză ), între dipoli permanenți (forța Keesom) sau între un dipol permanent și un dipol indus corespunzător ( forța Debye ).
La aceste interacțiuni trebuie adăugată tendința grupărilor de aminoacizi hidrofobi (fenilalanină, leucină, izoleucină, triptofan, valină, cisteină, metionină, prolină, alanină și glicină) de a se apropia și de a se uni, formând buzunare hidrofobe departe de rețeaua de legături. hidrogen care trebuie întotdeauna imaginat prezent într-un mediu apos între moleculele de apă. În general, grupurile de aminoacizi hidrofobi sunt plasate aproape întotdeauna în interiorul proteinei, deoarece aceasta se găsește de obicei într-un mediu apos, în timp ce aminoacizii săi hidrofili, polari și încărcați vor tinde să fie la exterior. Structura tridimensională a unei proteine este determinată numai de dispunerea secvențială a aminoacizilor săi și conformația pe care o presupune tinde să fie cea cu cea mai mică energie liberă.
A fost posibilă descoperirea acestei particularități a proteinelor prin efectuarea experimentelor de denaturare (folosind solvenți precum ureea) și renaturarea proteinelor in vitro. S-a observat că unele proteine, odată denaturate și solventul îndepărtat, s-au pliat independent. Cu toate acestea, nu toate proteinele odată denaturate se pot replia spontan în conformația lor originală. Conformația unei proteine, deși este în mod normal cât mai stabilă pentru secvența aminoacizilor săi, nu este imuabilă și suferă mici modificări datorită interacțiunii cu liganzi sau alte proteine. Această caracteristică stă la baza funcționalității majorității proteinelor. Conformarea unei proteine poate fi mult ajutată și rafinată de către chaperone , proteine care se leagă de lanțurile parțial pliate și le ajută până se ajunge la conformația corectă. De multe ori funcționează prin izolarea buzunarelor hidrofobe ale unei proteine unele de altele, care altfel ar tinde să se asocieze prematur.
O porțiune de proteină care se pliază independent de restul lanțului polipeptidic se numește domeniu proteic și o proteină poate avea chiar mai mult de unul. Se presupune că există aproximativ 2.000 de domenii proteice cu structuri diferite în natură, aproximativ 800 au fost identificate, cu toate acestea marea majoritate a domeniilor proteice presupun câteva zeci de conformații diferite.
Α-helixul și β-foaia plisată
A-helixul și foaia β sunt cele mai frecvente conformații găsite în lanțurile polipeptidice ale unei proteine. O singură proteină poate avea atât helice α, cât și foi β în număr variabil.
- Helixul α este cea mai frecventă conformație găsită în proteine, prezentă în special în receptorii celulari, unde este scufundată în membrana plasmatică a celulei, adesea cu mai multe helici α per proteină unică (unite prin lanțuri polipeptidice în formă de U). În acest caz, grupurile hidrofobe sunt în contact cu membrana plasmatică, iar grupurile hidrofile sunt în interior sau se confruntă cu citoplasma și spațiul extracelular. Helixul este una dintre cele mai favorabile conformații, deoarece reduce în mod natural energia liberă la minimum, poate fi stângaci sau dreptaci. A fost descoperită pentru prima dată în α-keratină în anii 1960. A-helixul se formează atunci când un lanț polipeptidic se pliază pe sine cu formarea de legături de hidrogen între o legătură peptidică și următoarea a patra, în special între gruparea cetonă C = O a unuia și grupa NH a celeilalte și legătura este între O și H. Toate grupurile amino ale unei spirale sunt direcționate către N-terminal al proteinei, toate grupurile cetonice spre C-terminal , deci elica își asumă o sarcină parțială pozitivă la N-terminal și sarcină negativă parțială la terminalul C. Elica care se formează are o revoluție completă la fiecare 3,6 aminoacizi, iar distanța medie dintre aceștia este de 0,54 nm. În unele proteine, două sau trei helice α se înfășoară una în jurul celeilalte formând bobina înfășurată. În general, această conformație este presupusă atunci când fiecare helix are majoritatea lanțurilor laterale de aminoacizi hidrofobi pe o parte, în acest fel, profitând de atracțiile hidrofobe, helicele se pot înfășura una în jurul celeilalte. Α-cheratina este un exemplu de proteină care își asumă această conformație specială, preferată de proteinele cu funcție structurală.
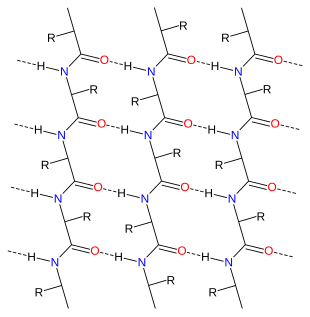
- Foaia β plisată este a doua cea mai frecventă conformație a proteinelor, foarte prezentă în unele enzime și proteine implicate în apărarea imună. A fost descoperită în anii 1960 prin studierea fibroinei, principala proteină constitutivă a mătăsii. Foaia β plisată constă din numeroase lanțuri polipeptidice care sunt dispuse adiacente unele cu altele, conectate într-o structură continuă prin secvențe scurte în formă de U. Astfel de lanțuri pot indica în aceeași direcție (lanțuri paralele) sau în direcții alternative (lanțuri antiparalele). Încă o dată lanțurile polipeptidice adiacente sunt unite într-o structură rigidă prin legături de hidrogen care leagă legăturile peptidice ale unui lanț cu cel adiacent.
Nivelurile de organizare
O proteină în ansamblu este o moleculă în care se disting în mod convențional diferite niveluri de organizare, care pot fi trei sau patru în funcție de proteină. [8]
- Structura primară este formată din secvența specifică de aminoacizi, de lanțul peptidic și de numărul de lanțuri în sine, ea singură determină plierea proteinei.
- Structura secundară constă în conformarea spațială a lanțurilor; de exemplu conformația spirală (sau alfa helix ), menținută și permisă de legături de hidrogen , plană (sau foaia β ), bobina înfășurată ( colagen ) sau cele globulare aparținând grupului KEMF ( keratină , epidermină, miozină, fibrinogen) . Într-o singură proteină poate exista o combinație de secvențe de helix α , foaie β și secvențe nerepetitive și acestea se află la un nivel de complexitate între structura secundară și terțiară .
- Domeniul este o unitate globulară sau fibroasă formată din lanțuri polipeptidice pliate în mai multe regiuni compacte, constituie diviziuni ale structurii terțiare , are caracteristica de pliere mai mult sau mai puțin independent de restul proteinei. Un domeniu este în general între 30 și 350 de aminoacizi. Multe dintre proteinele mai complexe sunt agregări modulare ale numeroaselor domenii proteice. Printre cele mai frecvente sunt SH2 sau SH3; proteina Src posedă un domeniu SH2, un domeniu SH3 și un domeniu kinază catalitică C-terminală.
- Structura terțiară (din punct de vedere al termodinamicii este forma cu cea mai mică energie liberă ) este reprezentată de configurația completă tridimensională pe care o asumă lanțul polipeptidic în mediul în care se află.
Este permis și întreținut de mai mulți factori, cum ar fi punțile disulfură și forțele Van der Waals . Fundamentale pentru formarea sa sunt chaperoninele , proteine numite și „stres” sau „ proteine de șoc termic” (Hsp, „ proteine de șoc termic” ), datorită rolului lor în renaturarea proteinelor denaturate.
O mare parte din structurile terțiare pot fi clasificate ca globulare sau fibroase. - Structura cuaternară este cea care derivă din asocierea a două sau mai multe unități polipeptidice, unite între ele prin legături slabe (și uneori punți disulfidice ) într-un mod foarte specific, cum ar fi în constituția hemoglobinei, constând din patru subunități, două α globuline și două β globuline.
Proteinele care conțin și o parte non-polipeptidică, grupul protetic , se numesc proteine conjugate . Due proteine si dicono isoforme se, a parità di struttura primaria, differiscono in uno degli altri livelli di struttura. Denaturare una proteina significa distruggerne la conformazione spaziale, rompendo i legami idrogeno e ponti disolfuro per mezzo di acidi , basi, calore, radiazioni o agitazione (un esempio comune di denaturazione è la cottura di un uovo nel quale l' albumina , che costituisce la maggior parte dell'albume, viene denaturata). Una proteina denaturata, pur mantenendo intatta la sua struttura primaria, non è più in grado di esplicare la sua funzione, a meno che non si riesca a ristabilirne la struttura terziaria.
Proteine complesse
Le proteine, per quanto siano complesse anche prese singolarmente, negli organismi viventi possono aggregarsi ad altre proteine identiche oppure a proteine apparentemente molto differenti creando dei complessi proteici. Ciò che permette questo legame sono gli stessi legami non covalenti che permettono ad una proteina di assumere una determinata conformazione. In una proteina sono spesso presenti una o più zone caratteristiche capaci di interazioni non covalenti con altre proteine dette siti di legame . Quando una proteina, tramite un sito di legame, si lega ad un'altra proteina formando un complesso proteico ogni singola proteina del complesso prende il nome di subunità proteica.
Se le subunità che formano il complesso proteico sono due si dirà che è un dimero , se sono tre un trimero , se quattro un tetramero e così via. Esistono complessi proteici che contengono decine di subunità. Il legame fra le subunità può essere per esempio "testa-testa" (in tal caso sono favoriti i dimeri) o "testa-coda" (dove spesso le proteine sono globulari o ad anello).

Un esempio di proteina provvista di più subunità è l' emoglobina , una proteina globulare formata da quattro subunità, due α-globuline ad uno dei due poli e due β-globuline all'altro (le subunità non sono perciò alternate), con un gruppo prostetico (l'eme) legato a ciascuna subunità.
Altri complessi proteici sono formati da molte più subunità che permettono di realizzare dei filamenti dal momento che ad un polo possiedono un sito di legame e all'altro polo una struttura proteica complementare a quello stesso sito. Si creano così catene di filamenti proteici come l'actina-F, formata da centinaia di subunità globulari di actina-G che le conferiscono al microscopio elettronico un aspetto simile a quello di una collana elicoidale di perle. La ridondanza della struttura elicoidale e non retta è sempre dovuta all'affinità di una conformazione con la minore energia libera.
Una variante all'elica è il coiled coil , che coinvolge due o tre catene polipeptidiche, come nella cheratina o nel collagene. Si può dire, a grandi linee, che le proteine globulari tendono ad avere funzione enzimatica, mentre quelle che formano filamenti hanno funzione strutturale (formano ad esempio le miofibrille nelle fibre muscolari o le fibre della matrice extracellulare, o ancora il citoscheletro di una cellula).
Vi sono proteine la cui funzione è resa possibile proprio dalla loro struttura poco caratterizzabile e casuale, ne è un esempio l' elastina , che forma le fibre elastiche della parete delle arterie e di molti altri tessuti del corpo umano. Nell'elastina numerose catene polipeptidiche sono legate covalentemente tra loro senza una disposizione regolare e tale struttura disordinata ne determina la sua deformabilità. Proteine poco strutturate hanno svariate funzioni nella cellula, alcune ad esempio hanno funzione strutturale come l'elastina, altre però sono dei canali come le nucleoporine poste sulla membrana nucleare di ciascuna cellule, altre ancora fungono da proteine impalcatura, cioè proteine che raggruppano in stretta vicinanza altre proteine dalla funzione correlata, fondamentali nella segnalazione e nella comunicazione cellulare. Una caratteristica comune a tutte le proteine poco strutturate è una grande ridondanza di aminoacidi e la bassa presenza di amminoacidi idrofobici.
Certe proteine molto esposte alla degradazione nell'ambiente extracellulare sono stabilizzate da legami disolfuro (SS) che si formano tra due proteine; questo legame agisce come una vera e propria graffetta sulla proteina, permettendole anche in ambienti ostili di mantenere la sua conformazione. All'interno del citoplasma è difficile riscontrare legami disolfuro a causa dell'ambiente riducente, per cui le cisteine mostrano gruppi (-SH).
L'evoluzione ha fatto inoltre in modo che vi fosse la possibilità di creare complessi proteici ancora più grandi di filamenti, coiled coil , o proteine globulari. Il vantaggio di tali strutture è che siccome sono spesso costituite dalla ripetizione di subunità identiche o simili, occorre poco materiale genetico per sintetizzare grandi complessi proteici, come, ad esempio, i capsidi dei virus . Inoltre l'associazione tra le subunità necessita generalmente di un'energia molto bassa, oppure, in certi casi, le subunità sono autoassemblanti (per esempio il ribosoma batterico). Il capside di molti virus è formato o da un tubo cavo (come nel virus del mosaico del tabacco ) oppure assomiglia ad un icosaedro o ad una sfera cava, come per il poliovirus.
Generalmente tali strutture si rivelano sia molto stabili, date le numerose interazioni tra le subunità, sia adattabili, dal momento che per infettare una cellula devono permettere la fuoriuscita dell'acido nucleico, sia RNA o DNA.
Chiralità delle proteine
Tutti gli amminoacidi , ad eccezione della glicina presentano un carbonio legato a quattro sostituenti diversi che è un centro chirale . Tutti gli amminoacidi possono dunque esistere in due conformazioni: L o D , sintetizzandoli artificialmente si ottiene una miscela racema .
Tuttavia tutti gli amminoacidi dei composti biologici si trovano in natura soltanto conformazione L. Amminoacidi in conformazione D si rinvengono in alcune specie batteriche e vengono pure adoperati per la sintesi di farmaci. La gramicidina S, un peptide naturale con funzione antibatterica, nella sua struttura primaria contiene anche alcuni amminoacidi appartenenti alla conformazione D.
Sintesi
Sintesi biologica
Le proteine sono formate a partire dagli amminoacidi utilizzando le informazioni codificate nei geni . Ogni proteina possiede una propria sequenza amminoacidica che deriva dalla sequenza nucleotidica del gene che la codifica. Il codice genetico è costituito da triplette di nucleotidi dette codoni e ogni combinazione di tre nucleotidi designa un amminoacido, ad esempio AUG ( adenina - uracile - guanina ) è il codice per la metionina . Poiché il DNA contiene 4 diversi nucleotidi, il numero totale di possibili codoni è di 64; essendo gli amminoacidi standard solo 20 nel codice genetico vi è un certo grado di ridondanza e ad alcuni amminoacidi corrispondono più codoni. [9] I geni presenti nel DNA sono prima trascritti in pre-mRNA (pre-RNA messaggero) da proteine quali l' RNA polimerasi .
La gran parte degli organismi processano il pre-mRNA (anche noto come trascritto primario ) mediante diverse forme di modifiche post-trascrizionali per formare l' mRNA maturo. L'RNA messaggero maturato è quindi usato come templato per la biosintesi proteica nel ribosoma . Nei procarioti l'mRNA può essere usato subito dopo essere stato prodotto o dopo essersi allontananto dal nucleoide . Al contrario gli eucarioti formano l'mRNA nel nucleo cellulare e successivamente lo traslocano attraverso la membrana nucleare nel citoplasma , dove avviene la biosintesi proteica . La velocità di sintesi delle proteine è maggiore nei procarioti rispetto agli eucarioti e può raggiungere i 20 residui amminoacidici per secondo. [10]
Il processo di sintesi di una proteina a partire da uno stampo di mRNA è noto come traduzione. L'mRNA è caricato nel ribosoma e letto tre nucleotidi per volta accoppiando ciascun codone con il corrispondente anticodone localizzato sull' RNA di trasporto che porta l'amminoacido corrispondente al codone riconosciuto. L'enzima amminoacil-tRNA sintetasi "carica" la molecola di tRNA con il corretto amminoacido. Le proteine sono sempre biosintetizzate a partire dall'estremità N-terminale in direzione di quella C-terminale . [9] Gli aminoacidi vengono poi legati tra loro tramite la rimozione di una molecola di acqua tramite la peptidil-trasferasi.
Le dimensioni di una proteina sintetizzata possono essere misurate dal numero di amminoacidi che contiene e dalla sua massa molecolare totale, la quale normalmente è misurata in dalton (sinonimo di unità di massa atomica ) o nell'unità derivata kilodalton (kDa). Ad esempio le proteine del lievito sono lunghe in media 466 residui amminoacidici e pesano mediamente 53kDa. [5]
Sintesi artificiale
Le proteine più corte possono essere sintetizzate anche per via chimica mediante una serie di metodi di sintesi peptidica che si basano su tecniche di sintesi organica come la chemical legation per produrre peptidi in alte rese. [11]
La sintesi chimica permette l'introduzione nella sequenza di amminoacidi non naturali, come l'inserimento di sonde fluorescenti . [12] Questi metodi sono utili nei laboratori di biochimica e biologia cellulare , sebbene generalmente non abbiano applicazione commerciale.
La sintesi chimica è inefficiente (in termini di rese) per polipeptidi più lunghi di 300 residui amminoacidici, e le proteine sintetizzate possono avere problemi ad assumere rapidamente la struttura terziaria della conformazione nativa. La gran parte dei metodi di sintesi chimica procedono dall'estremità C-terminale a quella N-terminale, in direzione opposta alla biosintesi naturale. [13]
Funzioni cellulari
Le proteine hanno un ruolo fondamentale internamente alla cellula, svolgendo i compiti specifici codificate nelle informazioni contenute nei geni. [5] Esse possono svolgere funzione strutturale, immunitaria, trasporto (di ossigeno, minerali, lipidi, di membrana), di identificazione dell'identità genetica, ormonale, enzimatica, contrattile, energetica. Con l'eccezione di alcuni tipi di RNA, la maggior parte delle altre molecole biologiche sono elementi relativamente inerti su cui agiscono le proteine. Le proteine rappresentano la metà del peso a secco di una cellula di Escherichia coli , mentre altre macromolecole, come il DNA e l'RNA, costituiscono rispettivamente solo il 3% e 20%. [14] L'insieme delle proteine espresse in un particolare tipo di cellula è noto come la sua proteoma .
La principale caratteristica delle proteine che permette a loro un insieme diversificato di funzioni è la capacità di legarsi altre molecole in modo specifico. La regione della proteina che permette il legame con l'altra molecola è conosciuta come il sito di legame ed è spesso una depressione o "tasca" sulla superficie molecolare. Questa capacità di legame è mediata dalla struttura terziaria della proteina, che definisce la tasca del sito di legame, e dalle proprietà chimiche delle catene laterali degli amminoacidi circostanti. I legami tra le proteine possono essere straordinariamente stretti e specifici; ad esempio, la proteina inibitrice della ribonucleasi si lega all' angiogenina umana con una costante di dissociazione sub-femtomolare (<10 −15 M), ma non si lega affatto al suo omologo degli anfibio (> 1 M). Cambiamenti chimici estremamente minori, come l'aggiunta di un singolo gruppo metilico ad una proteina legante, a volte può essere sufficiente per eliminare questo vincolo: per esempio, l' amminoacil-tRNA sintetasi è specificata dall'amminoacido valina discriminandola dalla catena laterale molto simile della isoleucina . [15]
Le proteine possono legarsi ad altre proteine nonché a substrati piccole molecole. Le interazioni proteina-proteina regolano anche l'attività enzimatica, controllano la progressione del ciclo cellulare e permettono l'assemblaggio di grandi complessi di proteine che svolgono molte reazioni strettamente correlate con una funzione biologica comune. Le proteine possono anche legarsi, o anche essere integrate, nelle membrane cellulari . La capacità dei partner di legame di indurre cambiamenti conformazionali nelle proteine permette la costruzione di reti di segnalazione estremamente complesse. [16] [17]
È importante sottolineare che le interazioni tra le proteine sono reversibili e dipendono fortemente dalla disponibilità di diversi gruppi di proteine partner per formare aggregati che sono in grado di effettuare insiemi discreti. Lo studio delle interazioni tra proteine specifiche è una chiave per comprendere gli aspetti importanti della funzione cellulare e, in ultima analisi, le proprietà che distinguono particolari tipi di cellule. [18]
Funzione enzimatica
Il ruolo più noto delle proteine all'interno della cellula è quello di operare come enzimi in grado di catalizzare reazioni chimiche . Quasi tutti i nomi degli enzimi terminano in "-asi" per convenzione. Gli enzimi sono generalmente altamente specifici e riescono ad accelerare solo una, o poche altre, reazioni. Essi sono fondamentali per la maggior parte delle reazioni coinvolte nel metabolismo , così come nei processi di manipolazione del DNA , quali la replicazione del DNA , la riparazione del DNA e la trascrizione . Alcuni enzimi agiscono su altre proteine aggiungendo o rimuovendo gruppi chimici in un processo noto come modificazione post-traslazionale . Sono note circa 4.000 reazioni catalizzate da enzimi. [19] L'accelerazione conferita dalla catalisi enzimatica è spesso enorme, fino a 10 17 volte maggiore rispetto alla reazione non catalizzata nel caso di decarbossilasi orotato , che richiederebbe un tempo di 78 milioni di anni senza l'intervento dell'enzima, ma grazie al suo intervento questo tempo si riduce a soli 18 millisecondi. [20]
Il ligando di un enzima prende il nome di substrato ed è generalmente molto più piccolo dell'enzima stesso. Sebbene gli enzimi possono essere costituiti da centinaia di amminoacidi, solitamente solo una piccola frazione dei residui vengono a contatto con il substrato, e in media uno su quattro viene coinvolto direttamente nella catalisi ancora più piccolo di tre frazioni. [21] La regione dell'enzima che lega il substrato e contiene i residui catalitici è conosciuta come il sito attivo .
- idrolasi , gli enzimi che tagliano un substrato mediante idrolisi, ne fanno parte le proteasi (che tagliano altre proteine) e le nucleasi (che tagliano acidi nucleici, cioè DNA e RNA);
- sintasi , enzimi che sintetizzano una nuova molecola a partire da due substrati, generalmente per condensazione;
- isomerasi , enzimi che trasformano un ligando in un suo isomero modificandolo chimicamente a livello dei legami;
- polimerasi , enzimi che associano varie molecole costituendo un polimero, per esempio un acido nucleico;
- chinasi , enzimi che aggiungono gruppi fosfato ad alcune molecole;
- fosfatasi , enzimi che rimuovono gruppi fosfato da alcune molecole;
- ossidoreduttasi , enzimi che ossidano e riducono alcune molecole, ne fanno parte le ossidasi, le reduttasi e le deidrogenasi;
- ATPasi , enzimi che idrolizzano ATP liberandone l'energia.
Segnalazione cellulare e ligando
Molte proteine sono coinvolte nel processo di segnalazione cellulare e nella trasduzione del segnale . Alcune proteine, come l' insulina , operano in ambiente extracellulare trasmettendo un segnale proveniente dalla cellula in cui sono state sintetizzate ad altre cellule facenti parte di tessuti distanti. Altre, come le proteine di membrana , agiscono come recettori la cui funzione principale è quella di legare una molecola di segnalazione e indurre una risposta biochimica nella cellula. Molti recettori possiedono un sito di legame esposto sulla superficie cellulare e un dominio effettore che si trova invece internamente, il quale può avere un'attività enzimatica o può subire un cambiamento conformazionale che viene rilevato da altre proteine all'interno della cellula. [22]
La proteina di biopigmento crittocromo è nota per le sue proprietà di formare radicali liberi durante la sua interazione con la luce , per la sincronizzazione dei ritmi circadiani .
Gli anticorpi sono componenti proteiche del sistema immunitario adattativo la cui funzione principale è quella di legarsi gli antigeni o alle sostanze estranee nel corpo e quindi segnarle per essere distrutte. Gli anticorpi possono essere secreti nell'ambiente extracellulare o ancorati nelle membrane dei linfociti B , conosciuti come cellule del plasma. Se gli enzimi sono limitati nella loro affinità di legame per i loro substrati dalla necessità di condurre la reazione, gli anticorpi non hanno tali vincoli. L'affinità di legame di un anticorpo con il suo obiettivo è straordinariamente elevato. [23]
Quasi tutte le proteine conosciute interagiscono con altre proteine o con altri tipi di molecole, comunque detti ligandi, tramite i loro siti di legame, ciò sta alla base di gran parte delle interazioni presenti in una cellula. Una proteina di norma possiede un sito di legame che le permette di legarsi con uno o pochi ligandi, per cui la maggior parte delle proteine ha alta specificità. L'entità del legame può essere differente, vi sono proteine che si legano ai propri ligandi in modo molto tenace, altre invece che si legano debolmente e la tipologia di legame influenza la funzione della stessa proteina. Ad esempio, gli anticorpi legano strettamente i propri ligandi (detti antigeni ), mentre certi enzimi per questioni di cinetica e per velocizzare le reazioni non legano così strettamente il proprio substrato.
La capacità di legame dipende sempre dalla capacità della proteine di stabilire legami non covalenti ( legame idrogeno , attrazioni elettrostatiche , attrazioni idrofobiche e forze di van der Waals ) con il ligando. Più legami si formano, più il legame con il ligando sarà complessivamente intenso. Il sito di legame di una proteina possiede una forma che è generalmente quasi complementare a quella del ligando che vi deve aderire, ciò ne determina la specificità. Le caratteristiche di ciascun sito di legame sono date dalle catene laterali degli amminoacidi che si affacciano in esso; gli amminoacidi che vi prendono parte sono spesso distanti lungo la catena polipeptidica della proteina. Mutazioni nel sito di legame generalmente determinano malfunzionamento o cessazione dell'attività catalitica o di legame originaria. Non è sorprendente pensare che i siti di legame siano alcuni degli amminoacidi più conservati all'interno di una proteina. I siti di legame sono isolati dall'ambiente acquoso in cui sono immersi dal momento che alcune catene laterali poste in prossimità del sito di legame tendono a respingere le molecole d'acqua; è inoltre sfavorevole per una molecola d'acqua dissociarsi dalla rete di legami idrogeno con cui è interconnessa alle altre molecole d'acqua per reagire con una catena laterale di un amminoacido del sito di legame. Il ligando può essere attratto mediante alcuni espedienti, come il raggruppamento in siti specifici di amminoacidi provvisti di carica, che sono quindi in grado di attrarre più facilmente ligandi di carica opposta e nel contempo di respingere quelli con la stessa carica. Le possibili interfacce tra una proteina e il suo ligando sono molti, tra le più comuni le interazioni superficie (sito di legame)-stringa (ligando), oppure elica-elica (comune nelle proteine regolatrici di geni), o ancora, più comunemente delle altre due, superficie-superficie (quanto avviene in moltissimi enzimi). La forza di legame di una proteina verso il suo ligando all'equilibrio, cioè nello stato in cui le associazioni e le dissociazioni tra la proteina e il ligando sono in egual numero, è misurata tramite la costante di equilibrio.
La velocità di dissociazione è calcolata tramite la formula: velocità associazione = k off [AB] dove [AB] è la concentrazione del complesso proteico in moli ek off è la costante di dissociazione.
La velocità di associazione è calcolata tramite la formula: velocità dissociazione = k on [A] [B], dove [A] e [B] sono le due molecole ek on è la costante di associazione.
Eguagliando le due velocità si ricava la costante di equilibrio (detta anche di affinità) K a = [AB] / [A][B].
Maggiore è la costante di equilibrio, maggiore sarà la forza di legame, inoltre essa è una misura diretta della differenza di energia libera tra lo stato legato e dissociato della proteina. Un modello usato per determinare l'entità dell'affinità di un ligando per una proteina si basa sull' equazione di Scatchard .
Molte proteine legano particolari piccole molecole e le trasportano in altre zone di un organismo multicellulare. Queste proteine possiedono un'elevata affinità di legame quando il loro ligando è presente in alte concentrazioni, ma devono anche essere in grado di rilasciarlo quando è presente a basse concentrazioni nei tessuti bersaglio. L'esempio classico di una proteina-ligando è l' emoglobina , che trasporta in tutti i vertebrati l' ossigeno dai polmoni ad altri organi e ha stretti omologhi in ogni regno biologico. [24] Le lectine sono proteine altamente specifiche per determinati zuccheri . Svolgono un importante ruolo biologico nel processo di riconoscimento dei polisaccaridi presenti sulle membrane cellulari. [25] I recettori e gli ormoni sono proteine di legame altamente specifiche.
Le proteine transmembrana possono anche servire come proteine di trasporto del ligando alterando la permeabilità della membrana cellulare per le piccole molecole e gli ioni. La sola membrana ha un centro idrofobico attraverso il quale le molecole polari o cariche non possono diffondersi. Le proteine di membrana contengono canali interni che consentono tali molecole di entrare e uscire dalla cellula. Molte canali ionici proteici sono specializzati per selezionare solo un particolare di ioni; per esempio, i canali potassio ei canali del sodio spesso selezionano uno solo dei due ioni. [26]
Proteine strutturali
Le proteine strutturali conferiscono rigidità alle componenti biologiche che altrimenti sarebbero fluide. La maggior parte delle proteine strutturali sono proteine fibrose; per esempio, collagene ed elastina sono componenti fondamentali dei tessuti connettivi come la cartilagine mentre la cheratina si trova in strutture rigide o filamentose, come capelli , unghie , piume , zoccoli e alcune conchiglie . [27] Alcune proteine globulari possono anche svolgere una funzione strutturale, per esempio, l' actina e la tubulina sono globulari e solubili come monomeri, ma sono in grado di polimerizzare per formare fibre lunghe e rigide che compongono il citoscheletro , la struttura che permette alla cellula di mantenere la sua forma e dimensione.
Altre proteine che svolgono funzioni strutturali, sono le proteine motore come la miosina , la chinesina e la dineina , che sono in grado di generare forze meccaniche. Queste proteine sono fondamentali per la motilità cellulare degli organismi unicellulari e per gli spermatozoi di molti organismi multicellulari che si riproducono sessualmente . Esse permettono anche la contrazione dei muscoli [28] e svolgono un ruolo essenziale nel trasporto intracellulare.
Metodi di studio
Le attività e le strutture delle proteine possono essere esaminate in vitro , in vivo e in silico . Studi in vitro su proteine purificate in ambienti controllati sono utili per comprendere come una proteina svolga la sua funzione: per esempio, gli studi di cinetica enzimatica esplorano il meccanismo chimico di azione catalitica di un enzima e le relative affinità con le possibili molecole substrato. Per contro, gli esperimenti in vivo possono fornire informazioni sul ruolo fisiologico di una proteina nel contesto di una cellula o un intero organismo. Studi in silico utilizzano metodi computazionali per studiarle.
Purificazione della proteina
Per eseguire l'analisi in vitro , una proteina deve essere purificata, cioè isolata dalle altri componenti cellulari. Questo processo di solito inizia con la lisi cellulare, in cui la membrana di una cellula viene interrotta ed il suo contenuto interno rilasciato in una soluzione nota come lisato grezzo . La miscela risultante può essere purificata mediante ultracentrifugazione , che fraziona i vari componenti cellulari in parti contenenti proteine solubili; lipidi e proteine di membrana; organelli cellulari e acidi nucleici. Il fenomeno della precipitazione , con un metodo noto come salting out , può concentrare le proteine da questo lisato. Vari tipi di tecniche cromatografiche vengono poi utilizzate per isolare la proteina, o le proteine, di interesse sulla base di proprietà come il peso molecolare , carica netta e l'affinità di legame. [29] Il livello di depurazione può essere monitorato utilizzando vari tipi di gel di poliacrilammide se il peso molecolare e il punto isoelettrico della proteina desiderata sono noti, tramite spettroscopia se la proteina ha caratteristiche spettroscopiche distinguibili o mediante saggi enzimatici se la proteina possiede un'attività enzimatica. Inoltre, le proteine possono essere isolate secondo la loro carica grazie alla isoelettrofocalizzazione . [30]
Per quanto riguarda le proteine naturali, una serie di fasi di purificazione possono rendersi necessarie per ottenere proteine sufficientemente pure per le applicazioni di laboratorio. Per semplificare questo processo, l' ingegneria genetica viene spesso utilizzata al fine di aggiungere caratteristiche chimiche alle proteine che le rendano facili da isolare senza compromettere la loro struttura o attività. Si agisce inserendo un " tag " che consiste di una specifica sequenza di amminoacidi, spesso una serie di residui di istidina (un " His-tag "), vengono inserite in un terminale della proteina. Come risultato, quando il lisato viene passato su una colonna cromatografica contenente nichel , i residui di istidina legano il nichel e si aggregano alla colonna, mentre le componenti senza tag passano senza impedimenti. Un certo numero di tag diversi sono stati sviluppati per aiutare i ricercatori a isolare proteine specifiche da miscele complesse. [31]
Localizzazione cellulare

Lo studio delle proteine in vivo spesso riguarda la loro sintesi e localizzazione all'interno della cellula. Anche se molte proteine intracellulari sono sintetizzate nel citoplasma mentre quelle di membrana sono secrete nel reticolo endoplasmatico , il modo di come le proteine vengano mirate a organelli specifici oa strutture cellulari è spesso poco chiaro. Una tecnica utile per valutare la localizzazione cellulare utilizza l'ingegneria genetica per esprimere in una cellula una proteina di fusione o una chimera, costituita dalla proteina naturale di interesse legata a una " gene reporter ", come laproteina fluorescente verde (GFP). [32] La posizione della proteina fusa all'interno della cellula può essere isolata ed efficacemente osservata con un microscopio [33] , come mostrato nella figura a fianco.
Altri metodi per chiarire la localizzazione cellulare delle proteine richiede l'uso di marcatori per comparti noti come il reticolo endoplasmatico , il Golgi , i lisosomi o vacuoli , i mitocondri , i cloroplasti , la membrana plasmatica , ecc. Con l'uso di versioni fluorescenti di questi marcatori o tramite anticorpi markers noti, diventa molto più semplice identificare la localizzazione di una proteina di interesse. Ad esempio, l' immunofluorescenza indiretta consentirà di dimostrare la posizione. I coloranti fluorescenti sono usati per etichettare compartimenti cellulari per uno scopo simile. [34]
Esistono ulteriori possibilità. Ad esempio, l' immunoistochimica di solito utilizza un anticorpo di una o più proteine di interesse che sono coniugate ad enzimi che producono segnali sia luminescenti che cromogenici e che poi possono essere confrontati tra i campioni, consentendo di ottenere le informazioni di localizzazione. Un'altra tecnica applicabile è il confronto nel gradiente di saccarosio (o altro materiale) mediante centrifugazione isopicnica . [35] Questa tecnica è maggiormente utilizzata per studi di larga scala.
Infine, il metodo considerato il gold standard per la localizzazione cellulare è l'utilizzo del microscopio elettronico . Questa tecnica utilizza anche un anticorpo per la proteina di interesse, con tecniche di microscopia elettronica classiche. Il campione viene preparato per il normale esame al microscopio elettronico, e poi trattato con un anticorpo per la proteina di interesse che è coniugata ad un materiale estremamente elettro-denso, di solito oro. Ciò consente sia la localizzazione dei dettagli ultrastrutturali, sia della proteina di interesse. [36]
Attraverso un'altra applicazione dell'ingegneria genetica, nota come mutagenesi sito specifica , i ricercatori possono alterare la sequenza proteica e quindi la sua struttura, la sua localizzazione cellulare e la suscettibilità alla regolazione. Questa tecnica permette anche l'incorporazione di amminoacidi non naturali nelle proteine, utilizzando tRNA modificati [37] e può consentire la progettazione di nuove proteine con nuove proprietà. [38]
Proteomica
L'insieme di tutte le proteine in una cellula o in un tipo di cellule è chiamato proteoma , e lo studio di tali insiemi di dati su larga scala viene identificato come il campo della proteomica , in analogia con il nome del campo della genomica . Le tecniche chiave sperimentali della proteomica includono l' elettroforesi bidimensionale , [39] che consente la separazione di un gran numero di proteine, la spettrometria di massa , [40] che consente una rapida identificazione ad alto rendimento di proteine e il sequenziamento dei peptidi, la tecnica del microarray per le proteine, [41] che permette la determinazione dei livelli relativi a un gran numero di proteine presenti in una cellula e lo screening del doppio ibrido che consente l'analisi sistematica delle interazioni proteina-proteina. [42] Il complemento totale di tali interazioni biologicamente possibili è conosciuta come interattoma . [43] Un tentativo sistematico di determinare le strutture delle proteine che rappresentano tutte le possibili ripiegature è conosciuta come genomica strutturale . [44]
Bioinformatica
Una vasta gamma di metodi di calcolo sono stati sviluppati per analizzare la struttura, la funzione e l'evoluzione delle proteine.
Lo sviluppo di tali strumenti è stata guidata dalla grande quantità di dati genomici e proteomici disponibili per una varietà di organismi, compreso il genoma umano . È semplicemente impossibile studiare tutte le proteine sperimentalmente, quindi solo poche vengono sottoposte a esperimenti di laboratorio, mentre gli strumenti computazionali vengono utilizzati per estrapolare i dati delle proteine simili. Tali proteine omologhe possono essere efficacemente identificate in organismi imparentati alla lontana dall'allineamento di sequenze. Il genoma e la sequenza genetica possono essere determinati grazie ad una grande varietà di strumenti e sfruttando alcune proprietà. Strumenti di profiling di sequenza possono trovare i siti di enzimi di restrizione , gli open reading frame nelle sequenze nucleotidiche e prevedere le strutture secondarie. Alberi filogenetici possono essere costruiti e ipotesi evolutive sviluppate utilizzando il software speciali, come ClustalW, per quanto riguarda l'ascendenza degli organismi moderni e dei geni che esprimono. Il campo della bioinformatica è ormai indispensabile per l'analisi dei geni e delle proteine.
Previsione della struttura e simulazione

Complementare al campo della genomica strutturale, la previsione della struttura delle proteine mira a sviluppare modi efficaci per fornire modelli plausibili per le proteine la cui struttura non è ancora stata determinata sperimentalmente. [45] Il modo più efficace per prevedere una struttura, conosciuto come modellazione omologa, si basa sulla esistenza di una struttura "modello" con similarità di sequenza con la proteina che deve essere individuata; obiettivo della genomica strutturale è quello di fornire una rappresentazione sufficiente delle strutture risolte per modellare la maggior parte di quelle che non lo sono state. [46] Anche se la produzione di modelli accurati rimane una sfida in cui solo le strutture dei modelli correlati sono disponibili, è stato suggerito che l'allineamento della sequenza sia il " collo di bottiglia " di questo processo, infatti modelli molto accurati potrebbero essere realizzati se fosse noto un "perfetto" allineamento della sequenza. [47] Molti metodi di previsione della struttura sono serviti per informare il settore emergente dell'ingegneria delle proteine, in cui ripiegature della nuova proteina sono già state esaminate. [48] Un problema computazionale più complesso è la previsione delle interazioni intermolecolari, come in un docking molecolare e nelle previsioni delle interazioni proteina-proteina. [49]
I processi di ripiegamento di proteine e le interazioni possono essere simulati utilizzando tecniche di meccanica molecolare , in particolare, la dinamica molecolare e il metodo Monte Carlo , che si avvalgono sempre di più del calcolo parallelo e distribuito (progetto Folding@home ; [50] modellazione molecolare su GPU ). La piegatura di piccoli domini proteici alfa-elica, come la testata di villina [51] e la proteina accessorio dell' HIV [52] sono state simulate con successo al calcolatore, e metodi ibridi che combinano la dinamica molecolare standard con i calcoli della meccanica quantistica hanno permesso lo studio degli stati elettronici della rodopsina . [53]
Proteine disordinate
Molte proteine (tra il 20 e il 40% di molti proteomi) contengono grandi segmenti strutturati biologicamente funzionali e possono essere classificati come proteine intrinsecamente disordinate . Predire il disordine di una proteina è, quindi, una parte sempre più importante della caratterizzazione della loro struttura.
Utilizzo
Le proteine sono necessarie nella dieta degli animali, in quanto gli animali non possono sintetizzare tutti gli amminoacidi di cui necessitano e devono ottenere alcuni di essi (i cosiddetti amminoacidi essenziali ) dal cibo. Attraverso il processo di digestione , gli animali spezzano le proteine ingerite in amminoacidi liberi, che sono successivamente impiegati nella creazione di nuove proteine strutturali, enzimi, ormoni, o come fonti di energia mediante la gluconeogenesi .
Le proteine possono essere purificate separandole dagli altri componenti cellulari utilizzando tecniche diverse, tra cui ultracentrifugazione , precipitazione , elettroforesi e cromatografia ; l'avvento dell' ingegneria genetica ha reso possibili molti metodi che facilitano la purificazione proteica. I metodi comunemente usati per studiare la struttura e la funzione delle proteine includono l' immunoistochimica , la mutagenesi sito specifica , la risonanza magnetica nucleare e la spettrometria di massa .
Il ruolo nell'alimentazione
La maggior parte dei microorganismi e delle piante possono sintetizzare tutti e 20 gli amminoacidi standard, mentre gli animali (incluso l'uomo) devono ottenere alcuni di essi con la dieta . [54] Gli amminoacidi che l'organismo non può sintetizzare sono detti " amminoacidi essenziali ". [55] Alcuni enzimi chiave che sintetizzano alcuni amminaocidi non sono presenti negli animali, tra cui l' aspartato chinasi , che catalizza il primo step nella sintesi di lisina , metionina e treonina a partire da aspartato . Se gli amminoacidi sono presenti nell'ambiente, i microorganismi possono risparmiare energia prelevandoli dall'ambiente circostante e limitando le proprie vie biosintetiche.
Negli animali gli amminoacidi sono ottenuti con il consumo di cibi contenenti proteine. Le proteine ingerite sono suddivise in amminoacidi tramite la digestione , [55] che generalmente prevede la denaturazione delle proteine nell'ambiente acido dello stomaco e l' idrolisi da parte di enzimi detti proteasi . Alcuni amminoacidi ingeriti sono usati nella biosintesi delle proteine, mentre altri sono convertiti in glucosio tramite la gluconeogenesi , o entrano a far parte del ciclo dell'acido citrico . Questo impiego di proteine come fonte energetica è particolarmente importante in condizioni di inedia in quanto permette di impiegare anche le proteine dell'organismo, in particolare quelle presenti a livello muscolare, come substrato per mantenere la vita. [56]
Valori nutrizionali
I due principali indici nutrizionali per gli alimenti che contengono proteine sono:
- Coefficiente di utilizzazione digestiva (CUD) = (azoto assorbito / azoto introdotto con la dieta)
- Utilizzazione proteica netta (NPU) = N trattenuto dall'organismo / N introdotto con la dieta. L'indice tiene conto sia dell'efficienza digestiva che del pattern di amminoacidi.
- Valore biologico (VB): indica la quantità di azoto effettivamente assorbito e utilizzato al netto delle perdite (urinarie, fecali, cutanee ecc.). Per uova e siero di latte è pari al 100%, un perfetto equilibrio tra aminoacidi assorbiti e tra amminoacidi ritenuti.
Storia ed etimologia
Le proteine sono state riconosciute come una classe distinta di molecole biologiche a partire dal XVIII secolo grazie agli studi condotti da Antoine Fourcroy ed altri, sulla base della capacità di tali sostanze di coagulare o flocculare sotto un trattamento con il calore o con l' acido . [57] In tale epoca, alcuni celebri esempi comprendevano l' albume , l' albumina del sangue , la fibrina e il glutine del frumento.
Le proteine sono state descritte dal chimico olandese Gerardus Johannes Mulder e gli fu attribuito il nome dal chimico svedese Jöns Jacob Berzelius nel 1838. [58] [59] Mulder effettuò analisi elementari sulle proteine comuni e scoprì che quasi tutte avevano la stessa formula empirica , C 400 H 620 N 100 O 120 P 1 S 1 . [60] Egli giunse alla conclusione erronea che esse fossero composte da un solo tipo, ma molto grande, di molecola. Il termine "proteina" per descrivere queste molecole è stata proposta da Berzelius, collega di Mulder; il termine deriva dalla parola greca ( proteios , πρώτειος ), che significa "primario", [61] "in testa" o "in piedi davanti", [62] Mulder continuò a identificare i prodotti dellai degradazione delle proteine, come l'aminoacido leucina di cui calcolò un peso molecolare , quasi corretto, di 131 Da . [60]
I primi scienziati nutrizionali, come il tedesco Carl von Voit , ritenevano che la proteina fosse il nutriente più importante per il mantenimento della struttura del corpo, poiché si pensava che "carne fa carne". [63] Karl Heinrich Ritthausen estese le forme proteiche note con la scoperta dell' acido glutammico . Al Connecticut Agricultural Experiment Station fu eseguito un dettagliato esame delle proteine vegetali da parte dello scienziato Thomas Osborne Burr . Lavorando con Lafayette Mendel e applicando la legge del minimo all'alimentazione dei ratti di laboratorio, fu possibile stabilire quali fossero gli amminoacidi essenziali . Lo studio fu continuato da William Cumming Rose . Fu grazie all'opera di Franz Hofmeister e Hermann Emil Fischer che si riuscì a identificare le proteine come polipeptidi. Il ruolo centrale delle proteine come enzimi negli organismi viventi non è stato pienamente accettato fino al 1926, quando James Batcheller Sumner dimostrò che l' ureasi era in realtà una proteina. [64]
La difficoltà di isolare proteine in grandi quantità rendeva molto difficile ai primi biochimici lo studio delle proteine. Quindi, i primi esperimenti erano focalizzate su quelle che potevano essere purificate più facilmente, come quelle del sangue, l'albume d'uovo, le varie tossine e enzimi metabolici/digestivi ottenuti nei macelli . Nel 1950, la Armour and Company purificò 1 kg di ribonucleasi A dal pancreas di un bovino e lo rese disponibile gratuitamente agli scienziati; ciò fece diventare la ribonucleasi A uno strumento importante per lo studio della biochimica per i decenni successivi. [60]

Linus Pauling è riconosciuto per aver previsto le regolari strutture secondarie proteiche a base di legami idrogeno , un'idea che era già stata proposta da William Astbury nel 1933. [65] Il successivo lavoro di Walter Kauzmann sulla denaturazione, [66] [67] basato in parte sul precedente studi di Kaj Linderstrøm-Lang , [68] ha contribuito una comprensione del ripiegamento delle proteine e della struttura mediata da interazioni idrofobiche.
La prima proteina sequenziata fu l' insulina nel 1949, grazie al lavoro di Frederick Sanger . Sanger determinò correttamente la sequenza di amminoacidi dell'insulina e quindi dimostrò definitivamente che le proteine sono costituite da polimeri lineari di amminoacidi anziché catene ramificate o colloidi . [69] Questa scoperta gli valse il Premio Nobel nel 1958.
Le prime strutture proteiche risolte furono quelle dell' emoglobina e della mioglobina , rispettivamente per merito di Max Perutz e Sir John Cowdery Kendrew , nel 1958. [70] [71] A partire dal 2014 la Protein Data Bank possiede oltre 90.000 strutture proteiche a livello atomico. [72] In tempi più recenti, lacriomicroscopia elettronica di grandi assiemi macromolecolari [73] e la predizione computazionale delle strutture proteiche dei piccoli domini proteici [74] sono due metodi di approccio alla risoluzione atomica.
Note
- ^ Gutteridge A, Thornton JM, Understanding nature's catalytic toolkit , in Trends in Biochemical Sciences , vol. 30, n. 11, 2005, pp. 622–29, DOI : 10.1016/j.tibs.2005.09.006 , PMID 16214343 .
- ^ Murray et al ., p. 31.
- ^ Murray et al ., p. 19.
- ^ Nelson DL, Cox MM, Lehninger's Principles of Biochemistry , 4th, New York, New York, WH Freeman and Company, 2005.
- ^ a b c Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipurksy SL, Darnell J, Molecular Cell Biology , 5th, New York, New York, WH Freeman and Company, 2004.
- ^ ( EN ) IUPAC Gold Book, "poltypeptides"
- ^ ( EN ) IUPAC Gold Book, "proteins"
- ^ Murray et al ., pp. 30–34.
- ^ a b vanHolde1996 , pp. 1002–42 .
- ^ Dobson CM, The nature and significance of protein folding , in Pain RH (ed.) (a cura di), Mechanisms of Protein Folding , Oxford, Oxfordshire, Oxford University Press, 2000, pp. 1–28, ISBN 0-19-963789-X .
- ^ Thomas Bruckdorfer, Oleg Marder, Fernando Albericio, From Production of Peptides in Milligram Amounts for Research to Multi-Tons Quantities for Drugs of the Future , in Current Pharmaceutical Biotechnology , vol. 5, n. 1, 2004, pp. 29–43, DOI : 10.2174/1389201043489620 .
- ^ Dirk Schwarzer, Philip A Cole, Protein semisynthesis and expressed protein ligation: chasing a protein's tail , in Current Opinion in Chemical Biology , vol. 9, n. 6, 2005, pp. 561–569, DOI : 10.1016/j.cbpa.2005.09.018 .
- ^ Stephen BH Kent, Total chemical synthesis of proteins , in Chemical Society Reviews , vol. 38, n. 2, 2009, p. 338, DOI : 10.1039/b700141j .
- ^ Voet D, Voet JG. (2004). Biochemistry Vol 1 3rd ed. Wiley: Hoboken, NJ.
- ^ Sankaranarayanan R, Moras D, The fidelity of the translation of the genetic code , in Acta Biochimica Polonica , vol. 48, n. 2, 2001, pp. 323–35, PMID 11732604 .
- ^ van Holde and Mathews, pp. 830–49.
- ^ Copland JA, Sheffield-Moore M, Koldzic-Zivanovic N, Gentry S, Lamprou G, Tzortzatou-Stathopoulou F, Zoumpourlis V, Urban RJ, Vlahopoulos SA, Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible? , in BioEssays: news and reviews in molecular, cellular and developmental biology , vol. 31, n. 6, 2009, pp. 629–41, DOI : 10.1002/bies.200800138 , PMID 19382224 .
- ^ Samarin S, Nusrat A, Regulation of epithelial apical junctional complex by Rho family GTPases , in Frontiers in bioscience: a journal and virtual library , vol. 14, n. 14, 2009, pp. 1129–42, DOI : 10.2741/3298 , PMID 19273120 .
- ^ Bairoch A, The ENZYME database in 2000 ( PDF ), in Nucleic Acids Research , vol. 28, n. 1, 2000, pp. 304–305, DOI : 10.1093/nar/28.1.304 , PMC 102465 , PMID 10592255 (archiviato dall' url originale il 1º giugno 2011) .
- ^ Radzicka A, Wolfenden R, A proficient enzyme , in Science , vol. 267, n. 5194, 1995, pp. 90–93, Bibcode : 1995Sci...267...90R , DOI : 10.1126/science.7809611 , PMID 7809611 .
- ^ EBI External Services, The Catalytic Site Atlas at The European Bioinformatics Institute , su ebi.ac.uk . URL consultato il 16 gennaio 2011 .
- ^ Branden and Tooze, pp. 251–81.
- ^ van Holde and Mathews, pp. 247–50.
- ^ van Holde and Mathews, pp. 220–29.
- ^ Rüdiger H, Siebert HC, Solís D, Jiménez-Barbero J, Romero A, von der Lieth CW, Diaz-Mariño T, Gabius HJ, Medicinal chemistry based on the sugar code: fundamentals of lectinology and experimental strategies with lectins as targets , in Current Medicinal Chemistry , vol. 7, n. 4, 2000, pp. 389–416, DOI : 10.2174/0929867003375164 , PMID 10702616 .
- ^ Branden and Tooze, pp. 232–34.
- ^ van Holde and Mathews, pp. 178–81.
- ^ van Holde and Mathews, pp. 258–64; 272.
- ^ Murray et al ., pp. 21–24.
- ^ Hey J, Posch A, Cohen A, Liu N, Harbers A, Fractionation of complex protein mixtures by liquid-phase isoelectric focusing , in Methods in Molecular Biology , Methods in Molecular Biology™, vol. 424, 2008, pp. 225–39, DOI : 10.1007/978-1-60327-064-9_19 , ISBN 978-1-58829-722-8 , PMID 18369866 .
- ^ Terpe K, Overview of tag protein fusions: from molecular and biochemical fundamentals to commercial systems , in Applied Microbiology and Biotechnology , vol. 60, n. 5, 2003, pp. 523–33, DOI : 10.1007/s00253-002-1158-6 , PMID 12536251 .
- ^ Stepanenko OV, Verkhusha VV, Kuznetsova IM, Uversky VN, Turoverov KK,Fluorescent proteins as biomarkers and biosensors: throwing color lights on molecular and cellular processes , in Current Protein & Peptide Science , vol. 9, n. 4, 2008, pp. 338–69, DOI : 10.2174/138920308785132668 , PMC 2904242 , PMID 18691124 .
- ^ Yuste R, Fluorescence microscopy today , in Nature Methods , vol. 2, n. 12, 2005, pp. 902–904, DOI : 10.1038/nmeth1205-902 , PMID 16299474 .
- ^ Margolin W, Green fluorescent protein as a reporter for macromolecular localization in bacterial cells , in Methods (San Diego, Calif.) , vol. 20, n. 1, 2000, pp. 62–72, DOI : 10.1006/meth.1999.0906 , PMID 10610805 .
- ^ Walker JH, Wilson K, Principles and Techniques of Practical Biochemistry , Cambridge, UK, Cambridge University Press, 2000, pp. 287–89, ISBN 0-521-65873-X .
- ^ Mayhew TM, Lucocq JM,Developments in cell biology for quantitative immunoelectron microscopy based on thin sections: a review , in Histochemistry and Cell Biology , vol. 130, n. 2, 2008, pp. 299–313, DOI : 10.1007/s00418-008-0451-6 , PMC 2491712 , PMID 18553098 .
- ^ Hohsaka T, Sisido M, Incorporation of non-natural amino acids into proteins , in Current Opinion in Chemical Biology , vol. 6, n. 6, 2002, pp. 809–15, DOI : 10.1016/S1367-5931(02)00376-9 , PMID 12470735 .
- ^ Cedrone F, Ménez A, Quéméneur E, Tailoring new enzyme functions by rational redesign , in Current Opinion in Structural Biology , vol. 10, n. 4, 2000, pp. 405–10, DOI : 10.1016/S0959-440X(00)00106-8 , PMID 10981626 .
- ^ Görg A, Weiss W, Dunn MJ, Current two-dimensional electrophoresis technology for proteomics , in Proteomics , vol. 4, n. 12, 2004, pp. 3665–85, DOI : 10.1002/pmic.200401031 , PMID 15543535 .
- ^ Conrotto P, Souchelnytskyi S, Proteomic approaches in biological and medical sciences: principles and applications , in Experimental Oncology , vol. 30, n. 3, 2008, pp. 171–80, PMID 18806738 .
- ^ Joos T, Bachmann J, Protein microarrays: potentials and limitations , in Frontiers in Bioscience , vol. 14, n. 14, 2009, pp. 4376–85, DOI : 10.2741/3534 , PMID 19273356 .
- ^ Koegl M, Uetz P, Improving yeast two-hybrid screening systems , in Briefings in Functional Genomics & Proteomics , vol. 6, n. 4, 2007, pp. 302–12, DOI : 10.1093/bfgp/elm035 , PMID 18218650 (archiviato dall' url originale il 14 aprile 2009) .
- ^ Plewczyński D, Ginalski K, The interactome: predicting the protein–protein interactions in cells , in Cellular & Molecular Biology Letters , vol. 14, n. 1, 2009, pp. 1–22, DOI : 10.2478/s11658-008-0024-7 , PMID 18839074 .
- ^ Zhang C, Kim SH, Overview of structural genomics: from structure to function , in Current Opinion in Chemical Biology , vol. 7, n. 1, 2003, pp. 28–32, DOI : 10.1016/S1367-5931(02)00015-7 , PMID 12547423 .
- ^ Zhang Y,Progress and challenges in protein structure prediction , in Current Opinion in Structural Biology , vol. 18, n. 3, 2008, pp. 342–48, DOI : 10.1016/j.sbi.2008.02.004 , PMC 2680823 , PMID 18436442 .
- ^ Xiang Z,Advances in homology protein structure modeling , in Current Protein and Peptide Science , vol. 7, n. 3, 2006, pp. 217–27, DOI : 10.2174/138920306777452312 , PMC 1839925 , PMID 16787261 .
- ^ Zhang Y, Skolnick J, The protein structure prediction problem could be solved using the current PDB library , in Proceedings of the National Academy of Sciences USA , vol. 102, n. 4, 2005, pp. 1029–34, Bibcode : 2005PNAS..102.1029Z , DOI : 10.1073/pnas.0407152101 , PMC 545829 , PMID 15653774 .
- ^ Kuhlman B, Dantas G, Ireton GC, Varani G, Stoddard BL, Baker D, Design of a novel globular protein fold with atomic-level accuracy , in Science , vol. 302, n. 5649, 2003, pp. 1364–68, Bibcode : 2003Sci...302.1364K , DOI : 10.1126/science.1089427 , PMID 14631033 .
- ^ Ritchie DW, Recent progress and future directions in protein–protein docking , in Current Protein and Peptide Science , vol. 9, n. 1, 2008, pp. 1–15, DOI : 10.2174/138920308783565741 , PMID 18336319 .
- ^ Scheraga HA, Khalili M, Liwo A, Protein-folding dynamics: overview of molecular simulation techniques , in Annual Review of Physical Chemistry , vol. 58, 2007, pp. 57–83, Bibcode : 2007ARPC...58...57S , DOI : 10.1146/annurev.physchem.58.032806.104614 , PMID 17034338 .
- ^ Zagrovic B, Snow CD, Shirts MR, Pande VS, Simulation of folding of a small alpha-helical protein in atomistic detail using worldwide-distributed computing , in Journal of Molecular Biology , vol. 323, n. 5, 2002, pp. 927–37, DOI : 10.1016/S0022-2836(02)00997-X , PMID 12417204 .
- ^ Herges T, Wenzel W, In silico folding of a three helix protein and characterization of its free-energy landscape in an all-atom force field , in Physical Review Letters , vol. 94, n. 1, 2005, p. 018101, Bibcode : 2005PhRvL..94a8101H , DOI : 10.1103/PhysRevLett.94.018101 , PMID 15698135 .
- ^ Hoffmann M, Wanko M, Strodel P, König PH, Frauenheim T, Schulten K, Thiel W, Tajkhorshid E, Elstner M, Color tuning in rhodopsins: the mechanism for the spectral shift between bacteriorhodopsin and sensory rhodopsin II , in Journal of the American Chemical Society , vol. 128, n. 33, 2006, pp. 10808–18, DOI : 10.1021/ja062082i , PMID 16910676 .
- ^ Donald Voet, Judith G. Voet; Charlotte W. Pratt,Fundamentals of Biochemistry: Life at the Molecular Level , John Wiley & Sons, 1º aprile 2008, p. 1264, ISBN 978-0-470-23396-2 .
- ^ a b Briggs .
- ^ JT. Brosnan, Interorgan amino acid transport and its regulation. , in J Nutr , vol. 133, 6 Suppl 1, giugno 2003, pp. 2068S-2072S, PMID 12771367 .
- ^ Thomas Burr Osborne (1909): The Vegetable Proteins , History pp 1 to 6, from archive.org
- ^ Bulletin des Sciences Physiques et Naturelles en Néerlande (1838). pg 104. SUR LA COMPOSITION DE QUELQUES SUBSTANCES ANIMALES
- ^ Hartley Harold, Origin of the Word 'Protein.' , in Nature , vol. 168, n. 4267, 1951, pp. 244–244, DOI : 10.1038/168244a0 .
- ^ a b c Perrett D, From 'protein' to the beginnings of clinical proteomics , in Proteomics: Clinical Applications , vol. 1, n. 8, 2007, pp. 720–38, DOI : 10.1002/prca.200700525 , PMID 21136729 .
- ^ Reynolds JA, Tanford C, Nature's Robots: A History of Proteins (Oxford Paperbacks) , New York, New York, Oxford University Press, 2003, p. 15, ISBN 0-19-860694-X .
- ^ New Oxford Dictionary of English
- ^ ( DE ) Bischoff TLW, Voit, C, Die Gesetze der Ernaehrung des Pflanzenfressers durch neue Untersuchungen festgestellt , Leipzig, Heidelberg, 1860.
- ^ Sumner JB, The isolation and crystallization of the enzyme urease. Preliminary paper ( PDF ), in Journal of Biological Chemistry , vol. 69, n. 2, 1926, pp. 435–41.
- ^ Pauling L, Corey RB, Branson HR, The structure of proteins: two hydrogen-bonded helical configurations of the polypeptide chain ( PDF ), in Proceedings of the National Academy of Sciences USA , vol. 37, n. 5, 1951, pp. 235–40, Bibcode : 1951PNAS...37..235P , DOI : 10.1073/pnas.37.5.235 , PMC 1063348 , PMID 14834145 .
- ^ Kauzmann W, Structural factors in protein denaturation , in Journal of Cellular Physiology. Supplement , vol. 47, Suppl 1, 1956, pp. 113–31, DOI : 10.1002/jcp.1030470410 , PMID 13332017 .
- ^ Kauzmann W, Some factors in the interpretation of protein denaturation , in Advances in Protein Chemistry , Advances in Protein Chemistry, vol. 14, 1959, pp. 1–63, DOI : 10.1016/S0065-3233(08)60608-7 , ISBN 978-0-12-034214-3 , PMID 14404936 .
- ^ Kalman SM, Linderstrom-Lang K, Ottesen M, Richards FM, Degradation of ribonuclease by subtilisin , in Biochimica et Biophysica Acta , vol. 16, n. 2, 1955, pp. 297–99, DOI : 10.1016/0006-3002(55)90224-9 , PMID 14363272 .
- ^ Sanger F,The terminal peptides of insulin , in Biochemical Journal , vol. 45, n. 5, 1949, pp. 563–74, PMC 1275055 , PMID 15396627 .
- ^ Muirhead H, Perutz M, Structure of hemoglobin. A three-dimensional fourier synthesis of reduced human hemoglobin at 5.5 Å resolution , in Nature , vol. 199, n. 4894, 1963, pp. 633–38, Bibcode : 1963Natur.199..633M , DOI : 10.1038/199633a0 , PMID 14074546 .
- ^ Kendrew J, Bodo G, Dintzis H, Parrish R, Wyckoff H, Phillips D, A three-dimensional model of the myoglobin molecule obtained by X-ray analysis , in Nature , vol. 181, n. 4610, 1958, pp. 662–66, Bibcode : 1958Natur.181..662K , DOI : 10.1038/181662a0 , PMID 13517261 .
- ^ RCSB Protein Data Bank , su rcsb.org . URL consultato il 5 aprile 2014 (archiviato dall' url originale il 18 aprile 2015) .
- ^ Zhou ZH,Towards atomic resolution structural determination by single-particle cryo-electron microscopy , in Current Opinion in Structural Biology , vol. 18, n. 2, 2008, pp. 218–28, DOI : 10.1016/j.sbi.2008.03.004 , PMC 2714865 , PMID 18403197 .
- ^ Keskin O, Tuncbag N, Gursoy A, Characterization and prediction of protein interfaces to infer protein-protein interaction networks , in Current Pharmaceutical Biotechnology, vol. 9, nº 2, 2008, pp. 67–76, DOI : 10.2174/138920108783955191 , PMID 18393863 .
Bibliografia
- ( EN ) Christopher K. Mathews, Kensal Edward Van Holde, Biochemistry: Guide , Benjamin-Cummings Publishing Company, 1996, ISBN 978-0-8053-3931-4 .
- ( EN ) Dobson CM, The nature and significance of protein folding , in Pain RH (ed.) (a cura di), Mechanisms of Protein Folding , Oxford, Oxfordshire, Oxford University Press, 2000, ISBN 0-19-963789-X .
- ( EN ) Walker JH, Wilson K, Principles and Techniques of Practical Biochemistry , Cambridge, UK, Cambridge University Press, 2000, ISBN 0-521-65873-X .
- ( EN ) Donald Voet, Judith G. Voet; Charlotte W. Pratt,Fundamentals of Biochemistry: Life at the Molecular Level , John Wiley & Sons, 2008, ISBN 978-0-470-23396-2 .
- ( EN ) Reynolds JA, Tanford C, Nature's Robots: A History of Proteins (Oxford Paperbacks) , New York, New York, Oxford University Press, 2003, ISBN 0-19-860694-X .
- ( EN ) David Briggs, Mark Wahlqvist, Visionary Voyager, Food Facts - Protein , Penguin Books, 1998.
Voci correlate
Altri progetti
-
 Wikiquote contiene citazioni sulla proteina
Wikiquote contiene citazioni sulla proteina -
 Wikibooks contiene testi o manuali sulla proteina
Wikibooks contiene testi o manuali sulla proteina -
 Wikizionario contiene il lemma di dizionario « proteina »
Wikizionario contiene il lemma di dizionario « proteina » -
 Wikimedia Commons contiene immagini o altri file sulla proteina
Wikimedia Commons contiene immagini o altri file sulla proteina
Collegamenti esterni
- Proteine , su Treccani.it – Enciclopedie on line , Istituto dell'Enciclopedia Italiana .
- Proteine , su sapere.it , De Agostini .
- ( EN ) Proteine , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- ( EN ) Opere riguardanti Proteine , su Open Library , Internet Archive .
- Esperienze in laboratorio - Le proteine , su itchiavari.org .
- Purificazione di proteine e dosaggio quantitativo : descrizione delle tecniche di purificazione delle proteine, principio ed esempi di dosaggio quantitativo.
- Il cibo e le proteine , su my-personaltrainer.it .
| Controllo di autorità | Thesaurus BNCF 51 · LCCN ( EN ) sh85107666 · GND ( DE ) 4076388-2 · BNF ( FR ) cb11936447p (data) · NDL ( EN , JA ) 00572676 |
|---|