Sulfură de zinc
| Sulfură de zinc | |
|---|---|
| Numele IUPAC | |
| sulfură de zinc | |
| Caracteristici generale | |
| Formula moleculară sau brută | ZnS |
| Masa moleculară ( u ) | 97,43 g / mol |
| Aspect | solid alb inodor |
| numar CAS | |
| Numărul EINECS | 215-251-3 |
| PubChem | 14821 |
| ZÂMBETE | S=[Zn] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 4,01 (20 ° C) |
| Solubilitate în apă | (20 ° C) aproape insolubil |
| Temperatură de topire | 1185 ° C (sublimează) |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | –204.6 |
| Proprietăți toxicologice | |
| LD 50 (mg / kg) | > 2000 (șobolan oral) [1] |
| Informații de siguranță | |
| Fraze H | --- |
| Sfaturi P | --- |
Sulfura de zinc este compusul anorganic cu formula ZnS. Apare în mod natural în principal în sfalerita minerală sau în forma mai rară a wurtzitei . Sphalerita este principala sursă industrială de zinc metalic. Mineralele sunt de obicei negre datorită prezenței diferitelor impurități, dar ZnS pur este un solid alb inodor. ZnS este utilizat în principal ca pigment , dar își găsește și aplicația ca material luminiscent pentru fosfor , ca semiconductor și pentru materiale optice.
fundal
Fosforescența sulfurii de zinc a fost documentată pentru prima dată în 1866 de chimistul francez Théodore Sidot . [2] ZnS a fost folosit de Ernest Rutherford și colab în primii ani de fizică nucleară ca detector de scintilație , deoarece emite lumină atunci când este excitat de raze X sau de fascicule de electroni, făcându-l util pentru ecranele cu raze X și tuburile catodice . [3]
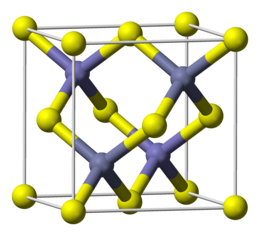
Structura


ZnS există în două forme cristaline principale, care constituie un exemplu tipic de polimorfism . Aceste două structuri cristaline sunt importante, deoarece sunt observate și în mulți alți compuși cu formula generală AB și sunt desemnate în mod obișnuit sub numele mineralelor în care apar, și anume blenda de zinc (sau sfalerita ) și wurtzita . În ambele structuri, atât zincul, cât și sulful sunt tetracoordonate; diferența de structură apare dintr-un ambalaj diferit al atomilor. [3]
Cea mai obișnuită formă, stabilă la temperatură obișnuită, este tipul de blendă de zinc, care poate fi descris ca un ambalaj cubic compact de anioni sulfuri, cu ioni Zn 2+ care ocupă jumătate din siturile tetraedrice. Constanta rețelei este a = 540,93 pm . [4] Această rețea cristalină este similară cu cea a diamantului , care se obține prin schimbul tuturor atomilor de Zn și S cu atomi de carbon. [3]
Structura asemănătoare wurtzitei devine mai stabilă decât blenda de zinc la peste 1020 ° C, dar wurtzita minerală este încă prezentă în natură, deoarece viteza de interconversie între cele două structuri diferite este foarte lentă pe scara de timp geologică. [5] În wurtzită, ambalarea anionilor sulfuri este hexagonală compactă , cu ioni Zn 2+ care ocupă jumătate din siturile tetraedrice. Constantele de rețea sunt a = 381,1 și c = 623,4 pm. [4]
Sinteză
Sulfura de zinc este obținută de obicei din depozite naturale sau din materiale reziduale din alte procese, cum ar fi turnătorii, zgură și saramură. [6] Este, de asemenea, un produs secundar al sintezei de amoniac din metan , deoarece oxidul de zinc este utilizat pentru captarea impurităților de hidrogen sulfurat prezente în gazele naturale :
- ZnO + H 2 S → ZnS + H 2 O
În laborator, poate fi produs prin aprinderea unui amestec de zinc și sulf sau prin tratarea unei soluții de sare solubilă a zincului cu o sursă de ioni sulfură, cum ar fi sulfura de hidrogen. Această reacție stă la baza analizei gravimetrice a zincului: [7]
- Zn 2+ + S 2− → ZnS
Aplicații
Ca pigment
Cea mai importantă aplicare a sulfurii de zinc este ca pigment . În asociere cu sulfatul de bariu formează un pigment alb numit litoponă , utilizat pe scară largă în vopselele interioare. [6]
Ca material luminescent
Sulfura de zinc, cu adăugarea câtorva ppm de activator, este utilizată ca fosfor în diferite aplicații, cum ar fi tuburile cu raze catodice , ecranele cu raze X și produsele fosforescente . [3] Folosind argintul ca activator, se obține o culoare albastru deschis, cu emisii maxime la 450 nm . Cu manganul are o culoare galben-portocalie, la aproximativ 590 nm. Cuprul permite o luminescență verzuie de lungă durată, tipică obiectelor fosforescente comerciale. Sulfura de zinc dopată cu cupru (ZnS: Cu) este utilizată și în panourile electroluminescente . [8]
Ca material optic
Sulfura de zinc este utilizată ca material optic pentru regiunea infraroșie , deoarece este transparentă la radiații de lungimi de undă de până la 12 micrometri . Puteți construi ferestre sau chiar lentile. Este, de asemenea, cunoscut sub numele comerciale Cleartran și Irtran-2 .
Ca semiconductor
Atât sfalerita, cât și wurtzita sunt semiconductori intrinseci cu un spațiu de bandă mare. Sphalerita are o distanță de bandă de 3,54 eV la 300 K, în timp ce wurtzita are o distanță de bandă de 3,91 eV. Sulfura de zinc poate fi dopată atât în tipul n, cât și în tipul p .
Informații privind toxicitatea / siguranța
ZnS este disponibil comercial. Compusul nu este clasificat ca periculos conform Directivei 67/548 / CEE, dar poate elibera gaze toxice (H 2 S) la contactul cu acizii. Poate fi dăunător prin inhalare, ingestie și contact cu pielea. Nu există dovezi ale efectelor cancerigene. Nu există date privind vătămarea mediului. [9]
Notă
Bibliografie
- ( EN ) G. Auer, P. Woditsch, A. Westerhaus, J. Kischkewitz, W.-D. Griebler și M. Liedekerke, Pigmenți, anorganici, 2. Pigmenți albi , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2009, DOI : 10.1002 / 14356007.n20_n01 , ISBN.
- ( EN ) KA Franz, WG Kehr, A. Siggel, J. Wieczoreck și W. Adam, Luminescent Materials , în Ullmann's Encyclopedia of Industrial Chemistry , Wiley-VCH, 2002, DOI : 10.1002 / 14356007.a15_519 .
- GESTIS, Sulfură de zinc , pe pagina Sulfură de zinc din baza de date GESTIS . Adus la 4 martie 2014 .
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( EN ) CE Housecroft și AG Sharpe, Chimie anorganică , ediția a III-a, Harlow (Anglia), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6 .
- ( RO ) W.-K. Li, G.-D- Zhou, TCW Mak, Advanced Structural Inorganic Chemistry , New York, Oxford University Press, 2008, ISBN 978–0–19–921694–9 .
- ( EN ) J. Mendham; RC Denney, JD; Barnes, MJK Thomas, Vogel's Quantitative Chemical Analysis , ediția a 6-a, New York, Prentice Hall, 2000, ISBN 0-582-22628-7 .
- MT Sidot, Sur les propriétés de la blende hexagonale , în Compt. Rupe. , vol. 63, 1866, pp. 188-189. Accesat la 5 martie 2014 .
- Sigma-Aldrich, Fisa cu date de siguranta a sulfurii de zinc .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre sulfura de zinc
Wikimedia Commons conține imagini sau alte fișiere despre sulfura de zinc
linkuri externe
- ( EN ) Sulfură de zinc , pe Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Compoziția fosforilor CRT , pe geocities.com (arhivat din original la 1 ianuarie 2008) .
- Filtre IR Universitatea din Reading
| Controlul autorității | Tezaur BNCF 36255 · LCCN (EN) sh85149872 · BNF (FR) cb12482848g (data) |
|---|