Istoria industriei chimice
Istoria industriei chimice , în fiecare fază, demonstrează complexitatea interacțiunii dintre cunoștințe și producția materială.
Rezultatele obținute de chimist în activitatea experimentală sau în reflecția teoretică au necesitat (și necesită) o mediere complicată, adesea imprevizibilă, între tejgheaua de laborator și realitatea industrială.
Industria chimică s-a bazat inițial pe cunoștințele tipice chimistului de laborator, dar industrializarea ulterioară a celor mai dispar procese chimice, determinată de nevoile continue ale pieței, care a necesitat o cantitate tot mai mare de produse, a însemnat că cifra chimistului s- a alăturat ulterior celui al inginerului , agronomului , medicului , cu un domeniu nesfârșit de intervenție, care de-a lungul a două secole a ajuns să pătrundă în întregime civilizația industrială , atât în aspectele productive, cât și în cele din viață zilnic.
Chimia este prin definiție știința transformării substanțelor. Flexibilitatea industriei chimice, menținând în același timp limita constantă a cantității de investiții imobilizate în plante, a crescut odată cu dezvoltarea cunoștințelor în sine și s-a desfășurat pe deplin în timpul conflictelor economice și militare din secolul al XX-lea .
Istoria relației dintre știință, chimie și industrie arată că este posibil să se obțină cele mai disparate produse pornind de la o anumită bază de materii prime și că, în același timp, este posibil să se obțină aceleași produse folosind diferite materii prime; Prin urmare, este necesar să se facă alegeri cu privire la tipul de proces industrial care trebuie urmat pentru a obține un produs specific, ponderat pe baza diferiților factori, inclusiv factorul economic, factorul de siguranță și factorul de mediu. Mai mult, industria chimică poate furniza altor sectoare de producție sau consumatorului final, produse intrinsec „diferite”, capabile să joace același „rol” chimic ( solvenți , detergenți ), mecanic ( aliaje , fibre , lipici ), energie. ( combustibili ), estetici ( coloranți , produse cosmetice ) sau fiziologice ( medicamente ).
Creșterea răspândirii produselor chimice în civilizația industrială a diferențiat producția în numeroase sectoare, caracterizate prin propria lor „istorie”, cu etape de dezvoltare și maturitate repartizate în timp.
Unele linii distinctive pot fi trasate în istoria industriei chimice:
- marea industrie chimică anorganică , născută din revoluția industrială ;
- chimie organică industrială a produselor „ chimice ” ( produse chimice fine), înflorite între jumătatea secolului al XIX-lea și mijlocul secolului al XX-lea ;
- reînnoirea tehnologiilor de sinteză, cu căutarea condițiilor extreme de reacție (în primele decenii ale secolului al XX-lea);
- apariția industriei organice grele de astăzi;
- apariția modernă a tehnicilor sintetice legate de biotehnologii .
Origini și dezvoltare a industriei chimice (1750 - 1900)
Sectorul industriei chimice care a realizat mai întâi o producție vizibilă din punct de vedere economic a fost cel al alcalinilor . A atins maturitatea tehnologică în ultimele decenii ale secolului al XIX-lea .
De-a lungul secolului al XIX-lea, termenul „industrie alcalină” însemna un sistem de producții diferite, care includea sodă , sodă caustică și, din punct de vedere lingvistic necorespunzător, acid sulfuric . La aceste producții s-a adăugat după 1870 fabricarea prafului de albire , un produs esențial pentru vremea respectivă. Industria alcalină s-a plasat în serviciul altor sectoare: în primul rând sectorul textil , conducând întreaga revoluție industrială, apoi cele ale săpunului , sticlei , hârtiei , toate legate de consumul civil într-o mare creștere odată cu răspândirea unor niveluri modeste de sonde - a fi .
Unii „alcali” fuseseră pregătiți și folosiți de ceva timp. În special, soda (carbonat de sodiu) a fost obținută prin levigarea cenușii unor alge și specii de plante prezente în mlaștinile sălcii, în timp ce potasiu (carbonat de potasiu ) a putut fi obținut oriunde au fost pădurile de incinerat. Derivații caustici de sodă și potasiu au fost obținuți prin tratament cu var viu ( caustificare a carbonatului ). Soda caustică a fost apreciată în special în fabricile de săpun, întrucât a permis producția de săpunuri solide, de valoare comercială mai mare decât cele lichide (obținute prin tratarea grăsimilor cu potasiu caustic).
Sifonul Leblanc

Datorită creșterii cererii, prețul alcalinilor a crescut semnificativ în prima jumătate a secolului al XVIII-lea , până când a fost întrezărită producția din alte materii prime, altele decât legumele. În 1736 francezii Henri Louis Duhamel du Monceau au dovedit că sarea obișnuită era un compus bazic al sifonului și al băuturilor sărate ( acid clorhidric ). Când chimistul englez Joseph Black a stabilit că soda și potasa nu erau altceva decât compușii caustici corespunzători combinați cu aerul fix ( dioxid de carbon ), a apărut și legătura dintre materiile prime ușor accesibile, precum saramură , calcar și sodă, dar a fost necesare trei decenii de propuneri și încercări practice înainte de a ajunge la o „soluție” acceptabilă.
În 1775 Academia de Științe din Paris oferise un premiu uriaș în bani pentru cei care au reușit să obțină sifon din saramură. Nicolas Leblanc a modificat unele procese cunoscute, realizând un proces în două etape: în prima etapă saramura a fost transformată în sulfat de sodiu , în a doua sulfatul a fost amestecat cu cărbune și carbonat de calciu , iar prin încălzire soda și sulfura de calciu au fost obținute. Soda a fost levigată și a rămas un nămol conținând carbon nebunat, sodă neachivată și sulfură de calciu, ușor descompuse cu vapori de hidrogen sulfurat . Este evident că în această versiune primordială s-au pierdut complet două componente esențiale: clorul sării a fost dispersat în aer sub formă de clorură de hidrogen , sulful acidului sulfuric a rămas „blocat” într-un caput mortuum pestilențial . În afară de aceste puncte negative, procesul pentru acele vremuri a fost cu adevărat benefic.
Leblanc a fost copleșit de evenimentele Revoluției Franceze , care l-a ghilotinat pe ducele de Orleans (finanțatorul său) în 1793 și a anulat brevetele procesului. După moartea sa prin sinucidere (în 1806 ), a fost necesar să se aștepte revoluția industrială pentru ca procesul Leblanc să fie reevaluat. Charles Tennant a introdus procesul Leblanc în St. Rollox încă din 1818 , dar un impozit foarte mare pe sare a împiedicat dezvoltarea și răspândirea acestuia. În 1825 obstacolul a fost eliminat și prețul sării a scăzut la o cincizecime din valoarea sa anterioară. În același an, James Muspratt a început procesul la scară largă în St. Helens , îmbunătățind calitatea produsului vândut. Cenușa sa neagră conținea deja un procent din greutate de sodă dublu comparativ cu standardul anterior (40% față de 20%), împreună cu impuritățile clorurilor și sulfurilor, dar în 1830 a început să comercializeze cenușa albă , adică carbonatul de sodiu anhidru .
Soda caustică a fost preparată de utilizatorii finali până la începutul anilor 1850 , când William Gossage a început să o pregătească din partea cea mai impură a leșurilor Leblanc și a pus-o pe piață în containere de fier .
Soda Solvay și problema mediului
Sistemul tehnic al sifonului Leblanc a rămas substanțial neschimbat până în 1863 , când printr-o singură coincidență s-a trezit supus unei duble presiuni: economică și politică. Primul a venit din propunerea pentru un proces alternativ de către belgianul Ernest Solvay , al doilea a fost legea engleză anti- poluare nepublicată, Legea Alcali .
Noțiunile științifice care stau la baza noului proces erau cunoscute încă din anii 1820 : dacă dioxidul de carbon era barbotat într-o soluție de sare saturată cu amoniac , se obținea un precipitat de bicarbonat de sodiu , nu foarte solubil, din care, prin încălzire, soda oftată. Metoda în practică ridicase probleme de inginerie de neîntrerupt, până când în mâinile lui Ernest Solvay și a fratelui său Alfred - după ani de încercări - a devenit practicabilă. Pasul decisiv a fost făcut cu dezvoltarea unui anumit turn de carbonatare ; s-au produs îmbunătățiri suplimentare în cuptoare pentru producerea de dioxid de carbon și pentru calcinarea bicarbonatului. Société Solvay et Cie a fost fondată în 1863, iar drepturile de producție pentru Anglia au fost cumpărate de Ludwig Mond în 1872 .
Din acel moment, competiția dintre cele două procese a devenit acerbă. În 1874, doar 30.000 de tone de sodă Solvay au contribuit la totalul de 525.000 de tone produse în întreaga lume; unsprezece ani mai târziu, 365.000 din 800.000 de tone de sodă s-au datorat procesului Solvay. „Depășirea” a avut loc la scurt timp după aceea și în 1902 uzinele Solvay au produs 1.650.000 t, iar o marjă „reziduală” de 150.000 t a fost lăsată pentru procesul Leblanc. Aceste cifre demonstrează, pe de o parte, măreția producției chimice de bază la sfârșitul secolului al XIX-lea și, pe de altă parte, rezistența obstinată a producătorilor Leblanc.
Această rezistență a fost facilitată - dialectic - de efectele Legii alcaline . Pentru fiecare tonă de sodă produsă prin metoda Leblanc, 0,75 t de clorură de hidrogen au fost evacuate în aer. Districtele industriale engleze întregi, cum ar fi Widnes , unde se concentra industria alcalină, fuseseră literalmente devastate de această neglijare aberantă. Sub presiunea protestelor fermierilor, unii producători de sodă au încercat să remedieze efluenții acizi; Gossage , în special, patentase în 1836 un turn în care gazele provenite din prima etapă a procesului erau spălate cu apă înainte de a fi eliberate în atmosferă. Soluția foarte diluată de acid clorhidric a fost deversată în râuri. Acest sistem a rămas opțional până în 1863 , când a fost impusă o reducere radicală a fumului acid. Chiar și „remediul” aruncării totul în râuri a fost blocat după câțiva ani de Legea poluării râurilor de către Benjamin Disraeli [1] : pentru o serie de motive politice, sociale și economice devenise esențială utilizarea clorului conținut în sare de mare.
Pulberea de albire și evoluțiile procesului Leblanc
Proprietățile de albire a gazului de clor au fost observate în 1774 de către descoperitorul său, suedezul Karl Scheele , și de Savoia Claude Louis Berthollet au efectuat experimente practice pentru albirea țesăturilor ( 1785 ). Inovația sa răspândit rapid, deoarece procesul de albire a fost unul dintre cele mai laborioase ale vremii; în țările nordice ar putea dura toată perioada din martie până în septembrie, cu soarele ca agent de înălbire, iar clorul mult mai activ (și dăunător) a fost binevenit în ciuda pericolului său.
Dar tocmai la începutul secolului al XVIII-lea și al XIX-lea, Tennant și Charles Macintosh au reușit să pregătească o pulbere ( clorură de var ) din care o soluție puternică de albire a fost ușor obținută prin acidificare. Pentru prepararea pulberii Tennant, clorul a fost esențial și acest lucru a fost obținut la rândul său, conform metodei descoperitorului său: tratamentul piroluzitului (dioxidului de mangan) cu acid clorhidric . De vreme ce cererea de pulbere de albire a crescut enorm, problema tehnico-științifică cu care s-au confruntat chimistii englezi în 1863 a fost de a găsi o cale viabilă din punct de vedere economic către clor din soluția de acid clorhidric (care curgea în râuri din turnurile Gossage). Tehnicienii englezi au putut da două răspunsuri, ambele valabile.
Walter Weldon a modificat procesul de preparare a clorului pornind de la piroluzită, găsind o modalitate ingenioasă de recuperare a manganului , care la sfârșitul fiecărui ciclu de oxidare a fost găsit sub formă de clorură de mangan . Weldon a tratat masa clorurii cu calcar și var și a trimis jeturi puternice de aer la 50 ° C prin ea ; manganul a fost astfel aproape total reoxidat și a fost gata pentru un ciclu suplimentar ( 1866 ). Propunerea lui Henry Deacon a fost mai inovatoare din punct de vedere tehnologic. Deacon a proiectat un sistem în care clorura de cupru permite acidului clorhidric să fie „ars” cu aer la 500 ° C, dând clor și apă ( 1868 ). Curentul de clor obținut a fost într-adevăr foarte diluat, dar în 1870 Deacon a depășit și această limită, reușind să obțină pulbere de albire foarte activă.
Odată cu recuperarea clorului, procesul Leblanc și-a îmbunătățit semnificativ performanța economică, dar totuși un element dintre cei care au intervenit în prima etapă a fost complet pierdut. Sulful din sulfura de calciu inutilizabilă s-a acumulat în munții de deșeuri care înconjurau atelierele Leblanc. Chiar și în acest caz, succesul a venit numai după multe încercări: Gossage a arătat cum era posibilă eliberarea hidrogenului sulfurat din sulfura de calciu, prin suflarea dioxidului de carbon în reziduurile producției Leblanc, dar Alexander Chance a profitat de această propunere, găsirea unei modalități de îmbogățire a gazului obținut și oxidarea acestuia în apă și sulf într-un cuptor proiectat de Carl Friedrich Claus ( procesul Claus ).
Metodele de producere a acidului sulfuric
În primele decenii ale secolului al XVIII-lea , producția de acid sulfuric era încă într-un stadiu complet artizanal, deoarece sulful era pur și simplu ars sub clopote de sticlă sau în baloane mari și aproape totul s-a pierdut sub formă de dioxid de sulf . Prima îmbunătățire a fost introdusă în Anglia în 1749 de Joshua Ward , care a adăugat salpetru la încărcăturile de sulf (sulful și salpetrul au fost asociate în praful de pușcă de secole), îmbunătățind considerabil randamentul acidului sulfuric. În același timp, John Roebuck a depășit limita de scară impusă de utilizarea sticlei și a început să folosească camere cu plumb [2] de aproximativ 8 m³ de volum cub pentru arderea sulfului. Din punctul de vedere al gestionării reacției propriu-zise, progresele fundamentale au fost făcute abia spre sfârșitul secolului cu Nicolas Clément și Charles Bernard Desormes în 1793 . În 1806, acești doi cercetători au descoperit din nou funcția catalitică (cuvântul nu era încă folosit) a oxizilor de azot, care ar putea fi, prin urmare, menținută la un nivel limitat. Cu toate acestea, vaporii de azot au fost lăsați să se disperseze în aer, până când un alt chimist francez, Joseph Louis Gay-Lussac , a propus să fie absorbiți în camere de un acid care a fost plouat din vârful unui turn de spălare pus înainte de descărcare. gaz final. Turnul Gay-Lussac ( 1827 ) s-a străduit să se stabilească oarecum, deoarece metoda de recuperare a oxizilor de azot, bazată pe diluarea amestecului de azot colectat la baza turnului, a fost costisitoare din punct de vedere economic în ceea ce privește acidul. A intrat într-adevăr în folosință abia după 1859 , când englezul John Glover a inventat un turn de denitrare, unde amestecul de azot, provenind de la turnul Gay-Lussac, a fost puternic încălzit de gazele direcționate către camerele de plumb și a fost forțat să elibereze oxizi de azot, care astfel au revenit la ciclu.
Longevitatea metodei camerei de plumb a fost extraordinară, întrucât mai multe dintre ele au funcționat încă în anii 1970 , la mai mult de două secole după introducerea procesului. În plus față de inovațiile deja descrise, gestionarea lor a fost făcută mai economică prin prăjirea piritelor în loc de arderea sulfului ca sursă de dioxid de sulf și prin creșterea continuă a dimensiunilor camerelor de plumb, care au ajuns până la 10.000 m³ deja în cei 1 830 de ani. Durata lungă a procesului a fost favorizată și de utilizarea acidului în camerele de producție a superfosfatului ; aceasta a fost începută pe scară largă în Anglia în 1843 de John Bennet Lawes , o figură excelentă de antreprenor și om de știință (a fost unul dintre fondatorii experimentării agricole). Cu toate acestea, cererea tot mai mare de fumare a acidului sulfuric de către industria explozivilor și a coloranților sintetici a forțat dezvoltarea unui nou proces de sinteză a dioxidului de sulf, bazat pe cataliza eterogenă , proces care s-a născut pentru prepararea unui produs special ( chimie specială ), dar care a suplinit-o treptat pe cea tradițională și în producția de masă.
Prepararea oleumului (o soluție de anhidridă sulfurică în acid sulfuric) fusese timp de decenii monopolul familiei Starck, care l-a obținut în cele 12 fabrici din Boemia cu metode vechi de secole. În aceste condiții, nu este surprinzător faptul că s-a făcut o încercare activă de a rupe atât de departe de monopolul natural prin utilizarea unor tehnici mai moderne de distilare a amestecurilor de sulfat.
Calea de urmat fusese deja indicată de ceva timp cu brevete și articole, care încă de la începutul anilor 1830 subliniaseră activitatea catalitică a buretelui de platină . După obișnuitele nenumărate încercări nereușite, în 1875 Rudolf Messel în Anglia și Clemens Winkler în Germania au ajuns independent la o primă soluție: oxidarea catalitică a dioxidului de sulf în sulf și absorbția acestuia în acid sulfuric concentrat. Blocat în Anglia prin brevetul Messel, procesul s-a răspândit în diferite țări germane, deoarece Winkler își publicase pur și simplu cercetările. Metoda de contact a devenit cu adevărat eficientă sub îngrijirea inteligentă a lui Rudolf Knietsch . Acesta a fost unul dintre mulți cercetători care au lucrat în laboratoarele Badischen Anilin und Soda Fabrik (BASF), compania germană care mai mult decât oricare altul s-a angajat în studiul științific al tehnologiilor de producție din industria chimică. Acest tehnician BASF a publicat un articol în 1901 în care a fost publicată o cantitate imensă de cunoștințe despre procesul catalitic și cataliza, acumulate de-a lungul anilor de cercetare. Articolul indica faptul că însăși sediul procesului de producție materială, întreprinderea, a devenit capabil să rivalizeze cu instituția științifică prin excelență, universitatea, în producția de cunoștințe.
Coloranți sintetici (1850 - 1950)
Nașterea unei noi industrii: Perkin și purpura anilină

Istoria coloranților sintetici începe cu o intenție „farmaceutică”. În 1855 , William Henry Perkin , de 17 ani, intrase în Colegiul Regal de Chimie ; Introdus rapid la tehnicile chimiei organice , i s-a dat o întreprindere ambițioasă ca subiect de cercetare: sinteza chininei , o substanță vegetală utilizată în tratamentul malariei . În laboratorul său de acasă, Perkin a luat literalmente informațiile primite, urmând calea oxidării unei serii de amine aromatice ; pe acest traseu, impracticabil pentru scopul său, a dat de mai multe ori precipitate de compoziție nesigură, dar de culoare marcată. Poate pentru că nu era încă bine condiționat de o lungă practică de cercetare, poate pentru că era deviant în mod natural, Perkin a ignorat avertismentul de a studia numai substanțele purificate și cristalizate și și-a concentrat interesul asupra rezultatelor reacției dintre dicromatul de potasiu și anilina . [3] Tânărul cercetător a fost imediat convins de abilitățile excelente de vopsire ale noului produs și a prezentat un eșantion în atenția Pullar, proprietarii unei mari vopsitorii din Perth . După ce a obținut un răspuns pozitiv (12 iunie 1856 ), după un experiment inițial efectuat pe o fabrică pilot de tip familial, a depus la 26 august 1856 brevetul pentru noul colorant [4] , anilină purpurie (sau mauveină [5]) sau CI 50245 [6] ).
Este interesant de observat că încă de la început, însăși structura sistemului de cunoștințe de chimie organică și- a demonstrat bogăția și flexibilitatea ca funcție a producției de materiale. Conform procedurilor de laborator, Perkin avea tot ce putea face ca linia de producție să fie concretă:
Benzenul a fost accesibil prin distilarea fracționată a gudronului , dezvoltată de un alt student al Royal College , Charles Mansfield . Nitrobenzenul fusese obținut de un chimist german, Eilhard Mitscherlich încă din 1834 ; reducerea acestui compus la anilină fusese studiată de rusul Nikolaj Nikolajevic Zinin în 1842 .
Planul științific al producției a fost ușor de pregătit, dar a fost un alt lucru să se confrunte cu realizarea procesului pe scară largă și comercializarea produsului. Perkin a fost foarte eficient în acest sens, întrucât el a întrezărit posibilitățile economice ale precipitatelor sale ciudate: a „inventat” o industrie cu totul nouă, de la achiziționarea de materii prime, la diferitele etape de producție, până la aplicarea vopsirii, la introducerea produsului pe piață. În această întreprindere a trebuit să se confrunte cu multe dificultăți, dintre care trebuie amintite cel puțin două, paradigmatice pentru noul tip de producție materială. Operația de nitrare , necesară pentru a trece de la benzen la nitrobenzen, a devenit extrem de periculoasă imediat ce a fost efectuată la scară industrială și a trebuit să fie studiate cu atenție condițiile practice cu care să se desfășoare într-o situație de siguranță relativă. Această tranziție de la situația de laborator la cea a fabricii a fost întotdeauna un factor necunoscut în toate proiectele de inginerie chimică , dar necesitatea unui control strict al calității reactivilor și a condițiilor de reacție a fost surprinzătoare pentru cei obișnuiți cu conduita destul de grosieră a implanturile Leblanc sau camerele de plumb.
Al doilea aspect tipic al inovației Perkin a fost necesitatea de a inova și utilizarea finală a produsului. Noua vopsea nu a dat rezultate satisfăcătoare cu bumbacul și numai atunci când Perkin a folosit acid tanic ca mordant a fost capabil să obțină țesături de bumbac comercializabile. În acest moment, succesul a fost imens, imortalizat în legendă prin apariția Reginei Victoria la Expoziția Universală din 1862 îmbrăcată în întregime în mov , conform denumirii franceze a colorantului Perkin.
Noul curcubeu chimic
După lansarea comercială a movului , descoperirile din noul domeniu au fost nenumărate: începând de la magenta (sau fucsinul ) lui François-Emmanuel Verguin ( 1859 ), un curcubeu complet de culori a fost pus la dispoziția industriei textile, cu o tendință că a accelerat în urma cunoașterii în creștere privind reactivitatea organică și, prin urmare, în analiza structurală. Culorile acestui curcubeu au fost sintetizate în mare măsură de chimiștii germani; ne amintim de albastru de metilen , descoperit de Heinrich Caro în 1876 și încă folosit pentru bumbac, verde malachit al lui Otto Fischer ( 1878 ) și roșu Congo al lui Paul Böttiger ( 1884 ), primul colorant direct pentru bumbac. Dar cea mai evidentă trecere de la empirism la intenția constructivă a chimiei structurale a avut loc deja cu sinteza alizarinei de către Carl Liebermann și Carl Graebe în 1869 . Pentru a ajunge la sinteza lor, cei doi cercetători au folosit cele mai avansate cunoștințe despre chinone și compuși aromatici, precum și despre reacțiile care au permis trecerea de la o clasă de compuși organici la alta. Cererea de brevet britanic a fost depusă de BASF cu o zi înainte de Perkin, o carte de vizită a noii puteri industriale germane. Alizarina a fost principiul activ al rădăcinii mai nebunești ( Rubia tinctorum ), în cultivarea căruia 175.000 de hectare au fost implicate în jumătate din Europa . Chiar și ruina inevitabilă a acestor culturi a devenit un semn al vremurilor, un vestitor al altor înlocuiri, mai dificile și uneori mai radicale.
Într-adevăr, mari dificultăți au întâmpinat cercetările care au condus la sinteza industrială a indigo și care au constituit unul dintre cele mai mari succese antreprenoriale de la sfârșitul secolului al XIX-lea . Structura moleculei de indigo a necesitat aproape douăzeci de ani de studiu pentru a fi elucidată de Adolf von Baeyer , care între 1880 și 1883 a propus patru moduri distincte de sintetizare a compusului. Niciuna dintre acestea nu s-a dovedit a fi de natură să facă sinteza industrială competitivă cu produsul natural, iar presiunea BASF asupra lui Baeyer (care devenise consultant) a fost de așa natură încât a dus la o pauză în 1885 . Da quel momento in poi le decisioni sulla strategia di sintesi in grande rimasero nelle mani dei dirigenti dell'impresa renana, che finalmente ebbero aperta la strada commercialmente giusta dalle ricerche di Karl Heumann . Per la traduzione industriale della sintesi di Heumann occorsero ancora diversi anni di messa a punto, in quanto si articolava in otto reazioni diverse, ciascuna con i suoi particolari problemi di resa , di velocità o di rifornimento degli intermedi. La più restia a dare risultati accettabili fu proprio la prima di queste reazioni, che riguardava la trasformazione del naftalene in anidride ftalica mediante l'azione di acido solforico concentrato e caldo. Solo un provvidenziale incidente di laboratorio (la rottura di un termometro ) permise di individuare il catalizzatore adatto ad accelerare la reazione.
L'indaco sintetico fu commercializzato dalla BASF a partire dal 1897 ; l'esportazione di indaco naturale dall' India , che era stata di 19.000 t nel 1897 , scese a 1.100 t nel 1914 , con la conseguente rovina economica di molti produttori. Lo sviluppo del processo aveva richiesto l'investimento enorme di un milione di marchi , pari al costo di un incrociatore da battaglia. Inoltre era stato necessario trovare il modo di produrre grandi quantità di oleum e di cloro , indispensabili per la conduzione della sintesi e la preparazione di intermedi. Queste nuove produzioni, indotte dalla scelta strategica della sintesi dell'indaco, arricchirono il patrimonio conoscitivo interno della BASF, con effetti sinergici che si avvertirono con forza pochi anni dopo anche nel settore lontano della sintesi dell' ammoniaca .
L'industria farmaceutica (1850 - 1950)
Chimica farmaceutica e sintesi organica

All'industria chimica organica si era intanto aperto un nuovo settore di intervento, quello dei prodotti farmaceutici . Anche in questo caso il concetto di struttura molecolare giocò un ruolo fondamentale nell'articolare la metodologia di ricerca. Non solo la struttura di un composto naturale riconosciuto attivo poteva (in via di principio) essere replicata in laboratorio, ma le capacità costruttive e permutative dei chimici potevano generare illimitate variazioni, da cui attendere effetti fisiologici più efficaci e/o diversi.
Questo modello di produzione di conoscenza si andò formando negli ultimi due decenni del XIX secolo , ed è ancora oggi attivo e fecondo. Uno dei primi tentativi fu di "mimare" gli effetti terapeutici della chinina , un principio attivo contro la malaria e quindi benefico per milioni di pazienti in tutto il mondo. La molecola della chinina è assai complessa e resistette a una sintesi completa fino agli anni quaranta , ma per una parte di essa, la chinolina , fu proposta una preparazione piuttosto facile dal ceco Zdenko Skraup nel 1880 . Su questa molecola iniziò a lavorare Otto Fischer , producendone numerosi derivati: uno di essi si dimostrò attivo come febbrifugo, ma non aveva alcun effetto contro la malaria. Con lo stesso metodo di indagine un successo in un certo senso definitivo fu colto da Felix Hoffmann , con la ripresa della sintesi dell' estere acetilico dell' acido salicilico , già preparato nel 1853 dal grande chimico francese Charles Gerhardt . L'uso dell' acido salicilico come febbrifugo e antireumatico era stato spinto con vigore da Hermann Kolbe , che ne aveva realizzato la sintesi nel 1853 , ma la sua azione irritante sul sistema digestivo ne aveva limitato l'impiego. Il composto di Gerhardt e Hoffmann non aveva effetti collaterali così vistosi, e fu messo in commercio dalla Bayer nel 1899 , sotto il nome commerciale di aspirina . Una variante importante di questo modello di ricerca venne alla luce fra il 1886 e il 1889 nei lavori del tedesco Eugen Baumann ( 1848 - 1896 ) sugli ipnotici solfonici. Durante ricerche sul metabolismo di composti contenenti zolfo i due scienziati si imbatterono nell'effetto soporifero di certi composti solfonici, la cui stessa struttura, con almeno quattro possibili "sostituzioni", invitava all'attività di trial-and-error .
Il modello di ricerca chimico-farmaceutica si strutturò in quattro stadi: scoperta più o meno intenzionale dell'attività fisiologica di una certa sostanza chimica; determinazione della struttura (se non nota) e preparazione di varianti; prove cliniche prima su animali e poi sull'uomo; produzione su larga scala e lancio sul mercato. I risultati di questo modello operarono (e operano) sul margine più oscuro dell'esistenza, la malattia e la morte , è evidente quindi il suo impatto sociale, e il suo permanente interesse storico. Importanti tappe di queste ricerche sono la prima vittoria contro la sifilide ( 1910 ), la scoperta dei sulfamidici ( 1935 ), e lo sviluppo degli antibiotici .
La teoria eziologica di Louis Pasteur e Robert Koch indicava nei microorganismi responsabili di specifiche malattie gli intrusi da eliminare dall'organismo malato. Paul Ehrlich , medico, batteriologo e chimico , si pose con chiarezza l'obiettivo di colpire i microorganismi con molecole mirate, partendo dall'osservazione dell'assorbimento differenziato dei coloranti di sintesi nei vari tessuti e nei diversi batteri. Il suo progetto fu di trovare molecole in grado di attaccare il parassita e non l'ospite ( 1891 ). I primi grandi successi vennero contro i tripanosomi , protozoi che minavano anche l'uomo con la terribile malattia del sonno : i "proiettili" (la metafora è di Ehrlich) erano due derivati azoici della benzidina , il rosso Trypan ( 1904 ) e il blu Trypan ( 1909 ). Al momento della scoperta dell'agente della sifilide, il Treponema pallidum , Fritz Schaudinn sottolineò che esso era più vicino ai protozoi che ai batteri. Questa quasi-analogia accese le speranze di Ehrlich, che sulla base di una precisa analogia chimica sostituì al gruppo azoico - N = N -, così attivo contro i tripanosomi, il gruppo - As = As -, con l'arsenico trivalente efficace contro la malattia del sonno. Dopo prove condotte con centinaia di sostanze sintetizzate ad hoc , nel 1909 Ehrlich e il suo assistente giapponese Sahachiro Hata scoprirono che il composto 606 (il salvarsan ) era attivissimo contro le spirochete della sifilide. La tossicità di questo prodotto venne attenuata nel 1912 , con la produzione del composto 914 (il neosalvarsan ). Malgrado gli effetti secondari, le molecole di Ehrlich rimasero l'unico rimedio efficace contro la sifilide fino all'avvento degli antibiotici .
Con la cura della sifilide si raggiunse un limite che per molto tempo apparve insuperabile. Fino al 1935 la totalità dei prodotti farmaceutici di sintesi era attiva solo contro le malattie causate da protozoi (con l'eccezione importante della sifilide). Si trattava di malattie per lo più tropicali, ei batteri nocivi, presenti nelle zone temperate parevano richiedere l'intervento di molecole che si dimostravano invariabilmente troppo pericolose per il malato. Ma la tradizione di ricerca instaurata da Ehrlich, e mantenuta con granitica determinazione nei laboratori dell'industria tedesca, doveva dare i suoi frutti migliori negli anni trenta del Novecento.
Nel 1932 Fritz Mietzsch e Josef Klarer sintetizzarono un colorante diazoico rosso che conteneva il gruppo -SO2. NH2; Gerhard Domagk , direttore dei laboratori di patologia sperimentale e di batteriologia della IG Farben , ne determinò la forte attività contro infezioni da streptococchi e da stafilococchi . Il lancio del prontosil , il primo sulfamidico , avvenne nel 1935 . Questa nuova "molecola magica" attirò subito l'attenzione di un gruppo di ricercatori dell' Istituto Pasteur di Parigi , e nello stesso anno 1935 i coniugi francesi Tréfouël , Daniel Bovet e Federico Nitti pubblicarono un articolo in cui si dimostrava che il principio attivo era in realtà un metabolita del prontosil . I sulfamidici si dimostrarono straordinariamente efficaci contro malattie mortali come la febbre puerperale e la meningite da streptococchi .
Gli antibiotici e il cortisone
Il batteriologo inglese Alexander Fleming aveva osservato nel 1928 che una muffa blu aveva parzialmente invaso una capsula Petri e aveva causato tutto intorno a sé una lisi delle colonie preesistenti di stafilococchi. Fleming aveva provato sperimentalmente che il Penicillum notatum produceva una sostanza (incognita e allora non isolata) con proprietà antibatteriche, e non tossica per gli animali. Tuttavia anche negli anni seguenti Fleming non riuscì a superare le estreme difficoltà sperimentali connesse all'isolamento del principio attivo, da lui chiamato penicillina . Nel 1936 il problema fu ripreso da un gruppo di Oxford , di cui facevano parte Howard Walter Florey e Ernst Chain , e dal 1940 , sotto la spinta delle esigenze belliche, le ricerche si intensificarono. Il metodo di purificazione, assai complesso per l'instabilità del composto attivo, fu messo a punto da Chain, e un primo chiarimento della struttura si ebbe nel 1943 . La chimica di sintesi, appoggiata dall'industria farmaceutica, aveva colto grandi successi nel campo delle vitamine e degli ormoni , ma i tempi ristretti della guerra non permisero di attendere la sintesi di laboratorio (che venne per la penicillina solo nel 1957 ), e si scelse la via biochimica .
Le tecniche di fermentazione industriale erano progredite vistosamente durante la prima guerra mondiale ad opera di Chaim Weizmann , che aveva asservito il Clostridium acetobutylicum alla produzione di massa dell' acetone dall' amido . L'acetone era indispensabile per la fabbricazione della cordite , l' esplosivo prediletto dall'esercito inglese, e il nuovo processo si diffuse in tutto il Commonwealth . Ma la produzione di penicillina per via biotecnologica presentava difficoltà di ben diverso ordine, per la già citata sensibilità del prodotto ai cambiamenti di pH e alle tracce di metalli pesanti . L'era degli antibiotici era comunque iniziata, e la preparazione della penicillina raggiunse rapidamente livelli utili per lo sforzo bellico. Nel 1948 il monopolio anglo-americano della penicillina fu infranto da Domenico Marotta , che chiamò Chain a dirigere il Centro internazionale di chimica microbiologica , costituito presso l' Istituto Superiore di Sanità a Roma . D'altra parte fin dai primi anni del 1940 tutte le maggiori case farmaceutiche avevano scatenato una vera e propria caccia ai microorganismi utili: nel 1943 Selman Abraham Waksman isolò la streptomicina , attiva in diverse infezioni che non rispondevano al trattamento con penicillina, e nel 1948 Benjamin Duggar ottenne l' aureomicina . Negli anni cinquanta si dimostrò che questa era un derivato della tetraciclina , sostanza madre di una classe di antibiotici a largo spettro.
Oltre al "fiorire" degli antibiotici il secondo dopoguerra vide anche la commercializzazione del cortisone ( 1949 ), frutto delle laboriosissime ricerche di Edward Calvin Kendall . Nei quindici anni precedenti Kendall, che lavorava alla Mayo Clinic di Rochester , alimentò le sue indagini sulla porzione corticale delle ghiandole surrenali , barattando i rifornimenti di ghiandole surrenali di bue (150 t in tutto) con l' adrenalina pura che isolava dalla porzione midollare. Lo scienziato americano chiamò con le lettere dell' alfabeto i composti cristallini che man mano andava isolando; il composto E (chiamato poi cortisone ) si dimostrò essere un potente antinfiammatorio. Lewis Hastings Sarett , dei laboratori della Merck , mise a punto nel 1944 una prima sintesi che necessitava di 37 passaggi prima di giungere al prodotto finale; pur semplificato, al momento della commercializzazione il processo era ancora il più complesso mai portato nelle condizioni di produzione industriale. Al primo cortisone commerciale contribuì anche un prodotto semisintetico, a cui si giungeva impiegando come materiale di partenza un composto della famiglia degli steroidi , presente nella bile bovina, l' acido desossicolico .
L'industria degli esplosivi (1850 - 1950)
Gli esplosivi ad alto potenziale

La storia degli esplosivi comincia verso la fine degli anni 1840 , quando si cercava di nitrare qualunque composto organico per ottenere sostanze esplosive. Particolare successo ebbero il tedesco Christian Friedrich Schönbein con la preparazione del fulmicotone ( 1846 ) e l'italiano Ascanio Sobrero con la sintesi della nitroglicerina ( 1847 ). La produzione di fulmicotone a scopi militari, che seguì immediatamente la scoperta, fu sospesa quando una terribile esplosione distrusse la prima fabbrica inglese il 14 luglio 1847 . La produzione riprese solo dopo che il ricercatore inglese Frederick Abel dimostrò che il fulmicotone poteva essere stabilizzato mediante un processo di purificazione completa da ogni traccia di acido , lasciata nella massa dopo l'operazione di nitrazione.

Ancora più drammatica e avventurosa la vicenda dell'impiego pratico della nitroglicerina. Alfred Nobel ne iniziò lo studio nel 1859 e, dopo la scoperta che l'esplosione poteva essere innescata con polvere da sparo , ne iniziò la commercializzazione sotto il nome di "olio esplodente". Un'esplosione distrusse la prima fabbrica svedese, uccidendo il fratello di Alfred. Il commercio di nitroglicerina continuò fino al 1867 , anno in cui Nobel adottò il fulminato di mercurio come detonatore e stabilizzò la nitroglicerina, facendola assorbire da farina fossile (una diatomite ), ottenendo una pasta morbida che chiamò dinamite . Il tecnico-imprenditore svedese brevettò nel 1875 la cosiddetta "gelatina esplosiva", a base di cotone collodio e nitroglicerina [7] , con un potere esplosivo maggiore della dinamite.
I nuovi esplosivi erano tutti dirompenti, e quindi non adatti a un uso balistico . Qui la prima innovazione avvenne in Francia , con la Poudre B di Paul Vieille prodotta nel 1886 , cui seguì la balistite di Nobel nel 1887 , e la cordite di Abel nel 1889 . In tutti questi casi si trattava di miscele particolari di composti già noti; la rivoluzione delle tecniche costruttive delle armi fu profonda, ei massacri della prima guerra mondiale resero consapevoli le grandi potenze dell'efficacia mortale di queste armi. D'altro canto, gli esplosivi moderni resero più sicuro il lavoro in miniera , e permisero la realizzazione di grandi opere civili come il canale di Panama .
Elettrochimica, alte temperature e pressioni, catalisi (1890 - 1940)
Molte delle produzioni descritte nella sezione precedente non erano tecnologicamente dissimili da quelle usuali in un laboratorio di chimica organica : temperature poco elevate, pressione atmosferica . L' industria chimica però aveva cercato condizioni estreme, creandosi essa stessa i materiali più adatti per realizzarle, non appena l'industria elettromeccanica mise a disposizione generatori abbastanza potenti.
L'industria elettrochimica
La data di nascita della grande industria elettrochimica può essere posta nel 1886 , quando Paul-Louis-Toussaint Héroult in Francia e Charles Martin Hall negli Stati Uniti brevettarono un processo per la preparazione dell' alluminio (chiamato appunto " processo di Hall-Héroult "), che si basava sull' elettrolisi di una soluzione di allumina in criolite fusa. La produzione di alluminio a basso costo, già rilevante di per sé, venne valorizzata a pieno da Hans Goldschmidt , che dopo aver studiato a fondo la riduzione termica degli ossidi metallici mediante polvere di alluminio, ne propose l'uso industriale nel 1898 . Nei primi anni del XX secolo il processo alluminotermico permise la produzione a costi ragionevoli di metalli altrimenti inaccessibili, come cromo , manganese , tungsteno , molibdeno . Ogni ossido metallico richiedeva particolari accorgimenti, ma la temperatura doveva raggiungere in ogni caso almeno i 2200 °C . I metalli ottenuti allargarono la produzione di acciai speciali, ampliando ancora l'induzione tecnologica indiretta dell'innovazione di Héroult e Hall.
Un chimico statunitense, Hamilton Young Castner ( 1858 - 1899 ), aveva progettato un metodo per ottenere il sodio , con il quale intendeva ridurre l'allumina e ricavare l'alluminio, ed era emigrato in Inghilterra alla ricerca di capitali . Dopo qualche sperimentazione limitata, aveva aperto un'officina nel 1888 , ma presto la concorrenza del processo elettrolitico rese non remunerativa la sua produzione di alluminio. A questo punto si impegnò a trovare uno sbocco per il sodio, di cui invero c'era una scarsa domanda; dopo un tentativo verso il perossido si concentrò nella produzione del cianuro di sodio . La corsa all'oro in varie parti del mondo e il metodo al cianuro per l'estrazione dei metalli preziosi (brevettato nel 1887 ) fecero la sua fortuna, così che per stare dietro alla domanda di cianuro cercò un nuovo processo per la preparazione del sodio, trovando conveniente l'elettrolisi della soda caustica . Ma il mercato offriva soda caustica troppo impura per i suoi scopi, e Castner si accinse a prepararla in proprio, mediante un secondo processo elettrolitico, basato su una cella particolare con catodo di mercurio ( 1894 ). Il prodotto, puro al 100%, era inedito e trovò un grande mercato esterno all'impresa di Castner nella produzione di carta , tessuti , oli e saponi , infliggendo un ulteriore colpo all'agonizzante industria Leblanc inglese.
La disponibilità di energia elettrica a basso costo, aprì una strada diversa dai processi elettrolitici appena descritti. Le fornaci impiegate prima degli anni 1880 erano riscaldate mediante combustibili che bruciavano all' aria , e una parte cospicua dell'energia emessa era perduta per aumentare la temperatura dei prodotti di combustione e dell' azoto inerte dell'aria stessa. Con questo metodo tradizionale era difficile superare i 1200 °C. Con la fornace riscaldata da un arco elettrico , o dalla corrente fatta passare attraverso un reagente che fosse conduttore, si poteva lavorare con temperature fino a 2000 °C, e il limite era dato essenzialmente dai refrattari impiegati. Il primo composto a essere preparato su larga scala con questo metodo fu il carburo di calcio , con un processo proposto ancora una volta contemporaneamente in Francia e negli Stati Uniti nel 1892 . Il metodo impiegava come materie prime calce viva e antracite , e si stimava che la temperatura raggiungesse i 2000 °C. Il carburo di calcio serviva per la produzione di acetilene , impiegato per l' illuminazione fino all'introduzione del filamento di tungsteno nelle lampade a incandescenza ( 1910 ), ma a partire dal 1905 venne impiegato anche per "fissare" l' azoto atmosferico sotto forma di calciocianamide . Questo composto poteva essere venduto direttamente come fertilizzante , oppure convertito in ammoniaca o in cianuri .
La fissazione dell'azoto
La parte più avanzata dell' agricoltura europea utilizzava come fertilizzante ingenti quantità di nitrato di sodio , estratto dai depositi naturali del Cile ; nell'industria chimica la produzione di coloranti e di esplosivi ne dipendeva totalmente, in quanto era materia prima indispensabile per la preparazione dell' acido nitrico . L'attacco al problema della sostituzione del nitro cileno fu condotto in diverse direzioni, non tutte legate alla fissazione diretta dell'azoto. Da una rapida selezione dei diversi processi emerse una nuova industria, detta appunto industria dell'azoto.
Il primo metodo di fissazione dell'azoto operativo su scala industriale fu quello dei norvegesi Kristian Birkeland e Samuel Eyde , che riuscirono a rendere praticabile la reazione dell'azoto con l' ossigeno alla temperatura dell' arco voltaico , espandendo l'arco per azione di un campo magnetico . Il processo Birkeland-Eyde fu avviato nel 1903 e nel 1905 era pienamente operativo a Notodden ; la sua convenienza era legata al bassissimo costo dell'energia elettrica.
Un altro processo importante apparve agli inizi del secolo: l' ossidazione catalitica dell'ammoniaca, e la sua trasformazione in acido nitrico . Le reazioni erano note da tempo, ma non erano note, fino al 1900 , le condizioni con cui ottenere un'alta resa in acido nitrico. Fu allora che uno dei fondatori della teoria della catalisi , Wilhelm Ostwald , ne iniziò lo studio. Nel 1902 vennero presi i brevetti, e il primo impianto fu eretto nel 1908 nella cokeria di Gerthe [8] nella Ruhr ; alla vigilia della guerra forniva circa 250 t di acido nitrico al giorno. La posizione di questo processo nel problema della fissazione dell'azoto fu assolutamente centrale: da una parte apriva la strada verso l'acido nitrico ai metodi sintetici che, come quello della calciocianamide, davano azoto fissato sotto forma di ammoniaca; dall'altra permetteva una parziale rimozione del problema stesso della fissazione, in quanto ovunque nel mondo civilizzato erano potenzialmente disponibili enormi quantità di ammoniaca, di solito fermata come solfato d'ammonio nelle acque di lavaggio del gas di cokeria. Quale delle due strade dovesse essere seguita dipendeva evidentemente dai costi di produzione dell'ammoniaca. Solo le necessità belliche riuscirono comunque a imporre il processo Ostwald, in quanto la disponibilità del nitro del Cile lo rendeva poco appetibile in tempo di pace. Una verifica si ha nel fatto che inizialmente la BASF , partendo dal metodo Haber-Bosch, produsse solo ammoniaca sintetica e solfato d' ammonio .
Il metodo fondamentale di fissazione dell'azoto, quello della sintesi diretta dell'ammoniaca dagli elementi , divenne una realtà scientifica, tecnica e industriale nello specialissimo clima culturale della Germania imperiale , dove nessuno scienziato era in effetti disinteressato alle applicazioni pratiche delle sue idee. I tentativi di laboratorio di sintetizzare ammoniaca da idrogeno e azoto nacquero infatti da una dura polemica fra Walther Nernst e Fritz Haber sul valore da assegnare alle costanti d'equilibrio della reazione. Entrambi i contendenti erano perfettamente consci del senso economico della loro discussione, e dal loro sforzo congiunto Haber fu trascinato a mettere a punto nel 1908 un apparecchio dimostrativo che, con un catalizzatore a base di uranio e operando a 550 °C e 200 atm , permetteva di ottenere una miscela gassosa così ricca in ammoniaca che questa poteva essere liquefatta per semplice raffreddamento. La BASF fu subito contattata ma i dirigenti della grande impresa, che si recarono a Karlsruhe per assistere a una dimostrazione di Haber, rimasero alquanto scettici. Carl Bosch non si fermò nemmeno abbastanza a lungo per vedere funzionare l'apparecchio di Haber, ma Alwin Mittasch rimase, e poté constatare la "facilità" della sintesi. Nel 1910 cominciò a funzionare un impianto pilota a Ludwigshafen , e nel 1913 , con il superamento di grandi difficoltà ingegneristiche e dopo l'esplorazione di centinaia di catalizzatori da parte di Mittasch, fu aperto lo stabilimento di Oppau , in cui operavano giganteschi reattori del peso di 8 tonnellate. Durante la guerra la BASF costruì un secondo impianto a Leuna , con una produzione complessiva al termine del conflitto di 95.000 t di azoto fissato, circa la metà del consumo tedesco.
La diffusione delle sintesi ad alta pressione
Al momento dell' armistizio gli ufficiali alleati visitarono l'impianto di Oppau con il meravigliato rispetto che imponeva questo tempio della tecnologia chimica, ma intanto altri scienziati-tecnici in Francia e in Italia mettevano a punto nuove varianti del processo. Georges Claude , uno dei massimi esperti di reazioni in fase gassosa , faceva operare i suoi impianti in condizioni estremamente severe, mentre condizioni un po' più blande erano ammesse da Luigi Casale , un tecnico-imprenditore indipendente, il cui processo ebbe ampia diffusione negli anni venti . Nel 1923 entrò in funzione il primo impianto (quasi artigianale) di Giacomo Fauser , che aveva introdotto modifiche sostanziali rispetto al processo Haber-Bosch . Il primo impianto su grande scala che lavorava con i brevetti Fauser-Montecatini fu inaugurato a Merano nel 1926 , e da allora questo processo si diffuse in tutto il mondo.

Le tecniche acquisite nel trattamento di gas ad alte pressioni trovarono sbocchi imprevedibili, in settori molto lontani da quello originale. Il punto di partenza di questi sviluppi va individuato nelle ricerche di Paul Sabatier sull' idrogenazione di composti organici insaturi mediante l' azione catalitica di metalli finemente suddivisi, in particolare nichel ( 1897 ). Nel 1902 in Germania Wilhelm Normann brevettò un processo che permetteva la preparazione di grassi solidi per uso alimentare a partire da oli ( indurimento ); l'idrogeno veniva fatto gorgogliare in olio caldo in cui era stato sospeso nichel finemente suddiviso. Il metodo permetteva di commercializzare sotto forma di margarina l'olio di semi di cotone ( Stati Uniti ) o gli oli di pesce ( Europa ). Il processo di Normann lavorava a pressione atmosferica , ma il russo Vladimir N. Ipatieff si era fatto da tempo assertore dell'impiego delle alte pressioni anche nelle sintesi organiche, e all'inizio degli anni 1910 questa tecnica fu impiegata nell' idrogenazione dei grassi. Nella stessa direzione si mosse Friedrich Bergius ; allievo di Nernst e di Haber nel 1913 brevettò un procedimento per l'idrogenazione del carbon fossile , adatto a produrre idrocarburi volatili . Nel 1925 Bergius cedette i suoi diritti alla BASF; le connessioni con le tecniche sviluppate in funzione della sintesi dell'ammoniaca erano evidenti: uso di grandi quantità di idrogeno e impiego di alte pressioni. Il processo fu perfezionato da Bosch, che per questo condivise con Bergius il premio Nobel per la chimica nel 1931 . Il Nobel sanzionava l'acuto interesse economico e strategico che il processo suscitava, in quanto durante la seconda guerra mondiale partecipò allo sforzo bellico della Germania e dell' Inghilterra .
È da ricordare inoltre un altro processo volto alla produzione di carburanti sintetici, dovuto ad altri due tedeschi, Franz Fischer e Hans Tropsch . Secondo questi due ricercatori il gas d'acqua (una miscela di idrogeno e ossido di carbonio ) veniva fatto passare a 200 °C ea pressioni moderate su opportuni catalizzatori ; si ottenevano idrocarburi adatti all'impiego come combustibile per il motore a combustione interna . La produzione commerciale iniziò nel 1935 , e si sviluppò velocemente durante la guerra. Agli inizi degli anni settanta l'unico impianto di questo tipo era mantenuto in funzione in Sudafrica nel periodo dell' apartheid , a salvaguardia delle conseguenze di un embargo petrolifero.
Dal carbone al petrolio (1870 - 1970)
Lo sviluppo dell'industria petrolifera ei processi di cracking
Le vicende dell' industria petrolifera e di quella chimica rimasero a lungo separate. Fino ai primi anni del XX secolo le raffinerie di petrolio avevano il compito esclusivo di distillare il greggio per separare le varie frazioni di idrocarburi e commercializzarle per i diversi usi. Questi usi non avevano affatto domande bilanciate: fra il 1890 e il 1900 vi fu penuria della frazione a 10-15 atomi di carbonio ( cherosene ) ed eccesso di quella a 6-10 atomi di carbonio ( benzina ). Il cherosene era richiestissimo per le lampade a petrolio , mentre la benzina era ritenuta troppo pericolosa per la sua infiammabilità ed era in genere scaricata nei fiumi.
Con l'"avvento" dell' automobile e la diffusione dell' illuminazione elettrica la situazione mutò radicalmente, e ritornò d'attualità una proposta fatta molti anni prima: spezzare termicamente le catene degli idrocarburi più pesanti per ottenere frazioni più leggere, a catena più corta. Il primo processo di cracking termico che diede ottimi risultati commerciali fu realizzato negli Stati Uniti da WM Burton ( 1865 - 1954 ), direttore di una raffineria della Standard Oil . Gli impianti pilota, che operavano a 4-5 atmosfere , presentarono grandi difficoltà costruttive ed erano piuttosto pericolosi, così che nel 1910 la direzione della Standard rifiutò di autorizzare la spesa per un impianto commerciale. Tuttavia nel 1911 la legge antitrust americana scisse la Standard Oil in diversi tronconi, e la nuova direzione aziendale favorì l'investimento. Il processo fu avviato nel 1913 , ed è stato calcolato che i costi di sviluppo (236.000 $ ) furono ripagati 10 volte nel primo anno operativo dell' impianto .
Il metodo Burton dominò il settore fino al 1921 , periodo in cui furono proposti ben nove processi, fra cui risultò importantissimo quello di CP Dubbs. Dubbs era figlio d'arte (le iniziali del nome corrispondono a Carbon Petroleum ), e da un facoltoso finanziatore fece acquistare alcuni brevetti di suo padre, che allora dirigeva una piccola raffineria californiana . I brevetti erano stati presi per il trattamento del greggio californiano, ma Dubbs junior vi aveva visto la possibilità di migliorare il processo Burton, in particolare rendendolo continuo. I cinque anni che furono necessari per la messa a punto del processo richiesero 6 milioni di dollari di spese di sviluppo (mandando in rovina il finanziatore di Dubbs), tuttavia il nuovo metodo, funzionante a partire dal 1923 , era effettivamente molto più efficiente di quello di Burton.
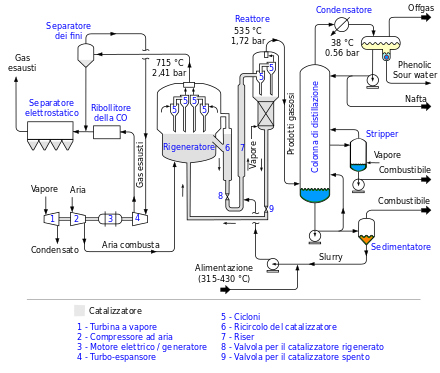
Negli anni venti diverse compagnie petrolifere incominciarono a interessarsi delle potenzialità che la catalisi offriva al processo di cracking, ma lo fecero senza entusiasmo e con magrissimi risultati. Nel 1925 un ingegnere francese, Eugene Houdry , intraprese una ricerca sistematica dell'effetto sul cracking di centinaia di catalizzatori , e nel 1927 ottenne i primi risultati positivi. Houdry aveva investito nella ricerca una parte ingente della sua fortuna personale, ma presto la scala delle ricerche di sviluppo divenne tale da richiedere l'esperienza impiantistica ei capitali di una grande impresa. Privo di appoggi in Francia , emigrò negli Stati Uniti , dove costituì una società con la Socony Vacuum Oil (1930), cui si aggiunse più tardi la Sun Oil ( 1932 ). Il processo cominciò a funzionare a livello industriale fra il 1936 e il 1937 , dopo che erano stati investiti circa 11 milioni di dollari (3 provenienti dal patrimonio privato di Houdry).
Fin dagli inizi fu chiaro che lo stesso processo Houdry poteva essere perfezionato, in quanto era semi-continuo e con catalizzatore a letto fisso, e la "minaccia" di questa innovazione era tale che nel 1938 fu formato un gruppo, denominato Catalytic Research Associates , che coordinava gli sforzi di ricerca di giganti quali l' Indiana Standard , la Jersey Standard , la Shell e la Texaco . Il processo a letto fluido divenne operativo nel 1942 ; al termine di una serie di perfezionamenti nel 1952 era costato 30 milioni di dollari di investimenti in ricerca e sviluppo .
La transizione dal carbone al petrolio

Come si è visto si trattò di una (costosa) vicenda interna all'industria petrolifera, e tale rimase il suo risultato tecnicamente più valido, il cracking catalitico, ancora migliorato dal punto di vista della produzione di combustibili con l'introduzione dei catalizzatori zeolitici ( 1965 ). Il cracking termico invece ha permesso una svolta radicale nei rifornimenti di materie prime all'industria chimica, e ha dato un impeto violento alla produzione di materie plastiche .
L'accessibilità alle materie prime è stata sempre la prima comprensibilissima preoccupazione in tutti i settori produttivi, ma in quello chimico questa preoccupazione è esasperata dal fatto che un singolo nuovo processo può esaurire - di colpo - tutte le risorse disponibili in un certo settore di "intermedi". Così la IG Farben affidò a un chimico di genio, Walter Reppe , il compito di sintetizzare a partire dall' acetilene il butadiene , necessario per il Buna-S. Fra il 1926 ed il 1930 Reppe risolse il problema con un metodo basato su quattro reazioni successive, di cui una era un' idrogenazione ad alta pressione, e tre richiedevano catalizzatori specifici. L'acetilene era ricavato a sua volta dal carburo di calcio , e l'intero sistema tecnico del Buna-S si basava su intermedi provenienti in modo più o meno mediato dal carbone .
Dopo la fine della seconda guerra mondiale la formazione di un nuovo mercato mondiale svaporò gli spettri dell'autarchia nelle grandi economie capitalistiche , e gli sviluppi dell'industria petrolifera che abbiamo appena descritti dettarono una nuova interpretazione del problema degli intermedi, così che, per gradi, si passò dal "tutto dal carbone" al "tutto dal petrolio". Il passaggio fu favorito anche da un altro fatto: gli intermedi richiesti per le nuove sostanze plastiche erano ottenuti con forti economie di scala , impiegando i procedimenti petrolchimici. Un caso emblematico chiarirà la svolta degli anni 1950 .
Quando la ICI iniziò a produrre il polietilene , l'impianto era progettato per una produzione annua di 50 t, e l' etilene era ricavato da alcool etilico di fermentazione . Nel 1952 la produzione di 2.000 t annue di polietilene era impiegata ancora per usi speciali; l'etilene ricavato da fermentazione portava i costi a 250 sterline per tonnellata: il passaggio all'etilene da cracking significò una caduta dei costi a 90 sterline per tonnellata. Ulteriori vantaggi si ebbero spingendo verso l'alto la scala degli impianti; secondo calcoli del 1963 il costo per tonnellata di etilene da cracking sarebbe stato di 22 sterline per tonnellata con un impianto da 50.000 t/anno, e sarebbe sceso a 16 sterline con una produzione annua di 300.000 t. Su questa base tecnico-economica, imperniata sull'ottenimento di idrocarburi alifatici mediante cracking, e sulla produzione di massa di materie plastiche si sarebbe stabilizzato in buona parte quel paesaggio industriale della chimica che è giunto ai giorni nostri.
Plastica e polimeri (1870 - 1970)

In tutti i casi analizzati fino ad ora le molecole sintetiche erano indistinguibili da quelle di origine naturale, già si erano presentati casi in cui un particolare "effetto" (ad esempio fisiologico ), migliorativo o peggiorativo, era ottenuto con molecole di struttura completamente diversa da quelle della sostanza naturale. Così la saccarina (o solfammide benzoica), sintetizzata nel 1879 da Ira Remsen , aveva un potere dolcificante circa cinquecento volte maggiore del saccarosio e non aveva nulla a che fare con gli zuccheri dal punto di vista chimico. Lo stesso vale per i nuovi polimeri sintetici, in quanto portano a sostanze simili ma con caratteristiche diverse rispetto a quelle "mimate" (in particolare le proprietà fisiche , come la duttilità e la malleabilità ).
I primi materiali plastici
L'onda di marea di queste nuove sostanze plastiche cominciò ad alzarsi impercettibilmente in un'occasione "ludica". Negli Stati Uniti era stato offerto un premio di 10.000 $ per chi avesse trovato un materiale sostitutivo dell' avorio , di cui si avvertiva grande penuria per la fabbricazione delle palle da biliardo . John Wesley Hyatt puntò a vincere il premio e, fra le varie sostanze prese in considerazione, studiò la nitrocellulosa ; egli scoprì che la soluzione di canfora in etanolo era un solvente perfetto e un plastificante ideale della nitrocellulosa. Nel 1872 Hyatt mise in commercio i primi articoli di celluloide , una soluzione solida di nitrocellulosa e canfora; malgrado l'estrema infiammabilità , l'eccellente stabilità dimensionale [9] della celluloide la rese insostituibile nei lavori fotografici di precisione, fin quando fu sostituita nel secondo dopoguerra dal triacetato di cellulosa , molto meno infiammabile.

Un secondo materiale plastico destinato a una lunghissima vita sul mercato fu ottenuto da Leo Hendrik Baekeland , un geniale chimico belga trapiantato negli Stati Uniti , che con i suoi brevetti del 1907 aprì il nuovo settore delle sostanze termoplastiche . All'inizio del XX secolo aveva già guadagnato un milione di dollari cedendo a George Eastman il brevetto di una speciale carta fotografica , e si era concesso un periodo di studio a Berlino . Di ritorno negli Stati Uniti, aveva constatato che il suo paese d'adozione importava 27 milioni di chilogrammi di gommalacca , e si era impegnato nella ricerca di un sostituto. La reazione fra fenolo e formaldeide era già stata molto studiata, fin da quando Baeyer aveva segnalato nel 1871 la formazione di una sostanza scura e catramosa, ma nessuno era giunto a controllarla con la maestria di Baekeland: in presenza di alcali aveva ottenuto un materiale resinoso che una volta riscaldato diventava duro, insolubile e non più fusibile. Il nuovo materiale era un ottimo isolante termo elettrico ; il materiale era termoindurente , per cui immesso in stampi sotto forma di polvere dava per un semplice aumento di temperatura oggetti di buona resistenza meccanica , sagomati e complessi a piacere. Il successo di questo materiale, chiamato bachelite fu duraturo; al momento della morte del suo scopritore erano prodotte in tutto il mondo 125.000 t di resine fenoliche .
La seta artificiale

Le ambizioni iniziali di Hyatt e Baekeland erano relativamente modeste: avorio e gomma lacca non servivano certo a consumi di massa. Qui l'inizio della sostituzione avvenne in un territorio classico, quello dell' industria tessile , e germinò da un'intenzione affatto lontana: la produzione di filamenti adatti alle lampade a incandescenza di Edison . Il materiale di partenza dell'inglese Joseph Wilson Swan fu ancora una volta la nitrocellulosa; egli ottenne i primi filamenti nel 1883 iniettando in acido acetico una soluzione di nitrocellulosa. Gli schizzi di soluzione coagulavano in filamenti che Swan successivamente carbonizzava, essiccava e montava su supporti isolanti. La stessa traccia fu seguita in Francia da Hilaire Bernigaud de Chardonnet , un discepolo di Pasteur ; egli disciolse il dinitrato di cellulosa in alcool e etere ; la soluzione, molto densa, veniva forzata attraverso una filiera in un apposito bagno, ed era così ottenuta una "seta artificiale" commerciabile. I nuovi tessuti spuntarono un certo successo perché la fibra era estremamente lucente, ma erano anche piuttosto pericolosi per l'infiammabilità intrinseca della nuova fibra.
Con l'innovazione di Chardonnet, l'idea tecnica di base era formulata con chiarezza: dissolvere la cellulosa o qualche altra sostanza simile in una soluzione viscosa e trafilarla in fibre. Il passo successivo si realizzò in Inghilterra a opera di due chimici industriali, Charles Frederick Cross e Edward John Bevan . Essi erano nei primi anni 1880 i maggiori esperti mondiali dell'industria della cellulosa e della carta ; nel loro laboratorio privato scoprirono che la cellulosa, trattata con soda, reagisce con il solfuro di carbonio dando un composto solubile in acqua (debolmente alcalina ). La soluzione viscosa poteva dare una fibra continua se iniettata in un bagno di acido solforico e solfato di sodio ( 1892 ). L'utilizzazione industriale del processo di Cross e Bevan incontrò non poche difficoltà, ma esso aveva grandi potenzialità in quanto richiedeva come punto di partenza la stessa pasta di legno dell'industria della carta , e non la costosa cellulosa del cotone . Il brevetto fu ceduto a Samuel Courtauld , che avviò la produzione nel 1906 ; alla vigilia della prima guerra mondiale questo processo controllava l'80% del mercato della seta artificiale (" viscosa ").

La storia della produzione di questa fibra è importante anche perché costituisce un caso particolare di pluralismo tecnologico. Sono infatti da ricordare altri due processi: quello che solubilizzava la cellulosa mediante anidride acetica , avviato in Germania nel 1902 e fiorito nel primo dopoguerra, e quello basato su una soluzione cuproammoniacale di cellulosa, il cui prodotto divenne noto sotto il nome di seta Bemberg ( 1911 ).
La convergenza dei diversi processi portò a un vero boom postbellico delle fibre derivate dalla cellulosa: nel 1919 la produzione mondiale era di 11.000 t, dieci anni dopo era salita a 197.000 t. Nel 1933 il pluralismo tecnologico si attenuò con la chiusura degli impianti Chardonnet, mentre alla fine degli anni trenta il processo alla viscosa dominava più dei 4/5 della produzione.
La legislazione a tutela della seta impedì poi l'uso del termine "seta artificiale", che venne sostituita con il termine rayon . Ma allora si stavano già producendo i primi campioni di nylon , ed era iniziata una storia diversa, quella delle fibre totalmente sintetiche.
La nascita della chimica macromolecolare

La chimica macromolecolare fu fondata con un lavoro duro e appassionato da Hermann Staudinger , che fra il 1922 e il 1932 dovette sostenere una lotta estenuante all'interno della comunità scientifica tedesca per affermare il concetto stesso di macromolecola . Ancora nel 1926 , in un grande congresso scientifico a Düsseldorf , apparve completamente isolato; tuttavia a questo isolamento accademico faceva riscontro una forte integrazione con gli interessi della grande industria chimica . Fra i maggiori frutti di questa collaborazione, dobbiamo ricordare la produzione di massa del Buna-S (5.000 t nel 1938), un elastomero che si otteneva dalla co-polimerizzazione del butadiene e dello stirene , e che si dimostrò un buon sostituto del caucciù . L'interesse della Bayer alla ricerca sulla gomma sintetica risaliva al 1906 , però il crollo dei prezzi del prodotto naturale dopo il 1910 aveva messo in ombra l'ipotesi di uno sviluppo commerciale. La situazione drammatica dei rifornimenti durante la guerra aveva permesso la produzione di 2.350 t di gomma metile , derivata dalla polimerizzazione di 2,3-dimetilbutadiene . Il progresso fra questa situazione e quella nella seconda guerra mondiale può essere visto (oltre che nella qualità del prodotto) nei tempi di polimerizzazione . Per la gomma metile erano necessari da 3 a 5 mesi per la polimerizzazione al 97% di una carica; nel primo dopoguerra l'impiego del butadiene e del sodio come catalizzatore fece scendere i tempi a due settimane. Il passo decisivo avvenne nel 1927 , quando alla Bayer (allora "inclusa" nell' IG Farben ) venne messa a punto la nuova tecnologia della polimerizzazione in emulsione ; durante la seconda guerra mondiale la reazione richiedeva solo più 30 ore negli impianti tedeschi di Schkopau , e appena 14 negli Stati Uniti , dove la situazione delle applicazioni della chimica macromolecolare era piuttosto diversa da quella tedesca.
Le ricerche sviluppate da Wallace Carothers per conto della DuPont a partire dal 1928 , pur condotte in un laboratorio industriale furono più specializzate, e in un certo senso più eleganti di quelle di Staudinger . Ne derivarono due prodotti di qualità; nel 1931 Carothers sintetizzò un elastomero derivato dal cloroprene ; esso fu commercializzato come gomma per usi speciali ( neoprene ) nel 1935 , anno in cui il chimico della DuPont brevettò una serie di nuovi polimeri poliammidici. La produzione del nylon -66 iniziò nel 1938 , dopo quattro anni di lavoro di sviluppo, costato alla DuPont 27 milioni di dollari. Malgrado questi successi (o forse proprio per questi) al momento dell' invasione giapponese delle Indie olandesi gli Stati Uniti non possedevano conoscenze "indigene" atte a sopperire ai mancati rifornimenti di caucciù; la produzione a scopi militari di gomma sintetica fu quindi alimentata con i brevetti del Buna-S. Al termine della guerra, la produzione mondiale di Buna-S era di 756.000 t all'anno, quella di neoprene di 45.000 t.
PVC, polietilene e polipropilene
La prima sintesi del cloruro di vinile risale alle ricerche giovanili di Henri Victor Regnault , condotte nel 1835 nel laboratorio di Justus von Liebig . Le proprietà di polimerizzazione di questa sostanza rimasero incontrollabili, fin quando un chimico industriale della Höchst , Fritz Klatte , prese (fra il 1912 e il 1913 ) una serie di brevetti che puntavano alla foto- polimerizzazione del cloruro di vinile ; il polivinilcloruro così ottenuto risultava essere un materiale intrattabile: instabile alla luce, duro da lavorare, e poteva liberare acido cloridrico se riscaldato. Fu nei laboratori dell' IG Farben che si trovò una soluzione a tutti questi problemi, man mano che divenivano accessibili i fondamenti della chimica macromolecolare di Staudinger. Il passo fondamentale fu compiuto nei laboratori di Ludwigshafen ( 1929 - 1931 ), con il trasferimento alla sintesi del PVC delle conoscenze acquisite nella polimerizzazione in emulsione del Buna-S e conseguente commercializzazione iniziata come materiale adatto agli usi più svariati.
Del tutto diverso fu il contesto scientifico-tecnico in cui venne alla luce il polietilene . L' Alcali Division della Imperial Chemical Industries aveva forti tradizioni di ricerca, ereditate dall'impresa di Mond che vi era stata incorporata al momento della formazione della ICI nel 1926 . Proprio alla vigilia della fondazione dell' oligopolio inglese, aveva iniziato a lavorarvi un giovane chimico, RO Gibson, già allievo di A. Michels, uno studioso olandese delle tecniche di sintesi ad altissime pressioni. Il progetto di ricerca fondamentale era nato da un interesse verso il processo Haber, ed era rivolto allo studio delle reazioni di addizione fra etilene e la benzaldeide . I primi reattori disegnati da Michels furono installati nei laboratori di Winnington [10] nel 1931 , e il 27 marzo 1933 fu notato che una cera bianca ricopriva le pareti di un recipiente che aveva contenuto etilene e benzaldeide a una pressione fra le 1.000 e le 2.000 atmosfere ; l'analisi rivelò che era un polimero dell'etilene, ma solo nel dicembre del 1935 l'etilene fu fatto reagire da solo, con l'ottenimento di 8 g di polimero. A questo punto il problema tecnico di rendere il processo sicuro, con compressori affidabili, occupò la ICI fino al marzo 1938 , quando fu avviata la preparazione su piccola scala. La prima tonnellata di materiale dimostrò che questo aveva qualità impareggiabili come isolante elettrico , e nell'agosto del 1939 iniziò la produzione industriale , che fu interamente assorbita dalle necessità belliche (in particolare nelle tecniche collegate al radar ). Finita la guerra , il polietilene rischiò di scomparire dai prodotti della ICI, ma i risultati delle ricerche sulle possibili nuove applicazioni dimostrarono che il polietilene era un materiale assai più versatile di quanto si fosse pensato.
Uno sviluppo imprevisto venne dalle ricerche di Karl Ziegler , che si era occupato nel 1928 dell' attività catalitica del sodio nella preparazione del Buna-S, e non aveva mai abbandonato il campo dei composti metallorganici . Dal 1945 si era dedicato a ricerche sui composti organici dell' alluminio , e nel 1953 stava cercando di sintetizzare derivati tri-alchilici superiori dell'alluminio scaldando i termini inferiori con etilene, quando si imbatté in un risultato sorprendente: la dimerizzazione completa dell'etilene in butilene. Seguendo questa traccia, Ziegler scoprì che il tetracloruro di titanio favoriva la formazione di alti polimeri lineari dell'etilene in condizioni di temperatura e pressione assai blande. Era l'inizio di una vera rivoluzione, non solo per il nuovo processo di sintesi del polietilene (Höchst, 1955 ), ma anche per il formidabile effetto amplificatore di queste scoperte nel laboratorio milanese di Giulio Natta , che da tempo era in contatto con Ziegler attraverso la mediazione della Montecatini . Natta estese la reazione di Ziegler al propilene , scoprendo un'intera nuova classe di polimeri, e spiegandone le eccezionali proprietà attraverso una precisa indagine strutturale. La Montecatini cominciò la produzione commerciale del polipropilene nel 1957 . Nel 1962 la produzione mondiale del polietilene ad alta densità di Ziegler e del polipropilene di Natta raggiungeva le 250.000 t; l'anno successivo i due scienziati ricevettero congiuntamente il premio Nobel per la chimica .
I processi di innovazione con cui i nuovi materiali polimerici furono portati sul mercato sono stati tortuosi, punteggiati da eventi inaspettati, e spesso vissuti dalle imprese con ritmi decennali. Sono i segni vistosi di una rivoluzione scientifica, che metteva in discussione il concetto classico di molecola e di una rivoluzione tecnica coeva, che doveva gestire nello stesso momento nuovi processi e nuovi prodotti. Un'analisi dettagliata dei principali "avanzamenti tecnici" nel periodo fino al 1955 (117 in tutto) ha dimostrato la presenza dominante di tre soli paesi, e quella rilevante di poche grandi imprese: su un totale di 51 innovazioni originate in Germania , 30 si erano realizzate all'interno dell' IG Farben ; sul totale degli Stati Uniti di 43 la DuPont ne poteva rivendicare 12; l' Inghilterra contava 15 innovazioni. A tutti gli altri paesi rimanevano solo 8 innovazioni.
Per quanto riguarda i tempi di trasferimento delle scoperte di laboratorio alla produzione industriale, la commercializzazione dei risultati di Ziegler e Natta appare particolarmente rapida. A questo hanno contribuito diversi fattori: innanzi tutto le condizioni blande in cui si realizzavano le reazioni di polimerizzazione, e un generale progresso delle pratiche costruttive degli impianti chimici, ma forse il fattore essenziale è stato la flessibilità conseguita dall' industria petrolchimica nella produzione delle diverse classi di idrocarburi .
L'industria chimica in Italia

L' industria chimica in Italia si basa essenzialmente sul settore petrolchimico e farmaceutico .
Le prime industrie chimiche in Italia nascono a partire dalla seconda metà dell' Ottocento . Il 26 marzo 1882 nasce l' ACNA ( Azienda Coloranti Nazionali e Affini ), a cui seguono la A. Menarini Industrie Farmaceutiche Riunite Srl ( 1886 , Napoli ) e la Società Anonima delle Miniere di Montecatini (che più tardi si chiamerà Montecatini ) nel 1888 .
Nella prima metà del Novecento fioriscono in Italia numerose aziende farmaceutiche, in particolare:
- 1919 : Francesco Angelini fonda la ACRAF ( Aziende Chimiche Riunite Angelini Francesco ), che diventerà una azienda farmaceutica operante a livello nazionale.
- 1926 : viene fondato il gruppo "Laboratorio Farmacologico Reggiano", che in seguito cambierà nome in Recordati
- 1935 : nasce a Parma il gruppo farmaceutico Chiesi
- 1935 : viene fondata l'azienda farmaceutica Farmitalia .
- 1936 : viene aperto il Polo chimico di Ferrara , con le prime aziende di saponi e gomma.
Nel 1915 viene fondata la Chimico Mineraria Rumianca , poi semplicemente Rumianca , seguita nel 1918 dalla Società Elettrochimica del Toce a Villadossola , per la produzione di carburo di calcio . Altra importante industria chimica e la Società Italiana Resine o SIR fondata nel 1922. Nel 1936 è la volta dell' Anic ( Azienda Nazionale Idrogenazione Combustibili ), dopo che l' Agip e Aipa , in collaborazione con la Montecatini , decisero di fondarla con lo scopo di ottenere combustibili succedanei del petrolio tramite l'idrogenizzazione del carbone nelle raffinerie di Livorno e Bari .
Nel decennio che va tra il 1950 e il 1960 l'economia italiana attraversa il periodo storico che verrà poi chiamato "boom economico" o "miracolo economico"; durante questa fase vengono fondate la Mossi & Ghisolfi ( 1953 ) e l' Eni ( 1953 ), e viene costruito il polo petrolchimico di Gela ( 1959 ).
Nel 1963 Giulio Natta riceve il premio Nobel per la chimica per la realizzazione del polipropilene isotattico e del polietilene ad alta densità (HDPE), che vennero messi in commercio da aziende del gruppo Montecatini con i nomi di Moplen e Meraklon .
Nel 1966 per fusione della Montecatini con la Edison nasce la Montedison ; l'azienda produceva materie prime di base (organiche ed inorganiche) e una vasta gamma di polimeri . La progressiva frammentazione del gruppo, con conseguente vendita delle varie sedi produttive, ha portato alla definitiva chiusura nel 2002 .
Nel 1967 la Società Italiana Resine incorpora la Rumianca costituendo il gruppo SIR-Rumianca .
Gli anni settanta segnarono negativamente il mondo dell'industria chimica internazionale, e così anche il panorama industriale italiano: questi anni corrispondono infatti a due successive crisi energetiche (la crisi del '73 e quella del '79 ), che avvennero conseguentemente al raggiungimento (per gli Stati Uniti d'America ) del picco di Hubbert , dal nome dello studioso Marion King Hubbert che già nel 1956 aveva previsto delle crisi associate allo sfruttamento di risorse limitate [11] . Nel decennio successivo sparì la SIR-Rumianca , assorbita dall' ENI tramite l' Anic , mentre nel 1991 un nuovo tentativo di fusione tra ENI e Montedison, chiamato Enimont e nato solo tre anni prima, falliva con la confluenza di tutte le attività chimiche del gruppo Montedison all'ENI. Venne in seguito accertato che questa fusione fu favorita dal pagamento di un'importante tangente ai politici di allora da parte dell'imprenditore Montedison Raul Gardini .
Il periodo successivo alla crisi energetica vede le industrie chimiche impegnate in attività a sostegno dell'ambiente. Un esempio in questo senso è la Novamont , produttrice di materiale termoplastico biodegradabile, seguendo un processo che utilizza come materie prime l' amido di mais , il grano e la patata [12] . Nel 2011 ENI ha creato una joint venture con Novamont per la creazione di un polo chimico verde presso lo stabilimento di Porto Torres in Sardegna.
La chimica e l'ambiente
Abbiamo seguito le principali vicende dell'industria chimica dalla metà del XVIII secolo fino alle soglie della crisi energetica degli anni 1970 , quando inizia una difficile presa di coscienza dei costi sociali e ambientali di due secoli di sviluppo tecnico e di crescita produttiva.
Oltre ai danni causati dalle armi e dalla tecnologia bellica, a conferma dei grandi costi ambientali e sociali dello sviluppo industriale, riportiamo qui di seguito una breve cronologia di noti avvenimenti:
- 1921 - Oppau ( Germania ) - esplosione di nitrato d'ammonio alla BASF , oltre 800 morti; [13]
- anni cinquanta - Minamata ( Giappone ) e Iraq - casi di intossicazione da metilmercurio ( malattia di Minamata ); [14]
- anni sessanta - Gruenenthal ( Germania ) - scoppia il caso talidomide , numerosi bambini nati deformi; [15]
- 1965 - 70 - durante la Guerra del Vietnam sono scaricate nell'ambiente e sulla popolazione vietnamita 80.000 t di agente Arancio ; [16]
- 1976 disastro di Seveso - da un reattore dell'azienda ICMESA [17] fuoriesce TCDD tetracloro-p-dibenzodiossina, 6.000 residenti esposti ai danni provocati dalla sostanza;
- 1984 disastro di Bhopal [18] ( India ) - dispersione di 40 t di metilisocianato fuoriuscite dallo stabilimento della Union Carbide che produceva il Sevin, decine di migliaia d'intossicati e più di 2000 morti;
- 1985 - è descritto per la prima volta sulla rivista Nature il buco dell'ozono ;
- 2001 - Tolosa ( Francia ) - esplosione di nitrato d'ammonio alla AZF , 31 morti e 2442 feriti. [19]
Anche ciò che al momento del suo sorgere era apparso una grande conquista divenne altro nel suo permanere. È esemplare il caso dei prodotti farmaceutici in cui le pressioni dell'industria, le ambizioni dei medici, e le ossessioni dei pazienti sono riuscite a far "dimenticare" che sulfamidici e antibiotici hanno salvato (e salvano) da morte sicura milioni di malati. Analoghi sintomi di rigetto si sono manifestati verso altre classi di prodotti chimici, dagli antiparassitari ai nuovi materiali plastici .
Riepilogo
L'epoca dei tecnici imprenditori ebbe il suo massimo fiorire nella seconda metà dell' Ottocento , quando figure come Perkin, Solvay, Nobel, Castner, Chardonnet, Baekeland, fondarono grandi industrie a partire da modesti capitali iniziali. Già negli anni fra le due guerre mondiali questo modello era in piena crisi: Casale affermò il suo processo morendo a 45 anni, stroncato dal superlavoro; Bergius preferì cedere i suoi brevetti alla BASF, e Houdry non riuscì a mantenersi indipendente nemmeno dando fondo al suo ingente patrimonio personale. I due modi con cui i produttori di conoscenza, scienziati e tecnici, si rapportano attualmente con la produzione materiale, furono messi a punto nella cultura industriale tedesca nei decenni a cavallo fra il XIX e il XX secolo. Il modello "perfetto" si realizzò con la sintesi dell' ammoniaca , quando due grandi scienziati, Nernst e Haber, re-inventarono il problema, uno di essi (Haber) lo risolse in laboratorio, un tecnico-scienziato (Mittasch) lo rielaborò nella BASF, e un imprenditore (Bosch) ne curò la realizzazione ingegneristica su scala gigantesca. Più in generale la conoscenza giunge all'impresa sia dall'esterno del processo di produzione materiale, sia dall'interno. Questa situazione ormai consolidata delega il massimo di responsabilità all'imprenditore, nelle cui mani viene accentrato un potere di orientamento della ricerca e della produzione non sempre bilanciato da opportuni strumenti di controllo sociale .
La necessità di un'attenzione viva e razionale sugli sviluppi dell'industria chimica è acuita da una seconda tendenza di lungo periodo. L'approfondirsi delle conoscenze chimiche ha seguito una direzione precisa: dall' inorganico all' organico , fino al biologico . Nello stesso tempo la produzione materiale ha cominciato a duplicare i prodotti "naturali" maggiormente richiesti dall'industria: la soda, l'acido solforico, l'acido nitrico. La duplicazione si è estesa a molecole più complesse: prima i coloranti , poi via via molti composti di interesse direttamente fisiologico quali vitamine , ormoni , antibiotici . L' industria chimica ha cominciato a sostituire una parte cospicua del nostro mondo materiale, a partire dalle fibre tessili per giungere a parti del nostro corpo come le valvole cardiache .
In aggiunta, la coscienza riguardo ai problemi etici e ambientali dell'industria rende necessario, per il nuovo secolo, una filosofia più attenta ai temi ambientali ed allo sviluppo sostenibile , che può essere rappresentata dalla chimica verde . [20]
Note
- ^ Michael Flavin, Benjamin Disraeli: The Novel As Political Discourse , Sussex Academic Press, 2005. ISBN 1-903900-30-1
- ^ Lead Chamber Process , su sulphuric-acid.com . URL consultato il 21-12-2008 .
- ^ L'anilina è un agente cancerogeno , la cui cancerogenicità fu accertata per la prima volta da studi epidemiologici tedeschi sugli operai dell'industria dei coloranti, che associarono il tumore all'esposizione lavorativa.
- ^ Mauveine: The First Industrial Organic Fine-Chemical , su ch.ic.ac.uk . URL consultato il 21-12-2008 .
- ^ La porpora di anilina è una miscela composta da 4 composti aromatici simili, che si differenziano solo per la disposizione dei gruppi metilici. Questi composti sono la mauveina A, la mauveina B, la mauveina B2 e la mauveina C.
- ^ La sigla CI sta per Colour Index , che fa riferimento alla designazione nell'ambito dell' indice internazionale dei coloranti .
- ^ 26 giugno 2019 , su parodos.it (archiviato dall' url originale l'8 aprile 2016) .
- ^ Gerthe è una parte della città di Bochum , in Germania .
- ^ Per stabilità dimensionale si intende la caratteristica chimico-fisica di mantenere la propria forma anche in presenza di sollecitazioni esterne .
- ^ Winnington è un'area della città di Northwich , nel Cheshire , in Inghilterra .
- ^ King Hubbert : Il picco di produzione del petrolio , su dani2989.com . URL consultato il 22-12-2008 .
- ^ La bioraffineria di Terni Qui nasce la plastica pulita , su peacelink.it . URL consultato il 22-12-2008 .
- ^ Copia archiviata ( PDF ), su barpipdf.geniecube.info . URL consultato il 13 febbraio 2009 (archiviato dall' url originale il 25 marzo 2009) .
- ^ Minamata Disease The History and Measures - Chapter 2 [MOE]
- ^ http://www.modenasitiweb.it/img-talidomide-focomelia/art-gianni-moriani.doc
- ^ www.monde-diplomatique.it , su monde-diplomatique.it . URL consultato il 13 febbraio 2009 (archiviato dall' url originale il 25 gennaio 2012) .
- ^ allora parte del gruppo Givaudan & C. di Vernier SA di Ginevra .
- ^ ( EN ) W. Morehouse, The Bhopal Tragedy , 1986.
- ^ Lecco: Lecco
- ^ ( EN ) Italo Pasquon, Luciano Zanderighi, La chimica verde , Hoepli, Milano, 1987. ISBN 88-203-1567-X
Bibliografia
- Geoffrey John Pizzorni (a cura di), L'industria chimica italiana nel Novecento , 1ª ed., Franco Angeli edizioni, 2006, ISBN 88-464-7226-8 .
- Antonio Corvi, L'officina farmaceutica: due secoli di storia , 1999, Primula Multimedia, ISBN 88-87344-08-6 .
- Livio Cambi, Ernestina Dubini Paglia, Le grandi conquiste della chimica industriale , ERI, Torino, 1970.
- Luciano Caglioti , I due volti della chimica. Benefici e rischi , EST Mondadori, Milano, 1979.
- ( EN ) Fred Aftalion, History of the International Chemical Industry: From the "Early Days" to 2000 , 2ª ed., Chemical Heritage Foundation, 2005, ISBN 0-941901-29-7 .
- ( EN ) Alfred Dupont, Jr. Chandler, Shaping the Industrial Century: The Remarkable Story of the Evolution of the Modern Chemical and Pharmaceutical Industries , Harvard University Press, 2005, ISBN 0-674-01720-X .
- ( EN ) Fritz Ullmann, Ullman's Encyclopedia of Industrial Chemistry , 6ª ed., Wiley-VCH, 2002, ISBN 3-527-30385-5 .
- ( EN ) Robert P. Multhauf, The History of Chemical Technology. An Annotated Bibliography , 6ª ed., Garland Pub., New York, 1984, ISBN 0-8240-9255-4 .
- ( EN ) Ludwig F. Haber, The chemical industry during the nineteenth century: A study of the economic aspects of applied chemistry in Europe and North America , Clarendon Press, Oxford, 1958, ISBN 0-19-858102-5 .
- ( EN ) Ludwig Fritz Haber, The Chemical Industry, 1900-1930. International Growth and Technological Change , Clarendon Press, Oxford, 1971, ISBN 0-19-858133-5 .
- ( EN ) Frank Sherwood Taylor, A History of Industrial Chemistry , Heinemann, Londra, 1957, ISBN 978-0-405-04725-1 .
- ( EN ) Aaron John Ihde, The Development of Modern Chemistry , Dover Publications, New York, 1984, ISBN 0-486-64235-6 .
- ( EN ) (a cura di Charles Joseph Singer), A History of Technology, vol. IV e V , Oxford, 1958.
- ( EN ) (a cura di Trevor Illtyd Williams), A History of Technology, vol. VI, parte I , Oxford, 1978.
- ( EN ) Williams Haynes, American Chemical industry, vol. VI , The University of Chicago Press, New York, 1945-1954.
- ( EN ) Paul M. Hohenberg, Chemicals in Western Europe, 1850-1914. An economic study of technical change , Chicago, 1967.
- ( EN ) John Joseph Beer, The Emergence of the German Dye Industry (The development of science) , Ayer Co Pub, Urbana, 1981, ISBN 0-405-13835-0 .
- ( EN ) Martha Moore Trescott, The Rise of the American Electrochemicals industry, 1880-1910. Studies in the American Technological Environment , Westport, 1981.
- ( EN ) Peter H. Spitz, Petrochemicals. The Rise of an industry , Wiley, New York, 1988, ISBN 0-471-85985-0 .
- ( EN ) William Joseph Reader, Imperial Chemical Industry. A History, vol. II , Londra, 1970.
- ( EN ) Frank M. McMillan, The Chain Straighteners , Macmillan Press, Londra, 1979, ISBN 0-333-25929-7 .
- ( EN ) Bryan G. Reuben, ML Burstall, The Chemical Economy. A Guide to the Technology and Economics of the Chemical Industry , Longmans, Londra, 1973, ISBN 0-582-46307-6 .
- ( EN ) Chris Freeman, Luc Soete, The Economics of Industrial Innovation , 3ª ed., The MIT Press, 1997, ISBN 0-262-56113-1 .
- ( EN ) Kurt Lanz, Around the World with Chemistry , 1980.
- ( EN ) Graham D. Taylor, Du Pont and the International Chemical Industry , 1984.
- ( EN ) Fred Aftalion, A History of the International Chemical Industry , 1991.
- ( EN ) Alan Heaton, The Chemical Industry , 2ª ed., 1994.
- ( DE ) Fritz ter Meer, Die IG Farben Industrie Gesellschaft , Düsseldorf, 1953.
Voci correlate
- Ambiti dell'industria chimica
- Chimica
- Chimica industriale
- Industria
- Industria farmaceutica
- Industria petrolchimica
- Industria tessile
- Impianti chimici
Altri progetti
-
 Wikibooks contiene testi o manuali su storia dell'industria chimica
Wikibooks contiene testi o manuali su storia dell'industria chimica
Collegamenti esterni
- Minerva: Storia dell'industria chimica da cui la versione iniziale di questa voce è tratta.
- Trattazione dei processi dell'industria chimica (in formato pdf)
- I Corsi di Storia e Cultura dell'Industria - Settori industriali e imprese - Chimica e farmaceutica - Acna - Storia (pag.1) , su corsi.storiaindustria.it .
- Storia dell'industria chimica in Italia. , su corsi.storiaindustria.it .
- ( EN ) Chemical Industry Archives , su chemicalindustryarchives.org . URL consultato il 16 dicembre 2008 (archiviato dall' url originale il 20 dicembre 2008) .
- ( EN ) Rassegna storica dei coloranti artificiali. ( PDF ), su stoltz.caltech.edu . URL consultato il 21 dicembre 2008 (archiviato dall' url originale il 30 agosto 2008) .
- ( DE ) Storia dell'industria chimica tedesca. ( PDF ), su deutsches-chemie-museum.de . URL consultato il 16 dicembre 2008 (archiviato dall' url originale il 9 maggio 2015) .