Tetrafluorură de seleniu
| Tetrafluorură de seleniu | |
|---|---|
| Caracteristici generale | |
| Formula moleculară sau brută | SeF 4 |
| Masa moleculară ( u ) | 154.954 |
| Aspect | lichid incolor |
| numar CAS | |
| Numărul EINECS | 236-703-6 |
| PubChem | 123311 |
| ZÂMBETE | F[Se](F)(F)F |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2,77 |
| Solubilitate în apă | reacție violentă |
| Temperatură de topire | −13 ° C (260 K) |
| Temperatura de fierbere | 101 ° C (374 K) |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| | |
| Expresii R. | 23 / 25-33-50 / 53 |
| Fraze S. | 20 / 21-28-45 |
Tetrafluorura de seleniu este compusul anorganic cu formula SeF 4 . În condiții normale, este un lichid incolor fumuros care reacționează violent cu apa. Este un compus toxic și coroziv. Poate fi utilizat ca agent de fluorurare în chimia organică (fluorarea alcoolilor , a acizilor carboxilici și a compușilor carbonilici ); în comparație cu SF 4 este mai avantajos, deoarece necesită condiții mai blânde și este mai degrabă un lichid decât un gaz. [1]
Structura
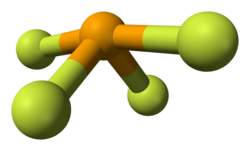
SeF 4 este un compus molecular; în stare gazoasă molecula are o formă de oscilație, cu simetrie C 2v , similar cu SF 4 . Această structură este în conformitate cu teoria VSEPR , care prezice că perechea de electroni nepartajați ocupă o poziție ecuatorială într-o schemă de bază bipiramidă trigonală. Distanța dintre atomul de seleniu și atomii de fluor axial este de 177 pm , iar unghiul F - Se - F este de 169,2 °. Cei doi atomi de fluor ecuatoriali au o distanță de legătură mai mică (168 pm) cu un unghi F - Se - F de 100,6 °. În soluțiile diluate, această structură monomerică este specia predominantă, dar la o concentrație mai mare există dovezi ale unei asocieri slabe între moleculele de SeF 4 , iar în jurul atomului de seleniu există o coordonare octaedrică distorsionată. [2] Chiar și în stare solidă, atomul de seleniu are un mediu octaedric distorsionat. [3]
Sinteză
SeF 4 a fost descris pentru prima dată în 1907 de Paul Lebeau , care l-a obținut prin reacția de seleniu și fluor : [4]
SeF 4 poate fi obținut și prin fluorurarea seleniului cu trifluorură de clor sau prin reacția tetrafluorurii de sulf cu dioxid de seleniu :
Reactivitate
În HF, SeF 4 se comportă ca o bază slabă, mai slabă decât SeF 4 (K b = 2 x 10 –2 ):
- SeF 4 + HF ⇄ SeF 3 + + [HF] 2 - (K b = 4 x 10 –4 )
Aducți ionici care conțin 3 + cationi SEF sunt formate cu SBF 5 , asf 5 , NBF 5 , TAF 5 și BF3 . [5]
Cu CsF , pe de altă parte, se formează anionul SeF 5 - care are o structură piramidală cu o bază pătrată similară cu speciile izoelectronice ClF 5 și BrF 5 . [6]
Anionul SeF 6 2– este format cu fluorură de hexametilpiperidiniu sau fluorură de 1,2-dimetilpropiltrimetilamoniu; are o structură octaedrică distorsionată, spre deosebire de analogul SeCl 6 2– care are o structură octaedrică regulată. [7]
Siguranță
SeF 4 este un compus toxic și coroziv care reacționează violent cu apa. Provoacă arsuri ale pielii, ochilor, sistemului respirator și ale tuturor membranelor mucoase. [8]
Notă
- ^ GA Olah, M. Nojima, I. Kerekes, Metode și reacții sintetice. I. Tetrafluorura de seleniu și complexul său de piridină. Agenți de fluorurare convenabili pentru fluorinarea cetonelor, aldehidelor, amidelor, alcoolilor, acizilor carboxilici și anhidrurilor , în J. Am. Chem. Soc. , Vol. 96, nr. 3, 1974, pp. 925-927, DOI : 10.1021 / ja00810a052 .
- ^ ( DE ) K. Seppelt, Die Struktur des Selentetrafluorid in Lösung , in Z. anorg. Anexă Chem. , vol. 416, nr. 1, 1975, pp. 12-18, DOI : 10.1002 / zaac.19754160103 .
- ^ NN Greenwood, A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ^ P. Lebeau, Action du fluor sur le sèlénium. Tétrafluorure de sèlénium , în Comptes Rendus Acad. Sci., Paris , vol. 144, 1907, pp. 1042-1044. Adus la 26 mai 2011 .
- ^ RJ Gillespie, A. Whitla, Selenium tetrafluoride adducts. II. Aduce cu trifluorură de bor și câteva pentafluoruri , în Can. J. Chem. , vol. 48, nr. 4, 1970, pp. 657-663, DOI : 10.1139 / v70-106 .
- ^ KO Christe, EC Curtis, CJ Schack, D. Pilipovich, Spectre vibraționale și constante de forță ale anionilor pătrat-piramidali SF 5 - , SeF 5 - și TeF 5 - , în Inorg. Chem. , vol. 11, n. 7, 1972, pp. 1679-1682, DOI : 10.1021 / ic50113a046 .
- ^ AR Mahjoub, X. Zhang, K. Seppelt, Reacțiile ionului de fluor „gol”: sinteze și structuri ale SeF 6 2– și BrF 6 - , în Chem. Eur. J. , vol. 1, nr. 4, 1995, pp. 261-265, DOI : 10.1002 / chim . 19950010410 .
- ^ Oakwood Products, Fișa cu date de securitate SeF 4 ( PDF ) [ link rupt ] , pe labseeker.com . Adus pe 9 iunie 2011 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe tetrafluorură de seleniu
Wikimedia Commons conține imagini sau alte fișiere pe tetrafluorură de seleniu