Tetrazfur tetranitridă
| Tetrazfur tetranitridă | |
|---|---|
| Caracteristici generale | |
| Formula moleculară sau brută | S 4 N 4 |
| Masa moleculară ( u ) | 184,29 |
| Aspect | portocaliu galben solid |
| numar CAS | |
| PubChem | 141455 |
| ZÂMBETE | N1=S=NSN=S=NS1 |
| Proprietăți fizico-chimice | |
| Temperatură de topire | 187 ° C (460 K) |
| Proprietăți termochimice | |
| Δ f H 0 (kJ mol −1 ) | +460 |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| | |
Tetrazfur tetranitrida este compusul anorganic cu formula S 4 N 4 . În condiții standard este un solid cristalin galben portocaliu. Este cel mai important dintre nitrurile de sulf, compuși binari între sulf și azot . A atras multă curiozitate, deoarece are o structură și legături neobișnuite și este precursorul multor compuși S-N. [1] [2]
Impuritățile de sulf au o putere de stabilizare a întregului compus, care devine mai puțin supus exploziei.
Azotul și sulful au valori de electronegativitate similare; în aceste cazuri cei doi atomi formează adesea un număr mare de structuri cu legături covalente. S 4 N 4 poate fi considerat progenitorul a numeroși compuși cunoscuți S - N și S - NH.
Caracteristici
S 4 N 4 este unul dintre cei mai cunoscuți compuși în cuști (structură cu simetrie D 2d ) și a fost descris pentru prima dată în 1835 de W. Gregory. Tinde spre descompunere explozivă și termocromism , ceea ce înseamnă o trecere a compusului de la incolor (la 77 K) la o culoare galben-portocalie tipică (la 298 K, care este și culoarea la temperatura camerei ) până la un roșu intens (la 373 K). [3]
Când tetranfurul tetrazfur trece la starea gazoasă, în prezența vatei de argint (de la 200 la 300 ° C), se descompune formând S 2 N 2 . [4]
Tetrazfur tetranitridă se sublimează la temperaturi sub 130 ° C și 0,1 mbar de presiune . Este insolubil în apă , alcali și acizi numai cu descompunere sub protonație. Tetranitrida solidă de tetrazfur se descompune prin explozie ( detonare ) atunci când este încălzită la peste 130 ° C sau la impact (460 kJ / mol).
Compusul gazos se descompune în principal peste 200 ° C în forme S 3 N 3 și S 4 N 2 . Peste 300 ° C se descompune în elemente mononitridice SN. [5]
Tetranfurul de tetrazfur este una dintre principalele materii prime pentru producerea compușilor de sulf și azot , cum ar fi trimerul ciclic clorură de tionitrosil . [3]
Proprietăți fizice
S 4 N 4 este un solid cristalin diamagnetic , stabil în aer. Având o entalpie de formare de +460 kJ mol -1, totuși, este instabil termodinamic, deoarece produșii de descompunere ai sulfului elementar și azotului sunt foarte stabili. Această entalpie endotermică de formare contribuie la instabilitatea sa inerentă și provine din diferența de energie a S 4 N 4 în comparație cu produsele sale de descompunere foarte stabile ( sulf și azot ):
- 2S 4 N 4 → 4N 2 + S 8
Deoarece unul dintre produsele de descompunere este gazos, S 4 N 4 este un exploziv și poate detona dacă este lovit sau încălzit rapid, mai ales dacă puritatea compusului este mare. [1] Probele pure tind să fie mai ușor explozive.
S 4 N 4 este termocrom : schimbarea culorii de la galben deschis la –30 ° C în roșu închis peste 100 ° C. [1]
Deși multe molecule complexe sunt instabile termodinamic, ele pot fi încă cinetice stabile, acest lucru este rar în compoziții foarte simple, cum ar fi nitrura de sulf .
Proprietăți chimice
Tetranfurul tetrazfuric formează cristale galben - portocalii cu structură ortorombică, grup spațial P mmm , parametri celulari a = 0,847 нм, b = 0,887 нм, c = 0,720 нм, Z = 4.
- Se descompune la cald :
- Se descompune în apă fierbinte:
- Reacționează cu acizi concentrați fierbinți:
- Reacționează cu alcalii :
- Reacționează cu sulf dizolvat în disulfură de carbon :
- Este un agent oxidant slab:
De asemenea, reacționează în următoarele reacții chimice complexe, obținute în principal în laborator sau, în orice caz, experimental:
- Dizolvarea sulfului în amoniac lichid cu reacție de iodură de argint (este mai rapidă):
- Dizolvarea în amoniac lichid:
Structura
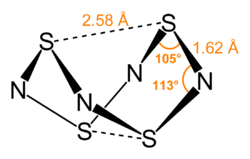
Acest compus poate fi văzut formal ca un derivat al unui inel ipotetic de opt atomi alternativi de sulf și azot . Legătura S 4 N 4 este considerată delocalizată și acest lucru este indicat de faptul că distanțele legăturii dintre atomii de sulf vecini și atomii de azot sunt aproape aceiași. S 4 N 4 are o structură de leagăn foarte pronunțată neobișnuită, cu simetrie D 2d . Măsurătorile de difracție cu raze X indică faptul că cei doi atomi de sulf transanulari sunt distanți la 2,586 Å, astfel încât structura moleculei seamănă cu o cușcă (așa cum este determinată de cristalul de difracție cu raze X). [6] Distanța transanulară S - S rămâne în curs de investigare, deoarece este semnificativ mai mică decât suma distanțelor de raze van der Waals , dar a fost explicată în contextul teoriei orbitale moleculare . [7] și mai mare decât cea prezisă de o legătură simplă, indicând că există o interacțiune slabă, dar semnificativă între acești atomi de sulf. [1] Legătura din S 4 N 4 este considerată delocalizată, așa cum se indică prin distanțele egale între atomii de sulf și azot adiacenți.
Sinteză
S 4 N 4 a fost preparat pentru prima dată de W. Gregory în 1835, [8] prin reacția S 2 Cl 2 cu amoniac . Ulterior a fost folosit și SCl 2 . [9] Mecanismele de reacție sunt necunoscute, dar stoichiometria generală este:
- 6 S 2 Cl 2 + 16 NH 3 → S 4 N 4 + S 8 + 12 NH 4 Cl
- 24 SCl 2 + 64 NH 3 → 4S 4 N 4 + S 8 + 48 NH 4 Cl
O altă sinteză similară folosește în schimb S 2 Cl 2 și clorură de amoniu : [1]
- 4 NH 4 Cl + 6 S 2 Cl 2 → S 4 N 4 + 16 HCI + S 8
O sinteză mai recentă folosește [(Me 3 Si) 2 N] 2 S ca precursor cu legături S - N preformate. [(Me 3 Si) 2 N] 2 S se obține prin reacția bis (trimetilsilil) amidei de litiu și SCl 2 :
- 2 [Me 3 Si] 2 NLi + SCl 2 → [(Me 3 Si) 2 N] 2 S + 2 LiCl
[(Me 3 Si) 2 N] 2 S reacționează apoi cu SCl 2 și SO 2 Cl 2 pentru a forma S 4 N 4 , trimetil clorosilan și dioxid de sulf : [10]
- [(Me 3 Si) 2 N] 2 S + SCl 2 + SO 2 Cl 2 → S 4 N 4 + 4 Me 3 SiCl + SO 2
Tetranfurul de tetrazfur poate fi obținut și cu amoniac în plus față de clorură de metilen și urmat de recristalizare în toluen prin reacție de sulf (II), clorură de sulf (I) și amestec de clorură . [3]
În plus, este posibil să se găsească o reacție de sulf cu amoniac lichid în prezența azotatului de argint . [5]
Reactivitate
Reacții acido-bazice
S 4 N 4 poate funcționa ca o bază Lewis și se leagă cu azot acizi Lewis puternici precum SbCl 5 , BF 3 și SO 3 . În aduct, structura cuștii S 4 N 4 este distorsionată și, prin urmare, delocalizarea electronilor poate fi pierdută. [1]
- S 4 N 4 + SbCl 5 → S 4 N 4 SbCl 5
- S 4 N 4 + SO 3 → S 4 N 4 SO 3
S 4 N 4 poate fi protonat cu HBF 4 pentru a forma o sare de tetrafluoroborat :
- S 4 N 4 + HBF 4 → [S 4 N 4 H] + [BF 4 ] -
CuCl Lewis cu acid slab formează un polimer în care inelele intacte S 4 N 4 funcționează ca liganzi de punte: [1]
- n S 4 N 4 + n CuCl → (μ-S 4 N 4 ) n (-Cu-Cl-) n
În prezența bazelor S 4 N 4 este sensibil la hidroliză . Cu NaOH diluat, hidroliza duce la tiosulfat și tritionat: [1]
- 2S 4 N 4 + 6 OH - + 9H 2 O → S 2 O 3 2– + 2 S 3 O 6 2– + 8 NH 3
Dacă baza este mai concentrată, se obțin tiosulfat și sulfit :
- S 4 N 4 + 6 OH - + 3 H 2 O → S 2 O 3 2– + 2 SO 3 2– + 4 NH 3
Reacții cu complexe metalice
Acest subiect a fost revizuit; [2] [11] există reacții în care inelul S 4 N 4 rămâne aproape intact și reacții în care inelul este rupt.
De exemplu, S 4 N 4 dă adaos oxidativ cu complexul Vaska , Ir (CO) (Cl) (PPh 3 ) 2 , pentru a forma un complex hexacoordonat de iridiu unde S 4 N 4 este legat cu doi atomi de sulf și unul cu azot . Compusul se formează prin ruperea uneia dintre legăturile S - N în timpul adăugării oxidative; al doilea atom de sulf aparține inelului și se coordonează cu un dublet nepartajat. Un complex analog Pt (IV) este obținut din sarea Zeise . Reacția dintre S 4 N 4 și [Pd 2 Cl 6 ] 2− conduce în schimb la o serie de trei complexe de paladiu în care inelul S 4 N 4 a fost fragmentat.
Ca precursor al altor compuși S - N
Pornind de la S 4 N 4 mulți importante S - compuși N sunt preparați. [12] Reacția cu piperidina produce [S 4 N 5 ] - :
- 3S 4 N 4 + 4C 5 H 10 NH → (C 5 H 10 NH 2 ) + [S 4 N 5 ] - + (C 5 H 10 N) 2 S + ⅜S 8 + N 2
Cationul [S 4 N 5 ] + este, de asemenea, cunoscut pentru a indica bogăția acestei zone.
Reacția cu tetrametilamoniu azid produce heterociclu [S 3 N 3 ] - :
- S 4 N 4 + NMe 4 N 3 → NMe 4 [S 3 N 3 ] + ⅛S 8 + 2 N 2
În ceea ce privește numărul de electroni, [S 3 N 3 ] - are 10 electroni pi: doi pentru fiecare S, plus unul pentru fiecare N, plus unul pentru sarcina negativă.
Într-o reacție aparent similară, cu [(Ph 3 P) 2 N] N 3 se obține o sare care conține anionul albastru închis NS 4 - : [13]
- 2S 4 N 4 + [(Ph 3 P) 2 N] N 3 → [(Ph 3 P) 2 N] [NS 4 ] + ½S 8 + 5 N 2
Anionul NS 4 - este descris ca un hibrid rezonant de structuri [S = S = NSS] - ↔ [S - S - N = S = S] - .
Trecând S 4 N 4 gazos peste argint metalic, obținem polietiazilul , adesea denumit pur și simplu „(SN) x ”, care este un superconductor cu temperatură scăzută ( temperatura de tranziție 0,26 ± 0,03 K [14] ). În conversie, argintul devine primul sulfura , Ag 2 S, care catalizează apoi conversia S 4 N 4 în cele patru specii ciclice membri S 2 N 2, care se polimerizeaza imediat. [1]
- S 4 N 4 + 8 Ag → 4 Ag 2 S + 2N 2
- S 4 N 4 → (SN) x
- S 2 N 2 → (SN) x (polimerizare termică)
Producerea altor nitruri de sulf
- Tratamentul cu acid tetrametilamoniu:
S 4 N 4 + (CH3) 4 N + N 3 - → (CH3) 4 N + [S 3 N 3 ] - + 3/8 S 8 + 2 N 2 .
- Într-o reacție similară reacționează cu clorură de bis (trifenilfosfină) iminium ([(C 6 H 5 ) 3 P) 2 N] + N 3 - care conține anionul albastru [NS 4 ] - )
2 S 4 N 4 + [(C 6 H 5 ) 3 P) 2 N] + N 3 - → [(C 6 H 5 ) 3 P) 2 N] + [NS 4 ] - + 3/8 S 8 + 5 N 2 .
Alte reacții
S 4 N 4 reacționează cu metalele alcaline sărace în electroni. [15]
S 4 N 4 a fost demonstrat de co-cristaliza cu benzen și fullerene ( C60 ). [16]
Compusul similar al seleniului Se 4 N 4 este cunoscut și a făcut obiectul cercetării. [ fără sursă ]
Siguranță
S 4 N 4 este foarte sensibil la șocuri și este necesar să se evite măcinarea probelor solide. S-a raportat că probele mai pure sunt mai sensibile decât cele contaminate cu sulf elementar. Acesta explodează prin aprindere dacă este aprins în cantități mari sau dacă este închis în containere, în timp ce în cantități mici și în starea de praf impalpabil tinde să explodeze. Utilizați măsurile de precauție normale luate pentru explozivi primari.
Notă
- ^ a b c d e f g h i NN Greenwood, A. Earnshaw, Chimia elementelor , ed. a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ^ a b T. Chivers, Un ghid pentru chimia calcogenului-azotului , Singapore, World Scientific Publishing Company, 2004, ISBN 981-256-095-5 .
- ^ a b c ( DE ) Ralf Alsfasser și Erwin Riedel, Moderne Anorganische Chemie , Walter de Gruyter, 2007, p. 121, ISBN 978-3-11-019060-1 .
- ^ Hans-Georg Elias, Makromolekule Band 3: Industrielle Polymere und Synthesen , John Wiley & Sons, 2009, ISBN 3-527-62652-2 .
- ^ a b ( DE ) Arnold F. Holleman, Lehrbuch der anorganischen Chemie , Walter de Gruyter, 1995, p. 600, ISBN 978-3-11-012641-9 .
- ^ BD Sharma, J. Donohue, Structura cristalină și moleculară a nitrurii de sulf, S 4 N 4 , în Acta Crystallographica , vol. 16, n. 9, 1963, pp. 891–897, DOI : 10.1107 / S0365110X63002401 .
- ^ HS Rzepa, JD Woollins, Un studiu PM3 SCF-MO al structurii și lipirii în sistemele de cuști S 4 N 4 și S 4 N 4 X (X = N + , N - , S, N 2 S, P + , C, Si, B - și Al - , în Poliedru , vol. 9, n. 1, pp. 107-111, DOI : 10.1016 / S0277-5387 (00) 84253-9 .
- ^ WL Jolly, SA Lipp, Reacția tetrasulfurului tetranitrid cu acid sulfuric , în Inorg. Chem. , vol. 10, nr. 1, 1971, pp. 33-38, DOI : 10.1021 / ic50095a008 .
- ^ M. Villena-Blanco, WL Jolly, Tetrasulfur tetranitride, S 4 N 4 , în Inorg. Sintetizator. , vol. 9, 1967, pp. 98-102, DOI : 10.1002 / 9780470132401.ch26 .
- ^ A. Maaninen, J. Siivari, RS Laitinen, T. Chivers, Tetrasulfur-tetranitride (S 4 N 4 ) , în Inorg. Sintetizator. , vol. 33, 2002, pp. 196-199.
- ^ PF Kelly, AMZ Slawin, DJ Williams, JD Woollins, Explozivi în cuști: nitruri de calcogen stabilizate cu metal , în Chem. Soc. Rev. , vol. 21, 1992, pp. 245-252, DOI : 10.1039 / CS9922100245 .
- ^ J. Bojes, T. Chivers, RT Oakley, anioni binari ciclici cu azot-sulf , în Inorg. Sintetizator. , vol. 25, 1989, pp. 30-40, DOI : 10.1002 / 9780470132562.ch7 .
- ^ J. Bojes, T. Chivers, RT Oakley, lanuri binare-azot-sulf anoine , în Inorg. Sintetizator. , vol. 25, 1989, pp. 35-38.
- ^ RL Greene, GB Street, LJ Suter, Superconductivity in polysulfur nitride (SN) x , in Phys. Rev. Lett. , Vol. 34, 1975, pp. 577–579, DOI : 10.1103 / PhysRevLett.34.577 .
- ^ Dunn, PJ și Rzepa, HS , Reacția dintre tetrasulfur tetranitridă (S 4 N 4 ) și alchini cu deficit de electroni. A Molecular Orbital Study , în Journal of the Chemical Society, Perkin Transactions 2 , vol. 1987, nr. 11, 1987, pp. 1669–1670, DOI : 10.1039 / p29870001669 .
- ^ Konarev, DV; Lyubovskaya, RN; Drichko, NV; Yudanova, EI; Shulga, Yu. M.; Litvinov, AL; Semkin VN; Tarasov, BP, Donor-Acceptor Complexes of Fullerene C 60 with Organic and Organometallic Donors , în Journal of Materials Chemistry , vol. 10, nr. 4, 2000, pp. 803–818, DOI : 10.1039 / a907106g .
linkuri externe
- ( EN ) Tetrazulf Tetranitride , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.