Sibutramină
| Sibutramină | |
|---|---|
| Numele IUPAC | |
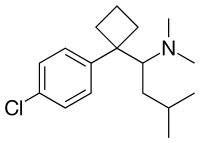
| (±) -1- (4-clorofenil) - N , N- dimetil- a - (2-metilpropil) - ciclobutan-metanamină | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 17 H 26 ClN |
| numar CAS | |
| Numărul EINECS | 600-761-4 |
| Codul ATC | A08 |
| PubChem | 5210 |
| DrugBank | DB01105 |
| ZÂMBETE | CC(C)CC(C1(CCC1)C2=CC=C(C=C2)Cl)N(C)C |
| Date farmacocinetice | |
| Biodisponibilitate | Reabsorbție 77% datorită primului efect de trecere |
| Metabolism | Hepatic (mediat de CYP3A4 ) |
| Jumătate de viață | Sibutramină aproximativ 1 oră Metabolit 1: 14 ore Metabolit 2: 16 ore |
| Excreţie | Biliare (sibutramină și metaboliți activi), renale (metaboliți inactivi) |
| Informații de siguranță | |
| Fraze H | --- |
| Sfaturi P | --- [1] |
Sibutramina (comercializată ca Meridia în SUA, Leptos în India, Reductil în Europa și în alte părți), de obicei sub formă de clorhidrat monohidrat, este un reductor al apetitului oral utilizat în tratamentul obezității. Este un inhibitor al recaptării serotoninei și noradrenalinei, dar nu dopamină; structural este similar cu amfetaminele [2], deși acționează diferit. [3] . În martie 2002, Ministerul Sănătății și-a decretat suspendarea de pe piață în urma unei revizuiri a datelor de siguranță, care a relevat existența unui risc cardiovascular legat de utilizarea acestuia. [4] . În același timp, Italia a început o procedură de arbitraj la nivel european solicitând un aviz din partea Comitetului tehnico-științific al Agenției Europene pentru Medicamente . Agenția europeană a dat un aviz favorabil pentru păstrarea medicamentului pe piață, prin urmare, în luna august a aceluiași an, sibutramina a fost readmisă, cu obligația, totuși, de a prezenta o rețetă de specialitate pentru achiziție și de a furniza pacientului o fișă informativă asupra riscurilor posibile. [5] . Cu toate acestea, agenția europeană a solicitat producătorului de medicamente un studiu multicentric pentru a evalua eficacitatea și siguranța medicamentului. Studiul solicitat s-a numit SCOUT ( S ibutramine C ardiovascular OUT come) și rezultatele, publicate în 2009, au relevat că:
- pierderea în greutate realizată cu sibutramină este modestă
- această pierdere în greutate nu persistă după terminarea tratamentului
- pacienții tratați cu sibutramină au avut un risc cardiovascular crescut cu 16% comparativ cu pacienții tratați cu placebo.
Prin urmare, pe 24 ianuarie 2010 , sibutramina a fost din nou suspendată de la comercializare.
Compania farmaceutică producătoare a declarat că va face apel împotriva acestei decizii. [6]
Avertizări
Siguranță: în urma unei revizuiri a siguranței și eficacității sibutraminei, Comitetul agenției pentru medicamente de uz uman (CHMP) a concluzionat că beneficiile sibutraminei nu depășesc riscurile potențiale și, prin urmare, a decis să întrerupă toate autorizațiile de introducere pe piață pentru medicamentele care conțin sibutramină. în Uniunea Europeană . Sibutramina făcuse deja obiectul unei reevaluări de către EMEA în urma raportării efectelor secundare cardiovasculare (creșterea tensiunii arteriale și a ritmului cardiac), dar cu acea ocazie, comitetul responsabil al Agenției de Reglementare nu se gândise să fie nevoit să schimbe avizul său cu privire la profilul de siguranță al medicamentului, dar în așteptarea datelor clinice suplimentare solicitate de la producător. Studiul SCOUT rezultat a înscris peste 9.000 de pacienți supraponderali și obezi cu risc crescut de boli cardiovasculare și a testat, în acest tip de populație, efectele sibutraminei față de placebo , în ceea ce privește gradul de scădere în greutate și apariția evenimentelor cardiovasculare. Datele preliminare din studii au confirmat un risc mai mare de probleme cardiovasculare la pacienții care iau sibutramină decât la martori (incidența evenimentelor cardiovasculare: 6,5% vs 6,5%, respectiv, cu placebo și sibutramină, la pacienții cu tip 2 (rata de risc de 1,010 95% IC 0,737-1,383); 8,3% vs 10,1% la pacienții cu antecedente de boli cardiovasculare (rata de risc 1,274 95% IC 0,915-1,774); 11,9% vs 13,9% (rata riscului 1,182 95% IC 1,024-1,354) (FDA, 2010). Deși sibutramina este contraindicată la pacienții cu boli cardiovasculare cunoscute, EMEA a considerat că riscul cardiovascular crescut asociat cu supraponderalitatea și obezitatea , în absența bolilor cardiovasculare cunoscute, este „excesiv” pentru o utilizare suficient de „sigură” a medicamentului. , comparativ cu pierderea în greutate obținută. Suspendarea autorizației de introducere pe piață a sibutraminei, stabilită de EMEA, va rămâne în vigoare până la apariția dinților a identificat un grup de pacienți pentru care beneficiile sibutraminei depășesc în mod clar riscurile sale [7] . FDA a retras sibutramina de pe piață din cauza riscului crescut de evenimente cardiovasculare adverse. [8]
Notă
- ^ Sigma-Aldrich; rev. din 04.09.2012, referindu-se la clorhidrat monohidrat
- ^ New Drugs , în Australian Prescriber , voi. 25, nr. 1, 2002, p. 22. PDF Arhivat la 24 iulie 2008 la Internet Archive .
- ^ Heal DJ, Aspley S, Prow MR, Jackson HC, Martin KF, Cheetham SC, Sibutramine: un medicament anti-obezitate nou. O revizuire a dovezilor farmacologice pentru a o diferenția de d-amfetamină și d-fenfluramină , în Int J Obes Relat Metab Disord , 22 Suppl 1, 1998, pp. S18-28; discuție S29, PMID 9758240 .
- ^ Interzicerea vânzării de specialități medicinale și preparate magistrale pe bază de sibutramină. , pe gazzette.comune.jesi.an.it , Monitorul Oficial nr. 61 din 13 martie 2002, MINISTERUL SĂNĂTĂȚII, 7 martie 2002. Accesat pe 04.04.2009 .
- ^ Obezitate: sibutramina lansată pe piață | Saninforma , pe saninforma.it . Adus la 6 aprilie 2009 (arhivat din original la 22 august 2006) .
- ^ Dieta, vânzarea de medicamente care conțin sibutramină este interzisă , pe welfare.guidone.it . Adus la 28 ianuarie 2010 (arhivat din original la 25 ianuarie 2010) .
- ^ EMEA, Întrebări și răspunsuri privind suspendarea medicamentelor care conțin sibutramină ( PDF ), pe ema.europa.eu . Adus în iunie 2010 (arhivat din original la 15 februarie 2010) .
- ^ Administrația SUA pentru alimente și medicamente, Meridia (sibutramină): Retragerea pieței din cauza riscului de evenimente cardiovasculare grave , la fda.gov . Adus la 10 februarie 2015 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe Sibutramină
Wikimedia Commons conține imagini sau alte fișiere pe Sibutramină
linkuri externe
- (RO) Efecte secundare pe rxlist.com. Adus pe 9 septembrie 2008 (depus de „url original 9 august 2008).