Biofilm
Un biofilm sau biofilm sau microfouling este o agregare complexă de microorganisme caracterizată prin secreția unei adezive și a unei matrice de protecție și, adesea, și prin:
- aderenta la o suprafata, atat biologica cat si inerta (de exemplu roci si proteze),
- eterogenitate structurală,
- interacțiuni biologice complexe,
- o matrice extracelulară de substanțe polimerice , adesea cu caracter polizaharidic .
Organismele unicelulare prezintă de obicei două moduri distincte de comportament. Prima este forma familiară plutitoare, sau planctonică, în care celulele separate plutesc sau înoată independent într-un mediu lichid. Al doilea este starea agregată, sau sesilă, în care celulele sunt strâns legate și fixate una de alta și, de obicei, de o suprafață solidă. Modificarea comportamentului este activată de un mecanism de comunicare chimică care diferă între specii. Unele specii, de exemplu, pot produce acil-homoseril-lactone ca un semnal „în repaus”, care induce celulele planctonice înconjurătoare să se schimbe fenotipic către starea sesilă, printr-o expresie diferită a genelor celulei.
Potrivit CDC (Centre for Disease Control and Prevention) din Atlanta, până la 80% din infecțiile bacteriene care afectează oamenii din țările occidentale sunt cauzate de biofilme polimicrobiene. Prin urmare, infecțiile uroginecologice recurente nu mai trebuie considerate ca infecții susținute de o singură tulpină patogenă, ci ca sindroame polimicrobiene caracterizate printr-o creștere semnificativă a încărcăturii bacteriene aerobe, anaerobe și fungice, cu o posibilă tulpină patogenă dominantă. [1]
Formare
Formarea unui biofilm începe cu ancorarea microorganismelor care plutesc liber pe o suprafață. Primii „coloniști” aderă la suprafață inițial prin forțe slabe și reversibile ale lui Van der Waals .
Dacă bacteriile colonizatoare nu sunt separate imediat de suprafață, se pot ancora mai ferm folosind molecule de adeziune celulară, cum ar fi pili .
Primii colonizatori facilitează sosirea altor celule prin furnizarea de diferite situri de adeziune celulară și încep să construiască matricea care permite integritatea biofilmului. Unele specii nu sunt capabile să se auto-atașeze la o suprafață, dar deseori reușesc să ancoreze la matrice sau la colonizatorii anteriori. Odată ce colonizarea a început, biofilmul crește prin divizarea celulară și integrarea bacteriilor externe, inclusiv din alte specii.
Dezvoltare
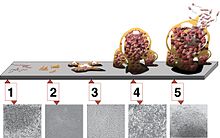
Există cinci etape în dezvoltarea unui biofilm:
- gravarea inițială
- atașament ireversibil
- maturare I
- maturarea II
- dispersie
Proprietate
Biofilmele se găsesc de obicei pe substraturi solide scufundate sau expuse unor soluții apoase, deși se pot forma și sub formă de rogojini sau mase plutitoare pe suprafețe lichide. Dacă este prevăzut cu resurse suficiente pentru creștere, un biofilm va deveni macroscopic în cel mai scurt timp. Biofilmele constau de obicei din multe specii de bacterii și arhaea . Un biofilm care conține diferite specii ia de obicei numele de consorțiu bacterian și este cantitativ mai frecvent decât biofilmele compuse din specii individuale, care sunt mai rare și posibile doar în anumite condiții. Fiecare specie prezentă în consorțiu îndeplinește funcții metabolice diferite și are de obicei trofisme diferite, cerințe de oxigen sau nișă ecologică . În acest fel, consorțiul este mai eficient fără ca diferitele specii să intre în conflict unul cu celălalt
Biofilmul este ținut împreună și protejat de o matrice de compuși polimerici excretați. Această matrice este atât de puternică încât, în anumite condiții, biofilmele se pot fosiliza. Matricea protejează celulele din interior și facilitează comunicarea prin semnale chimice sau fizice. Canalele de apă au fost găsite în unele biofilme care ajută la distribuirea substanțelor nutritive și a semnalului moleculelor. În același mod, aceste canale transmit substanțe reziduale și orice exotoxine către periferie.
Bacteriile care trăiesc pe un biofilm au de obicei proprietăți semnificativ diferite de bacteriile care circulă liber din aceeași specie, deoarece mediul dens și protejat al filmului le permite să coopereze și să interacționeze în diferite moduri. Un beneficiu al acestui mediu este rezistența crescută la detergenți și antibiotice , deoarece matricea extracelulară densă și stratul celular exterior protejează partea interioară a comunității. În unele cazuri, rezistența la antibiotice poate crește de 1000 de ori.
Locație
Biofilmele sunt omniprezente. Aproape fiecare specie de bacterie sau arheea are mecanisme prin care acestea pot adera la suprafețe și una la cealaltă. Biofilmele pot fi găsite pe roci și pietriș la fundul oricărui curs de apă și se formează adesea pe suprafața apei stătătoare. Pot crește atât în lacurile calde și acide din Yellowstone, cât și pe ghețarii din Antarctica .
În general biofilmele formate din colonii eterogene sunt mai groase și mai stabile decât monospeciile. După un timp, bacteriile atașate biofilmului se pot desprinde, formând o masă independentă care se desprinde periodic și, cu scopul de a supraviețui și de a coloniza alte nișe, poate da naștere la formarea unui nou biofilm în alt loc. Acest fenomen poate fi favorizat de forțele de curgere ale fluidului, de prezența anumitor compuși sau de caracteristicile fiecărei specii bacteriene.
Biofilmele permit supraviețuirea celulelor bacteriene într-un mediu ostil. De fapt, celulele planctonice sunt mai expuse la diferiți factori dăunători, cum ar fi bacteriofagii sau protozoarele în natură, agenții biocidi în dispozitivele industriale, agenții antimicrobieni în situații clinice și de la acțiunea anticorpilor și fagocitelor. Mai mult, complexitatea structurii lor și eterogenitatea metabolică și fiziologică sugerează o analogie între aceste comunități și țesuturile organismelor superioare. În timp ce formarea biofilmului a fost un aspect larg documentat al fiziologiei bacteriene de peste 100 de ani, acest proces abia acum începe să fie înțeles la nivel molecular. De fapt, cu doar 2 decenii în urmă, redescoperirea că în sistemele acvatice bacteriile aderă la diferite suprafețe a condus la concentrarea eforturilor asupra studiului biofilmelor. În ultimii ani, au fost concepute sisteme simple de screening pentru izolarea mutanților cu defecte în formarea biofilmului, creând instrumente pentru analiza genetică a acestei structuri complexe.
Biofilmul poate cuprinde o singură specie microbiană sau mai multe specii și se poate forma pe o gamă largă de suprafețe abiotice sau biotice. Deși biofilmele mixte predomină în multe medii, cele compuse dintr-o singură specie au un interes medical puternic, provocând o mare varietate de infecții, deoarece se pot forma la suprafața implanturilor medicale. Pseudomonas aeruginosa a fost cea mai studiată specie în rândul bacteriilor gram negative singulare care formează biofilm, dar alte microorganisme precum P.fluorescens, E.coli și Vibrio cholerae au fost, de asemenea, studiate pe larg. În timp ce printre cele mai analizate gram pozitive găsim Staphylococcus epidermidis, S. aureus și enterococi. Mai mult, se știe că, de asemenea, Legionella pneumophila se poate adăposti în biofilm în rețelele de distribuție a apei potabile, chiar protejate în amibe și, prin urmare, reprezintă un risc pentru sănătatea consumatorilor ( http://www.iss.it/ binary / publ / cont / 08-19_web.1219825010.pdf ). Biofilmele sunt compuse în principal din celule microbiene și matrice extracelulară (EPS). Procentul de EPS este între 50% și 90% și este considerat materia primă a biofilmului. Proprietățile fizico-chimice ale acestei matrice pot varia foarte mult, dar este compusă în principal din polizaharide. EPS poate fi foarte hidratat, deoarece poate încorpora cantități mari de apă în structura sa prin legături de hidrogen, dar în unele cazuri EPS poate fi, de asemenea, hidrofob. Compoziția și structura polizaharidelor determină conformația primară a matricei. De fapt, la unele bacterii, scheletul structurii poate conține reziduuri de hexoze legate împreună cu legături β-1,3 sau β-1,4, care oferă o rigiditate mai mare, o deformabilitate mai mică și, în unele cazuri, pot influența solubilitatea. Compoziția EPS nu este în general uniformă, dar poate varia spațial și temporal, de fapt cantitatea de EPS crește odată cu vârsta biofilmului. În plus, această matrice se poate asocia cu ioni metalici, cationi divalenți la alte macromolecule, cum ar fi proteine, ADN, lipide și chiar acizi humici. Datorită hidratării sale ridicate, matricea previne uscarea unor biofilme naturale. De asemenea, poate contribui la rezistența la antibiotice (un grup de bioingineri a descoperit de fapt că bacteriile din biofilm pot fi eliminate prin antibiotice convenționale dacă structura acestor comunități sesile este perturbată de ultrasunete sau câmpuri electrice de curent continuu) prin prevenirea transportului în masă și difuzarea acestor substanțe prin biofilm, probabil prin legarea directă a acestor molecule. Unele studii au arătat că stabilitatea structurii biofilmului este legată de prezența zaharurilor neutre, a polizaharidelor acide și a zaharurilor amino.
Rolul în medicină
Bacteriile și ciupercile formează biofilme în anumite condiții. Când un grup de bacterii sau ciuperci se acumulează pe o suprafață și ating o anumită densitate celulară, acestea încep să secrete o substanță polimerică care este alcătuită din polizaharide, proteine și ADN, formând o matrice în care celulele bacteriene sau fungice sunt puternic înrădăcinate.
Agregate celulare
Agregatele multi-celulare sau biofilmele permit celulelor bacteriene sau fungice unice sau coloniilor de bacterii sau ciuperci să prezinte un comportament coordonat și oferindu-le avantaje biologice, cum ar fi rezistența la antibiotice și la sistemul imunitar al gazdei. Biofilmele sunt structurate pentru a permite respirația și schimbul de fluide și substanțe nutritive, împiedicând în același timp accesul la celulele imune gazdă, cum ar fi fagocitele; în plus, reduc concentrațiile factorilor inhibitori sau litici de tip antimicrobian, împiedicându-i să ajungă la microorganisme. Rezultatul acestor proprietăți este că infecțiile rezultate din formarea biofilmului sunt notoriu greu de eradicat și aceste infecții necesită utilizarea unor concentrații ridicate de agenți antimicrobieni, îndepărtarea țesuturilor afectate sau o combinație a acestora.
Formarea de detectare a cvorumului
Formarea biofilmelor pare să fie guvernată de secreția anumitor molecule, conform unui proces numit cvorum sensing . Detectarea cvorumului este un proces de comunicare între celulele bacteriene. Este un proces auto-indus, ceea ce înseamnă că atunci când moleculele încep să se acumuleze în zona care înconjoară microorganismele, microorganismele suferă o serie de modificări fiziologice care permit formarea biofilmului extracelular. De exemplu, după detectarea cvorumului auto-indusă, microorganismele pot iniția producția de suprafață a polimerilor adezivi extracelulari, producția de biosurfactanți, sporularea, bioluminiscența și secreția de nutrienți; cu sechestrarea moleculelor și a factorilor de virulență ca o consecință a procesului de formare a biofilmului. Din aceste motive, uneori bacteriile prezente într-un biofilm pot fi de până la 4.000 de ori mai rezistente la antibiotice decât același organism, într-un mediu liber [2] [3] .
Rezistență la antibiotic
Comparația dintre Concentrația minimă inhibitoare (MIC), care descrie cantitatea de antimicrobiană necesară pentru a inhiba microorganismele libere capabile să formeze biofilme, și Concentrația minimă de eradicare a biofilmului (MBEC), care descrie concentrația minimă a unui agent antimicrobian capabil să inhibe creșterea unui biofilm (necesară pentru a inhiba sau elimina creșterea biofilmului), arată diferențele existente în sensibilitatea bacteriilor libere față de formarea de biofilme. Explicând de ce bacteriile care formează biofilme sunt mult mai puțin sensibile la agenții antimicrobieni decât schemele terapeutice obișnuite [4] .
Mai mult, folosind o concentrație de antibiotice într-o doză egală cu MIC, dacă infecția prezintă un biofilm, poate fi expusă biofilmul la doze sub-letale de antibiotice, provocând astfel o incidență mai mare a rezistenței microbiene, cu consecințe grave pentru oaspetele.
Cazuri specifice
Producția de biofilme are implicații specifice clare în medicină; în special:
- Placa dentară este un biofilm produs de bacteriile prezente în cavitatea bucală, cum ar fi Streptococcus mutans .
- Biofilmele pot crește pe suprafața implanturilor solide (de exemplu: proteze) în corp. Biofilmele care se propagă de-a lungul tuburilor sau firelor implantate pot provoca infecții periculoase la pacienți. Staphylococcus epidermidis poate produce biofilme pe catetere venoase, de exemplu.
- Pseudomonas aeruginosa și Staphylococcus aureus pot produce biofilme pe epiteliul respirator al plămânilor, complicând evoluția pacienților cu fibroză chistică . Celulele sistemului imunitar (cum ar fi macrofagele ) nu sunt de fapt capabile să contracareze prezența biofilmelor, ci doar să genereze inflamații cronice. Terapia se bazează de fapt pe medicamente antiinflamatorii (cum ar fi unele AINS ) și pe molecule dezintegrante.
- În faringită , se găsesc biofilme produse de streptococi din grupa A care cauzează eșecul terapiei cu antibiotice [5] .
- Biofilmele pot crește și pe lentile intraoculare nesterilizate (de exemplu, lentile artificiale) [6] [7] .
- Biofilmul este de asemenea produs în timpul infecțiilor vaginului de către G. vaginalis și A. vaginae : Vaginoza ; și, de asemenea, în urma implantării DIU spiral uterin. Acest biofilm explică faptul că vaginoza reapare adesea din cauza dificultății antibioticelor în eradicarea germenilor care se protejează cu biofilm [8] [9] .
- Infecțiile tractului urinar datorate bacteriilor producătoare de biofilme sunt foarte frecvente [10] [11]
Uroginecologie
De exemplu, Escherichia coli, adesea prezentă cu infecții uro-ginecologice, formează un biofilm în vezică sau în vagin. Acest biofilm poate include un microorganism de rezervă intracelular latent care alcătuiește aproximativ 1% din celulele bacteriene, sunt complet rezistente la antibiotice și la răspunsul imun al organismului, o caracteristică cheie responsabilă pentru eșecul terapiei cu antibiotice la pacienții cu infecții recurente. Odată ce terapia cu antibiotice sau antifungice este finalizată, celulele persistente reactivate rapid restabilesc încărcătura bacteriană sau fungică preexistentă, provocând infecții recurente . [12]
Tratamentul cu antibiotice poate fi decisiv pentru bacteriile aflate în faza planctonică, responsabile de exacerbările infecțioase eliberate de biofilm, dar nu este capabilă să elimine comunitatea bacteriană sesilă conținută în acesta.
Biofilmul de la Escherichia coli, prezent în același timp în vezică și în vagin, conține celule persistente, complet rezistente la antibiotice și la sistemul imunitar, făcând aceste infecții cronice și recurente. Progresia către cronicizare este mai rapidă și episoadele de cistită sunt mai rapide dacă biofilmul vaginal nu este tratat. [13]
Biofilmul se poate forma pe suprafețe inerte, precum dispozitive intrauterine, inele contraceptive, implanturi contraceptive, pesari. [14] [15] [16]
Urologie
Dacă microorganismele patogene creează un biofilm în vezică, ele pot provoca cistită cronică cu episoade acute de fiecare dată când biofilmul este deschis. [17] Terapia cu antibiotice în acest caz este ineficientă. [18] Biofilmele patogene tipice ale vezicii urinare sunt caracterizate prin tulpini uropatogene de Escherichia coli (UPEC Uropatogenic escherichia coli) responsabile de 75% -85% din cistita recurentă și biofilmul intracelular. [19] În celulele uroteliului, bacteriile organizează biofilme scufundate într-o matrice de polizaharide saturate înconjurate de o coajă protectoare de uroplachin lângă suprafață, unde creează umflături asemănătoare păstăilor. [20]
Eliminarea biofilmului
Rezultatele experimentelor recente au confirmat, pe lângă efectul antioxidant, eficiența N-acetilcisteinei (NAC) în distrugerea biofilmelor și o scădere a numărului de forme vii de bacterii prezente în acestea. N-acetilcisteina (NAC) previne formarea de biofilme de către agenți patogeni. N-acetilcisteina (NAC) are un efect devastator asupra biofilmelor patogene, acționând direct asupra matricei de polizaharide. [21]
Profilaxia și eliminarea biofilmelor patogene
Ingredientele active, eficiente în prevenirea și controlul biofilmelor, nu conțin antibiotice: D-manoză, n-acetilcisteină (NAC), probiotice, lactoferină, morinda citrifolie.
S-a demonstrat că n-acetilcisteina poate distruge biofilmul, poate face bacteriile disponibile pentru d-manoză sau antibiotice. [22]
Biofilmele de pe podele și suprafețele de lucru pot îngreuna igiena alimentelor în zonele de pregătire a alimentelor.
Aplicații
Biofilmele pot fi utilizate în scopuri utile. De exemplu, multe stații de epurare includ o etapă de tratare în care apa este trecută prin biofilme cultivate pe filtre, care extrag și metabolizează mulți compuși organici dăunători.
În industria alimentară, biofilmul cauzează în general probleme tehnologice considerabile prin prevenirea sau încetinirea fluxului de căldură, creșterea rezistenței unui fluid la curgere, promovarea coroziunii și, de asemenea, provocarea pierderilor de produs. Mai mult, din punct de vedere igienico-sanitar, reduce semnificativ eficacitatea unui dezinfectant convențional care este capabil să pătrundă doar parțial în stratul dens de polimeri pentru a intra în contact cu celulele bacteriene. De asemenea, trebuie avut în vedere faptul că aceste celule nu numai că prezintă caracteristici alterative, dar sunt deseori dotate cu potențial patogen ridicat: nu de puține ori este raportată prezența în biofilme a Listeria monocytogenes , Yersinia enterocolitica , Campylobacter jejuni și Escherichia coli .
Rolul în ecologia acvatică
Organisme prezente
Baza lanțului trofic este compusă din bacterii , care sunt, de asemenea, responsabile pentru formarea matricei gelatinoase care formează baza filmului ( glicocalix , definit în acest context ca EPS, substanțe polimerice extracelulare), aceste bacterii hrănind faune bogate în protozoare , sunt și ciuperci saprofite și sunt prezente diatomee fotosintetice [23] .
Rol ecologic
Acest „covor” organic conține un număr mare de organisme, organizate cu o structură comunitară similară cu cea a ecosistemelor la scară mai mare și joacă un rol important în colonizarea ulterioară a substratului de către organisme sesile mai mari [23] .
Notă
- ^ Verstraelen H, Swidinski A., Biofilmul în vaginoza bacteriană: implicații pentru epedemiologie, diagnostic și tratament. , în Opinia curentă privind bolile infecțioase , № 26/2013 p. 86-89 ..
- ^ Karatan E, Watnick P, Semnale, rețele de reglementare și materiale care construiesc și sparg biofilmele bacteriene , în Microbiology and Molecular Biology Reviews: MMBR , vol. 73, nr. 2, iunie 2009, pp. 310–47, DOI : 10.1128 / MMBR.00041-08 , PMC 2698413 , PMID 19487730 . Accesat la 2 martie 2010 .
- ^ Hoffman LR, D'Argenio DA, MacCoss MJ, Zhang Z, Jones RA, Miller SI, Antibioticele aminoglicozidice induc formarea de biofilme bacteriene , în Nature , vol. 436, nr. 7054, august 2005, pp. 1171-5, DOI : 10.1038 / nature03912 , PMID 16121184 . Accesat la 2 martie 2010 .
- ^ Høiby N, Bjarnsholt T, Givskov M, Molin S, Ciofu O. Rezistența la antibiotice a biofilmelor bacteriene. Int J Agenți antimicrobieni. 2010 apr; 35 (4): 322-32. Epub 2010 10 februarie Recenzie. PMID 20149602 .
- ^ Conley J, Olson ME, Cook LS, Ceri H, Phan V, Davies HD. Formarea biofilmului pe grupe a streptococi: există o relație cu eșecul tratamentului? J Clin Microbiol. Septembrie 2003; 41 (9): 4043-8. PMID 12958223 .
- ^ Kadry AA, Fouda SI, Shibl AM, Abu El-Asrar AA. Impactul dispersanților slime și anti-adezivi asupra formării in vitro a biofilmului Staphylococcus epidermidis asupra lentilelor intraoculare și asupra activităților antibiotice. J Antimicrob Chemother. 2009 mar; 63 (3): 480-4. Epub 2009 ianuarie 14. PMID 19147522 .
- ^ Casaroli-Marano RP, Adán A. [Infecții oculare asociate cu implanturi oculare]. Enferm Infecc Microbiol Clin. 2008 noiembrie; 26 (9): 581-8. Revizuire. Spaniolă. PMID 19100179 .
- ^ Durán EL, Mujica MT, Jewtuchowicz VM, Finquelievich JL, Pinoni MV, Iovannitti CA. [Examinarea variabilității genetice între izolatele clinice Candida albicans care formează biofilme]. Pr. Iberoam Micol. 31 decembrie 2007; 24 (4): 268-71. Spaniolă. PMID 18095758 .
- ^ Patterson JL, Girerd PH, Karjane NW, Jefferson KK. Efectul fenotipului biofilmului asupra rezistenței Gardnerella vaginalis la peroxidul de hidrogen și acidul lactic. Sunt J Obstet Gynecol. 2007 aug; 197 (2): 170.e1-7. PMID 17689638 .
- ^ Andreu A. [Patogeneza infecțiilor tractului urinar]. Enferm Infecc Microbiol Clin. 2005 Dec; 23 Suppl 4: 15-21. Revizuire. Spaniolă. PMID 16854354 .
- ^ Frank DN, Wilson SS, St Amand AL, Pace NR. Analiza microbiologică independentă de cultură a biofilmelor cu cateter urinar foley. Plus unu. 2009 noiembrie 12; 4 (11): e7811. PMID 19907661 .
- ^ Lewis K, Persister cells , în Revista anuală de microbiologie , 2010/64 p.357-372.
- ^ Graziottin A, Zanello PP, D'Errico G, Cistita recurentă și vaginita: rolul biofilmelor și celulelor persistente. De la Fipipatologie la noi strategii terapeutice. , în Minerva Ginecologica , octombrie, volumul 66, 5 (p.497-512).
- ^ Dondes GG, Vereecken A, Bosmans E, Dekeers-maeker A, Salembier G, Spitz, Definiția unui tip de floră vaginală anormală care este distinctă de vaginoza bacteriană: vaginitii aerobi. , în BJOG. , Nu. 2002.
- ^ Falagas ME, Velakoulis S, Iavazzo C, Athanasiou S, Mesh-related infections after chirurgie de reparație a prolapsului de organe pelvine. , în Jurnalul European de Obstetrică și Ginecologie și Biologie a Reproducerii , 2007. - № 134. - p.147-156 ..
- ^ Tenke P Köves B, Nagy K, Hultgren SJ, Mendling W, WulltB și colab., Actualizare privind infecțiile cu biofilm în tractul urinar , în Jurnalul Mondial de Urologie , 2012. - № 30. - p 51-57 ..
- ^ Lewis K, Persister cells , în Revista anuală de microbiologie. , № 64.
- ^ Naves P, Del Prado G, Huelves L, Rodriguez-Cerrato V, Ruiz V, Ponte MC, Effects of human sierum albumium, ibuprofen and N-acetil-L-cysteine against biofilm formation by patogenic Escheriachia Coli tulpini , în Journal de infecție spitalicească , 2010. - № 76 p.165-170.
- ^ Berry RE, Klumpp DJ, Schaeffer AJ, Culturile uroteliale susțin formarea comunității bacteriene intracelulare prin E.coli uropatogen , în Infecție și imunitate , 2009. - № 77. - p. 2762-2772 ..
- ^ Anderson GG, Palermo JJ, Intracellular bacterian biofilm-like capss in urinary tract infections , in Science , 2003. - № 301. - p. 105 -107 ..
- ^ Marchiori D, Zanello PP, Eficacitatea N-acetilcisteinei, D-manozei și Morinda citrifolia pentru tratarea cistitei recurente în supraviețuirea cancerului de sân , în In Vivo , 2017. - septembrie-octombrie (№ 31). - p. 931-936 ..
- ^ Marchese A, Bozzolasco M, Gualco L, Debbia EA, Schito GC, Schito AM, Efectul fosfomicinei singur și în combinație cu n-acetilcisteina asupra biofilmelor E.coli , în International Journal of Antimicrobial Agents , 2003. - Т. 22. - p. 95-100 ..
- ^ a b AA.VV. Manual de metodologii de eșantionare și studiu al bentosului marin mediteranean, Societatea italiană de biologie marină, Livorno 2003 - Supliment la biologia marină mediteraneană nr. 10
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere pe biofilme
Wikimedia Commons conține imagini sau alte fișiere pe biofilme
linkuri externe
- ( EN ) Biofilm , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.
- Biofilme bacteriene (covorase microbiene) , pe equisetites.de .
| Controlul autorității | Tezaur BNCF 52772 · LCCN (EN) sh89001286 · BNF (FR) cb122662826 (data) · NDL (EN, JA) 01.168.854 |
|---|