Fibroză chistică
| Fibroză chistică | |
|---|---|
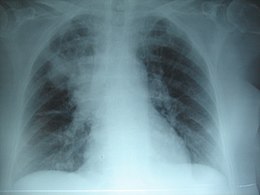
| Radiografia toracică la o persoană cu fibroză chistică | |
| Specialitate | genetică clinică , pediatrie și pneumologie |
| Clasificare și resurse externe (EN) | |
| ICD-10 | E84 |
| OMIM | 219700 |
| Plasă | D003550 |
| MedlinePlus | 000107 |
| eMedicină | 1001602 |
| Sinonime | |
| Mucoviscidoză | |
Fibroza chistică (adesea prescurtată ca CF, numită și mucoviscidoză sau boală fibrocistică a pancreasului ) este o tulburare genetică autosomală recesivă . Boala este cauzată de o mutație a genei CFTR (cromozomul 7), care codifică o proteină care funcționează ca un canal pentru clor numit CFTR ( Regulator al conductanței transmembranare a fibrozei chistice ). Fibroza chistică este cea mai frecventă boală genetică moștenită fatală la populația caucasoidă . [1]
Simptomele, care implică diferite organe interne, sunt atribuite anomaliei din excreția clorului , mediată în mod normal de proteina codificată de gena CFTR. Această alterare duce la secreția de mucus foarte gros și vâscos și, prin urmare, nu foarte netedă. Obstrucția rezultată a principalelor conducte determină principalele simptome (apariția infecțiilor pulmonare recurente, insuficiență pancreatică, steatoree , ciroză hepatică , obstrucție intestinală și infertilitate masculină ).
Note generale
Gena CFTR ( Regulator al conductanței transmembranare a fibrozei chistice ) codifică o proteină de 1480 aminoacizi localizați pe membrana celulară a celulelor epiteliale. Această proteină transportă fiziologic ioni de clorură prin membranele celulare la membrana apicală a celulelor epiteliale ale căilor respiratorii , pancreasului , intestinului , glandelor sudoripare , glandelor salivare și canalelor deferente .
Persoanele cu fibroză chistică au mutații ale genei CFTR. Aproape 2.000 de mutații au fost identificate în gena responsabilă de această boală, dintre care aproximativ 150 sunt recunoscute ca fiind cauza bolii și doar câteva zeci sunt responsabile pentru majoritatea cazurilor de fibroză chistică. Cea mai frecventă în populația caucaziană este o deleție cu 3 nucleotide (CTT), care determină pierderea aminoacidului fenilalanină codificată de codonul 508 (mutația se numește "delta F508").
Manifestarea completă a bolii apare numai la indivizii homozigoti (adică cu mutații în ambele alele ale genei CFTR). La astfel de indivizi, modificarea secreției de către celulele epiteliale a ionilor de clor duce la o reabsorbție mai mare a sodiului și a apei (deci a mucusului mai uscat). La heterozigoti există doar o ușoară simptomatologie: au un echilibru ionic funcțional, dar sunt mai greu de excretat apă din celule.
Istorie

Se presupune că fibroza chistică a apărut în jurul secolului 31 î.Hr. din cauza migrației oamenilor, a mutațiilor genetice și a noilor condiții de hrănire. [2] Deși spectrul clinic complet al bolii nu a fost recunoscut decât în anii 1930, unele aspecte ale afecțiunii au fost identificate mult mai devreme. Într-adevăr, într-o scriere din secolul al XVIII-lea raportează:
„Vai copilului care are gust sărat dintr-un sărut pe frunte, pentru că este blestemat și trebuie să moară în curând” |
Acest lucru demonstrează asocierea dintre pierderea de sare și boală. [2]
În secolul al XIX-lea , Karl von Rokitansky a descris un caz de deces fetal cu peritonită de meconiu , o complicație a ileusului de meconi asociat cu fibroza chistică. Meconium ileus a fost descris în 1905 de Karl Landsteiner . [2] În 1936, Guido Fanconi a publicat o lucrare care descrie o legătură între boala celiacă , fibroza chistică a pancreasului și bronșiectaziile . [3]
În 1938, Dorothy Hansine Andersen a publicat un articol, intitulat: „Fibroza chistică a pancreasului și relația sa cu boala celiacă: un studiu clinic și patologic”, în Jurnalul American de Boli ale Copiilor . Ea a fost prima care a descris caracteristicile fibrozei chistice a pancreasului și a corelat-o cu manifestările intestinale și pulmonare. [4] Mai mult, el a formulat prima dată ipoteza că fibroza chistică este o boală recesivă și că înlocuirea enzimei pancreatice ar putea fi utilizată pentru a trata copiii afectați. În 1952, Paul di Sant'Agnese a descoperit anomalii ale electroliților în transpirație . Un test de transpirație a fost dezvoltat și îmbunătățit în următorul deceniu. [5]
În 1989, Lap-Chee Tsui a condus o echipă de cercetători la Spitalul pentru copii bolnavi din Toronto , ceea ce a dus la descoperirea genei responsabile de boală. Fibroza chistică reprezintă prima patologie genetică clarificată riguros prin procesul genetic genetic invers . [6] [7]
Epidemiologie
| Mutaţie | Frecvență în lume [8] |
|---|---|
| ΔF508 | 66% –70% [9] |
| G542X | 2,4% |
| G551D | 1,6% |
| N1303K | 1,3% |
| W1282X | 1,2% |
| Toate celelalte | 27,5% |
Fibroza chistică este cea mai frecventă boală autozomală recesivă în rândul persoanelor de etnie caucaziană . [10] În Statele Unite , aproximativ 30.000 de persoane se confruntă cu această afecțiune. Majoritatea cazurilor sunt diagnosticate de la vârsta de șase luni. În Canada , există aproximativ 3.500 de persoane cu fibroză chistică. [11] Aproximativ 1 din 25 de persoane de origine europeană și unul din 30 de caucazieni americani [12] poartă o mutație care provoacă fibroză chistică. Deși afecțiunea este mai puțin frecventă în aceste grupuri, aproximativ 1 din 46 hispanici, 1 din 65 de africani și 1 din 90 de asiatici au cel puțin o genă CFTR anormală. [13] [14] Irlanda are cea mai mare incidență a fibrozei chistice din lume: 1 din 1353 de persoane. [15]
Deși este o boală rară , fibroza chistică este clasificată ca una dintre cele mai frecvente boli genetice care pot scurta viața. Este mai frecvent în rândul națiunilor din lumea occidentală. O excepție este Finlanda , unde doar una din 80 de persoane este găsită purtând o mutație a afecțiunii. [16] În Statele Unite, 1 din 4.000 de copii se nasc cu fibroză chistică. [17] Tot în Statele Unite, în 1997, aproximativ 1 din 3.300 de copii caucazieni s-au născut cu boala. În schimb, doar 1 din 15.000 de copii afro-americani au suferit de această afecțiune, la americanii asiatici rata a fost chiar mai mică: 1 din 32.000. [16]
Fibroza chistică se găsește la bărbați și femei. Din motive care nu sunt încă clare, datele au arătat că bărbații tind să aibă speranțe de viață mai lungi decât femeile, [18] [19] , cu toate acestea, studii recente sugerează că acest decalaj nu mai există, probabil datorită îmbunătățirii serviciilor de sănătate [20] [21 ] . ] , în timp ce un studiu recent irlandez a identificat o legătură între hormonul feminin estrogen și stările de boală mai grave. [22]
Distribuția alelelor de fibroză chistică variază între populații. Frecvența operatorului ΔF508 a fost estimată la 1: 200 în nordul Suediei , 1: 143 în Lituania și 1:38 în Danemarca . ΔF508 apare în Finlanda , dar este o alelă în minoritate. Fibroza chistică apare doar în 20 de familii finlandeze. [23]
Etiologie

Fibroza chistică este cauzată de o mutație a genei Regulatorului transmembranar al fibrei chistice (CFTR). Cea mai comună mutație, ΔF508, este o deleție (Δ semnificând suprimarea) a trei nucleotide [24] care are ca rezultat o pierdere de fenilalanină în poziția 508a a proteinei . Această mutație se găsește în două treimi (66-70% [9] ) din toate cazurile de fibroză chistică la nivel mondial și în 90% din cazuri în Statele Unite. Cu toate acestea, există mai mult de 1500 de mutații suplimentare care pot duce la boală. [25] Deși majoritatea oamenilor au două copii ( alele ) ale genei CFTR, este necesară doar una pentru a evita această afecțiune. Fibroza chistică se dezvoltă atunci când nu există o alelă capabilă să producă o proteină CFTR funcțională. Astfel, fibroza chistică este considerată o boală autozomală recesivă .
Gena CFTR, situată la locus q31.2 pe cromozomul 7 , este alcătuită din 230.000 de perechi de baze și creează o proteină care are o lungime de 1.480 de aminoacizi . În special, poziția este plasată între 117.120.016 și 117.308.718 perechi de baze pe brațul lung al cromozomului 7, regiunea 3, banda 1, sub-banda 2, reprezentată ca 7q31.2. Structural, gena CFTR este un tip de genă cunoscută sub numele de gena ABC . [26] Produsul acestei gene este un canal ionic clorură important în producția de transpirație, sucuri digestive și spută .
Genotip și fenotip
Există o oarecare corelație între mutația ( genotipul ) și manifestările clinice ale bolii ( fenotipul ). Marea variabilitate a manifestărilor și severitatea bolii sunt legate de mutațiile multiple ale genei CFTR.
Penetrarea este de obicei 100% dintre homozigoți cu mutații severe, dar severitatea bolii este variabilă cu forme mai ușoare, fără insuficiență pancreatică sau cu insuficiență respiratorie moderată.
Omozigoza ΔF508 / ΔF508 este asociată cu forma clasică a bolii, cu creșterea electroliților în transpirație, insuficiență pancreatică și pulmonară adesea severă. Unele mutații determină afectarea funcțiilor multiple și alte studii epidemiologice arată populații diferite cu mutații diferite, astfel încât mutațiile ΔF508 / R117H, ΔF508 / ΔI507, KBC-10 ΔF508 / 3849 → T și G-5 ΔF508 / 2789 → A au o rata mortalității mai mică decât homozigoza F508. Mutațiile ΔF508 / R117H, ΔF508 / ΔI507, F508 / 3849 10 KBC → T, G-5 ΔF508 / 2789 → A ΔF508 / A455E au manifestări fenotipice minore. [27]
Genotipuri existente: [28]
| Pereche de mutații | Frecvență |
|---|---|
| ΔF508 - ΔF508 (homozigozitate) | 50% |
| ΔF508 - alte mutații (heterozigoză) | 40% |
| alte mutații - alte mutații | 10% |
semne si simptome

Semnele distinctive ale fibrozei chistice sunt sarea pielii [30] , creșterea slabă și creșterea slabă în greutate în ciuda unui aport normal de alimente [31] , acumularea mucusului gros și lipicios [32] , infecții pulmonare frecvente și tuse sau dificultăți de respirație. [33] Bărbații pot să nu fie fertili din cauza absenței congenitale a canalului deferent . [34] Simptomele apar adesea în copilărie, cum ar fi obstrucția intestinală datorată ileusului meconiu patologic la sugari. [35]
Pe măsură ce copiii îmbătrânesc, există complicații în eliberarea mucusului în alveole. [36] Celulele de păr epiteliale ale pacientului au o proteină mutantă care duce la producerea de mucus anormal de vâscos . [32] Creșterea slabă la copii se prezintă de obicei ca o incapacitate de a câștiga în greutate sau înălțime față de colegii lor. De multe ori afecțiunea nu este diagnosticată până nu se caută cauzele acestei creșteri slabe. Cauzele eșecului de creștere sunt multifactoriale și includ infecții pulmonare cronice, absorbția slabă a substanțelor nutritive prin tractul gastro-intestinal și cererea metabolică crescută din cauza bolilor cronice. [31]
În cazuri rare, fibroza chistică se poate manifesta ca o tulburare de coagulare a sângelui . Copiii mici sunt deosebit de sensibili la tulburările de malabsorbție a vitaminei K , deoarece doar o cantitate mică din această vitamină traversează placenta , lăsând copilul cu rezerve foarte mici. Deoarece factorii II, VII, IX și X (factori de coagulare) sunt dependenți de vitamina K, nivelurile scăzute ale acestuia pot cauza probleme. [37]
Plămânii și sinusurile

Verde = Pseudomonas aeruginosa
Maro = Staphylococcus aureus
Albastru = Haemophilus influenzae
Roșu = Burkholderia cepacia
Boala pulmonară este consecința obstrucției căilor respiratorii cauzată de acumularea de mucus, scăderea clearance-ului mucociliar și inflamație. [9] [38] Inflamația și infecția cauzează leziuni și modificări structurale ale plămânilor, ducând la o varietate de simptome. În stadiile incipiente, tuse necontenită, producția abundentă de spută și capacitatea pulmonară redusă sunt condiții comune. Multe dintre aceste simptome apar atunci când bacteriile, care în mod normal locuiesc în sputa groasă, cresc fără control și provoacă pneumonie .
În etapele ulterioare, modificările structurii plămânului, cum ar fi bolile majore ale căilor respiratorii ( bronșiectazii ), agravează în continuare dificultățile de respirație. Alte simptome includ tuse de sânge ( hemoptizie ), hipertensiune arterială în plămâni (hipertensiune pulmonară), insuficiență cardiacă , dificultăți de a obține suficient oxigen ( hipoxie ) și insuficiență respiratorie care necesită sprijin cu măști respiratorii. [26]
Staphylococcus aureus , Haemophilus influenzae și Pseudomonas aeruginosa sunt cele mai comune trei organisme care cauzează infecții pulmonare la pacienții cu fibroză chistică. [9] Pe lângă infecțiile bacteriene tipice, persoanele cu această afecțiune dezvoltă de obicei alte tipuri de boli pulmonare. Acestea includ aspergiloza alergică bronhopulmonară , în care răspunsul organismului la ciuperca comună Aspergillus fumigatus determină agravarea problemelor respiratorii. O altă boală este infecția cu complexul Mycobacterium avium (MAC), un grup de bacterii legate de tuberculoză , care poate provoca leziuni pulmonare și nu răspunde la antibiotice obișnuite. [39]
Mucusul prezent în sinusuri este la fel de gros și poate provoca, de asemenea, blocarea pasajelor, rezultând infecție. Acest lucru poate provoca dureri faciale, febră , secreții nazale, cefalee și creșterea dificultăților de respirație. [40] [41] Persoanele cu fibroză chistică pot dezvolta o creștere excesivă a țesutului nazal ( polipoză naso-sinusală ) datorită inflamației cauzate de infecțiile cronice ale sinusurilor. [42] Polipii recurenți pot apărea la aproximativ 10% până la 25% dintre pacienții cu fibroză chistică. [9]
Complicațiile cardiorespiratorii sunt cea mai frecventă cauză de deces (~ 80%) la pacienții cu afecțiune. [9]
Semne și simptome gastrointestinale
Înainte de screeningul prenatal și neonatal, fibroza chistică a fost adesea diagnosticată atunci când un nou-născut nu a putut trece scaun ( meconiu ). Meconiul poate bloca complet intestinele și poate provoca boli grave. Această afecțiune, numită ileus meconiu , apare la 5-10% [9] [43] dintre sugarii cu fibroză chistică. În plus, proeminența membranei rectale interne ( prolapsul rectal) este mai frecventă, apare la aproximativ 10% dintre copiii cu afecțiune [9] și este cauzată de creșterea volumului fecal, malnutriție și presiune crescută. Intra-abdominal cauzată de tuse . [44]
Mucusul gros din plămâni are un echivalent în secrețiile groase din pancreas , un organ însărcinat cu furnizarea sucurilor digestive care ajută la descompunerea alimentelor. Aceste secreții exocrine blochează mișcarea enzimelor digestive în duoden și provoacă daune ireversibile pancreasului, ducând deseori la inflamații dureroase ( pancreatită ). [24] În cazurile severe și avansate, canalele pancreatice apar atrofice . [9]
Lipsa enzimelor digestive duce la dificultăți în absorbția nutrienților, cu excreția lor ulterioară în scaun, o tulburare cunoscută sub numele de malabsorbție . Malabsorbția duce la malnutriție și creștere slabă. Hipoproteinemia rezultată poate fi suficient de severă pentru a provoca edem generalizat. [9] Persoanele cu fibroză chistică au, de asemenea, dificultăți în absorbția vitaminelor liposolubile A , D , E și K.
În plus față de problemele pancreatice, persoanele cu fibroză chistică se plâng de arsuri la stomac, blocaj intestinal de la invaginarea și constipație . [45] Persoanele vârstnice cu fibroză chistică pot dezvolta obstrucție intestinală distală din cauza scaunului îngroșat. [46]
Insuficiența pancreatică exocrină apare la majoritatea (85% până la 90%) dintre pacienții cu fibroză chistică. [9] Este în principal asociată cu mutații „severe” în gena CFTR , în care ambele alele sunt complet nefuncționale (de exemplu, ΔF508 / ΔF508). [9] Apare la 10-15% dintre pacienții cu o mutație genică CFTR „severă” și „medie”, unde există încă o anumită activitate CFTR sau unde există două mutații „medii”. [9] În aceste cazuri mai ușoare, există încă o funcție exocrină suficientă a pancreasului, astfel încât suplimentarea enzimei nu este necesară. [9]
Secrețiile groase pot provoca, de asemenea, probleme hepatice . Bilele secretate pentru a ajuta digestia pot bloca conductele biliare , provocând leziuni hepatice. În timp, acest lucru poate duce la cicatrizare și nodularitate ( ciroză ). Ficatul nu poate scăpa sângele de toxine și nu sintetizează proteine importante, precum cele responsabile de coagularea sângelui . [47] [48] Boala hepatică este a treia cea mai frecventă cauză de deces legată de fibroza chistică. [9]
Sistemul endocrin

Pancreasul conține insulele Langerhans , care sunt responsabile pentru producerea de insulină , un hormon care ajută la reglarea glicemiei . Deteriorarea pancreasului poate duce la pierderea celulelor insulelor, provocând o formă de diabet caracteristică persoanelor cu fibroză chistică. [49] Aceasta este una dintre cele mai importante complicații nepulmonare ale bolii. [50]
Vitamina D este implicată în reglarea calciului și fosfatului . Absorbția slabă a vitaminei D dietetice, din cauza malabsorbției, poate duce la osteoporoză , o afecțiune în care oasele slăbite sunt mai predispuse la fracturi . [51] În plus, persoanele cu fibroză chistică dezvoltă adesea așa-numitele degetele de la picioare hipocrate (numite și cluburi ) datorită conținutului scăzut de oxigen din țesuturile lor. [52] [53]
Infertilitatea
Infertilitatea afectează atât bărbații, cât și femeile. Cel puțin 97% dintre bărbații cu fibroză chistică sunt infertili, dar nu sterili și pot avea copii cu tehnici de reproducere asistată . [54] Principala cauză a infertilității la bărbații cu fibroză chistică este absența congenitală a canalelor deferente (care conectează în mod normal testiculele la conductele ejaculatoare ale penisului ), dar poate exista și probleme suplimentare care pot provoca azoospermie , teratospermie și oligoastenospermia . [55]
Unele femei au dificultăți de reproducere din cauza îngroșării mucusului cervical sau din cauza malnutriției. În cazurile severe, malnutriția întrerupe ovulația și provoacă amenoree . [56]
Diagnostic

Fibroza chistică poate fi diagnosticată cu multe metode diferite, inclusiv screeningul nou-născuților, testarea transpirației și testarea genetică. Începând cu 2006 în Statele Unite , 10% din cazuri sunt diagnosticate la scurt timp după naștere ca parte a programelor de screening pentru nou-născuți. Testul începe cu evaluarea concentrației sanguine a tripsinogenului imunoreactiv. [57] Copiilor cu o doză anormală li se face un test de transpirație pentru a confirma diagnosticul de fibroză chistică. [58] [59] Nivelurile de tripsinogen pot fi crescute la persoanele care au o singură copie mutantă a genei CFTR sau, în cazuri rare, la persoanele cu două copii normale ale genei CFTR. Datorită acestor fals pozitive , utilitatea screeningului fibrozei chistice la sugari este controversată. [58] [59]
Majoritatea statelor și țărilor nu efectuează screening de rutină la momentul nașterii, ca urmare, majoritatea oamenilor sunt diagnosticați după apariția simptomelor. Cea mai des utilizată formă de diagnostic este testul transpirației. Implică aplicarea unui medicament care stimulează transpirația ( pilocarpina ). Transpirația rezultată este apoi colectată pe hârtie sau într-un tub capilar și analizată pentru valori anormale de sodiu și clor . Persoanele cu fibroză chistică au valori ridicate ale acestor două elemente în sudoare. În schimb, persoanele cu fibroză chistică au mai puțin tiocianat și izotiocianat în salivă [60] . Fibroza chistică poate fi, de asemenea, diagnosticată prin identificarea mutațiilor genei CFTR. [61]
Persoanele cu boala sunt de obicei plasate într-un registru care permite cercetătorilor și medicilor să urmărească rezultatele sănătății și să identifice candidații pentru studiile clinice. [61]
Diagnosticul prenatal
Cuplurile care așteaptă un copil sau care planifică o sarcină pot fi testate pentru mutații ale genei CFTR pentru a determina riscul ca bebelușul lor să se nască cu fibroză chistică. Testul se face de obicei pe unul sau pe ambii părinți mai întâi și, dacă riscul este mare, se fac teste fetale. Colegiul American de Obstetricieni și Ginecologi recomandă testul pentru cuplurile care au antecedente personale sau familiale ale bolii. [62]
Deoarece dezvoltarea fibrozei chistice la făt necesită ca fiecare părinte să transmită o copie mutantă a genei CFTR și pentru că testul este costisitor, se efectuează adesea inițial pe un singur părinte. Dacă testul arată că unul dintre părinți este purtătorul genei CFTR mutante, celălalt părinte este testat pentru a calcula riscul copiilor lor de a suferi de boală. Fibroza chistică poate rezulta din peste o mie de mutații diferite. Testul generic scanează sângele pentru a găsi cele mai frecvente mutații, cele mai multe dintre ele disponibile comercial căutând 32 sau mai puține mutații diferite. Dacă o familie are o mutație rară cunoscută, se poate face screeningul specific pentru acea mutație. Deoarece nu toate mutațiile cunoscute se găsesc la testele actuale, o evaluare a riscului negativă nu garantează că un copil nu va avea fibroză chistică. [63]
În timpul sarcinii , testul se poate face pe placentă ( vilozități corionice ) sau pe fluidul din jurul fătului ( amniocenteză ). Cu toate acestea, eșantionarea villusului corionic are un risc de 1 la 100 de deces fetal, în timp ce amniocenteza este 1 la 200. [63] Un studiu recent a indicat că acest lucru poate fi mult mai mic, în jur de 1 la 1600. [62]
Prognoză
Prognosticul pentru fibroza chistică este îmbunătățit prin diagnosticarea precoce prin screening , tratament mai bun și prin acces la asistența medicală. În 1959, vârsta medie de supraviețuire a copiilor cu fibroză chistică în Statele Unite a fost de șase luni. [64] În 2008, supraviețuirea mediană a fost de 37,4 ani. [65] În Canada , supraviețuirea mediană a crescut de la 24 de ani în 1982 la 47,7 ani în 2007. [66]
Dintre persoanele cu fibroză chistică care au peste 18 ani începând cu 2009, 92% aveau o diplomă de liceu, 67% aveau cel puțin unele studii universitare, 15% erau considerați cu dizabilități și 9% erau șomeri. 56% erau singuri, în timp ce 39% erau căsătoriți sau trăiau cu un partener. [67] În Rusia , vârsta mediană globală a pacienților este de 25 de ani, din cauza lipsei sau a costului ridicat al medicamentelor și a faptului că nu se efectuează transplant pulmonar. [68]
Tratament
Deși nu există un remediu pentru fibroza chistică, există mai multe metode de tratament. Gestionarea bolilor sa îmbunătățit semnificativ în ultimii 70 de ani. Pentru copiii născuți în urmă cu peste 70 de ani cu această afecțiune, ar fi fost puțin probabil să poată trăi dincolo de primul an, în timp ce în zilele noastre au șanse mari să ajungă la maturitate. Progresele recente în tehnicile de tratament au însemnat că o persoană cu boală poate petrece o viață din ce în ce mai puțin împovărată de boală. Pietrele de temelie ale managementului sunt tratarea infecțiilor căilor respiratorii, încurajarea unei alimentații bune și a unui stil de viață activ. Gestionarea afecțiunii trebuie prelungită de-a lungul vieții pacientului și are ca scop maximizarea funcției organelor și, în consecință, a calității vieții . Scopurile principale ale terapiei sunt plămânii , tractul gastro-intestinal (inclusiv terapia suplimentară pentru enzimele pancreatice), organele de reproducere (inclusiv tehnici de reproducere asistată) și sprijinul psihologic. [57]
Cel mai consistent aspect al terapiei cu fibroză chistică este limitarea și tratarea leziunilor pulmonare cauzate de sputa groasă și infecțiile ulterioare. Antibioticele sunt prescrise pentru tratarea infecțiilor cronice și acute. Dispozitivele mecanice de inhalare și medicamentele sunt utilizate pentru a elimina mucusul îngroșat. Deși aceste terapii sunt eficiente, ele pot fi deosebit de lungi pentru pacient. Una dintre cele mai importante dificultăți cu care trebuie să se confrunte pacientul este să găsească timpul pentru a urma tratamentele prescrise.
În plus, terapiile cum ar fi transplantul și terapia genică vizează vindecarea unora dintre efectele fibrozei chistice. Terapia genică își propune să introducă gena CFTR normală în căile respiratorii. Există două mecanisme care pot fi utilizate pentru introducerea genei CFTR: primul folosește un vector viral ( adenovirusul ) și al doilea folosește lipozomi .
Antibiotice
Mulți pacienți cu fibroză chistică trebuie să ia antibiotice în mod constant pentru a preveni infecțiile. Antibioticele sunt absolut necesare ori de câte ori se suspectează pneumonie sau se observă o scădere notabilă a funcției pulmonare. Terapia prelungită poate necesita spitalizare și inserarea unui cateter central permanent. Terapia prin inhalare cu antibiotice precum tobramicina , colistina și aztreonam este adesea prescrisă luni de zile pentru a îmbunătăți funcția pulmonară prin prevenirea creșterii bacteriilor. [69] [70] [71] Antibioticele orale, cum ar fi ciprofloxacina sau azitromicina sunt administrate pentru a preveni infecția sau pentru a controla orice infecție în curs. [72] Antibioticele aminoglicozidice (de exemplu tobramicina ) pot provoca pierderea auzului, deteriorarea sistemului de echilibru în urechea internă sau probleme renale pe termen lung. [73] Pentru a preveni apariția acestor efecte secundare , cantitatea de antibiotice din sânge trebuie măsurată în mod curent și ajustată în consecință.
Trapianto di polmone
Il trapianto di polmone può rendersi necessario negli individui affetti da fibrosi cistica, diminuendo la funzionalità polmonare diminuisce la tolleranza allo sforzo. Sebbene il trapianto singolo di polmone è possibile per altre condizioni, gli individui affetti da fibrosi cistica devono sostituire entrambi i polmoni poiché il polmone rimanente può contenere batteri che possono infettare il polmone trapiantato. Un trapianto di pancreas o di fegato può essere eseguita nello stesso momento, al fine di alleviare i deficit epatici e/o il diabete . [74] Il trapianto polmonare viene consigliato quando la funzionalità polmonare declina al punto in cui viene richiesta l'assistenza di dispositivi meccanici o la sopravvivenza del paziente viene minacciata. [75]
Altri aspetti

I neonati con ostruzione intestinale richiedono un intervento chirurgico , mentre agli adulti con sindrome da ostruzione intestinale distale non viene proposto. Il trattamento dell'insufficienza pancreatica, mediante sostituzione dei mancanti enzimi digestivi nel duodeno, consente di assorbire correttamente le sostanze nutritive e le vitamine che altrimenti andrebbero perse nelle feci.
Il diabete è la complicanza non-polmonare più frequente nei casi di fibrosi cistica. Viene riconosciuto come una entità distinta, e presenta caratteristiche miste del tipo 1 e del tipo 2 . [76] [77] Nonostante siano utilizzati farmaci orali contro il diabete, l'unico trattamento raccomandato consiste in iniezioni di insulina o l'uso di una pompa di insulina. [78] A differenza del diabete classico, non vengono raccomandate restrizioni nella dieta. [76]
Lo sviluppo di osteoporosi può essere prevenuto con l'aumento dell'assunzione di vitamina D e di calcio . I pazienti possono essere trattati anche con bifosfonati , anche se gli effetti negativi possono rappresentare un problema. [79] Le difficoltà nella crescita possono essere evitate grazie all'inserimento di un sondino per l'alimentazione al fine di aumentare il numero di calorie introdotte, oppure si può ricorrere alla somministrazione dell' ormone della crescita . [80]
Infezioni dei seni paranasali sono trattate con cicli prolungati di antibiotici. Lo sviluppo di polipi nasali può seriamente limitare il flusso d'aria attraverso il naso, e col tempo ridurre il senso dell' odore . La chirurgia dei seni è spesso utilizzata per alleviare l'ostruzione nasale e per limitare ulteriori infezioni. Per diminuire l'infiammazione nasale possono essere prescritti steroidi come il fluticasone . [81]
L' infertilità nella donna può essere superata grazie alle tecniche di riproduzione assistita , in particolare grazie al trasferimento embrionale . L'infertilità maschile causata dall'assenza dei vasi deferenti può essere ovviata con l' estrazione testicolare dello sperma (TEST) Se il campione raccolto contiene un numero troppo ridotto di spermatozooi per avere sufficienti chance di una fecondazione spontanea, si può ricorrere all' iniezione intracitoplasmatica dello spermatozoo . [82]
Vantaggio a favore dell'eterozigote
Trattandosi di una malattia autosomica recessiva, gli individui affetti da FC devono presentare un genotipo aa (dove "a" è l'allele recessivo). Gli eterozigoti avranno invece un genotipo Aa e non risulteranno essere affetti dalla malattia: tra l'altro in condizione di eterozigosi la presenza di un solo allele recessivo rende questi individui immuni dagli effetti della febbre tifoide . Questo fenomeno prende il nome di vantaggio a favore dell'eterozigote e spiega perché la frequenza dei portatori della mutazione sia così elevata (1 persona su 25). Se invece l'individuo eredita da ciascun genitore un allele mutato per la FC ma con diverse mutazioni, in quel caso si parlerà di eterozigote composito e manifesterà la malattia. Inoltre la patologia presenta manifestazioni cliniche variabili; questo in parte dipende dall'ambiente, in parte dipende dall'influsso o meno dei geni modificatori, una particolare classe di geni che può amplificare o ridurre i danni provocati dalla mutazione, portando gli individui con le stesse mutazioni ad avere sintomi e storie cliniche molto diversi fra loro.
Note
- ^ Autori vari, 8 - Pneumologia , in Gianni Bona, Roberto Miniero (a cura di), Pediatria pratica , 9ª ed., Saluzzo, Minerva Medica, 2013 [1975] , p. 92, ISBN 978-88-7711-774-8 .
- ^ a b c Busch R, On the history of cystic fibrosis , in Acta Univ Carol Med (Praha) , vol. 36, 1–4, 1990, pp. 13–5, PMID 2130674 .
- ^ G. Fanconi, E. Uehlinger e C. Knauer, Das coeliakiesyndrom bei angeborener zysticher pankreasfibromatose und bronchiektasien , in Wien. Med. Wschr , vol. 86, 1936, pp. 753–756.
- ^ Andersen DH. Cystic fibrosis of the pancreas and its relation to celiac disease: a clinical and pathological study. Am J Dis Child 1938; 56:344–399
- ^ Sant'Agnese PA, Darling RC, Perera GA, Shea E, Abnormal electrolyte composition of sweat in cystic fibrosis of the pancreas; clinical significance and relationship to the disease , in Pediatrics , vol. 12, n. 5, novembre 1953, pp. 549–63, PMID 13111855 .
- ^ LC. Tsui, Mutations and sequence variations detected in the cystic fibrosis transmembrane conductance regulator (CFTR) gene: a report from the Cystic Fibrosis Genetic Analysis Consortium. , in Hum Mutat , vol. 1, n. 3, 1992, pp. 197-203, DOI : 10.1002/humu.1380010304 , PMID 1284534 .
- ^ LC. Tsui, The cystic fibrosis transmembrane conductance regulator gene. , in Am J Respir Crit Care Med , vol. 151, 3 Pt 2, marzo 1995, pp. S47-53, PMID 7533605 .
- ^ Araújo FG, Novaes FC, Santos NP, et al ., Prevalence of deltaF508, G551D, G542X, and R553X mutations among cystic fibrosis patients in the North of Brazil , in Braz. J. Med. Biol. Res. , vol. 38, n. 1, gennaio 2005, pp. 11–5, DOI :10.1590/S0100-879X2005000100003 , PMID 15665983 .
- ^ a b c d e f g h i j k l m n o Mitchell, Richard Sheppard; Kumar, Vinay; Robbins, Stanley L.; Abbas, Abul K.; Fausto, Nelson, Robbins basic pathology , Saunders/Elsevier, 2007, ISBN 1-4160-2973-7 .
- ^ Edward Tobias, Essential Medical Genetics , John Wiley & Sons, 2011, p. 312, ISBN 1-118-29370-3 .
- ^ [edited by] Ruth A. Hannon ... [et al., Porth pathophysiology : concepts of altered health states , 1st Canadian ed., Philadelphia, PA, Wolters Kluwer Health/Lippincott Williams & Wilkins, 2010, p. 692, ISBN 978-1-60547-781-7 .
- ^ Cystic Fibrosis Foundation – Genetic Carrier Testing Archiviato il 23 marzo 2010 in Internet Archive . Updated 07/09/07
- ^ Rosenstein BJ, Cutting GR, The diagnosis of cystic fibrosis: a consensus statement. Cystic Fibrosis Foundation Consensus Panel , in J. Pediatr. , vol. 132, n. 4, aprile 1998, pp. 589–95, DOI : 10.1016/S0022-3476(98)70344-0 , PMID 9580754 .
- ^ Hamosh A, FitzSimmons SC, Macek M, Knowles MR, Rosenstein BJ, Cutting GR, Comparison of the clinical manifestations of cystic fibrosis in black and white patients , in J. Pediatr. , vol. 132, n. 2, febbraio 1998, pp. 255–9, DOI : 10.1016/S0022-3476(98)70441-X , PMID 9506637 .
- ^ P Farrel, S Joffe,L Foley,GJ Canny,P Mayne,M Rosenber, Irish Medical Journal , vol. 100, n. 8, settembre 2007, pp. 557–60, https://web.archive.org/web/20131203001750/http://www.imj.ie//ViewArticleDetails.aspx?ArticleID=2497 (archiviato dall' url originale il 3 dicembre 2013) .
- ^ a b Hytönen M, Patjas M, Vento SI, et al. , Cystic fibrosis gene mutations deltaF508 and 394delTT in patients with chronic sinusitis in Finland , in Acta Otolaryngol. , vol. 121, n. 8, dicembre 2001, pp. 945–7, DOI : 10.1080/000164801317166835 , PMID 11813900 .
- ^ Peter Russell, Biology : the dynamic science. , 2nd ed., Belmont, CA, Brooks/Cole, Cengage Learning, 2011, p. 304, ISBN 978-0-538-49372-7 .
- ^ Rosenfeld M, Davis R, FitzSimmons S, Pepe M, Ramsey B, Gender gap in cystic fibrosis mortality , in Am. J. Epidemiol. , vol. 145, n. 9, maggio 1997, pp. 794–803, PMID 9143209 .
- ^ Coakley RD, Sun H, Clunes LA, et al. , 17beta-Estradiol inhibits Ca2+-dependent homeostasis of airway surface liquid volume in human cystic fibrosis airway epithelia , in J. Clin. Invest. , vol. 118, n. 12, dicembre 2008, pp. 4025–35, DOI : 10.1172/JCI33893 , PMC 2582929 , PMID 19033671 .
- ^ Verma N, Bush A, Buchdahl R, Is there still a gender gap in cystic fibrosis? , in Chest , vol. 128, n. 4, ottobre 2005, pp. 2824–34, DOI : 10.1378/chest.128.4.2824 , PMID 16236961 .
- ^ Moran A, Dunitz J, Nathan B, Saeed A, Holme B, Thomas W,Cystic fibrosis-related diabetes: current trends in prevalence, incidence, and mortality , in Diabetes Care , vol. 32, n. 9, settembre 2009, pp. 1626–31, DOI : 10.2337/dc09-0586 , PMC 2732133 , PMID 19542209 .
- ^ CF worse for women 'due to effect of oestregen' , in The Irish Times , 8 agosto 2010.
- ^ Kere J, Savilahti E, Norio R, Estivill X, de la Chapelle A, Cystic fibrosis mutation delta F508 in Finland: other mutations predominate , in Hum. Genet. , vol. 85, n. 4, settembre 1990, pp. 413–5, DOI : 10.1007/BF02428286 , PMID 2210753 .
- ^ science.ca Profile : Lap-Chee Tsui
- ^ Bobadilla JL, Macek M, Fine JP, Farrell PM, Cystic fibrosis: a worldwide analysis of CFTR mutations—correlation with incidence data and application to screening , in Hum. Mutat. , vol. 19, n. 6, giugno 2002, pp. 575–606, DOI : 10.1002/humu.10041 , PMID 12007216 .
- ^ a b Rowe SM, Miller S, Sorscher EJ, Cystic fibrosis , in The New England Journal of Medicine , vol. 352, n. 19, maggio 2005, pp. 1992–2001, DOI : 10.1056/NEJMra043184 , PMID 15888700 .
- ^ EF. McKone, SS. Emerson; KL. Edwards; ML. Aitken, Effect of genotype on phenotype and mortality in cystic fibrosis: a retrospective cohort study. , in Lancet , vol. 361, n. 9370, maggio 2003, pp. 1671-6, DOI : 10.1016/S0140-6736(03)13368-5 , PMID 12767731 .
- ^ ( FR ) P Fanen e A Hasnain, Mucoviscidose et Gène CFTR , su atlasgeneticsoncology.org , Atlas Genet Cytogenet Oncol Haematol, settembre 2001. URL consultato il 12 giugno 2008 .
- ^ Kliegman, Robert; Richard M Kliegman, Nelson essentials of pediatrics , St. Louis, Mo, Elsevier Saunders, 2006, ISBN 0-8089-2325-0 .
- ^ Quinton PM, Cystic fibrosis: lessons from the sweat gland , in Physiology (Bethesda) , vol. 22, n. 3, giugno 2007, pp. 212–25, DOI : 10.1152/physiol.00041.2006 , PMID 17557942 . URL consultato il 1º novembre 2012 (archiviato dall' url originale il 15 aprile 2013) .
- ^ a b Hardin DS, GH improves growth and clinical status in children with cystic fibrosis – a review of published studies , in Eur. J. Endocrinol. , 151 Suppl 1, agosto 2004, pp. S81–5, DOI : 10.1530/eje.0.151S081 , PMID 15339250 .
- ^ a b De Lisle RC, Pass the bicarb: the importance of HCO3- for mucin release , in J. Clin. Invest. , vol. 119, n. 9, settembre 2009, pp. 2535–7, DOI : 10.1172/JCI40598 , PMC 2735941 , PMID 19726878 .
- ^ O'Malley CA, Infection control in cystic fibrosis: cohorting, cross-contamination, and the respiratory therapist ( PDF ), in Respir Care , vol. 54, n. 5, maggio 2009, pp. 641–57, DOI : 10.4187/aarc0446 , PMID 19393108 . URL consultato il 1º novembre 2012 (archiviato dall' url originale il 15 luglio 2011) .
- ^ Makker K, Agarwal A, Sharma R, Oxidative stress & male infertility ( PDF ), in Indian J. Med. Res. , vol. 129, n. 4, aprile 2009, pp. 357–67, PMID 19535829 . URL consultato il 1º novembre 2012 (archiviato dall' url originale il 5 luglio 2010) .
- ^ Blackman SM, Deering-Brose R, McWilliams R, et al. , Relative contribution of genetic and nongenetic modifiers to intestinal obstruction in cystic fibrosis , in Gastroenterology , vol. 131, n. 4, ottobre 2006, pp. 1030–9, DOI : 10.1053/j.gastro.2006.07.016 , PMC 1764617 , PMID 17030173 .
- ^ Ratjen FA, Cystic fibrosis: pathogenesis and future treatment strategies ( PDF ), in Respir Care , vol. 54, n. 5, maggio 2009, pp. 595–605, DOI : 10.4187/aarc0427 , PMID 19393104 . URL consultato il 1º novembre 2012 (archiviato dall' url originale il 15 luglio 2011) .
- ^ Reaves J, Wallace G. Unexplained bruising: weighing the pros and cons of possible causes . Consultant for Pediatricians. 2010;9:201–202.
- ^ Flume PA, Mogayzel Jr PJ, Robinson KA, et al. , Cystic Fibrosis Pulmonary Guidelines: Pulmonary Complications: Hemoptysis and Pneumothorax , in Am J Respir Crit Care Med , vol. 182, n. 3, marzo 2010, p. 298, DOI : 10.1164/rccm.201002-0157OC , PMID 20299528 .
- ^ ( ES ) Girón RM, Domingo D, Buendía B, Antón E, Ruiz-Velasco LM, Ancochea J, Nontuberculous mycobacteria in patients with cystic fibrosis [ collegamento interrotto ] , in Arch. Bronconeumol. , vol. 41, n. 10, ottobre 2005, pp. 560–5, DOI : 10.1016/S1579-2129(06)60283-8 , PMID 16266669 .
- ^ Maldonado M, Martínez A, Alobid I, Mullol J, The antrochoanal polyp , in Rhinology , vol. 42, n. 4, dicembre 2004, pp. 178–82, PMID 15626248 .
- ^ Ramsey B, Richardson MA, Impact of sinusitis in cystic fibrosis , in J. Allergy Clin. Immunol. , vol. 90, 3 Pt 2, settembre 1992, pp. 547–52, DOI : 10.1016/0091-6749(92)90183-3 , PMID 1527348 .
- ^ Franco LP, Camargos PA, Becker HM, Guimarães RE, Nasal endoscopic evaluation of children and adolescents with cystic fibrosis , in Braz J Otorhinolaryngol , vol. 75, n. 6, dicembre 2009, pp. 806–13, DOI :10.1590/S1808-86942009000600006 , PMID 20209279 .
- ^ Eggermont E, De Boeck K, Small-intestinal abnormalities in cystic fibrosis patients , in Eur. J. Pediatr. , vol. 150, n. 12, ottobre 1991, pp. 824–8, DOI : 10.1007/BF01954999 , PMID 1743211 .
- ^ Kulczycki LL, Shwachman H, Studies in cystic fibrosis of the pancreas; occurrence of rectal prolapse , in N. Engl. J. Med. , vol. 259, n. 9, agosto 1958, pp. 409–12, DOI : 10.1056/NEJM195808282590901 , PMID 13578072 .
- ^ Malfroot A, Dab I, New insights on gastro-esophageal reflux in cystic fibrosis by longitudinal follow up , in Arch. Dis. Child. , vol. 66, n. 11, novembre 1991, pp. 1339–45, DOI : 10.1136/adc.66.11.1339 , PMC 1793275 , PMID 1755649 .
- ^ Khoshoo V, Udall JN, Meconium ileus equivalent in children and adults , in Am. J. Gastroenterol. , vol. 89, n. 2, febbraio 1994, pp. 153–7, PMID 8304294 .
- ^ Williams SG, Westaby D, Tanner MS, Mowat AP, Liver and biliary problems in cystic fibrosis , in Br. Med. Bull. , vol. 48, n. 4, ottobre 1992, pp. 877–92, PMID 1458306 .
- ^ Colombo C, Russo MC, Zazzeron L, Romano G,Liver disease in cystic fibrosis , in J. Pediatr. Gastroenterol. Nutr. , 43 Suppl 1, luglio 2006, pp. S49–55, DOI : 10.1097/01.mpg.0000226390.02355.52 , PMID 16819402 .
- ^ Moran A, Pyzdrowski KL, Weinreb J, et al. , Insulin sensitivity in cystic fibrosis , in Diabetes , vol. 43, n. 8, agosto 1994, pp. 1020–6, DOI : 10.2337/diabetes.43.8.1020 , PMID 8039595 .
- ^ Alves Cde A, Aguiar RA, Alves AC, Santana MA, Diabetes mellitus in patients with cystic fibrosis , in J Bras Pneumol , vol. 33, n. 2, aprile 2007, pp. 213–21, DOI :10.1590/S1806-37132007000200017 , PMID 17724542 .
- ^ Haworth CS, Selby PL, Webb AK, et al. ,Low bone mineral density in adults with cystic fibrosis , in Thorax , vol. 54, n. 11, novembre 1999, pp. 961–7, DOI : 10.1136/thx.54.11.961 , PMC 1745400 , PMID 10525552 .
- ^ ( FR ) Vandemergel X, Decaux G, [Review on hypertrophic osteoarthropathy and digital clubbing] , in Rev Med Brux , vol. 24, n. 2, aprile 2003, pp. 88–94, PMID 12806875 .
- ^ Pitts-Tucker TJ, Miller MG, Littlewood JM, Finger clubbing in cystic fibrosis , in Arch. Dis. Child. , vol. 61, n. 6, giugno 1986, pp. 576–9, DOI : 10.1136/adc.61.6.576 , PMC 1777828 , PMID 3488032 .
- ^ McCallum TJ, Milunsky JM, Cunningham DL, Harris DH, Maher TA, Oates RD, Fertility in men with cystic fibrosis: an update on current surgical practices and outcomes , in Chest , vol. 118, n. 4, ottobre 2000, pp. 1059–62, DOI : 10.1378/chest.118.4.1059 , PMID 11035677 .
- ^ Augarten A, Yahav Y, Kerem BS, et al. , Congenital bilateral absence of vas deferens in the absence of cystic fibrosis , in Lancet , vol. 344, n. 8935, novembre 1994, pp. 1473–4, DOI : 10.1016/S0140-6736(94)90292-5 , PMID 7968122 .
- ^ Gilljam M, Antoniou M, Shin J, Dupuis A, Corey M, Tullis DE, Pregnancy in cystic fibrosis. Fetal and maternal outcome , in Chest , vol. 118, n. 1, luglio 2000, pp. 85–91, DOI : 10.1378/chest.118.1.85 , PMID 10893364 .
- ^ a b Davies JC, Alton EW, Bush A,Cystic fibrosis , in BMJ , vol. 335, n. 7632, dicembre 2007, pp. 1255–9, DOI : 10.1136/bmj.39391.713229.AD , PMC 2137053 , PMID 18079549 .
- ^ a b Ross LF,Newborn screening for cystic fibrosis: a lesson in public health disparities , in The Journal of Pediatrics , vol. 153, n. 3, settembre 2008, pp. 308–13, DOI : 10.1016/j.jpeds.2008.04.061 , PMC 2569148 , PMID 18718257 .
- ^ a b BM Assael, Castellani C, Ocampo MB et al.,Epidemiology and survival analysis of cystic fibrosis in an area of intense neonatal screening over 30 years , in American Journal of Epidemiology , vol. 156, n. 5, settembre 2002, pp. 397–401, DOI : 10.1093/aje/kwf064 , PMID 12196308 .
- ^ Minarowski Ł, Sands D, Minarowska A, Karwowska A, Sulewska A, Gacko M, Chyczewska E. Thiocyanate concentration in saliva of cystic fibrosis patients. Folia Histochem Cytobiol. 2008;46(2):245-6. [ collegamento interrotto ]
- ^ a b Stern RC, The diagnosis of cystic fibrosis , in N. Engl. J. Med. , vol. 336, n. 7, febbraio 1997, pp. 487–91, DOI : 10.1056/NEJM199702133360707 , PMID 9017943 .
- ^ a b American College of Obstetricians and Gynecologists and American College of Medical Genetics. Preconception and prenatal carrier screening for cystic fibrosis. Clinical and laboratory guidelines. American College of Obstetricians and Gynecologists, Washington, DC, October 2001.
- ^ a b Elias S, Annas GJ, Simpson JL, Carrier screening for cystic fibrosis: implications for obstetric and gynecologic practice , in Am. J. Obstet. Gynecol. , vol. 164, n. 4, aprile 1991, pp. 1077–83, PMID 2014829 .
- ^ What is the life expectancy for people who have CF (in the United States)? , su cff.org , Cystic Fibrosis Foundation, 2008. URL consultato il 14 marzo 2010 .
- ^ AY Elzouki ... [et al., Textbook of clinical pediatrics , 2nd ed., Berlin, Springer, p. 2214, ISBN 978-3-642-02201-2 .
- ^ Canadian Cystic Fibrosis Patient Data Registry Report ( PDF ), su cysticfibrosis.ca , Canadian Cystic Fibrosis Foundation, 2007. URL consultato il 14 marzo 2010 (archiviato dall' url originale il 15 luglio 2010) .
- ^ Cystic Fibrosis Patient Registry Annual Data Report 2009 ( PDF ), su cff.org , Cystic Fibrosis Foundation, 2009 (archiviato dall' url originale il 5 gennaio 2012) .
- ^ ( RU ) Copia archiviata , su mucoviscidos.ru . URL consultato il 1º novembre 2012 (archiviato dall' url originale il 29 marzo 2009) .
- ^ Pai VB, Nahata MC, Efficacy and safety of aerosolized tobramycin in cystic fibrosis , in Pediatr. Pulmonol. , vol. 32, n. 4, ottobre 2001, pp. 314–27, DOI : 10.1002/ppul.1125 , PMID 11568993 .
- ^ Westerman EM, Le Brun PP, Touw DJ, Frijlink HW, Heijerman HG, Effect of nebulized colistin sulphate and colistin sulphomethate on lung function in patients with cystic fibrosis: a pilot study , in J. Cyst. Fibros. , vol. 3, n. 1, marzo 2004, pp. 23–8, DOI : 10.1016/j.jcf.2003.12.005 , PMID 15463883 .
- ^ McCoy KS, Quittner AL, Oermann CM, Gibson RL, Retsch-Bogart GZ, Montgomery AB,Inhaled aztreonam lysine for chronic airway Pseudomonas aeruginosa in cystic fibrosis , in Am. J. Respir. Crit. Care Med. , vol. 178, n. 9, novembre 2008, pp. 921–8, DOI : 10.1164/rccm.200712-1804OC , PMC 2577727 , PMID 18658109 .
- ^ Hansen CR, Pressler T, Koch C, Høiby N, Long-term azitromycin treatment of cystic fibrosis patients with chronic Pseudomonas aeruginosa infection; an observational cohort study , in J. Cyst. Fibros. , vol. 4, n. 1, marzo 2005, pp. 35–40, DOI : 10.1016/j.jcf.2004.09.001 , PMID 15752679 .
- ^ Tan KH, Mulheran M, Knox AJ, Smyth AR, Aminoglycoside prescribing and surveillance in cystic fibrosis , in Am. J. Respir. Crit. Care Med. , vol. 167, n. 6, marzo 2003, pp. 819–23, DOI : 10.1164/rccm.200109-012CC , PMID 12623858 .
- ^ Fridell JA, Vianna R, Kwo PY, et al. , Simultaneous liver and pancreas transplantation in patients with cystic fibrosis , in Transplant. Proc. , vol. 37, n. 8, ottobre 2005, pp. 3567–9, DOI : 10.1016/j.transproceed.2005.09.091 , PMID 16298663 .
- ^ Belkin RA, Henig NR, Singer LG, et al. ,Risk factors for death of patients with cystic fibrosis awaiting lung transplantation , in Am. J. Respir. Crit. Care Med. , vol. 173, n. 6, marzo 2006, pp. 659–66, DOI : 10.1164/rccm.200410-1369OC , PMC 2662949 , PMID 16387803 .
- ^ a b Alves CAD, Aguiar RA, Alves AC, Santana MA, Diabetes mellitus in patients with cystic fibrosis , in J Bras Pneumol , vol. 33, n. 2, aprile 2007, pp. 213–21, DOI :10.1590/S1806-37132007000200017 , PMID 17724542 .
- ^ Zirbes J, Milla CE, Cystic fibrosis related diabetes , in Paediatr Respir Rev , vol. 10, n. 3, settembre 2009, pp. 118–23; quiz 123, DOI : 10.1016/j.prrv.2009.04.004 , PMID 19651382 .
- ^ Onady GM, Stolfi A, Insulin and oral agents for managing cystic fibrosis-related diabetes , in Gary M Onady (a cura di), Cochrane Database Syst Rev , n. 3, 2005, pp. CD004730, DOI : 10.1002/14651858.CD004730.pub2 , PMID 16034943 .
- ^ Conwell LS, Chang AB, Bisphosphonates for osteoporosis in people with cystic fibrosis , in Cochrane Database Syst Rev , n. 4, 2012, pp. CD002010, DOI : 10.1002/14651858.CD002010.pub3 , PMID 22513903 .
- ^ Hardin DS, Rice J, Ahn C, et al. , Growth hormone treatment enhances nutrition and growth in children with cystic fibrosis receiving enteral nutrition , in J. Pediatr. , vol. 146, n. 3, marzo 2005, pp. 324–8, DOI : 10.1016/j.jpeds.2004.10.037 , PMID 15756212 .
- ^ Marks SC, Kissner DG, Management of sinusitis in adult cystic fibrosis , in Am J Rhinol , vol. 11, n. 1, 1997, pp. 11–4, DOI : 10.2500/105065897781446810 , PMID 9065342 .
- ^ Phillipson GT, Petrucco OM, Matthews CD, Congenital bilateral absence of the vas deferens, cystic fibrosis mutation analysis and intracytoplasmic sperm injection , in Hum. Reprod. , vol. 15, n. 2, febbraio 2000, pp. 431–5, DOI : 10.1093/humrep/15.2.431 , PMID 10655317 .
Bibliografia
- Edward Tobias, Essential Medical Genetics , John Wiley & Sons, 2011, ISBN 1-118-29370-3 .
- [edited by] Ruth A. Hannon ... [et al.,Porth pathophysiology: concepts of altered health states , 1st Canadian ed., Philadelphia, PA, Wolters Kluwer Health/Lippincott Williams & Wilkins, 2010, ISBN 978-1-60547-781-7 .
- Peter Russell, Biology: the dynamic science , 2nd ed., Belmont, CA, Brooks/Cole, Cengage Learning, 2011, ISBN 978-0-538-49372-7 .
- Kliegman, Robert; Richard M Kliegman, Nelson essentials of pediatrics , St. Louis, Mo, Elsevier Saunders, 2006, ISBN 0-8089-2325-0 .
- Mitchell, Richard Sheppard; Kumar, Vinay; Robbins, Stanley L.; Abbas, Abul K.; Fausto, Nelson, Robbins basic pathology , Saunders/Elsevier, 2007, ISBN 1-4160-2973-7 .
- AY Elzouki ... [et al., Textbook of clinical pediatrics , 2nd ed., Berlin, Springer, ISBN 978-3-642-02201-2 .
Voci correlate
Altri progetti
-
 Wikizionario contiene il lemma di dizionario « mucoviscidosi »
Wikizionario contiene il lemma di dizionario « mucoviscidosi » -
 Wikimedia Commons contiene immagini o altri file su mucoviscidosi
Wikimedia Commons contiene immagini o altri file su mucoviscidosi
Collegamenti esterni
- ( EN ) Fibrosi cistica , su Enciclopedia Britannica , Encyclopædia Britannica, Inc.
- Fondazione per la ricerca sulla fibrosi cistica , su fibrosicisticaricerca.it .
- Sito di Telethon sulla fibrosi cistica , su telethon.it (archiviato dall' url originale il 19 dicembre 2008) .
- Lega Italiana Fibrosi Cistica , su fibrosicistica.it .
- Guida di alimentazione per la Fibrosi Cistica , su cftr.it . URL consultato il 13 settembre 2011 (archiviato dall' url originale il 25 settembre 2011) .
- ( EN ) Fibrosi cistica , su cysticfibrosis.com .
- Fibrosi Cistica su Orphanet, il portale delle malattie rare , su orpha.net .
| Controllo di autorità | Thesaurus BNCF 20386 · LCCN ( EN ) sh85035204 · GND ( DE ) 4040669-6 · BNF ( FR ) cb11956777v (data) · NDL ( EN , JA ) 00570677 |
|---|