Reacție electrociclică
În chimia organică, o reacție electrociclică este un tip de reacție periciclică în care rezultatul final este formarea unei legături pi și dispariția simultană a unei legături sigma sau invers. [1] În general, aceste reacții sunt clasificate în conformitate cu următoarele criterii:
- Reacțiile pot fi termice sau fotochimice .
- Reacțiile pot fi deschiderea sau închiderea inelului.
- Reacția poate continua cu un mecanism conrotator sau disrotator, în funcție de tipul de reacție (termică sau fotochimică) și de numărul de electroni pi implicați.
- Tipul de rotație determină dacă produsul format va fi cis sau trans .
Exemple clasice
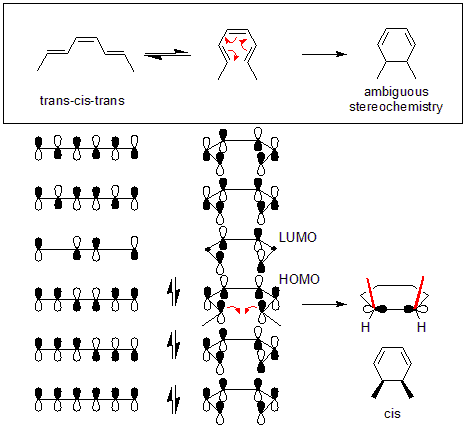
Reacția de ciclizare Nazarov este o reacție electrociclică care transformă divinilcetonele în ciclopentenone. Un exemplu clasic este deschiderea inelului 3,4-dimetilciclobutenă. Izomerul cis formează exclusiv cis, trans -2,4-hexadienă, în timp ce izomerul trans dă trans, trans dienă. [2]
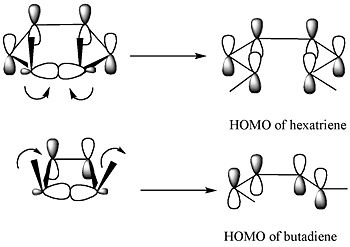
Cursul reacției poate fi explicat într-un mod simplu cu metoda orbitalelor de frontieră : legătura sigma a reactivului se va deschide astfel încât orbitalii pi rezultați să aibă aceeași simetrie ca HOMO a produsului (o butadienă ). Singura modalitate de a realiza acest lucru este o deschidere conrotantă a inelului care formează lobi terminali cu semne opuse.
Stereospecificitatea reacțiilor electrociclice
În efectuarea unei reacții electrociclice este uneori util să se cunoască în prealabil geometria cis / trans a produsului de reacție. În acest scop, primul pas este de a determina dacă reacția se desfășoară într-un mod conrotator sau disrotator. Tabelul de mai jos prezintă regulile de selectivitate pentru reacțiile electrociclice termice și fotochimice.
| Sistem | Inducție termică (stare de bază) | Inducție fotochimică (stare excitată) |
|---|---|---|
| Număr par de conjugări | Conrotator | Disrotator |
| Număr impar de conjugări | Disrotator | Conrotator |
În exemplul prezentat mai jos, reacția termică a ( trans, cis, trans ) -octa-2,4,6-trienă va avea loc cu un mecanism de disrotare. După stabilirea tipului de rotație, se poate determina dacă produsul va fi cis sau trans prin examinarea HOMO a moleculei de pornire. În exemplul de mai jos, mișcarea de disrotare aduce cei doi metili în direcție în sus, determinând produsul să fie cis- dimetilciclohexadienă.
Într-o reacție electrociclică poate exista, de asemenea, o selectivitate de torsiune în ceea ce privește direcția de rotație. De exemplu, într-o reacție conrotatorie, rotația poate avea loc în două direcții, ducând la produse enantiomerice. În cazul selectivității torsionale, una dintre direcțiile de rotație este favorizată (parțial sau total), ducând la un exces enantiomeric al produsului.
Mecanismul reacțiilor termice
Woodward-Hoffmann reguli
Pentru cele două procese este posibil să se construiască diagrame de corelație care să conecteze orbitalele moleculare ale reactivului cu cele ale produsului având aceeași simetrie. [3]
Aceste diagrame de corelație indică faptul că pentru 3,4-dimetilciclobutenă este permisă doar o singură deschidere a inelului rotativ prin simetrie, în timp ce pentru 5,6-dimetilciclohexa-1,3-dienă o singură deschidere de simetrie este permisă prin simetrie. Numai în aceste cazuri se obține de fapt o suprapunere maximă a orbitalilor în starea de tranziție. Mai mult, produsul format ar fi mai degrabă în starea fundamentală decât într-o stare excitată.
Teoria orbitală de frontieră
Conform acestei teorii, legătura sigma din inel se va deschide astfel încât orbitalii pi rezultați să aibă aceeași simetrie ca produsul HOMO. [4]
Suprapunerea maximă a orbitalilor în starea de tranziție se obține numai în modul disrotator, unde simetria față de planul oglinzii este păstrată în timpul reacției. Mai mult, ar avea ca rezultat formarea unui produs într-o stare excitată de stabilitate comparabilă cu starea excitată a reactantului.
Reacții electrociclice în sistemele biologice
Reacțiile electrociclice sunt frecvente în natură. [5] Una dintre cele mai frecvente este biosinteza vitaminei D 3 . În prima etapă, 7-dehidrocolesterolul suferă o deschidere conrotatorie a inelului pe cale fotochimică, formând pre vitamina D 3 . Urmează o transpunere sigmatropică [1,7] pentru a ajunge la vitamina D 3 . [6]
Un alt exemplu este propunerea pentru aranotina biosinteza, o -oxepin de origine naturală. Epoxidarea enzimatică a diketopiperazinei derivate din fenilalanină formează arena oxidului, ceea ce dă naștere unei reacții de electrociclizare 6rot disrotatoare care deschide inelul pentru a forma oxepină. După o a doua epoxidare a inelului, azotul nucleofil din apropiere atacă carbonul electrofil formând un inel cu cinci membri. Inelul rezultat este un sistem ciclic întâlnit frecvent în aranotină și în compuși similari.
Reacții electrociclice în sinteza organică
O reacție electrociclică deseori studiată este deschiderea inelului termic conrotator al benzociclobutenei . Produsul de reacție este un orto-chinodimetan foarte instabil, dar această moleculă poate fi prinsă într-o adiție endo cu un dienofil puternic, cum ar fi anhidridă maleică, pentru a da aductul Diels-Alder . Randamentul procesului de deschidere a inelului benzociclobutan (Schema 1) depinde de natura substituentului R. [7] Într-un solvent precum toluenul , la o temperatură de 110 ° C randamentul crește de la metil la izobutilmetil la trimetilsililmetil. Creșterea vitezei de reacție pentru compusul trimetilsilil poate fi explicată prin hiperconjugarea siliciuului, deoarece legătura βC-Si donează electroni la legătura CC a ciclobutanului, slăbindu-l.
A fost descoperită o reacție în cascadă biomimetică electrociclică prin izolarea și sintetizarea unor acizi endiandrici: [8] [9]
Reacțiile electrociclice asimetrice constituie un câmp emergent de sinteză organică. Cele mai studiate reacții în acest domeniu sunt sinteza 4π Staudinger a β-lactamelor [10] și reacția 4π Nazarov . Pentru ambele reacții, cataliza asimetrică a fost controlată folosind auxiliari chirali , iar reacția Nazarov a fost efectuată catalitic cu acizi Lewis chirali , acizi Brønsted și amine chirale. [11]
Notă
Bibliografie
- ( EN ) CM Beaudry, JP Malerich și D. Trauner, Electrociclizări biosintetice și biomimetice , în Chem. Rev. , vol. 105, nr. 12, 2005, pp. 4757-4778, DOI : 10.1021 / cr0406110 .
- ( EN ) FP Cossío, A. Arrieta și MA Sierra, Mecanismul reacției ketene-imine (Staudinger) în Centenarul său: încă o problemă nerezolvată? , în Acc. Chem. Rez. , Vol. 41, nr. 8, 2008, pp. 925-936, DOI : 10.1021 / ar800033j .
- ( EN ) I. Fleming, Frontier Orbitals and Organic Chemical Reactions , John Wiley & Sons, 1977, ISBN 9780471018209 .
- ( EN ) R. Hoffmann și RB Woodward, Conservarea simetriei orbitale , în Acc. Chem. Rez. , Vol. 1, nr. 1, 1968, pp. 17-22, DOI : 10.1021 / ar50001a003 .
- ( EN ) Y. Matsuya, N. Ohsawa și H. Nemoto, Deschiderea inelară electrociclică accelerată a benzociclobutenelor sub influența unui atom de β-siliciu , în J. Am. Chem. Soc. , Vol. 128, nr. 2, 2006, pp. 412-413, DOI : 10.1021 / ja055505 + .
- AD McNaught și A. Wilkinson, reacție electrociclică , pe IUPAC. Compendiu de terminologie chimică, ed. A II-a. („Cartea de aur”) , Blackwell Scientific Publications, 2006. Accesat la 15 februarie 2017 .
- ( EN ) KC Nicolaou, NA Petasis și RE Zipkin, Cascada acidului endiandric. Electrociclizări în sinteză organică. 4. Abordarea biomimetică a acizilor endiandrici AG. Sinteze totale și studii termice , în J. Am. Chem. Soc. , Vol. 104, nr. 20, 1982, pp. 5560-5562, DOI : 10.1021 / ja00384a080 .
- ( EN ) KC Nicolau, Inspirations, Discoveries, and Future Perspectives in Total Synthesis , în J. Org. Chem. , vol. 74, nr. 3, 2009, pp. 951-972, DOI : 10.1021 / jo802351b .
- ( EN ) WH Okamura, HY Elnagar, M. Ruther și S. Dobreff, Thermal [1,7] -sigmatropic shift of previtamin D3 to vitamin D3: synthesis and study of pentadeuterium derivates , în J. Org. Chem. , vol. 58, nr. 3, 1993, pp. 600-610, DOI : 10.1021 / jo00055a011 .
- ( EN ) S. Thompson, AG Coyne, PC Knipe și MD Smith, Reacții electrociclice asimetrice , în Chem. Soc. Rev. , vol. 40, 2011, pp. 4217-4231, DOI : 10.1039 / C1CS15022G .
- ( EN ) REK Winter, Prepararea și izomerizarea cis- și trans-3,4-dimetilciclobutenei , în Tetrahedron Letters , vol. 6, nr. 17, 1965, pp. 1207-1212, DOI : 10.1016 / S0040-4039 (01) 83997-6 .