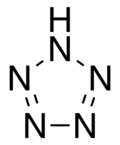
Pentazol
| Pentazol | |||
|---|---|---|---|
| Numele IUPAC | |||
| 1 H- pentazol [1] | |||
| Denumiri alternative | |||
| Acid pentazolidric | |||
| Caracteristici generale | |||
| Formula moleculară sau brută | HN 5 | ||
| Masa moleculară ( u ) | 71.04144 | ||
| numar CAS | |||
| PubChem | 6451467 | ||
| ZÂMBETE | N1N=NN=N1 | ||
| Proprietăți fizico-chimice | |||
| Densitate (g / cm 3 , în cs ) | 1.748 g / cm 3 | ||
| Indicele de refracție | 1,555 | ||
| Informații de siguranță | |||
Pentazolul este un compus chimic cu formula brută HN 5 . Este un compus aromatic homociclic , format dintr-un inel de cinci atomi de azot , dintre care unul este legat de un atom de hidrogen . Deși este clasificat tehnic între compuși anorganici și homociclici, deoarece nu conține atomi de carbon, pentazolul a fost considerat istoric ca aparținând familiei azolilor , adică moleculelor heterociclice care conțin de la unu la cinci atomi de azot, care includ și pirol. , pirazol , imidazol și tiazol . Din acest motiv, este uneori considerat ca legătura dintre chimia anorganică și organică .
Pentazolul a fost sintetizat pentru prima dată în 2003 de cercetători de laUniversitatea Națională din Irlanda [2] .
Derivate
Compușii care pot fi obținuți prin substituirea unui grup de atomi cu atomul de hidrogen se numesc pentazoli . Elementele acestei clase sunt instabile și adesea extrem de explozive . Primul pentazol descoperit a fost, în 1954 , fenilpentazolul , în care inelul de azot este stabilizat prin legarea la un inel de fenil . Cel mai stabil pentazol cunoscut este 4-dimetilaminofenilpentazolul , care totuși tinde să se descompună la temperaturi peste 50 ° C. Arilii unui pentazol sunt stabilizați de grupuri donatoare de electroni [3] .
Ionii pentazolului
Cationul ciclic al pentazolului, N 5 + , nu a fost încă produs, probabil datorită proprietăților sale antiaromatice prezise. Cu toate acestea, este cunoscut cationul pentazeniu N + 5 ), care are o structură liniară mai degrabă decât inelară. Spectrometria de masă a relevat prezența pentazolide anion (N 5 -) în reacțiile de descompunere ale phenylpentazole derivaților. S-au observat indicații privind formarea anionilor pentazol și pentazolid în soluție [2] , inclusiv formarea azidelor care conțin izotopul 15 N (izotop nu foarte comun în natură și, prin urmare, util pentru etichetarea atomilor prezenți în reactivi, distingându-i de cei prezenți în aer), dar dovezile că s-au produs anioni N 5 - au fost contestate [4] . Experimentele ulterioare, analizând în detaliu produsele de descompunere, au confirmat în schimb formarea pentazolului (HN 5 ) [5] , în acord larg cu previziunile teoretice [6] .
Cu toate acestea, pentazolul nu supraviețuiește într-o soluție apoasă mai mult de câteva secunde, fără ajutorul agenților de complexare . Dacă s-ar găsi o modalitate de stocare permanentă, aceasta ar pregăti calea pentru crearea sărurilor cu partea nemetalică compusă în întregime din azot, care ar putea fi combustibili extrem de puternici.
Notă
- ^ ( EN ) 1 H- Pentazol - Baza de date publică chimică PubChem , pe proiectul PubChem , Centrul Național pentru Informații despre Biotehnologie (SUA). Accesat la 2 octombrie 2012 .
- ^ a b ( EN ) Butler RN, Stephens JC, Burke LA, Prima generație de pentazol (HN5, acid pentazolic), azolul final și o sare pentazolată de zinc în soluție: o nouă N-carilatie a 1- (p-metoxifenil) ) pirazoli, un 2- (p-metoxifenil) tetrazol și aplicarea metodologiei la 1- (p-metoxifenil) pentazol. , în Chemical communications , vol. 8, Cambridge, Anglia, 21 aprilie 2003, pp. 1016-1017.
- ^(EN) THE Burke, PJ Fazen, Corelation Analysis of the interconversion and Azot Loss Reactions of Aryl Pentazenes and Pentazoles Derived From Aryl diazonium azide and Ions in the International Journal of Quantum Chemistry, vol. 109, nr. 15, decembrie 2009, pp. 3613–3618.
- ^ Thorsten Schroer, Haiges, Ralf, Schneider, Stefan, Christe, Karl O., Cursa pentru prima generație a anionului pentazolat în soluție este departe de a fi terminată , în Chemical Communications , n. 12, 31 decembrie 2004, p. 1607.
- ^ Richard N. Butler, Hanniffy, John M., Stephens, John C., Burke, Luke A., A Ceric Ammonium Nitrate N-Dearylation of Np-Anisylazoles Applied to Pyrazole, Triazole, Tetrazole, and Pentazole Rings: Release of Parent Azoli. Generation of Unstable Pentazole, HN5 / N5-, în soluție , în The Journal of Organic Chemistry , vol. 73, nr. 4, 31 ianuarie 2008, pp. 1354–1364.
- ^ S. Ajith Perera, Gregušová, Adriana, Bartlett, Rodney J., Primele calcule ale valorilor 15N - 15N J și noi calcule ale schimbărilor chimice pentru sistemele cu azot ridicat: un comentariu asupra căutării lungi a HN5 și a anionului său pentazol , în Jurnalul de chimie fizică A , vol. 113, nr. 13, 1 aprilie 2009, pp. 3197-3201.
linkuri externe
- Imagine 3D a moleculei de pentazol pe Chemapps
- ( EN ) Fișă informativă Pentazol pe ChemSpider