Efect Gauche
Termenul gauche se referă la acei izomeri conformaționali (conformeri) în care două grupuri vicinale sunt separate printr-un unghi diedru de 60 °. IUPAC definește gauche ca sinonim pentru alinierea sinclinală a grupurilor vicinale . [1]
În stereochimie , interacțiunile mari împiedică rotația în jurul legăturii. De exemplu, plasându-ne de-a lungul legăturii C2-C3 în conformația eșalonată a butanului , există două energii potențiale relative posibile . Cele două grupări metil pot fi într-o relație anti-legătură sau pot fi separate printr-un unghi diedru de 60 °. În cea de-a doua conformație, se spune că cele două metiluri se află într-o conformație gauche, iar energia potențială relativă a fiecărei interacțiuni metil-metil gauche este de 0,9 kilocalorii per mol (4 kJ / mol).
Efect Gauche
Efectul gauche caracterizează fiecare rotamer gauche care este mai stabil decât antirotamerul său. Conformația gauche a 1,2-difluoroetanului (H 2 FCCFH 2 ), de exemplu, este mai stabilă decât 1 kJ / mol (2,4 până la 3,4 kJ / mol) în faza gazoasă. Un alt exemplu este 1,2-dimetoxietan.
Există în principal două explicații pentru efectul Gauche: hiperconjugarea și legăturile pliate. În modelul de hiperconjugare, interacțiunea electronică între orbitalul de legare σ a C - H și orbitalul σ * de legătură a C - F este considerat a fi cauza stabilității izomerului gauche. Datorită electronegativității mari a fluorului, orbitalul σ al C - H este un donator de electroni mai bun decât orbitalul σ al C - F, în timp ce orbitalul σ * al C - F este un acceptor de electroni mai bun decât orbitalul molecular σ * al C - H. Numai conformația gauche permite suprapunerea dintre cel mai bun donator și cel mai bun acceptor de electroni
Cheia în explicarea efectului gauche prin modelul legăturii pliate în difluoroetan este creșterea caracterului p în orbitalele ambelor legături C - F datorită electronegativității mari a fluorului. Rezultatul este că densitatea electronilor se acumulează în jurul legăturii CC centrale. Suprapunerea orbitală redusă rezultată poate fi parțial compensată atunci când se presupune o conformație gauche datorită formării unei legături pliate. Dintre aceste două modele, hiperconjugarea este în general considerată a fi principala cauză a efectului gauche în difluoroetan. [2] [3]
Geometria moleculară a ambilor rotameri poate fi obținută experimental cu spectroscopie în infraroșu rafinată cu studii in silico . [4] Conform modelului descris mai sus, lungimea legăturii carbon-carbon este mai mare pentru antirotamer (151,4 µm versus 150 µm). Repulsia sterică între atomii de fluor din rotamerele gauche crește unghiul de legătură CCF (cu 3,2 °) și crește unghiul diedru (de la 60 ° la 71 ° standard).
În 1,2-difluorodifeniletan (în care, comparativ cu difluoroetanul, doi hidrogeni au fost înlocuiți cu doi fenili) s-a descoperit (cu cristalografie cu raze X și constante de cuplare RMN) că izomerii (S, S) și (R, R ) au cele două grupări fenil și cei doi atomi de fluor în poziție anti și s-a descoperit o conformație gauche pentru ambele grupe ale izomerilor (S, R) și (R, S). [5] Conform rezultatelor in silico această conformație este mai stabilă decât 0,21 kcal / mol (880 J / mol).
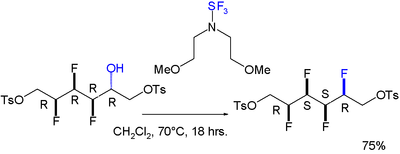
De asemenea, a fost identificat un efect gauche pentru o moleculă pe care se fac 4 substituții în combinație cu fluor, ultima datorită agentului trifluorură de bis (2-metoxietil) aminosulfur : [6]
Efectul gauche este foarte sensibil la așa-numitul efect solvent datorită diferenței mari de electronegativitate dintre cei doi conformeri. De exemplu, 2,3-dinitro-2,3-dimetilbutan, care în stare solidă există doar în conformația gauche, în benzen preferă conformația gauche cu un raport 79:21, în timp ce în tetraclorură de carbon preferă anti conformerul cu un raport de 58:42. [7] Un alt caz este difluorociclohexanul trans-1,2, care, în solvenții polari, preferă conformarea cu cei doi substituenți ecuatoriali. [3]
Un efect asociat este izomerismul trans cis .
Notă
- ^ gauche , pe goldbook.iupac.org , IUPAC Gold Book. Adus pe 2 februarie 2018 .
- ^ Goodman, L.; Gu, H.; Pophristic, V. Gauche Effect in 1,2-Difluoroetan. Hiperconjugare, obligațiuni îndoite, respingere sterică. J. Phys. Chem. A. 2005 , 109 , 1223-1229. DOI : 10.1021 / jp046290d
- ^ a b David O'Hagan. Înțelegerea chimiei organofluorului. O introducere în legătura C - F. Chem. Soc. Rev. 2008 DOI : 10.1039 / b711844a
- ^ Contribuție la studiul efectului Gauche. Structura completă a anti-rotamerului 1,2-difluoroetan Norman C. Craig, Anthony Chen, Ki Hwan Suh, Stefan Klee, Georg C. Mellau, Brenda P. Winnewisser și Manfred Winnewisser J. Am. Chem. Soc .; 1997 ; 119 (20) pp 4789–4790; (Comunicare) DOI : 10.1021 / ja963819e
- ^ Motivul difluor vicinal: Sinteza și conformarea eritro- și treo-diastereoizomerii 1,2-difluorodifeniletani, acizilor 2,3-difluorosuccinici și derivații lor O'Hagan D, Rzepa H, Schuler M, Slawin A, în Beilstein Journal de chimie organică , 2006 2:19 (2 octombrie 2006) DOI : 10.1186 / 1860-5397-2-19
- ^ Sinteza enantioselectivă a unui motiv de fluor pur Vicinal All-syn, Luke Hunter, David O'Hagan și Alexandra MZ Slawin, în J. Am. Chem. Soc. , 2006; 128 (51) pp 16422–16423; (Comunicare) DOI : 10.1021 / ja066188p
- ^ Smith, Michael. B.; Martie, chimia organică avansată a lui J. March, ediția a V-a. Wiley, 2001. ISBN 0-471-58589-0