Legea Boyle-Mariotte
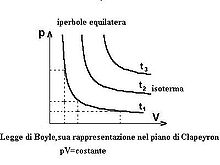
În termodinamică, legea lui Boyle și Mariotte (sau pur și simplu legea lui Boyle ) afirmă că, în condiții de temperatură constantă, presiunea unui gaz ideal este invers proporțională cu volumul său, adică produsul presiunii gazului de volumul pe care îl ocupă este constant : [1] [2]
sau: [3]
Această constantă este o funcție (în creștere) a temperaturii absolute , a naturii gazului și a numărului de moli .
Legea poate fi, de asemenea, scrisă cu următoarea notație mai completă:
în care se indică faptul că legea este valabilă la temperatură constantă, adică constanta variază cu temperatura.
fundal
Legea Boyle-Mariotte a fost enunțată pentru prima dată de Robert Boyle ( 1627 - 1691 ) care în 1662 a publicat „O apărare a doctrinei care atinge izvorul și greutatea aerului” . Această lege a fost reformulată într-un mod mai precis de Edme Mariotte (1620-1684) în 1676 , care confirmând datele lui Boyle a specificat că legea este valabilă numai dacă temperatura gazului este constantă.
O forță de greutate este aplicată gazului, care tinde spontan să se extindă, menținându-l comprimat.
Graficul de mai jos prezintă date din experimentul original al lui Boyle; [4] axa x arată volumul exprimat în unități de timp în inci cubi , în timp ce axa y arată înălțimea coloanei de mercur în inci , care conform legii lui Stevin este proporțională cu presiunea la care este supus gazul . În aceste date, produsul de presiune și volum este efectiv constant, cu o eroare procentuală de 1,4%.
Condiții de valabilitate
Legea lui Boyle și Mariotte este verificată experimental pentru gazele care se comportă ca un gaz ideal [2] sau pentru gaze în condiții de presiune nu prea ridicate (gaz rarefiat) și temperaturi nu prea apropiate de temperatura de lichefiere .
Legea nu este valabilă pentru lichide , al căror volum variază foarte puțin cu variația presiunii (variația densității este complet neglijabilă până la niveluri de presiune cu adevărat ridicate). Mai mult, de exemplu în mare , pe măsură ce adâncimea crește, presiunea crește, dar temperatura scade (în loc să crească) până se stabilizează peste 100-200 metri .
Reprezentarea grafică a acestor condiții este clopotul Andrews .
Exemple de aplicații
Legea lui Boyle și Mariotte în forma sintetică cu operatorul de diferență :
poate fi exprimat ca:
adică:
unde este Și reprezintă valorile volumului asumat de gaz într-o transformare izotermă în timpul căreia presiunea trece de la valoare a valorifica . Indiciile Și prin urmare ele indică starea termodinamică a gazului înainte de transformare și după transformare, fiind .
Prin urmare, legea lui Boyle și Mariotte poate fi exploatată în cazul transformărilor izoterme pentru a obține:
- volumul gazului după transformare, aplicând formula:
- presiunea gazului după transformare, aplicând formula:
- volumul gazului înainte de transformare, aplicând formula:
- presiunea gazului înainte de transformare, aplicând formula:
Scufundări
Legea lui Boyle și Mariotte constituie una dintre bazele pe care se sprijină tehnica și tehnologia scufundărilor . De fapt, comportamentul unui gaz (în acest caz aerul sau amestecurile ) este o funcție a presiunii hidrostatice la care este supus și modificările volumului său arată aplicarea practică a legii. Exemplul clasic este clopotul de scufundare pneumatic format dintr-un cilindru gol în interior și plin de aer cu capătul inferior deschis, care este coborât vertical în apă la adâncimi crescând progresiv. La o adâncime de 10 metri presiunea ambiantă se dublează, trecând de la 1 bar al suprafeței la 2 bar, apa pătrunde apoi în clopot reducând la jumătate volumul de aer conținut în acesta. Pentru a avea o înjumătățirea suplimentară a volumului de aer (adică 1/4 din volumul inițial) clopotul trebuie să fie coborât la o adâncime de 30 de metri, în cazul în care presiunea este de 4 bar (1 bar de suprafață + 1 bar pentru fiecare 10 metri ).
Notă
- ^ Silvestroni , p. 160 .
- ^ a b The Penguin Dictionary of Physics .
- ^(RO) DOE Fundamentals Handbook - "Termodinamică, transfer de căldură și flux de fluid", p. 97. Arhivat la 20 decembrie 2016 la Internet Archive .
- ^ datele pot fi găsite în Copie arhivată , la dbhs.wvusd.k12.ca.us . Adus la 14 decembrie 2004 (arhivat din original la 26 ianuarie 2005) .
Bibliografie
- Paolo Silvestroni, Fundamentals of chemistry , ed. A X-a, CEA, 1996, ISBN 88-408-0998-8 .
- ( EN ) The Penguin Dictionary of Physics , Londra, Penguin, 2009.
- Giulio Melegari, Mediul subacvatic al scafandrului , Bologna, Calderini, 1976.
Elemente conexe
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre legea Boyle-Mariotte
Wikimedia Commons conține imagini sau alte fișiere despre legea Boyle-Mariotte
linkuri externe
- Legea izotermă a gazelor (legea lui Boyle) , pe itchiavari.org .
- ( EN ) Thermopedia, „Legea lui Boyle (Boyle-Mariotte)”