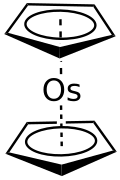
Osmocen
| Osmocen | |
|---|---|
| Numele IUPAC | |
| osmocen, bis (η 5 -ciclopentadienil) osmiu (II) | |
| Denumiri alternative | |
| Os (C 5 H 5) 2, OsCp 2 | |
| Caracteristici generale | |
| Formula moleculară sau brută | C 10 H 10 Os |
| Aspect | alb solid |
| numar CAS | |
| Numărul EINECS | 215-055-8 |
| PubChem | 79163 |
| ZÂMBETE | [CH-]1C=CC=C1.[CH-]1C=CC=C1.[Os+2] |
| Proprietăți fizico-chimice | |
| Densitate (g / cm 3 , în cs ) | 2,64 [1] |
| Temperatură de topire | 229 ° C (502 K) [2] |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
 | |
| Atenţie | |
| Fraze H | 315 - 319 - 335 [3] |
| Sfaturi P | 101 - 102 - 103 - 262 - 280 - 305 + 351 + 338 - 304 + 340 - 403 + 233 - 501 [3] |
Osmocenul este compusul organometalic cu formula Os (C 5 H 5 ) 2 , prescurtat adesea ca OsCp 2 . Aparține categoriei compușilor sandwich și mai precis este un metalocen . Osmocenul este disponibil comercial și este un solid alb în condiții normale . În acest compus osmiul are în mod formal starea de oxidare +2. [2] [4]
Structura
Structura osmocenului este cea a unui compus sandwich, cu atomul de osmiu închis între două inele ciclopentadienil. Este o structură similară cu cea a rutenocenului , cu cele două inele aromatice într-o configurație eclipsată ( simetrie D 5h ), în timp ce în ferocen au o configurație eșalonată (simetrie D 5d ). [4]
În osmocenul solid prezintă structura cristalină ortorombică, grupul spațial Pnma , cu constante de rețea a = 707,9 pm , b = 890.8 pm și c = 1 277,1 pm , patru unități de formulă pe unitate de celulă . Rezultatul distanței medii Os-C 219 pm , foarte asemănător cu Ru-C al rutenocenului (218,6 pm). [1]
Sinteză
Osmocenul a fost sintetizat pentru prima dată în 1959 de Ernst Otto Fischer prin tratarea tetraclorurii de osmiu cu un exces de ciclopentadienidă de sodiu . [5] Poate fi obținut și prin tratarea tetroxidului de osmiu cu acid bromhidric și reacția ulterioară cu zinc și ciclopentadienă. [1]
Reactivitate
Osmocenul este un compus stabil până la 540 ºC. [5] Dă naștere la reacții de substituție electrofilă, similare cu ferocenul și rutenocenul. Reactivitatea scade în ordinea ferocenului> rutenocenului> osmocenului. [6] Pe de altă parte, dintre cele trei, osmocenul este cel care formează cel mai ușor aducturi cu acizi Lewis, cum ar fi Cp 2 Os • HgCl 2 . [7]
Prin oxidarea osmocenului se formează un dimer conținând o legătură osmiu-osmiu. [8]
Notă
Bibliografie
- ( EN ) JCA Bobyens, DC Levendis, MI Bruce și ML Williams, Structura cristalină a osmocenului, Os (η-C 5 H 5 ) 2 , în Journal of Crystallographic and Spectroscopic Research , vol. 16, 1986, pp. 519-524, DOI : 10.1007 / BF01161040 .
- ( EN ) MW Droege, WD Harman și H. Taube, Chimie a stării de oxidare superioară a osmocenului: natura dimerică a ionului osmoceniu , în Inorg. Chem. , vol. 26, n. 8, 1987, pp. 1309-1315, DOI : 10.1021 / ic00255a023 .
- ( DE ) EO Fischer și H. Grubert, Über Aromatenkomplexe von Metallen, XXIX. Di - ciclopentadienil - osmiu , în Chem. Ber. , vol. 92, nr. 9, 1959, pp. 2302-2309, DOI : 10.1002 / cber . 19590920948 .
- ( EN ) NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- ( EN ) SA Kur, AL Rheingold și CH Winter, Sinteza, caracterizarea și halogenarea osmocenului Decakis (acetoxymercurio). Structura cristalină și moleculară a decaclorosmocenului , în Inorg. Chem. , vol. 34, nr. 1, 1995, pp. 414-416, DOI : 10.1021 / ic00105a067 .
- ( EN ) PA Shapley, Osmium: Organometallic Chemistry , în Encyclopedia of Inorganic Chemistry , ediția a doua, John Wiley & Sons, 2006, DOI : 10.1002 / 0470862106.ia172 , ISBN 9780470862100 .
- ( EN ) MD Rausch, EO Fischer și H. Grubert, Reactivitatea aromatică a ferocenului, rutenocenului și osmocenului , în J. Am. Chem. Soc. , Vol. 82, nr. 1, 1960, pp. 76-82, DOI : 10.1021 / ja01486a016 .
- Produse chimice STREM, Fișă tehnică de siguranță ( PDF ), pe strem.com , 2016. Accesat pe 29 ianuarie 2020 .