Uranil
Ionul uranil este un cation polatomic cu formula [UO 2 ] 2+ .
Este o specie chimică bine caracterizată, are o structură liniară cu legături U - O scurte, indicând prezența mai multor legături între uraniu și oxigen . Starea de oxidare a uraniului este de +6. Compușii care conțin ion uranil sunt de obicei de culoare galbenă. Ionul uranil poate forma mulți complecși , în special cu liganzii care utilizează atomi donatori de oxigen. Complexele ionice uranil sunt importante în extracția uraniului din minereurile sale și în reprocesarea combustibilului nuclear .
Structură și legături
Ionul uranil este liniar cu simetria D ∞h , cu distanțe U - O de aproximativ 180 pm . Aceste distanțe de legătură indică prezența unei legături multiple între atomii de uraniu și oxigen. Uraniul în starea de oxidare +6 are o configurație electronică [ Rn ] și, prin urmare, electronii utilizați pentru a forma legăturile provin din atomii de oxigen. Cei trei orbitali de oxigen sunt, în general, considerați că se combină cu orbitalii 6d și 5f ai uraniului pentru a furniza o legătură σ și două legături π . Rezultatul este trei legături între U și O, așa cum se arată în figură. [1]
Ionul uranil este întotdeauna însoțit de o componentă anionică, care în formă solidă este dispusă în planul ecuatorial al moleculei (adică cel perpendicular pe axa O - U - O și care trece prin atomul de uraniu).
Liantele suplimentare pot fi patru, cinci sau șase; rezultă structuri octaedrice, bipiramide pentagonale și respectiv bipiramide hexagonale. [1]
Spectroscopie
Compușii care conțin ion uranil sunt de obicei de culoare galbenă, dar pot fi de asemenea roșii, portocalii și verzi. În cele galbene, culoarea se datorează unei benzi de transfer de încărcare LMCT la aproximativ 420 nm, la capătul albastru al spectrului vizibil . [2] [3] Poziția exactă a benzii de absorbție și a benzilor XANES depinde de natura liganzilor ecuatoriali. [4]
Ionul uranil este luminescent, cu o bandă de emisie în intervalul 450-650 nm. Primul studiu asupra luminiscenței verzi a sticlei de uraniu a fost realizat de David Brewster în 1849. [5] Ulterior, au fost efectuate numeroase studii și s-a stabilit că luminescența este clasificabilă ca fosforescență , deoarece provine din tranziția de la tripletul inferior excitat. state to singlet state ground . [6] Luminiscența K 2 UO 2 (SO 4 ) 2 este implicată în descoperirea radioactivității .
Ionul uranil are frecvențe caracteristice de întindere la aproximativ 880 cm -1 ( spectru Raman ) și aproximativ 950 cm -1 ( spectru IR ). Frecvențele sunt oarecum influențate de natura liganzilor prezenți în planul ecuatorial. Frecvențele de întindere sunt corelate cu distanța de legătură U - O. De asemenea, s-a observat că frecvențele de întindere sunt corelate cu poziția liganzilor ecuatoriali din seria spectrochimică . [7]
Reactivitate
Ionul uranil din apă este stabil și își păstrează identitatea în multe reacții, dar chimia sa este complicată de prezența simultană a reacțiilor de complexare și hidroliză. Specia predominantă este cea cu cinci molecule de apă coordonate; există, de asemenea, un procent mic de ioni uranil coordonați cu patru molecule de apă. [8] Soluțiile de ion uranil din apă sunt acide datorită hidrolizei. Echilibrele de hidroliză sunt destul de complicate, cu formarea unor specii polimerice și sunt influențate de pH-ul și prezența altor ioni; cele mai importante specii sunt [UO 2 OH] + , [(UO 2 ) 2 (OH) 2 ] 2+ și [(UO 2 ) 3 (OH) 5 ] + . [1] [9]
Ionul uranil este destul de rezistent la reducere , dar poate fi redus la U 4+ cu Cr 2+ și la U 3+ cu amalgam de zinc sau electrolitic. Atât U 4+ cât și U 3+ în prezența aerului sunt reoxidate la [UO 2 ] 2+ . Specia corespunzătoare de U (V), [UO 2 ] +, pe de altă parte, este foarte instabilă și dă naștere dismutației . [9]
Prin iradiere cu lumină vizibilă se formează starea excitată * [UO 2 ] 2+ care este luminiscentă și este un oxidant foarte puternic (E ° = 2,6 V). [9]
Complexe
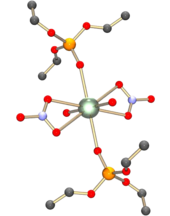
Ionul uranil se comportă ca un acid dur și, prin urmare, formează complexe mai stabile cu ionul fluor și liganzii cu atomi donatori de oxigen, cum ar fi ionii hidroxid , azotat , sulfat și carboxilat . Moleculele neutre, cum ar fi oxizii de apă și fosfină, se pot lega, de asemenea, în mod similar. Complexul format poate conține patru, cinci sau șase atomi coordonați în plan ecuatorial. De exemplu, azotatul de uranil, [UO 2 (NO 3 ) 2 ] • 2H 2 O, conține șase atomi coordonați în plan ecuatorial: patru din liganzii de azot legați bidentați și doi din cele două molecule de apă. Atomul de uraniu se află astfel în centrul unei structuri bipiramidice hexagonale, [1] similară cu cea ilustrată alături de UO 2 (NO 3 ) 2 • 2OP (OC 2 H 5 ).
Prezență în natură
Ca dovadă a stabilității ionului [UO 2 ] 2+ , se găsește în mod natural în multe minerale. Câteva exemple sunt:
- Carnotită K 2 (UO 2 ) 2 V 2 O 8 3 (H 2 O)
- Autunit Ca (UO 2 ) 2 (PO 4 ) 2 10-12 (H 2 O)
- Torbernit Cu (UO 2 ) 2 (PO 4 ) 2 8-12 (H 2 O)
- Uranophane Ca (UO 2) 2 (SiO 3 OH) 2 5H 2 O
- Coffinite U (SiO 4) 1 -x (OH) 4 x
Aceste minerale au o importanță comercială redusă; cea mai mare parte a uraniului este extrasă din pitchblendă , care este în esență UO 2 contaminată cu UO 3 și oxizi ai altor elemente.
Utilizări
Azotatul de uraniu, UO 2 (NO 3 ) 2 , este important în procesele de purificare a uraniului, deoarece poate fi extras în solvenți nepolari din soluții de acid azotic. [1] [9]
Oxalatul de uranil a fost utilizat ca actinometru înainte de introducerea ferrioxalatului de potasiu . [10]
Sărurile de uranil sunt utilizate pentru colorarea probelor pentru studii de microscopie electronică ADN. [11]
Toxicologie
Sărurile de uranil sunt toxice și pot provoca insuficiență renală severă și necroză tubulară acută . Organele țintă includ rinichii , ficatul , plămânii și creierul . Acumularea ionilor de uranil în gonocite provoacă boli congenitale [12], iar în celulele albe din sânge provoacă leziuni ale sistemului imunitar . [13] Compușii care conțin uranil sunt, de asemenea, neurotoxine . Contaminarea cu ioni uranil a fost detectată în apropierea țintelor lovite cu uraniu sărăcit . [14]
Toți compușii de uraniu sunt radioactivi. Cu toate acestea, uraniul este în general disponibil în forma sa epuizată, cu excepția industriei nucleare. Uraniul sărăcit constă în principal din 238 U care se descompune cu un timp de înjumătățire de 4,47 × 10 9 ani. Deoarece emite radiații alfa slabe, radioactivitatea sa este periculoasă doar prin contact direct sau prin ingestie.
Notă
- ^ a b c d e Greenwood și Earnshaw (1997)
- ^ Umreiko 1965
- ^ Berto și colab. 2006
- ^ Fillaux și colab. 2010
- ^ Brewster 1849
- ^ Balzani și Carassiti 1970
- ^ Nakamoto 1997
- ^ Hagberg și colab. 2005
- ^ a b c d Cotton și colab. 1999
- ^ Montalti și colab. 2006
- ^ Zobel și Beer 1961
- ^ Arfsten și colab. 2001
- ^ Schröder și colab. 2003
- ^ Salbu și colab. 2004
Bibliografie
- DP Arfsten, KR Still și GD Ritchie, O revizuire a efectelor expunerii la uraniu și uraniu sărăcit asupra reproducerii și dezvoltării fetale , în Toxicol. Ind. Sănătate , vol. 17, 5-10, 2001, pp. 180–191, DOI : 10.1191 / 0748233701th111oa .
- V. Balzani și V. Carassiti, Fotochimia compușilor de coordonare , Londra, Academic Press, 1970, ISBN 0-12-077250-7 .
- S. Berto, F. Crea, PG Daniele, C. de Stefano, E. Prenesti și S. Sammartano, Dioxouranium (VI) - Complexe carboxilate. Interacțiunea cu acizii dicarboxilici în soluție apoasă: speciație și structură , în Ann. Chim. , vol. 96, nr. 78, 2006, p. 399420, DOI : 10.1002 / adic.200690042 .
- D. Brewster, Trans. R. Soc. Edinburgh , voi. 6, 1849, pp. 111–121.
- FA Cotton, G. Wilkinson, CA Murillo și M. Bochmann,Advanced Inorganic Chemistry , ed. A VI-a, Wiley-Interscience, 1999, ISBN 978-0-471-19957-1 .
- C. Fillaux, D. Guillaumont, J.-C. Berthet, R. Copping, DK Shuh, T. Tyliszczak și C. Den Auwer, Investigarea structurii electronice și a legăturii în compușii uranilici prin combinarea spectroscopiei NEXAFS și a chimiei cuantice , în Phys. . Chem. Chem. Fizic. , vol. 12, 2010, pp. 14253–14262, DOI : 10.1039 / C0CP00386G .
- NN Greenwood și A. Earnshaw, Chimia elementelor , ediția a II-a, Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4 .
- D. Hagberg, G. Karlström, BO Roos și L. Gagliardi, Coordination of Uranyl in Water: A Combined Quantum Chemical and Molecular Simulation Study , în J. Am. Chem. Soc. , Vol. 127, nr. 41, 2005, pp. 14250–14256, DOI : 10.1021 / ja0526719 .
- M. Montalti, A. Credi, L. Prodi, MT Gandolfi, Manual de fotochimie , ed. A III-a, Boca Raton, CRC Press, 2006, ISBN 0-8247-2377-5 .
- K. Nakamoto, Spectrele infrarosu și Raman ale compușilor anorganici și de coordonare , partea A, ediția a 5-a, Wiley, 1997, ISBN 0-471-16394-5 . Partea B, ISBN 0-471-16392-9 .
- B. Salbu, K. Janssens, OC Lind, K. Proost, L. Gijsels și PR Danesi, Stări de oxidare a uraniului în particule de uraniu sărăcit din Kuweit , în J. Environ. Radioactivitate , vol. 78, nr. 2, 2004, pp. 125–135, DOI : 10.1016 / j.jenvrad.2004.04.001 .
- H. Schröder, A. Heimers, R. Frentzel-Beyme, A. Schott și W. Hoffman, Analiza aberației cromozomiale în limfocitele periferice ale războiului din Golf și Veteranilor de război din Balcani ( PDF ), în Radiația Protecției Dosimetrie , vol. 103, nr. 3, 2003, pp. 211-219. Adus la 5 martie 2012 (arhivat din original la 8 ianuarie 2014) .
- DS Umreiko, Simetrie în spectrele electronice de absorbție a compușilor uranilici , în J. Appl. Spectroscopie. , vol. 2, nr. 5, 1965, pp. 302-304, DOI : 10.1007 / BF00656800 .
- CR Zobel și M. Beer, pete de electroni I. Studii chimice privind interacțiunea ADN-ului cu sărurile de uranil , în J. Cell Biol. , vol. 10, nr. 3, 1961, pp. 335-346, DOI : 10.1083 / jcb.10.3.335 . Accesat la 2 martie 2012 .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre Uranile
Wikimedia Commons conține imagini sau alte fișiere despre Uranile
linkuri externe
- ( EN ) Uranile , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.