Complexul Vaska
| Complexul Vaska | |
|---|---|
| Numele IUPAC | |
| ( SP -4-1) -carbonil clor bis (trifenilfosfan) iridiu (I) | |
| Denumiri alternative | |
| trans- carbonilclorobis (trifenilfosfină) iridiu (I) Complexul Vaska compus din Vaska | |
| Caracteristici generale | |
| Formula moleculară sau brută | trans - [Ir (CO) Cl (PPh 3 ) 2 ] |
| Masa moleculară ( u ) | 780,25 |
| Aspect | solid cristalin galben deschis |
| numar CAS | |
| Numărul EINECS | 238-941-6 |
| ZÂMBETE | C1=CC=C(C=C1)P(C2=CC=CC=C2)(C3=CC=CC=C3)[Ir](C#O)(P(C4=CC=CC=C4)(C5=CC=CC=C5)C6=CC=CC=C6)Cl |
| Proprietăți fizico-chimice | |
| Solubilitate în apă | insolubil |
| Temperatură de topire | 488 (215 ° C) dec. |
| Informații de siguranță | |
| Simboluri de pericol chimic | |
| | |
| Expresii R. | 21.02.2022 |
| Fraze S. | 4-9-20-36 / 37 / 39-45-60 |
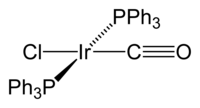
Complexul Vaska este denumirea comună a compusului chimic cu formula trans - [Ir (CO) Cl (PPh 3 ) 2 ]. Este un complex organometalic plan pătrat cu un ion central de Ir (I) legat cu doi liganzi trifenilfosfinici , un carbonil și un ion clorură . Geometria este cea prezentată în figură, cu cele două fosfine trans . Complexul a fost descris pentru prima dată de Lauri Vaska și John W. DiLuzio în 1961. [1] Complexul Vaska poate da reacții de adiție oxidativă și este renumit pentru capacitatea sa de a lega reversibil molecula de O 2 . În condiții normale, este un solid cristalin galben deschis.
Sinteză
Sinteza se realizează prin încălzirea oricărei sări de clorură de iridiu cu trifenilfosfină și o sursă de monoxid de carbon . Cea mai obișnuită procedură folosește dimetilformamida (DMF) ca solvent și uneori se adaugă anilină pentru a accelera reacția. Un alt solvent comun este 2-metoxietanol . Reacția se desfășoară în general într-o atmosferă inertă. Trifenilfosfina acționează atât ca liant, cât și ca agent reducător; liantul de CO este generat de descompunerea DMF. Reacția este complicată, dar poate fi schematizată cu următoarea ecuație: [2]
- Ir (H2O) 3 Cl 3 + 3PPh 3 + HCON (CH3) 2 + PhNH 2 →
- [Ir (CO) Cl (PPh 3 ) 2 ] + [(CH 3 ) 2 NH 2 ] Cl + OPPh 3 + [PhNH 3 ] Cl + 2H 2 O
Compușii iridiu în această sinteză sunt utilizate în general IrCl 3 • x H 2 O și H 2 IrCl 6.
Reactivitate
Studiile asupra complexului Vaska au ajutat la clarificarea bazei conceptuale a catalizei omogene și a mecanismelor de transport al oxigenului în biochimie. Complexul Vaska este un compus de 16 electroni și este considerat coordonat nesaturat ; poate adăuga apoi un ligand care donează doi electroni sau doi liganzi care donează câte un electron pentru a ajunge la configurația saturată la 18 electroni . Adăugarea a doi liganzi monoelectronici se numește adăugare oxidativă ; în urma unei reacții de acest tip, starea de oxidare a iridiului se schimbă de la Ir (I) la Ir (III). În același timp, reactantul tetracoordinat inițial pătrat devine hexacoordonat, cu geometrie octaedrică. Complexul Vaska dă reacții de adiție oxidativă cu oxidanți clasici, cum ar fi halogeni , acizi puternici, cum ar fi HCI , și alte molecule care acționează ca electrofili, cum ar fi iodiometan (CH 3 I).
Complexul Vaska a fost primul compus chimic anorganic capabil să lege reversibil O 2 : [3] [4]
- [Ir (CO) Cl (PPh 3 ) 2 ] + O 2 ⇄ [Ir (CO) Cl (O 2 ) (PPh 3 ) 2 ]
Ligandul dioxigen este legat bidentat de iridiu ( lateral în engleză) formând un perox complex. Pe de altă parte, în mioglobină și hemoglobină O 2, este legată într-un mod monodentat ( end-on în engleză), formând o superosă complexă. Oxigenarea are loc pur și simplu prin barbotarea oxigenului într-o soluție de toluen a complexului; vizual se observă o schimbare a culorii de la galben la portocaliu. Aductul de oxigen poate fi transformat înapoi în complexul inițial încălzindu-l la fierbere într-o soluție de benzen sau prin barbotarea unui gaz inert în soluție.
Spectroscopie
Spectroscopia în infraroșu este foarte utilă pentru analiza produselor de adiție oxidativă ale complexului Vaska, deoarece aceste reacții determină variații ale frecvenței de întindere a CO coordonat. [5] Aceste variații depind de modul în care retrodonația π Ir → C se schimbă în urma asocierii noilor liganzi. Există o documentație extinsă în literatura de specialitate cu privire la valorile frecvențelor de întindere a CO în complexul Vaska și în compușii obținuți prin adăugarea oxidativă a diferiților liganzi. [6] Unele valori sunt enumerate în următorul tabel:
Compusă ν CO (cm −1 ) Complexul Vaska 1967 Complex Vaska + O 2 2015 Complex Vaska + CH 3 I 2047 Complex Vaska + I 2 2067
Adăugarea oxidativă pentru a forma specii Ir (III) reduce donarea π Ir → C, determinând o creștere a frecvenței de întindere a CO. Frecvența observată depinde de liganzii adăugați, dar în complexele Ir (III) este întotdeauna mai mare de 2000 cm -1 .
Siguranță
Complexul Vaska este considerat dăunător prin inhalare, contact cu pielea și ingestie. Nu se cunosc date privind proprietățile cancerigene. [7]
Notă
- ^ L. Vaska, JW DiLuzio, Carbonil și complexe hidrid -carbonilice ale iridiului prin reacție cu alcooli. Complexe hidridice prin reacție cu acid , în J. Am. Chem. Soc., Voi. 83, nr. 12, 1961, pp. 2784-2785, DOI : 10.1021 / ja01473a054 . Adus 9 martie 2011.
- ^ GS Girolami, TB Rauchfuss, RJ Angelici, Sinteza și tehnica în chimia anorganică , Mill Valley, CA, University Science Books, 1999, ISBN 0-935702-48-2 .
- ^ L. Vaska, Proprietățile purtătoare de oxigen ale unui sistem sintetic simplu , în Știința , vol. 140, n. 3568, pp. 809-810, DOI : 10.1126 / science.140.3568.809 . Adus pe 10 martie 2011 .
- ^ AE Martell (eds), Complexe de oxigen și activarea oxigenului prin metale de tranziție , Springer, 1988, ISBN 978-0-306-42789-3 .
- ^ L. Vaska, JW DiLuzio, Activarea hidrogenului de către un complex de metale de tranziție în condiții normale care conduc la o dihidridă moleculară stabilă , în J. Am. Chem. Soc., Voi. 84, nr. 4, 1962, pp. 679-680, DOI : 10.1021 / ja00863a040 . Adus pe 7 martie 2011 .
- ^ RH Crabtree, Chimia organometalică a metalelor de tranziție , ediția a V-a, Wiley, 2009, ISBN 978-0-470-25762-3 .
- ^ Alfa Aesar, Fișa tehnică de siguranță a complexului Vaska ( PDF ), pe alfa.com . Adus la 16 iunie 2021 (arhivat din original la 13 mai 2016) .
Alte proiecte
-
 Wikimedia Commons conține imagini sau alte fișiere despre Complexul Vaska
Wikimedia Commons conține imagini sau alte fișiere despre Complexul Vaska