Regula a 18 electroni
Regula celor 18 electroni afirmă că complexele cu un total de 18 electroni la nivelul electronicului exterior sunt deosebit de stabile. Este folosit pentru raționalizarea structurii și stabilității complexelor organometalice ale metalelor de tranziție . Regula se bazează pe faptul că stratul electronic cel mai exterior al unui metal de tranziție este format din nouă orbitali, care pot conține un total de 18 electroni, parțial derivați din metal și parțial donați de liganzi în formarea complexului. Când nivelul este complet, se atinge configurația electronică ns 2 ( n -1) d 10 np 6 , similară cu cea a gazului nobil la sfârșitul perioadei și care reprezintă o carcasă închisă stabilă. Regula funcționează bine pentru complexele organometalici, unde metalul de tranziție este într - o scăzută stare de oxidare și liganzii sunt acceptori tt bune (acizi) tt. Pe de altă parte, regula nu este utilă pentru complexele nemetalorganice sau pentru complexele de metale ale blocurilor , lantanidelor și actinoizilor .
fundal
O primă încercare de a interpreta structura complexelor carbonilice metalice a fost făcută de Irving Langmuir în 1921. [1] El a considerat că stratul cel mai exterior de electroni (așa-numita valență) ar putea conține până la 18 electroni și a aplicat aceste considerații la Mo (CO ) 6 , Fe (CO) 5 și Ni (CO) 4 .
O metodă de numărare diferită a fost introdusă în 1927, [2] când Nevil Sidgwick a extins regula octetului Lewis la compușii de coordonare. Sidgwick a presupus că pentru a obține un compus stabil, metalul trebuie să atingă același număr total de electroni ca următorul gaz nobil . Suma tuturor electronilor metalici, inclusiv a electronilor donați de liganzi, a fost numită Number Effective Atomic (în engleză EAN = Effective Atomic Number) și când această valoare a devenit 36 ( Kr ), 54 ( Xe ) sau 86 ( Rn ) este a spus că regula EAN a fost respectată. Regula EAN a devenit mai populară și a fost folosită în mod obișnuit până la sfârșitul anilor 1960.
Mai târziu, regula a 18 electroni a fost din nou preferată, mai simplă, deoarece se limitează la numărarea doar a electronilor prezenți în stratul exterior și are, de asemenea, avantajul că un singur număr (18) este valabil pentru toate metalele de tranziție.
Exemple
Regula justifică faptul că carbonilii metalici stabili ai cromului , fierului și nichelului au formula Cr (CO) 6 , Fe (CO) 5 și Ni (CO) 4 . În toate cele trei cazuri, starea de oxidare a metalului central este zero și, la nivel electronic, cromul, fierul și nichelul posedă șase, opt și respectiv zece electroni. La aceștia trebuie adăugați electronii donați de liganzi, adică doi electroni pentru fiecare CO prezent, care sunt, prin urmare, 12 pentru Cr (CO) 6 , 10 pentru Fe (CO) 5 și 8 pentru Ni (CO) 4 . În toate cele trei cazuri, prin urmare, se ajunge la un total de 18 electroni la nivelul cel mai exterior, ajungând la configurația electronică a următorului gaz nobil, cripto .
Alte exemple sunt: ferocenul (18 electroni) este o moleculă foarte stabilă, în timp ce alte metalocene care nu respectă regula celor 18 electroni, precum cobaltocenul (19 electroni) și nichelocenul (20 electroni), sunt mai puțin stabile și au un caracter reducător.
Justificarea teoretică a regulii celor 18 electroni

Regula cu 18 electroni a fost inițial enunțată empiric, dar mai târziu a găsit sprijin în teoria orbitalilor moleculari . Pentru simplitate, va fi ilustrat doar cazul complexelor octaedrice. Diagrama relativă a orbitalilor moleculari este ilustrată în figura 1. Situația cea mai stabilă va fi cea în care toți orbitalii de legătură sunt ocupați în totalitate și toți cei anti-legătură sunt goi. Deoarece orbitalii de legătură sunt 9 (până la inclusiv t 2 g), atunci când acestea sunt complet ocupate acestea vor conține un total de 18 electroni. Această umplere se va realiza mai ușor dacă complexul are un câmp puternic (cu Δ mare), astfel încât să dezavantaj ocuparea nivelului e g *.
De fapt, pentru metalele din a doua și a treia serie de tranziție nu se observă compuși cu mai mult de 18 electroni, deoarece Δ este ridicat și nivelul e g * nu este ocupat. Cu toate acestea, există diverse cazuri de complexe cu mai puțin de 18 electroni, favorizați de liganzi electronegativi precum Cl - și F - care au orbitați π cu energie mai mică decât nivelul t 2 g . Cu astfel de liganzi donatori π , Δ tinde să fie mic și, mai presus de toate, nivelul t 2 g capătă un anumit caracter anti-lipire (a se vedea figura 2), deci nu este convenabil să-l umpleți cu electroni. Câteva exemple de acest tip sunt [WCl 6 ] 2− (14 electroni), [OsCl 6 ] 2− (16 electroni), [PtF 6 ] - (17 electroni). Pe de altă parte, complexele de mai puțin de 18 electroni cu liganzi cum ar fi CO și NO sunt rar observate, care acceptori fiind bune π au orbitali tt cu energie mai mare decât t 2 g nivelul de metal. În acest caz (figura 3) Δ este crescut (CO și NO sunt liganzi cu câmp puternic din seria spectrochimică ), nivelul t 2 g este stabilizat și, prin urmare, umplerea acestuia cu electroni duce la o creștere a energiei de legare.
În complexele din prima serie de tranziție, Δ este intrinsec mai mic și, prin urmare, este ușor să ocupe și nivelul e g *. În consecință, complexele cu mai mult de 18 electroni în a doua jumătate a seriei 3 d sunt, de asemenea, bine cunoscute și stabile, cum ar fi [Co (H 2 O) 6 ] 2+ (19 electroni), [Cu (NH 3 ) 6 ] 2 + (21 electroni) și [Zn (NH 3 ) 6 ] 2+ (22 electroni). În prima parte a seriei 3 d , complexele cu mai puțin de 18 electroni sunt comune, cum ar fi [TiF 6 ] 2− (12 electroni) și [Cr (NH 3 ) 6 ] 3+ (15 electroni).
În general, se observă că regula 18 de electroni lucrează în principal cu metale bogate în electroni (acesta este cazul stărilor de oxidare scăzută) și liganzi care sunt acceptori tt bune (acizi tt) pentru . Din acest motiv, regula celor 18 electroni este utilizată pe scară largă în complexele organometalice, pentru a prezice stabilitatea și structurile electronice.
Încălcări ale regulii celor 18 electroni
După cum sa menționat deja, regula celor 18 electroni funcționează în principal pentru complexele organometalice, cu metale într-o stare de oxidare scăzută și liganzi acidului π . Cu toate acestea, de asemenea, în acest tip de complexe se observă numeroase încălcări, care pot fi clasificate după cum urmează.
Complexe cu 16 electroni
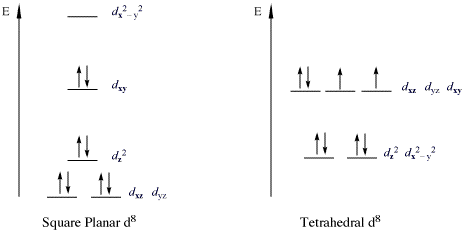
O clasă comună a complexelor care încalcă regula 18 electroni sunt 16 electroni complecși cu d 8 configurație. Sunt complexe atât de stabile încât uneori suntem numiți ca o regulă de 16 electroni . Aceste complexe sunt de obicei plane pătrate. Câteva exemple sunt complexul Vaska , [Ir (CO) Cl (PPh 3 ) 2 ], [PtCl 4 ] 2− și sarea Zeise K [PtCl 3 (η 2 −C 2 H 4 )]. În aceste cazuri, orbitalul d z 2 este ocupat de doi electroni și are un caracter neobligatoriu.
Multe cicluri catalitice funcționează cu complexe care alternează între 16 și 18 configurații de electroni. Exemple de acest tip sunt procesul Monsanto pentru sinteza acidului acetic, hidrogenări , hidroformilări , izomerizări ale olefinelor și unele polimerizări ale alchenelor .
Complexe cu mai mult de 18 electroni
Există diverse cazuri de complexe cu mai mult de 18 electroni. Cele mai cunoscute exemple sunt cobaltocenul , Co (C 5 H 5 ) 2 (19 electroni) și nichelocenul , Ni (C 5 H 5 ) 2 (20 electroni).
Complexe aglomerate steric
Există diverse cazuri în care obstacolul steric din jurul metalului poate împiedica apropierea tuturor liganzilor necesari pentru a ajunge la cei 18 electroni. Exemple:
- Ti (neopentil) 4 (8 electroni)
- Cp * 2 Ti (C 2 H 4 ) (16 electroni)
- V (CO) 6 (17 electroni)
- Cp * Cr (CO) 3 (17 electroni)
- Pt (P t Bu 3 ) 2 (14 electroni)
- Co (norbornil) 4 (11 electroni)
- [FeCp 2 ] + (17 electroni)
Notă
- ^ I. Langmuir, Tipuri de valență , în Știință , vol. 54, 1921, pp. 59-67, DOI : 10.1126 / science.54.1386.59 . Adus pe 3 martie 2011 .
- ^ NV Sidgwick, The electronic theory of valence , Ithaca, Cornell University, 1927.
Bibliografie
- JE Huheey, EA Keiter, RL Keiter, Chimie anorganică - principii, structuri, reactivitate , ediția a II-a, Padova, Piccin, 1999, ISBN 88-299-1470-3 .
- PR Mitchell, RV Parish, The optspeat electron rule , în J. Chem. Educ. , vol. 46, nr. 12, 1969, pp. 811-814, DOI : 10.1021 / ed046p811 . Adus pe 3 martie 2011 .
- WB Jensen, The origin of the 18-electron rule , în J. Chem. Educ. , vol. 82, nr. 1, 2005, p. 28, DOI : 10.1021 / ed082p28 . Adus pe 3 martie 2011 .
Elemente conexe
linkuri externe
- ( EN ) Regula a 18 electroni , în Encyclopedia Britannica , Encyclopædia Britannica, Inc.